POTENSI APLIKASI GRANULOCYTE-COLONY STIMULATING FACTOR VIA MICROCHIP SUBKUTAN SEBAGAI TERAPI PREVENTIF PADA TRAVELER PASCA INFARK MIOKARDIUM
on
ISSN: 2303-1395
E-JURNAL MEDIKA, VOL. 5 NO.4, APRIL, 2016
POTENSI APLIKASI GRANULOCYTE-COLONY STIMULATING FACTOR VIA MICROCHIP SUBKUTAN SEBAGAI TERAPI PREVENTIF PADA TRAVELER PASCA INFARK MIOKARDIUM
I Gede Yuhana Dharma Sasmita
Program Studi Pendidikan Dokter, Fakultas Kedokteran Universitas Udayana kesawa786@gmail.com
ABSTRAK
Insiden kematian pada traveler dengan infark miokardium (IM) sering terjadi pada traveler yang telah menjalani reperfusi pasca infark. Hal ini didasari oleh remodeling patologis yang berkorelasi signifikan dengan kematian akibat gagal jantung dan aritmia ventrikel. Kardiomioplasti seluler merupakan salah satu modalitas terapi regeneratif yang ditujukan untuk mencegah remodeling patologis pasca IM dengan memanfaatkan efek multipotensi stem cell. Sejumlah penelitian merekomendasikan Mesenchymal Stem Cell (MSC) yang diharapkan mampu dimodulasi secara endogen menuju zona infark. Efektivitas terapi Granulocyte-Colony Stimulating Factor (G-CSF) dalam memodulasi MSC endogen merupakan potensi yang relevan dengan kardiomioplasti seluler. Dalam perspektif travel medicine, terapi G-CSF mempertimbangkan kondisi pasien pasca reperfusi pra travel, pajanan faktor risiko selama berwisata dan kepatuhan terapi. Oleh karena itu, direkomendasikan satu strategi penghantaran terapi G-CSF terkontrol bernama microchip drugs delivery system yang terbukti efektif dalam meningkatkan efikasi obat, transfer obat yang stabil dan kontinyu, memperbaiki kepatuhan terapi, serta self-controlled therapy. Penulisan ini bertujuan untuk mengetahui mekanisme G-CSF sebagai modulator MSC, konstruksi dan mekanisme kerja microchip subkutan untuk memfasilitasi terapi G-CSF serta prospek implementasi terapi G-CSF via microchip subkutan pada traveler pasca IM. Mekanisme G-CSF sebagai modulator MSC mencakup mobilisasi, homing, dan regenerasi MSC. Dalam konstruksinya, microchip melalui proses mikropabrikasi dan dikemas dalam bentuk kapsul implan. Pelepasan G-CSF oleh microchip dikontrol secara eksternal dengan radio frekuensi yang memicu peluruhan membran microchip dan diikuti oleh pelepasan obat. Lebih jauh, berdasarkan potensi yang dikemukakan sejumlah penelitian, terapi G-CSF pada traveler pasca IM memiliki prospek sebagai modalitas preventif pada traveler pasca IM yang sekaligus meningkatkan kapasitas fungsional jantung dalam menghadapi faktor risiko selama travel. Dengan demikian, penelitian mendalam masih sangat diperlukan.
Kata kunci: traveler pasca IM, kardiomioplasti, MSC, G-CSF, microchip drugs delivery system
POTENTIAL APPLICATIONS GRANULOCYTE-COLONY STIMULATING FACTOR VIA SUBCUTANEOUS MICROCHIP ON PREVENTIVE THERAPY AFTER TRAVELER MYOCARDIAL INFARCTION
ABSTRACT
Death incidence among travelers with myocardial infarct (MI) highly reported among travelers experiencing previous reperfusion therapy. Pathological remodeling progresivity post MI have a strong corelation with mortality related with cardiac arythmia and heart failure. Cellular cardiomyoplasty considered as one regenerative therapy which capable in preventing post infarct pathological remodeling by applying the multipotency effect of stem cell. Several studies suggest the use of Mesenchymal Stem Cell (MSC) in the term of celluar cardiomyoplasty which focused on endogenous modulation of stem cells. Regarding to those concern, the emerging effectivity of Granulocyte-Colony Stimulating Factor (G-CSF) in modulates MSC endogenously proved to be relevant. From the travel medicine perspective, G-CSF therapy need several considerations including pre travel condition of a patient after reperfusion therapy, risk factors exposure during travel and medical compliance. Therefore, one strategy named microchip drugs delivery system was suggested as a response for the need of increasing drugs efficacy, stable and continuous transfer, high compliance and self-controlled therapy. This review aimed to explore the G-CSF mechanism as MSC modulator, introducing the construction and the mechanism of subcutaneus microchip to facilitate G-CSF therapy, and provide prospective view of G-CSF therapy via subcutaneus microchip among post MI traveler. G-CSF modulates MSC by performing stimulation for MSC mobilization from bone marrow, homing to the infarct zone and 1 http://ojs.unud.ac.id/index.php/eum
regeneration activity. Inside the construction, microchip as a drugs container passed microfabrication process and package into implant capsule. G-CSF release externally controled by radiofrequency signal that induce the microchip membrane degradation followed by drugs release. Furthermore, regarding to the revealed potentiality, G-CSF therapy expected to perform an evidence based preventive therapy for post MI traveler and increase heart functional capacity to adapt with risk exposure during travel. Overall, deep research strongly required.
Keywords: post MI traveler, cardiomyoplasty, MSC, G-CSF, microchip drugs delivery system
PENDAHULUAN
Mobilitas penduduk dunia mengarah pada laju perjalanan antar negara yang meningkat pesat. World Tourism Organization (WTO) mencatat angka kedatangan turis mancanegara mengalami peningkatan dari 199 juta pada tahun 2010 menjadi 124 juta pada tahun 2011. Aktivitas travel didominasi oleh penduduk negara maju yang memiliki preferensi tinggi untuk melakukan perjalanan ke negara berkembang di kawasan Afrika dan Asia.1,2 Konsekuensi dari perjalanan antar negara adalah munculnya isu kesehatan global yang berkaitan erat dengan karakteristik epidemiologi penyakit di suatu negara. Tingginya insiden penyakit degeneratif di negara maju, adanya risiko penyakit infeksi di negara berkembang ataupun double burden diseases di negara transisi berimplikasi pada morbiditas dan mortalitas terkait aktivitas traveling.3
Penyakit kardiovaskuler merupakan penyumbang insiden dan mortalitas tertinggi pada traveler secara global. Sebesar 50% kasus kesehatan terkait traveling adalah penyakit kardiovaskuler yang didominasi oleh kasus kegawatdaruratan medis dengan risiko kematian tinggi.4 Berdasarkan Heart Disease and Stroke Statistics 2011 Update, proyeksi angka kematian penyakit kardiovaskuler secara global mencapai 23,6 juta jiwa pada tahun 2030. Proyeksi tersebut mencakup angka kematian selama traveling yang representatif terhadap traveler dengan risiko ataupun riwayat penyakit kardiovaskuler.5 Penyakit jantung koroner yang didasari infark miokardium (IM) merupakan kasus
kegawatdaruratan yang sering dilaporkan terjadi pada traveler.6 Namun, data terkini menunjukkan bahwa insiden kematian tertinggi justru terjadi pada traveler yang telah berhasil menjalani reperfusi pasca IM pra travel (PCI/CABG).4 Hal ini disebabkan oleh kejadian komplikasi IM (gagal jantung dan aritmia ventrikel) yang didasari oleh mekanisme remodeling patologis pada ventrikel selama tiga bulan pasca IM.7 Adanya
kecenderungan penggunaan reperfusi dengan prosedur PCI/CABG pra travel sebagai pertimbangan dalam menentukan rekomendasi travel (i.e 2 minggu pasca PCI/CABG), tidak mengurangi risiko komplikasi IM pada pasien. Sejauh ini, reperfusi miokardium tidak menunjukkan efektivitas dalam menghambat progresivitas infark menuju remodeling patologis.7 Remodeling patologis adalah perubahan abnormal pada struktur dinding ventrikel pasca IM yang berimplikasi pada penurunan fungsi normal jantung secara signifikan.8 Remodeling patologis adalah risiko potensial yang mengarah pada terjadinya gagal jantung dan aritmia ventrikel pada traveler pasca IM.9 Traveler dengan remodeling patologis pasca IM terbukti memiliki kerentanan yang tinggi terhadap kondisi selama penerbangan (air travel)4 dan karakteristik travel (e.g transportasi, aktivitas fisik, akomodasi).6 Dengan demikian, remodeling patologis merupakan patomekanisme penting yang dapat menjadi acuan modalitas terapi pasca IM saat ini.
Kardiomioplasti seluler merupakan salah satu modalitas terapi regeneratif yang ditujukan untuk mencegah remodeling patologis pasca IM dengan memanfaatkan sifat multipotensi stem cell. Efek multipotensi yang berperan penting dalam kardiomioplasti seluler adalah kemampuan transdiferensiasi stem cell menjadi kardiomiosit.10 Pada uji klinis, beberapa tipe stem cell yang telah diinvestigasi adalah embryonic stem cell (ESC), skeletal stem cell, cardiac stem cell (CSC), adipocyte stem cell dan mesenchymal stem cell (MSC).11 Sejumlah penelitian merekomendasikan MSC sebagai agen yang relevan dalam kardiomioplasti seluler. Hal ini merujuk pada keberhasilan MSC untuk mengeliminasi kendala aplikasi stem cell terkait aspek etik, efikasi dan isu host-graft disease. Keberhasilan karakterisasi dan efektivitas transdiferensiasi yang terbukti secara klinis adalah faktor yang mendasari penggunaan MSC dalam kardiomioplasti.10
Aplikasi MSC pasca IM telah melalui dua fase penelitian klinis. Tahapan pertama mencakup sejumlah besar penelitian pre klinik dan clinical trial untuk menguji efikasi metode implantasi kultur MSC sumsum tulang intramiokardium. Meskipun parameter fungsional jantung ditemukan membaik secara bermakna, namun kuantitas sel pasca implantasi diidentifikasi belum maksimal. Hanya sejumlah kecil MSC yang mengalami retensi (survival) intramiokardium. Hal ini diakibatkan oleh kondisi hipoksik pada zona infark. Oleh karena itu, penelitian tahap kedua kemudian diarahkan pada modulasi MSC endogen yang lebih resisten terhadap hipoksia yaitu MSC sumsum tulang.12
Modulasi MSC sumsum tulang mencakup proses mobilisasi MSC menuju sirkulasi dan retensi intramiokardium untuk memulai transdiferensiasi. Bukti keberhasilan isolasi MSC dari darah tepi dikemukakan oleh I Kan, et. al12, Fernandez, et. al13 dan Kassis, et. al14 dengan penjelasan bahwa
mobilisasi MSC menuju darah tepi dimodulasi oleh granulocyte-colony stimulating factor (G-CSF). Riset mengenai aplikasi G-CSF untuk kepentingan terapi modulasi MSC pasca IM telah berhasil mencapai tahap randomized clinical trial.12
G-CSF menginisiasi mobilisasi MSC sumsum tulang menuju darah tepi melalui mekanisme yang berhubungan dengan SDF-1 dan reseptornya (CXCR4). MSC kemudian melakukan ekstravasasi dan invasi menuju jaringan infark. Pelepasan faktor parakrin oleh MSC menstimulasi tahap transdiferensiasi yang sangat spesifik.12 Multipotensi dan efek parakrin MSC terbukti memiliki efek kardiomioplasti seluler melalui mekanisme proteksi terhadap kardiomiosit, neovaskularisasi, sinkronisasi kontraktilitas sel dan regenerasi miokardium. Potensi kardiomioplasti seluler MSC yang distimulasi oleh G-CSF telah teruji dalam memperbaiki parameter fungsional jantung pasca IM.14
Efikasi terapi G-CSF dalam kardiomioplasti seluler pasca IM dipandang sebagai solusi yang relevan untuk mencegah komplikasi IM selama travel. Dalam perspektif travel medicine, terapi G-CSF memerlukan metode aplikasi yang potensial untuk meningkatkan efikasi G-CSF pada traveler pasca reperfusi. Selain itu, sebagai terapi jangka panjang, terapi G-CSF membutuhkan strategi yang menjamin kepatuhan terapi dan dapat diaplikasikan pada traveler tanpa menghambat mobilitas selama travelling. Oleh karena itu, direkomendasikan suatu metode penghantaran substansi terapi terkontrol bernama microchip drugs delivery system yang relevan dengan kebutuhan peningkatan efikasi G-CSF, transfer G-CSF yang stabil dan kontinyu, tingkat kepatuhan terapi yang tinggi serta selfcontrolled therapy pada traveler.
Microchip merupakan perangkat berukuran mikro yang dapat diimplantasikan pada organ tubuh untuk kepentingan penghantaran substansi terapi
terkontrol. Saat ini, aplikasi klinis microchip diindikasikan pada penyakit dengan terapi jangka panjang yang memerlukan kontrol secara kontinyu. Efektivitas microchip dalam meningkatkan efikasi terapi dan kepatuhan pada terapi jangka panjang adalah solusi atas keterbatasan terapi konvensional. Keberhasilan aplikasi microchip saat ini masih terbatas pada penyakit glaukoma, kanker, diabetes melitus dan osteoporosis.15
Oleh karena itu, terdapat inisiatif untuk mengkaji potensi terapi G-CSF via microchip sebagai terapi preventif pada traveler pasca IM. Sebagai suatu gagasan produk teknologi kedokteran mutakhir, sangat penting dilakukan kajian yang mempertemukan bukti ilmiah potensi microchip dengan efikasi G-CSF dalam mencegah komplikasi IM pada traveler.
KARAKTERISTIK MESENCHYMAL STEM CELL (MSC)
MSC ditemukan pertama kali oleh Friedenstein melalui identifikasi in vitro sel stroma sumsum tulang yang berekspansi menjadi colony forming units-fibroblastic (CFU-F). CFU-F mengekspresikan aktivitas proliferatif dan multipotensi (i.e. kondrosit, osteosit, sel hematopoetik stroma). Penamaan MSC adalah konsensus atas temuan sel kultur tersebut. Identifikasi lebih lanjut memberikan karakteristik mendasar, yaitu tereksklusinya antigen tipikal sel hematopoetik (i.e. CD34, CD45, CD14) sehingga MSC dikategorikan sebagai non hematopoetic stem cell. MSC identik dengan fibroblast dan memiliki morfologi berupa sel gelendong, berinti sel dominan dan berukuran 18µm-20µm. Kuantitas MSC pada stroma sumsum tulang diidentifikasi sebesar 2–5 MSC per 1 × 106 sel mononuklear.16,17 Antigen SB-10 diekspresikan oleh MSC yang belum berdiferensiasi, namun hilang ketika MSC berdiferensiasi menjadi sel osteogenik in vitro. MSC
mengespresikan antigen SH2, SH3, CD13, CD29 (b-1 integrin), CD58, CD71, CD90 (Thy-1), CD106 (VCAM-1), CD120a dan CD124.18,19,20. Jones, et. al21 menemukan homogenitas ekspresi Stro-1 pada MSC. Namun reaksi silang Stro-1 dengan sel-sel stroma yang lain menyulitkan identifikasi MSC. Ekspresi CD73, CD105, CD90, CD44 yang diduga sebagai marka MSC masih menimbulkan kerancuan dengan sel fibroblast yang mengekspresikan marka sejenis.22,23,24 Identifikasi berdasarkan ekspresi marka tertinggi dan terendah populasi sel sumsum tulang, merekomendasikan low-affinity nerve growth factor receptor (LNGFR)/CD271 sebagai marka MSC yang spesifik.25,26 Karakteristik fungsional yang mencakup multipotensi merupakan kapasitas terpenting bagi MSC dalam melakukan regenerasi jaringan.27,28. Reseptor sitokin dan growth factor yang diekspresikan oleh MSC merupakan molekul parakrin yang berfungsi sebagai regulator proliferasi dan transdiferensiasi10,25.
MEKANISME G-CSF SEBAGAI MODULATOR MSC DALAM KARDIOMIOPLASTI SELULER
Mekanisme mobilisasi MSC via stimulasi G-CSF melibatkan molekul kemokin (peptida kemotaksis (< 10 kDa) yang menginisiasi mobilisasi sel efektor) yang diidentifikasi sebagai stromal derived factor (SDF)-1. SDF-1 merupakan kemokin mayor dalam inisiasi mobilisasi MSC. Pada kondisi infark, miokardium melepaskan SDF-1 yang berlangsung selama tujuh hari. Meskipun miokardium memiliki kemampuan mensekresikan SDF-1, namun tidak ditemukan bukti mengenai mobilisasi MSC. Mobilisasi MSC sangat ditentukan oleh SDF-1 yang diekspresikan oleh sumsum tulang. Perbedaan efek SDF-1 pada kedua organ tersebut menunjukkan adanya mekanisme regulasi SDF-1 yang berbeda, terutama dalam mobilisasi MSC.29,30
Efek G-CSF dalam meregulasi SDF-1 sumsum tulang mendasari keberhasilan mobilisasi MSC menuju darah tepi. G-CSF mempengaruhi interaksi SDF-1 dengan reseptornya, CXCR4. Aksis SDF-1/CXCR4 telah dibuktikan sebagai inisiator mobilisasi MSC yang potensial. Mekanisme pelepasan MSC dari sumsum tulang melalui jalur SDF-1/CXCR4 diawali dengan aktivasi protease (i.e. elastase, cathepsin G, dipeptidylpeptidase IV) oleh G-CSF. Peningkatan level protease mengakibatkan pemotongan spesifik pada N-terminal CXCR4 dan inaktivasi SDF-1 sehingga memicu pelepasan MSC menuju rute sirkulasi. Dalam hal ini, prinsip dasar mekanisme G-CSF terkait SDF-1/CXCR4 adalah menekan (downregulasi) ekspresi SDF 1, di mana pada kondisi normal interaksi SDF-1 dan CXCR4 berfungsi mempertahankan stabilitas MSC di sumsum tulang.29,31 Isabelle, et al32 mempublikasikan efek G-CSF terhadap downregulasi SDF-1 dalam menginisiasi mobilisasi MSC. MSC diperoleh dari aspirasi sumsum tulang dan darah tepi subjek limpoma dengan terapi G-CSF dan pasien normal sebagai kontrol. Kadar SDF-1 kemudian diidentifikasi pada kultur sel dan darah tepi. Hasil penelitian menunjukkan efektivitas G-CSF dalam menekan SDF-1 sumsum tulang pasca terapi G-CSF. Efek serupa tidak ditemukan pada
darah tepi (p<0,001). Di luar aksis SDF-1, mobilisasi MSC juga diinisiasi oleh terganggunya interaksi antar MSC melalui degradasi matriks ekstraseluler. Peningkatan kadar IL-8 oleh G-CSF memicu pelepasan MMP-9 oleh neutrofil yang kemudian mendisrupsi interaksi anter sel.33
Sejumlah penelitian berhasil mengidentifikasi dan mengisolasi MSC dari darah tepi. Peranan sitokin G-CSF dalam memobilisasi MSC sumsum tulang telah dibuktikan. Fernandez et. al13 melakukan studi pada sampel wanita dengan kanker payudara yang menerima terapi sitokin G-CSF secara reguler pasca kemoterapi. Pada darah tepi sampel diidentifikasi sel dengan karakteristik fibroblast yang memproduksi kolagen (tipe I, III dan VI), fibronektin, ligan adesif (VCAM-1 (CD106), ICAM-1 (CD54)) dan antigen permukaan yang dikenali oleh antibodi monoklonal SH2 dan SH3. Kemudian, Reading, et.al26 berhasil mengisolasi populasi sel CD34 (-) (non hematopoetik stem cell) dari darah tepi seratus individu normal. Sel tersebut memproduksi vimentin, kolagen I, reseptor BMP serta struktur heterodimerik yang diekspresikan pada sel linial MSC dengan karakteristik CD105. Penelitian terkini dengan metode fibrin microbeads (FMB) berhasil mengisolasi MSC darah tepi sampel (pasien dewasa normal) pasca terapi G-CSF14 dengan temuan seperti pada gambar 1.
|
CDJS |
CDSJ |
VIM |
|
K |
CD 105 |
CD 90 100μjn |
5
Gambar 1. Imunofenotip MSC yang Diisolasi dari Darah Tepi dengan Metode FMB. Fluorosensi menunjukkan MSC dengan ekspresi vimentin (VIM), fibronektin (FIN), CD 105 dan CD 90. Antigen hemopoetik CD 45 dan CD 34 teridentifikasi negatif.14
Pasca mobilisasi menuju sirkulasi, MSC melakukan homing pada miokardium yang mengalami infark untuk menjalankan mekanisme regenerasi. Retensi MSC membutuhkan kemampuan ekstravasasi dan invasi menuju miokardium. Ekstravasasi dan invasi MSC menuju miokardium melibatkan degradasi lamina basalis oleh MMP-2 dan MMP-9. Selanjutnya, TGF-β dan FGF yang disekresikan oleh MSC memicu perekrutan MSC secara spesifik menuju miokardium. Kolagen, proteoglikan dan hialuronan yang melimpah pada MSC memfasilitasi proses agregasi MSC dengan kardiomiosit. Adaptasi matriks intersel sesuai karakter miokardium dimodulasi oleh periostin yang diinduksi oleh TGF-β.33,34
Sejumlah clinical trial menyimpulkan bahwa kardiomioplasti seluler oleh MSC tidak hanya tergantung pada kuantitas sel yang terakumulasi pada zona infark. Efikasi klinis MSC ditentukan dari keberhasilan diferensiasi dan efek parakrin yang dihasilkan. Efek parakrin mencakup pelepasan mediator pada lingkungan ekstra sel dan sirkulasi untuk menunjang fungsi regeneratif MSC. MSC dan fungsi parakrinnya telah dipahami dengan jelas terkait mekanisme neovaskularisasi, proteksi miokardium, remodelling fisiologis, kontraktilitas, metabolisme serta regenerasi miokardium yang dijabarkan sebagai berikut:
Efek Protektif MSC terhadap Kardiomiosit
Efek parakrin MSC mempertahankan multipotensi MSC dan memproteksi kardiomiosit pada kondisi hipoksia. MSC yang dikondisikan pada stroma sumsum tulang yang hipoksik memiliki resistensi yang lebih besar terhadap hipoksia
dibanding kardiomiosit. MSC mengekspresikan VEGF, bFGF, HGF, IGF-1, Tβ4, adrenomedulin dan sfrp 2 yang memiliki efek protektif untuk kardiomiosit. VEGF, bFGF, HGF, IGF-1 dan Tβ4 yang disekresikan oleh MSC berinteraksi dengan reseptor growth factor pada kardiomiosit yang kemudian mengaktivasi PI-3K. PI-3K teraktivasi mengaktifkan Akt untuk menghambat pensinyalan pro apoptosis seperti BAD, BAX, FOXO3a dan Caspase.31,35 Efek anti apoptosis juga dihasilkan oleh stimulasi adrenomedulin yang mengaktivasi PI-3K melalui pensinyalan protein-G. Sfrp 2 juga merupakan faktor antiapoptosis potensial dengan mekanisme inhibisi Wnt3 melalui non canonical pathway serta inhibisi GSK-3β (sinyal apoptosis terkait mitokondria). MSC juga melepaskan sitokin IL-11 untuk memicu JAK kardiomiosit. JAK kemudian mengaktivasi STAT yang berperan dalam upregulasi gen survival pada kardiomiosit. Efek proteksi MSC pada kardiomiosit ditunjukkan oleh penurunan indeks apoptosis kardiomiosit terkait hipoksia setelah 72 jam terapi G-CSF.35
Mekanisme MSC dalam Neovaskularisasi
Neovaskularisasi merupakan penjelasan biologis atas efektivitas MSC dalam meningkatkan perfusi pasca infark. MSC menjalankan mekanisme angiogenesis melalui dua jalur, meliputi transdiferensiasi MSC menjadi endotel dan otot polos vaskuler serta stimulasi Endothelial Progenitor Cell (EPC). Transdiferensiasi MSC menjadi sel endotel dipengaruhi oleh upregulasi FGF, VEGF, angiopoetin-1 dan PDGF. Pasca diferensiasi, MSC menunjukkan fenotip endotel vaskuler meliputi von Willebrand factor dan VEGF serta marka sel angioblast (CD34+), VE-cadherin+,
6
Flk1+. Temuan marka CD44 menunjukkan aktivitas transdiferensiasi MSC menjadi sel endotel. Lebih lanjut, MSC memodulasi proliferasi dan migrasi sel endotel dan sel otot polos vaskuler untuk membentuk formasi vaskuler kolateral. Kemudian, MSC menstimulasi EPC melalui sekresi VEGF dan SDF-1. Diferensasi EPC menjadi endotel telah dibuktikan pada kasus atherosklerosis.10,35 Aspek Kontraktilitas MSC
Aktivitas kontraksi MSC yang sinkron dengan kardiomiosit didasari oleh kapasitas MSC sebagai pace maker biologis. MSC terbukti memproduksi faktor inotropik untuk memodulasi kontraksi sel. IGF-1 diidentifikasi berperan dalam peningkatan kontraktilitas MSC. Sistem deteksi edge to edge menunjukkan peningkatan pemendekan sel, maximal rate of lengthening (+dL/dt), dan maximal rate of shortening (-dL/dt) pada MSC35. Interaksi intersel melalui gap junction adalah mekanisme penting dalam kontraktilitas sel. Pada MSC ditemukan gap junction spesifik meliputi connexins (Cx) 40 and 43. Temuan ini didasarkan atas analisis imunohistokimia yang menunjukkan interaksi intersel MSC dan MSC-kardiomiosit via gap junction.35
Aktivitas MSC dalam Regenerasi Miokardium
Regenerasi miokardium adalah mekanisme terpenting dalam kardiomioplasti seluler terkait perbaikan fisiologis jantung pasca infark. Terdapat tiga mekanisme yang menunjukkan aktivitas MSC dalam regenerasi miokardium. Pertama, transdiferensiasi Akt-MSC sebagai kardiomiosit; kedua, melalui modulasi proliferasi kardiomiosit; dan ketiga, melalui perekrutan Cardiac Progenitor Cell (CPC). Pada kondisi patologis, proliferasi kardiomiosit dan aktivitas CPC tidak menunjukkan mekanisme regenerasi yang signifikan. Intervensi MSC melalui aktivitas parakrin menstimulasi fungsi regeneratif kardiomiosit dan CPC. Ketiga
mekanisme regenerasi miokardium yang diperankan MSC terkait dengan upregulasi HGF, IGF-1, VEGF, bFGF, dan SDF-1. Terkait transdiferensiasi, MSC melakukan fusi dengan kardiomiosit dan melepaskan bFGF dan HGF yang merupakan growth factor spesifik untuk menginisiasi ekspresi fenotip kardiomiosit. Mekanisme ini menggantikan kardiomiosit yang mengalami nekrosis dan berperan penting dalam mencegah pembentukan jaringan fibrotik, penipisan dinding ventrikel dan compensatory hypertrophy miokardium. Efek regenerasi miokardium MSC telah dapat dideteksi dalam 48 jam10,35.
Kardiomioplasti seluler sedang difokuskan pada efikasi MSC dalam regenerasi miokardium dan peningkatan mekanisme fisiologis jantung pasca IM.36 Berbagai riset ex vivo melalui prestimulasi diferensiasi MSC, menunjukkan ultrastruktur kardiomiosit, seperti myotube, sarkomer, nukleus pada posisi sentral, dan granula atrial. Fenotip kardiomiosit spesifik yang berhasil diidentifikasi adalah ANP, MLC2a, MLC2v, GATA4, Nkx2.5, MHC dan α-aktinin. Peningkatan kapasitas fungsional jantung pasca transplantasi MSC telah didemonstrasikan pada hewan model meliputi pencegahan remodeling patologis, peningkatkan hemodinamika pasca IM dan penurunan tekanan akhir diastolik pada ventrikel sinistra yang bermakna peningkatan relaksasi diastolik dan penurunan stres dinding ventrikel. Aktivitas angiogenesis MSC dalam meningkatkan perfusi miokardium ditemukan pada babi guinea dalam 8 minggu pasca implantasi.37
Efikasi klinik MSC dalam kardiomioplasti diinvestigasi secara kontinyu dan telah dipublikasikan keberhasilannya. Meta analisis Abdel, et.al38 dengan 6 studi kohort dan 12 randomized clinical trial MSC pada seting klinis pasca IM (follow up 3-12 bulan) menunjukkan overal effect yang signifikan, mencakup
peningkatan left ventricle ejection fraction (LVEF), penurunan luas infark dan fibrosis, serta penurunan left ventricle end systolic volume (LVESV). Clinical trial MSC terkait parameter fisiologis dilakukan oleh Strauer, et. al39 dengan hasil peningkatan kontraktilitas, serta penurunan area hipokinetik dan diskinetik. Peningkatan wall motion, peningkatan perfusi lokal dan koroner, peningkatan LVEF global dipublikasikan dalam clinical trial Fuchs, et al40, Hamano, et.al,41 dan Stamm, et.al42 Secara prosedural, konsensus mengenai keamanan transplantasi MSC telah dicapai. Tidak ditemukan adverse effects oklusi arteri koroner ataupun penolakan oleh sistem imun dalam administrasi MSC (intravena, intrakoroner, intra miokardium) pada kondisi tanpa imunosupresor.41
KONSTRUKSI DAN MEKANISME KERJA MICROCHIP SUBKUTAN UNTUK MEMFASILITASI TERAPI G-CSF
Microchip merupakan perangkat mikroelektronik yang telah diaplikasikan secara klinis untuk kepentingan penghantaran substansi terapi yang dapat dimodulasi. (penentuan tipe substansi, dosimetri, kontrol pelepasan substansi). Microchip berukuran sekitar 100 μm3 yang memuat beberapa kompartemen dengan jumlah bervariasi sesuai dengan metode mikropabrikasi43. Potensi aplikasi microchip sebagai teknologi dalam memfasilitasi terapi G-CSF terletak pada penerapan microchip sebagai komponen administrasi G-CSF. Microchip berperan sebagai kontainer G-CSF dalam dosis tertentu.
Bahan dasar ruang kompartemen microchip adalah silikon yang diproses dengan metode isotropic etch. Sementara, membran pelepasan obat microchip terbuat dari lapisan anode elektroda emas dan katode elektrolit NaCl yang menutupi jalan keluar substansi dari kompartemen microchip. Saat proses aktivasi microchip, katode-anode akan
mengalami reaksi membentuk Gold(III)Cl yang terlarut dalam cairan elektrolit sehingga substansi bisa keluar dari ruang microchip.44,45 Beberapa metode telah dipertimbangkan untuk pengisian substansi pada kompartemen dalam microchip. Metode terbaik yang dapat dipergunakan untuk pengisian obat adalah sistem inkjet. Sistem inkjet mempergunakan tabung kapiler kaca yang terhubung dengan ruang microchip.
Teknik pengisian dengan sistem inkjet menyingkirkan kemungkinan kontak subtansi dengan lingkungan dan mencegah kebocoran substansi ke ruang mikromachine yang lain. Namun metode ini memiliki kelemahan yaitu masuknya udara ke dalam kapiler. Udara di dalam ruang mikromachine dapat menyebabkan evaporasi obat sebelum dilakukan penyegelan. Hal tersebut dapat menyebabkan berkurangnya dosis yang telah ditentukan. Keterampilan teknis sangat dibutuhkan untuk mengatasi kelemahan tersebut.46 Setelah
Proses pengisian, kompartemen microchip yang telah disegel dengan membran pelepasan obat kemudian dikemas dalam bentuk kapsul. Kapsul terbuat dari materi kaca yang memiliki nano pori. Microchip kemudian dimasukkan ke dalam kapsul dan direkatkan pada dinding kapsul dengan menggunakan molekul adesif seperti UV curing epoxies dan polidimethilsiloxane elastomer (PDMS). Tahap selanjutnya adalah penambahan kapasitor dan antena mikro ke dalam kapsul yang berfungsi sebagai penerima sinyal pelepasan obat.46,47
Implantasi microchip subkutan menggunakan teknik Avid needle injection yang memfasilitasi masuknya kapsul microchip ke dalam jaringan subkutan. Dinding kapsul memungkinkan fiksasi microchip dengan jaringan subkutan secara stabil.47 Pelepasan obat oleh microchip dipicu oleh sinyal eksternal yang berasal dari transmiter radio frequency (RF). Aktivasi pelepasan obat dimulai
dengan menekan tombol pada remote RF dengan jangkauan maksimal 10 cm. Tombol pada remote RF merupakan kode perintah yang menentukan jumlah kompartemen yang akan melepaskan obat.
Gelombang remote kemudian diterima oleh receiver (mikro antena pada kapsul microchip) dan diteruskan pada voltgate regulator yang mengubah gelombang menjadi energi listrik sehingga terjadi peningkatan beda potensial. Peningkatan beda
potensial 2,5 volt akan mengakibatkan reaksi anode elektrode emas yang melapisi jalan substansi dengan katode elekrolit NaCl. Reaksi emas dengan Cl- akan menghasilkan Gold(III)Cl yang larut dalam cairan elektrolit. Lapisan emas yang menutupi jalan substansi akan terlarut sehingga obat keluar dari kompartemen microchip menuju organ target. Pelepasan obat dari kompartemen berlangsung dengan kecepatan 10µg/menit46.
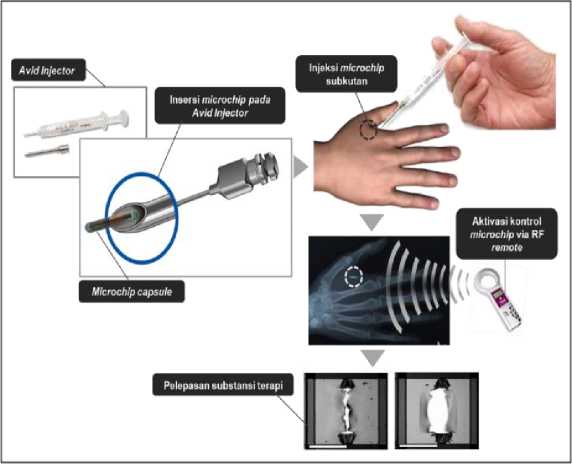
Gambar 2. Ilustrasi Implantasi Microchip Subkutan dan Mekanisme Pelepasan Substansi Terapi
Gelombang remote kemudian diterima oleh receiver (mikro antena pada kapsul microchip) dan diteruskan pada voltgate regulator yang mengubah gelombang menjadi energi listrik sehingga terjadi peningkatan beda potensial. Peningkatan beda potensial 2,5 volt akan mengakibatkan reaksi anode elektrode emas yang melapisi jalan substansi dengan katode elekrolit NaCl. Reaksi emas dengan Cl- akan menghasilkan Gold(III)Cl yang larut dalam cairan elektrolit. Lapisan emas yang menutupi jalan substansi akan terlarut sehingga obat keluar dari kompartemen microchip menuju organ target. Pelepasan obat dari kompartemen berlangsung dengan kecepatan 10µg/menit46.
Keunggulan microchip dibandingkan dengan sistem adminstrasi obat konvensional adalah kemampuan microchip dalam (1) mempertahankan konsentrasi obat pada organ target secara konstan; (2) mencegah fluktuasi peak-valley; (3) memperkecil dosis obat dan frekuensi obat; (4) menekan efek samping; dan (5) meningkatkan kepatuhan terapi. Microchip telah memenuhi standar etik dalam aplikasinya dan berhasil melalui fase clinical trial.48
PROSPEK IMPLEMENTASI TERAPI G-CSF VIA MICROCHIP SUBKUTAN PADA TRAVELER PASCA IM
Sasaran akhir terapi G-CSF pada traveler pasca IM adalah melakukan pencegahan komplikasi IM dan meningkatkan kapasitas fungsional jantung dalam menghadapi risiko selama travel. Potensi G-CSF sebagai terapi pasca IM ditentukan oleh efikasi terapi pada kasus remodelling patologis pasca IM dan implikasinya. Terdapat hubungan yang konsisten antara minimalisasi remodelling patologis dengan penurunan risiko kematian pasca IM.49
Terapi G-CSF terbukti memiliki efek terapi dalam kardiomioplasti pasca infark. Studi menunjukkan bahwa G-CSF memperbaiki end systolik volume (ESV) dan end dyastolic volume (EDV) ventrikel sinistra, ejection fraction, gangguan elektris serta mencegah IM residual. Efek tersebut menurunkan risiko kejadian aritmia ventrikel dan gagal jantung. Kemampuan mobilisasi MSC in situ, retensi pada zona infark yang hipoksik dan efek parakrin yang dihasilkan merupakan keunggulan terapi G-CSF dibandingkan dengan terapi MSC eksternal yang diimplantasikan intramiokardium ataupun intra koroner. Terapi G-CSF sekaligus mengeliminasi risiko graft vs host diseases. Rekomendasi riset terkait indikasi terapi G-CSF pada pasca IM adalah pada rentang 10-65 jam setelah pasien memperoleh reperfusi melalui PCI ataupun CABG dengan dosis 10 µg/kg BB subkutan per hari. Mobilisasi MSC menuju miokardium sudah dapat dideteksi dalam 24 jam pasca administrasi G-CSF. Dalam penggunaan jangka panjang, terapi G-CSF merupakan terapi yang terbukti aman dan dapat ditoleransi dengan baik oleh tubuh. Beberapa subjek mengeluhkan nyeri muskuloskeletal ringan sampai sedang dalam enam hari terapi. Kontraindikasi terapi G-CSF adalah pada pasien dengan kanker, leukositosis dan hipersensitif terhadap G-CSF. Terapi G-CSF belum dapat direkomendasikan pada pasien gagal ginjal dan kehamilan.50
Aplikasi microchip sebagai perangkat teknologi transfer G-CSF pada traveler pasca IM direkomendasikan atas dasar adanya kebutuhan transfer G-CSF yang stabil dan kontinyu, diperlukan tingkat kepatuhan terapi yang tinggi, pentingnya self-controlled therapy pada traveler serta kebutuhan terapi jangka panjang yang dapat dilakukan selama travel. Microchip sebagai perangkat administrasi G-CSF subkutan terbukti aman untuk diimplantasikan dalam jangka waktu yang lama. Jaringan subkutan merupakan lokasi potensial untuk implantasi microchip jangka panjang. Jaringan subkutan memiliki reaktivitas yang rendah terhadap komponen microchip dan risiko toksisitas sistemik yang minimal jika dibandingkan dengan administrasi parenteral. Penggunaan kapsul dengan materi kaca dan emas sebagai komponen microchip telah direkomendasikan oleh FDA terkait aspek biokompaitibilitas35. Tidak ditemukan efek imunogenik pada penggunaan emas sebagai komponen microchip. Penggunaan emas sebagai perangkat terapi yang diinternalisasi pada organ tubuh dibuktikan keamanannya pada transfer gen transdermal dan reumatoid arthritis.46
G-CSF tetap stabil pada penyimpanan intra kompartemen microchip jangka panjang. Pelepasan G-CSF secara kontinyu via microchip memungkinkan akurasi dosis, toksisitas yang minimal, peningkatan efikasi terapi dan penentuan waktu terapi yang tepat. Penyesuan dosis selama terapi dapat dimodulasi secara eksternal dengan menggunakan remote RF. Data mengenai kepatuhan terapi dengan implant microchip dipublikasikan oleh Santini et al51 pada terapi hormon paratiroid jangka panjang untuk penatalaksanaan osteoporosis, dengan tingkat kepatuhan 100%. Hingga saat ini, perkembangan terapi microchip telah memasuki fase aplikasi pada terapi insulin, osteoporosis, kanker dan glaukoma dengan tingkat kepatuhan
yang baik46. Lebih jauh, microchip berpotensi mengatasi kelemahan implantasi MSC eksternal intramiokardium/intrakoroner pada traveler pasca IM yang dipandang kurang efisien selama travel. Efikasi terapi G-CSF dalam kardiomioplasti seluler pasca IM dan potensi microchip memberikan gambaran implementasi dalam praktik travel medicine. Implantasi microchip pada traveler pasca IM dapat memiliki prospek sebagai terapi preventif pra travel.
SIMPULAN DAN SARAN
Berdasarkan analisis dan sintesis dapat disimpulkan beberapa hal sebagai berikut:
-
1. Mekanisme G-CSF sebagai modulator MSC dalam kardiomioplasti seluler mencakup mobilisasi dan homing MSC. Mobilisasi MSC via stimulasi G-CSF diperankan oleh kemokin SDF-1 dan reseptornya CXCR4. G-CSF menekan efek SDF-1 pada sumsum tulang melalui pelepasan protease. Pelepasan protease mendisrupsi interaksi SDF-1/CXCR4 sehingga terjadi pelepasan MSC menuju sirkulasi dan proses homing MSC menuju zona infark pada miokardium. Multipotensi dan sekresi parakrin mendasari efek kardiomioplasti seluler MSC yang meliputi proteksi kardiomiosit pada kondisi hipoksik, neovaskularisasi, pemulihan
kontraktilitas dan regenerasi miokardium.
-
2. Konstruksi kompartemen microchip adalah silikon yang dilapisi oleh membran pelepasan obat (elektroda emas). Pengisian G-CSF ke dalam microchip menggunakan metode inkjet. Microchip dikemas dalam bentuk kapsul yang diimplantasikan secara subkutan dengan menggunakan metode avid injection. Pelepasan G-CSF oleh microchip dikontrol secara eksternal via remote RF yang memicu peluruhan membran microchip.
-
3. Sasaran akhir terapi G-CSF pada traveler pasca IM adalah melakukan pencegahan komplikasi IM dan meningkatkan kapasitas fungsional jantung dalam menghadapi risiko selama travel. Keberhasilan reperfusi (PCI/CABG) pada pasien dapat menjadi prosedur yang penting sebelum dilakukan implantasi microchip.
Konsep aplikasi microchip sebagai perangkat terapi G-CSF merupakan suatu proses transfer gagasan yang perlu dikonfirmasi potensinya melalui serangkaian penelitian lebih lanjut. Teknologi microchip memiliki keterbatasan struktural dalam melakukan transfer substansi terapi dosis tinggi jangka panjang, sehingga diperlukan pengkajian dalam mikropabrikasi microchip. Diperlukan analisis lebih komprehensif mengenai implementasi terapi G-CSF pada traveler pasca IM dalam aspek travel medicine.
DAFTAR PUSTAKA
-
1. World Tourism Organization. Promoting Tourism for Sustainable Development and Poverty Reduction 2011. Available from URL: http://unwto.org/en/event/unwto-activities-itb-2011. Accessed Januari 11, 2012
-
2. ITB World Travel Trends Report 2010/2011. IPK International. 2011; 1-26
-
3. Zuckerman, JN. Recent developments, Travel medicine. BMJ. 2007;325:260-264.
-
4. Thomas R, Hinds C W, Morgan P, Mason D, Hildick S. Safety of aeromedical repatriation after myocardial infarction: a retrospective study. Heart. 2006; 92:1864–1865.
-
5. Véronique L, Roger, A S, Donald M, Lloyd J, Robert J, Adams, JD, et. al. Heart Disease and Stroke Statistics 2011 Update. Circulation. 2011;123:18-209.
-
6. Willem JK, Vingerhoets GK, John S. G. Risk Factors For Myocardial Infarction During
11
Vacation Travel. Psychosomatic Medicine. 2007; 65:396–401.
-
7. Andrew J. E, Daniel P, Feifei Y, Lin Y, Peter W, Groeneveld. Coronary Revascularization Trends in the United States. JAMA. 2011; 305: 1769-1776.
-
8. Stefan F, Johann B, and Georg E. Post-infarct remodelling: contribution of wound healing and inflammation. Cardiovascular Research. 2009; 81: 474–481.
-
9. McKay RG, Pfeffer MA, Pasternak RC, Markis JE, Come PC, Nakao S, et. al. Left ventricular remodeling after myocardial infarction: a corollary to infarct expansion. Circulation. 2005; 74:693–702.
-
10. Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, et. al. Multilineage potential of adult human mesenchymal stem cells. Science. 2004; 284:143–147
-
11. Wagner W, Wein F, Seckinger A. Comparative characteristics of mesenchymal stem cells from human bone marrow, adipose tissue, and umbilical cord blood. Exp Hematol. 2005;33:1402–16.
-
12. I. Kan, E. Melamed and D. Offen. Integral Therapeutic Potential of Bone Marrow Mesenchymal Stem Cells. Current Drug Targets. 2005; 6: 1-11.
-
13. Fernández, M. Simon, V. Herrera, G. Cao, C. Del, H. Minguell. Peripheral Blood MSC Isolation in Breast Cancer Patient Treated with G-CSF. Bone Marrow Transplant. 2006; 20:259-265.
-
14. Kassis L, L Zangi, R Rivkin, L Levdansky, S Samuel. Isolation of mesenchymal stem cells from G-CSF-mobilized human peripheral blood using fibrin microbeads. Bone Marrow Transplantation. 2006; 37: 967–976.
-
15. Smith S, Tang T, Stevenson J, Flynn B, Reekie H, Murray A, et.al. Miniaturised drug delivery
system with wireless power transfer and communication. Inst. Eng. Technol. 2006; 155–162.
-
16. Calvi LM, Adams GB, Weibrecht KW. Osteoblastic cells regulate the haematopoietic stem cell niche. Nature. 2003;425:841–6.
-
17. Horwitz EM, Le Blanc K, Dominici M. Clarification of the nomenclature for MSC:The international society for cellular therapy position statement. Cytotherapy. 2005;7:393– 5.
-
18. Kotobuki, N. Hirose, M. Takakura, Y Ohgushi, H. Mesenchymal Stem Cell Proliferation in vitro. Artificial Organs. ,2004; 28-33.
-
19. Gronthos S, Simmons PJ. The growth-factor requirements of Stro-1-positive humanbone marrow stromal precursors under serum-deprived conditions in-vitro. Blood. 1995;85:929–40.
-
20. Quirici N, Soligo D, Bossolasco P, Servida F, Lumini C, Deliliers GL. Isolation of bone marrow mesenchymal stem cells by anti-nerve growth factor receptor antibodies. Exp Hematol. 2002;30:783–9.
-
21. Jones EA, English A, Kinsey S. Optimization of a flow cytometry-based protocol for detection and phenotypic characterization of multipotent mesenchymal cells from human bone marrow. Cytometry Part B: Clin Cytometry. 2006;70:391–9.
-
22. Jones EA, Kinsey SE, English A. Isolation and characterization of bone marrow multipotential mesenchymal progenitor cells. Arthritis Rheum. 2002;46:3349–60.
-
23. Jarocha D, Lesko E, Ratajczak MZ, Majka M. Comparison of different strategies of MSC isolation revels advantage to expand MSC directly from purified CD105(+) and
CD271(+) cells. Blood. 2006;108:725A.
12
-
24. Colter DC, Class R, DiGirolamo CM, and Prockop DJ. Rapid expansion of recycling stem cells in cultures of plastic-adherent cells from human bone marrow. Proc Natl Acad Sci USA. 2000; 97: 3213–3218.
-
25. Satomura K, Derubeis AR, Fedarko NS, Ibaraki-O’Connor K, Kuznetsov SA, Rowe DW, Young MF, Gehron Robey P. Receptor tyrosine kinase expression in human boen marrow stromal cells. J Cell Physiol. 1998; 177:426–438.
-
26. Reading L, Still K, Bishop N, Scutt A. Peripheral blood as an alternative source of mesenchymal stem cells. Bone. 2000; 26:9-17
-
27. Mosca JD, Hendricks JK, Buyaner D, Davis J, Chuang LC, Majumdar MK, et al. Mesenchymal stem cells as vehicles for gene delivery. Clin Orthop. 2000;71–90
-
28. Wang L, Li Y, Chen J, Gautam SC, Zhang Z, Lu M, et.al. Ischemic cerebral tissue and MCP-1 enhance rat bone marrow stromal cell migration in interface culture. Exp Hematol. 2002;30:831–836.
-
29. Lapidot T, Petit I. Current understanding of stem cell mobilization: the roles of
chemokines, proteolytic enzymes, adhesion molecules, cytokines, and stromal cells. Exp Hematol. 2002;30:973–981.
-
30. Smart N and Riley P R. The Stem Cell Movement. Circ. Res. 2008;102: 1155-1168.
-
31. Penn M S and Mangi A. Genetic Enhancement of Stem Cell Engraftment, Survival, and Efficacy. Circ. Res. 2008;102:1471-1482.
-
32. Isabelle P, Martine S-K, Arnon N, Meir L, Amnon P, Liliana H, et.al. G-CSF Induces Stem Cell Mobilization By Decreasing Bone Marrow SDF-1 And Up-Regulating CXCR4. Nature Immunology. 2002; 3 (7):687-787.
-
33. Schenk S, Mal N, Finan A, Zhang M, Kiedrowski M, Popovic Z, et.al. Monocyte
chemotactic protein-3 is a myocardial mesenchymal stem cell homing factor. Stem Cells. 2007;25:245–251.
-
34. Askari A, Unzek S, Popovic ZB, Goldman CK, Forudi F, Kiedrowski M, et.al. Effect of stromal-cell-derived factor-1 on stem cell homing and tissue regeneration in ischemic cardiomyopathy. Lancet. 2003;362:697–703.
-
35. Gnecchi M, Zhang Z, Ni A, and Dzau V J. Paracrine Mechanisms in Adult Stem Cell Signaling and Therapy. Circ. Res. 2008; 103: 1204-1219.
-
36. Anversa P, Nadal-Ginard B. Myocyte renewal and ventricular remodeling. Nature. 2005;415:240–243
-
37. Caparrelli DJ, Cattaneo SM, Shake JG, Flynn EC, Meyers J, Baumgartner WA, et.al. Cellular myoplasty with mesenchymal stem cells results in improved cardiac performance in a swine model of myocardial infarction. Circulation. 2006;104:589-599.
-
38. Abdel-L A, Bolli R, Tleyjeh I M, Montori V M, Perin E, Hornung A, et.al. Adult Bone Marrow–Derived Cells for Cardiac Repair: A Systematic Review and Meta-analysis. Arch Intern Med. 2007;167:989-997.
-
39. Strauer BE, Brehm M, Zeus T. Repair of infarcted myocardium by autologous intracoronary mononuclear bone marrow cell transplantation in humans. Circulation.
2002;106:1913–18.
-
40. Fuchs S, Satler LF, Komowski R. Catheterbased autologous bone marrow myocardial in no-option patients with advanced coronary artery disease: a feasibility study. Jam Coll Cardiol. 2003;41:1721–4.
-
41. Hamano K, Nishida M, Hirata K. Local implantation of autologous bone marrow cells for therapeutic angiogenesis in patients with ischemic heart disease: clinical trial and
preliminary results. Jpn Circulation J. 2001;65:845–7.
-
42. Stamm C, Westphal B, Kleine HD. Autologous bone marrow stem-cell transplantation for myocardial regeneration. Lancet.
2003;361:45–6.
-
43. Sinha P, Valco G, Sharma S, Liu X, and Ferrari M. Nanoengineered device for drug delivery application. Nanotechnology. 2004; 15: 585– 589
-
44. Sarah L T, and Tejal A D. Microfabrication of Multilayer, Asymmetric, Polymeric Devices for Drug Delivery. Advance Mater. 2005; 17: 1625-1630
-
45. Sharma G S, Srikanth M, Uhumwangho M, Phani K and Ramana M. Recent trends in pulsatile drug delivery systems. International Journal of Drug Delivery. 2010; 2: 200-212.
-
46. Smith T B, Tang J G, Terry J T, Stevenson B W, Flynn H M, Reekie. Development of a miniaturised drug delivery system with wireless power transfer and communication. IET Nanobiotechnol. 2011; 1(5): 80–86.
-
47. Zachary H, Nicholas A P. Microfabricated drug delivery devices. International Journal of Pharmaceutics. 2005; 306: 15–23.
-
48. Bussemer T, Otto I, Bodmeier R. Pulsatile drug delivery systems. Crit Rev. Ther Drug Carrier Syst. 2001;18(5):433-58.
-
49. Ahmed A L, Roberto B, Ewa K, Imad M T, Carlton A H, and Buddhadeb D. G-Csf Therapy For Cardiac Repair After Acute Myocardial Infarction: A Systematic Review And Metaanalysis Of Randomized Controlled Trials. Am Heart J. 2008; 156(2): 216–226.
-
50. Rasmus S R, Erik J, Yongzhong W, Jens J T, Jens C N, Lars S, et al. Placebo-Controlled Stem Cells in Myocardial Infarction (STEMMI) Trial Myocardial Infarction : Result of the Double-Blind, Randomized,
Stimulating Factor to Improve Cardiac Regeneration After Acute ST-Elevation Stem Cell Mobilization Induced by Subcutaneous Granulocyte-Colony. Circulation. 2006; 113: 1983-1992.
-
51. Santini J, Cima M, and Langer R. A controlled-release microchip. Nature. 1999; 397: 335–338
14
Discussion and feedback