POTENSI FOTODINAMIK SEBAGAI MODALITAS TERAPI ALTERNATIF NON INVASIF PADA ORAL CANCER STADIUM DINI:
on
ARTIKEL TINJAUAN PUSTAKA
Essence of Scientific Medical Journal (2022), Volume 20, Number 43-54

P-ISSN.1979-0147, E-ISSN. 2655-6472
TINJAUAN PUSTAKA
POTENSI FOTODINAMIK SEBAGAI MODALITAS TERAPI ALTERNATIF NON INVASIF PADA ORAL CANCER STADIUM DINI: TINJAUAN EFIKASI DAN PROFIL KEAMANAN
Timotius William Yusuf1, Jason Chen1, Vincentius Mario Yusuf2
ABSTRAK
Pendahuluan: Oral cancer didefinisikan sebagai keganasan yang terjadi pada kavitas oral dan kini menempati 10 besar penyebab kanker tertinggi sedunia. Tingkat mortalitas oral cancer masih tinggi dengan five-year survival rate hanya mencapai 50-60%. Tatalaksana saat ini bersifat invasif, berisiko tinggi, dengan berbagai efek samping yang berpotensi tinggi mengurangi efektivitas terapi hingga quality of life pasien. Berdasarkan studi terdahulu, fotodinamik merupakan modalitas terapi alternatif oral cancer stadium dini yang menjanjikan karena bersifat selektif dan non invasif dengan efikasi serta outcome klinis yang baik. Tinjauan pustaka dibuat dengan kriteria PICO dari studi klinis yang memenuhi kriteria inklusi. Studi diekstraksi dari database “PubMed”, “ScienceDirect”, dan “SpringerLink” menggunakan metode pencarian “boolean operator”.
Pembahasan: Terdapat total 11 studi klinis yang memenuhi kriteria inklusi dan menyatakan terapi fotodinamik efektif dalam tatalaksana oral cancer stadium dini. Efikasi klinis dilihat dari tingkat complete response dan survival rate yang baik disertai tingkat rekurensi yang rendah. Mekanisme yang melatarbelakangi efikasi yakni eksitasi photosensitizer memicu produksi reactive oxygen species yang mengakibatkan destruksi sel kanker. Selain itu juga ditemukan paparan fotodinamik dapat menyebabkan shut-down pembuluh darah jaringan tumor dan aktivasi sistem imun. Efek samping yang paling umum ditemukan adalah nyeri, pembengkakan, dan fotosensitivitas. Secara garis besar, efek samping tidak bersifat fatal, dapat dikendalikan dan tidak menyebabkan dampak fungsional maupun estetik yang persisten.
Simpulan: Fotodinamik efektif sebagai modalitas terapi alternatif non invasif pada oral cancer stadium dini dengan efikasi klinis dan profil keamanan yang baik.
Kata kunci: Oral Cancer, Photosensitizer, Stadium dini, Terapi Fotodinamik.
ABSTRACT
Introduction: Oral cancer is defined as a type of malignancy that occurs in the oral cavity and occupies the top 10 leading causes of cancer worldwide. Oral cancer mortality rate is high with a five-year survival rate of only 50-60%. The current treatment is invasive, risky, with severe complications that can reduce therapy efficacy and patients’ quality of life. Based on previous studies, photodynamics is a promising alternative therapy for oral cancer because of its selective non-invasive traits and good clinical results. This literature review was done based on PICO and determined inclusion criterias. Studies were extracted from “PubMed”, “ScienceDirect”, and “SpringerLink” databases using “boolean operator” search method.
Discussion: There were a total of 11 clinical studies that met the inclusion criteria and stated that photodynamic therapy was effective in the treatment of oral cancer. Clinical efficacy is seen from high complete response rates and survival rates accompanied by low recurrence rates. The mechanism underlying its efficacy is photosensitizer excitation triggers the production of reactive oxygen species that lead to the destruction of cancer cells. It was also found that photodynamic exposure can cause shut- down of tumor tissue blood vessels and activation of immune system. The most common side effects are pain, swelling, and photosensitivity. In general, side effects found are not fatal, can be controlled and do not cause lasting functional or aesthetic impacts. Conclusion: Photodynamic is effective as a non-invasive therapy modality in oral cancer with good clinical efficacy and safety profile.
Keywords: Early Stage, Oral Cancer, Photosensitizer, Photodynamic therapy.
-
1 Pendidikan Dokter Gigi, Fakultas Kedokteran Gigi, Universitas Trisakti, Jakarta Barat
-
2 Pendidikan Dokter, Fakultas Kedokteran, Universitas Brawijaya, Malang
PENDAHULUAN
Oral cancer didefinisikan sebagai neoplasma ganas yang muncul pada bibir atau rongga mulut. Penyakit ini secara tradisional didefinisikan sebagai OSCC (oral squamous cell carcinoma). Insiden oral cancer menempati peringkat sepuluh besar jumlah kanker terbanyak di dunia.[1] Berdasarkan WHO Cancer Register, diperkirakan terdapat 350 kasus baru dan 50 ribu kematian tercatat pada tahun 2017. Oral cancer merupakan penyakit serius dengan hanya setengah dari total pasien yang bertahan hidup dalam jangka lima tahun setelah diagnosis (50-60% five-year survival rate). [2] Hingga kini oral cancer menjadi salah satu penyakit keganasan yang sering terjadi di negara berkembang, salah satunya Indonesia. Berdasarkan data dari WHO, terdapat 5.780 kasus baru, 3.087 kematian dan 5 tahun prevalensi oral cancer sebanyak 14.197 kasus di Indonesia.[3]
Lebih dari 90% tumor ganas di daerah mulut adalah SCC (squamous cell carcinoma) yang berasal
dari epitel mukosa.[4] Etiologi terjadinya karsinogenesis SCC merupakan proses multifokal sangat kompleks yang terjadi ketika epitel squamosa dipengaruhi oleh berbagai perubahan genetik.[5] OSCC (oral squamous cell carcinoma) muncul dari lapisan epitel dari rongga mulut dengan fitur histopatologis khas berupa “conventional” squamous cell carcinoma. Kriteria untuk menentukan diagnosis karsinoma adalah adanya invasi sel epitel melalui membran basal ke jaringan ikat superfisial. Invasi dimulai melalui proses penyusupan (breaching) dari beberapa sel atau pulau epitel kecil, dan berprogesi menjadi infiltrasi pada submukosa ataupun tulang oleh lembaran dan pulau-pulau sel ganas. Proses invasi ini memunculkan tanda klinis klasik berupa indurasi yang terfiksasi pada jaringan di bawahnya. Lesi dengan ukuran lebih besar dapat berkembang melebihi suplai darahnya, sehingga menimbulkan tanda klinis ulserasi pada permukaan tumor. Pada pemeriksaan mikroskopis, semua squamous cell carcinoma memiliki komponen invasif, di mana pulau
tumor dapat diliat pada permukaan epitel bagian dalam.[4]
Pada oral cancer, merokok dan alkohol dianggap sebagai faktor risiko utama yang terdapat pada 90% kasus, melakukan keduanya dapat menimbulkan efek sinergis. [1] Konsumsi tembakau terus menjadi risiko kanker oral yang paling prominen karena diperkirakan menyebabkan jutaan kematian setiap tahunnya.[6] Alkohol (etanol) meningkatkan permeabilitas mukosa mulut, melarutkan komponen lipid/ lemak dari epitel, menyebabkan atrofi epitel dan gangguan pada sintesis dan perbaikan DNA; juga memiliki efek genotoksisitas dan mutagenik, penggunaan kronisnya dikaitkan dengan penurunan kekebalan bawaan dan adaptif, mengakibatkan peningkatan kerentanan terhadap infeksi dan neoplasma.[1]
Terdapat berbagai cara kuratif dalam penatalaksanaan oral cancer, umumnya dilakukan dengan tindakan pembedahan, kemoterapi, dan radioterapi yang dapat dilaksanakan secara individual maupun bersamaan.[7] Tindakan pembedahan menjadi penanganan utama terhadap penatalaksanaan oral cancer stadium dini seperti pengangkatan tumor primer, manajemen dari limfonodi servikal, dan lain-lain.[8] Meskipun tindakan pembedahan adalah penanganan yang ideal untuk oral cancer, lokasi lesi yang terdapat pada struktur-struktur organ kritis seperti arteri karotis, basis cranii, rongga orbital, dan rongga intrakranial menjadi limitasi tindakan operatif karena bersifat invasif dan berisiko tinggi. [9] Hal tersebut juga didukung dengan penurunan quality of life (QOL) pasien yang umumnya membutuhkan tindakan pembedahan rekonstruktif setelah pembedahan resektif pada tumor. Tindakan ini dilakukan akibat kehilangan gigi dan keberadaan luka pasca operasi yang menyebabkan kehilangan fungsi dan estetik dalam jaringan yang sehat.[7,11] Meskipun kemoterapi dan radioterapi merupakan pilihan kedua terbaik setelah tindakan pembedahan, efikasi dan pengaplikasian kemoterapi dan radioterapi terhadap pasien sering terganggu dikarenakan risiko kardiositotoksisitas, nefrotoksisitas, myelosupresi, neurotoksisitas, dan hepatotoksisitas yang mengurangi QOL dari pasien dan berpotensi mengakibatkan efek samping lain terhadap pasien kanker. [11]
Terapi fotodinamik telah muncul sebagai pilihan terapi alternatif atau lini kedua potensial terhadap oral cancer superfisial primer pada stadium dini dengan tingkat invasif yang minimal.[13] Rangkaian terapi fotodinamik meliputi injeksi dari obat photosensitizing (PS) sistemik yang diaktivasi dengan reaksi fotokimia melalui pemberian cahaya pada panjang gelombang tertentu pada situs tumor. Hal tersebut akan memicu produksi dari reactive oxygen species (ROS) dan mengakibatkan oksidasi molekular yang berakibat pada penghancuran dari neoplasma. Terapi ini dapat mendestruksi jaringan tertentu secara spesifik dengan interaksi antara oksigen, cahaya, dan PS sistemik. [12-14]
Ada beberapa kelebihan dari metode terapi fotodinamik, yakni: (1) Terapi fotodinamik tidak menyebabkan toksisitas sistemik; (2) Terapi dapat menghancurkan tumor secara selektif selagi mempertahankan keberadaan jaringan normal; (3)
Terapi ini dapat diulangi kembali di area anatomi yang sama tanpa komplikasi terhadap terapi selanjutnya; (4) Terapi fotodinamik meminimalisir pembentukan bekas luka hasil operasi lebih baik dibandingkan dengan tindakan pembedahan atau radioterapi sehingga meningkatkan QOL dari pasien; (5) Penanganan ini dapat dilakukan sebelum atau setelah dilakukannya penanganan secara
konvensional. [10] Namun disisi lain terapi fotodinamik dapat menimbulkan berbagai komplikasi seperti nyeri, fotosensitisasi residual, hingga edema/pembengkakan yang dapat menyebabkan dispnea dan disfagia pada pasien, sehingga terapi simtomatik, adjuvan, dan rehabilitatif
direkomendasikan selama pasien menjalani terapi.[7,10]
Berdasarkan temuan dan urgensi yang telah dipaparkan di atas, penulis memiliki sebuah inisiasi untuk melakukan tinjauan pustaka mengenai efektivitas fotodinamik sebagai modalitas terapi alternatif yang bersifat non invasif dengan efikasi klinis yang baik dalam terapi oral cancer.
Kajian pustaka dilakukan dengan pencarian jurnal sesuai kriteria inklusi melalui database PubMed, ScienceDirect, dan SpringerLink. Strategi pencarian artikel menggunakan boolean operator dengan kata kunci “Photodynamic therapy”, “Photodynamic chemotherapy”, “Oral cancer”, “Oral squamous cell carcinoma”, dan “Therapy”. Kriteria inklusi jurnal adalah 1) rentang tahun publikasi 20112021, 2) studi klinis orisinil berbahasa inggris, dan 3) memenuhi framework PICO (Tabel 1).
Tabel 1. Kriteria Inklusi Kajian Pustaka berdasarkan PICO Framework
Kriteria Inklusi
I----------------------------------------------------11
Problems Oral Cancer
I----------------------------------------------------11
Intervention Penggunaan fotodinamik
sebagai modalitas terapi
I----------------------------------------------------11
Comparation Outcome sebelum dan
sesudah intervensi atau fotodinamika dengan tindakan operatif
I----------------------------------------------------1------------------------------------------------------------------------------------------------1
Outcome • Respons Terapi
-
• Tingkat rekurensi
-
• Survival rate
-
• Profil Keamanan
Penelusuran dan evaluasi artikel berdasarkan kriteria inklusi dilakukan oleh ketiga penulis untuk menurunkan potensi bias akibat seleksi studi antar penulis. Berdasarkan hasil penelusuran artikel didapatkan 583 jurnal pada pencarian awal dan didapatkan 17 jurnal yang valid karena jurnal yang lainnya tidak memenuhi kriteria inklusi (n=566). Pada akhirnya, hasil analisis full text didapatkan 11 jurnal akhir karena jurnal yang lainnya terduplikasi antar database (n=6). Alur seleksi studi dirangkum dalam diagram alur pada Gambar 1. Karakteristik studi dilaporkan pada Lampiran 1.
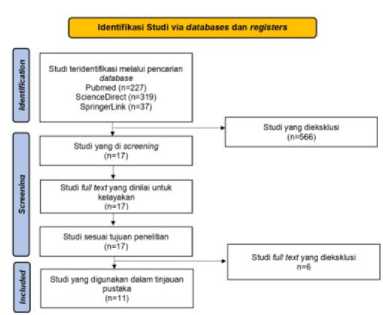
Gambar 1. Diagram Flow Alur Pencarian Artikel
HASIL & PEMBAHASAN
Efikasi Terapi Fotodinamik dalam Tatalaksana Oral Cancer
Sebelas studi clinical trial yang memenuhi kriteria inklusi membahas potensi penggunaan fotodinamik sebagai terapi alternatif dalam penatalaksanaan oral cancer stadium dini. Semua studi klinis yang dikaji memaparkan adanya persetujuan dari komite kajian etik uji klinis setempat. Sampling dari studi-studi yang dikaji dilakukan dengan menawarkan fotodinamik sebagai opsi alternatif pada pasien dengan oral cancer yang persisten dari terapi sebelumnya, rekuren, dianggap tidak eligible ataupun menolak tindakan standar (salvage surgery/reirradiation). Pasien yang menyetujui dievaluasi eligiblitasnya oleh tim multidisipliner, pasien yang dianggap layak diberikan penjelasan risk-benefit serta diminta informed consent tertulis sebelum dilakukan intervensi. Secara umum, rangkuman hasil tinjauan digambarkan pada Tabel 2.
Dari hasil didapatkan fakta bahwa penggunaan terapi fotodinamik efektif dalam penatalaksanaan oral cancer. Efektivitas yang dimaksud dilihat dari tingkat complete response yang baik, tingkat rekurensi yang rendah, dan survival rate yang baik dalam penatalaksanaan oral cancer dengan menggunakan terapi fotodinamik.
Beberapa studi melaporkan penanganan oral cancer stadium dini dengan terapi fotodinamik menggunakan PS mTHPC paling sering digunakan karena menghasilkan outcome klinis yang relatif baik.[12-17] Hal ini dikarenakan PS mTHPC dapat mengeksitasi gelombang lebih panjang sehingga dapat mencapai penetrasi jaringan lebih baik dibandingkan dengan PS photofrin. Temuan ini didukung oleh studi oleh Jerjes di mana tingkat complete response sebesar 81%, dengan tingkat rekurensi sebesar 11.6 %, dan 5-year survival rate sebesar 84.2 %.[16] Menurut RECIST, complete response didefinisikan sebagai hilangnya semua lesi target setelah penanganan, sedangkan partial response yaitu ketika terjadi setidaknya penurunan sekitar 30 persen jumlah diameter lesi target dibandingkan diameter awal. Berbeda dengan studi oleh Jerjes, studi oleh Karakullukcu yang
menggunakan mTHPC melaporkan hasil tingkat complete response sebesar 45 %, partial response sebesar 40 % dan no change sebesar 25 % dengan tingkat rekurensi 25 %.[14] Hal ini dikarenakan pada penatalaksanaan terapi, ada kemungkinan terjadinya “geographical miss” atau dalam kata lain, sebuah area yang tidak menerima dosis cahaya yang cukup pada margin lesi yang diterapi tersebut.[14]
Hasil studi Durbec tahun 2013 menunjukkan persentase complete response sebesar 93.%, namun terdapat rekurensi sebesar 53.%.[18] Hal ini dapat terjadi dikarenakan beberapa faktor, pertama, anatomi rongga mulut sering mengalami keadaan abnormal berupa mulut tidak terbuka secara adekuat atau mikrostomia sebagai akibat pengobatan sebelumnya. Hal ini dapat menghalangi paparan homogen menuju area tumor sehingga penyinaran tidak merata dan meningkatkan resiko terjadinya rekurensi. [18]
Studi oleh Ikeda pada tahun 2018 melaporkan 25% pasien tetap menunjukkan partial response setelah diberi dua kali terapi fotodinamik dengan PS talaporfin sodium. Hal ini diperkirakan karena administrasi talaporfin sodium yang tidak adekuat ke dalam lesi tumor ganas. Sehingga menghasilkan hasil prognosis yang buruk. [7] Studi dari Ikeda pada tahun 2013 menunjukkan persentase rekurensi sebesar 12 %. Hal ini dikarenakan PS yang digunakan yakni photofrin memiliki panjang gelombang eksitasi sebesar 630 nm yang hanya dapat menembus jaringan hingga kedalaman 10 mm. Sehingga ditemukan adanya sisa tumor di dasar mulut pada satu pasien, bersamaan dengan rekurensi pasien lain pada langit-langit mulut atau mulut bagian palatal. Palatal dan dasar mulut memiliki struktur yang kompleks di dalam rongga mulut, dengan kedua tempat memiliki permukaan yang tidak teratur sehingga sulit untuk secara akurat menyinari struktur yang non-homogen. Oleh karena itu, kedalaman penetrasi yang tidak cukup dengan struktur yang kompleks mungkin menjadi faktor atas keberadaan sel tumor residual. [10]
Dalam studi oleh Toratani dengan menggunakan PS photofrin, rekurensi pada lesi tumor merah lebih tinggi secara signifikan dibandingkan lesi putih (p=0.011).[19] Hal ini dipengaruhi faktor perbedaan warna pada lesi, di mana warna lesi bergantung pada derajat keratinisasi dan vaskularisasi, lesi putih memiliki tingkat keratinisasi yang tinggi sedangkan lesi merah mengandung banyaknya pembuluh darah. Hemoglobin pembuluh darah mengurangi absorbsi intensitas cahaya pada terapi PS photofrin, menyebabkan penetrasi lesi merah kurang efektif. Aktivasi photofrin yang lebih rendah pada lesi tumor merah menyebabkan respon klinis yang lebih buruk dibandingkan tumor lesi putih. Studi ini didukung dengan studi oleh Ikeda di mana keterbatasan kedalaman penetrasi merupakan salah satu kelemahan dalam penggunaan PS photofrin dan disarankan penggunaan PS generasi kedua seperti mTHPC dalam terapi fotodinamik.[19]
Tabel 2. Tabel Rangkuman Efikasi Terapi Fotodinamik
|
Penulis |
Response Rate (%) |
Recurrence (%) |
Survival Rate | ||
|
CR |
PR |
NC | |||
|
Toratani et al., 2016[19] |
88.2 |
8.8 |
2.9 |
26.5 |
|
|
de Visscher et al., |
Intervensi • TI: 86 •T2: 63 |
Intervensi • TI: 28.6 • T2: 53.3 |
Overall Survival Intervensi • TI: 101.5 bulan • T2: 116.9 bulan | ||
|
2013[15] r |
I Kontrol: • T1: 76 •T2:79 |
I |
Kontrol: • T1: 29.3 • T2: 24.2 |
I Overall Survival Kontrol: • T1: 122.6 bulan • T2: 109.5 bulan | |
|
Ikeda et al., 2013[10] |
96 |
4 |
- |
12 |
• Disease-specific survival: 95.8% |
|
Ikeda et al., 2018[7] |
75 |
25 |
- |
16.7 |
N/A |
|
Jerjes et al., 2011[16] |
81 |
8.2 |
10.8 |
11.6 |
|
|
Jerjes et al., 2011[12] |
68.4 |
- |
- |
15.8 |
• 5 years survival: 84.82% |
|
Karakullukcu et al., 2011[13] |
70.8 |
19.9 |
9.3 |
24.7 |
|
|
Karakullukcu et al., 2012[14] |
45 |
40 |
15 |
25 |
N/A |
|
Karakullukcu et al., 2013[17] |
89 |
11 |
- |
- |
|
|
Durbec et al., 2013[18] |
93.3 |
6.7 |
- |
53.3 |
Overall survival • 1 year: 72% • 3 year: 43% • 5 years: 36% Disease-spesific survival • 1 year: 82% • 5 year: 45% |
|
Rigual et al., 2013[20] |
88.2 |
8.8 |
2.9 |
26.5 |
|
CR, Complete Response. NC, No Change. PR, Partial Response
Mekanisme Terapi Fotodinamik
Terapi fotodinamik merupakan terapi berbasis reaksi fotokimia yang bekerja dengan cara aktivasi komponen sensitif cahaya yaitu PS onkotropik untuk memicu kerusakan sel kanker secara selektif.[18] Dalam pelaksanaannya, PS diberikan secara topikal maupun intravena pada area tumor, PS kemudian terkonsentrasi pada sel-sel over-proliferatif dengan laju metabolisme tinggi dan defek struktur membran seperti sel kanker. [21]
Foton dari laser dengan panjang gelombang yang berkorespondensi dengan daya absorbsi puncak spesifik PS diaplikasikan pada jaringan target untuk menghasilkan aksi sitotoksik bersama dengan oksigen.[10] Percepatan konsumsi molekul oksigen dapat dikendalikan melalui power density, semakin tinggi maka semakin besar pula penggunaan oksigen pada area terapi fotodinamik.[22] Proteksi jaringan sekitar yang sehat dapat dipastikan melalui shielding spons basah maupun special shielding waxes. [13]
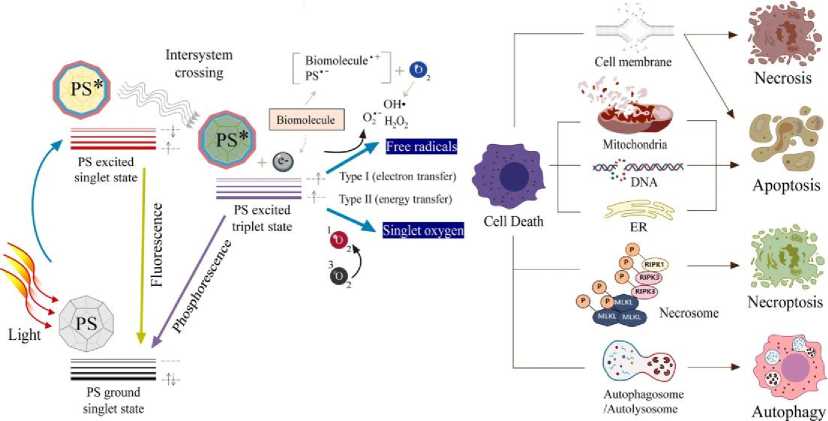
Gambar 2. Rangkuman Mekanisme Kerja Terapi Fotodinamik terhadap Sel Kanker [23]
Cara kerja terapi fotodinamik sebagai anti kanker dimulai dari PS yang tereksitasi secara langsung beraksi pada substrat (unsaturated lipid, protein, atau asam nukleat) untuk menghasilkan ROS seperti hidrogen peroksida (H2O2), radikal hidroksil (·OH), anion superoksida (O2•-) melalui transfer proton maupun elektron (reaksi tipe 1).[24,25] Selain itu, PS tereksitasi dapat bereaksi dengan molekul oksigen melalui transfer energi untuk membentuk singlet oxygen (1O2), komponen sitotoksin mayor (reaksi tipe 2). [26] Radikal-radikal bebas ini menghasilkan efek tumorisidal direk, yang secara langsung mengganggu komponen seluler dari sel-sel kanker melalui oksidasi ireversibel dan memicu kematian sel melalui apoptosis jika PS terletak pada organel intraseluler (nukleus, mitokondria, lisosom, retikulum endoplasma) dan nekrosis jika PS terletak pada membran sel.[19,27]
Selain itu, ditemukan terapi fotodinamik berakibat pada formasi nekrosom yang mengandung receptor-interacting protein kinase 1 (RIP1) dan RIP3 yang memicu nekroptosis. Mekanisme lainnya berupa aktivasi dari respons imun, fotosensitisasi memicu autofagosom yang juga mengakibatkan autolisosom untuk memecah komponen sitoplasma.[28] Rangkaian mekanisme dapat dilihat pada Gambar 2.[23] Selain autofagi, ROS yang diproduksi dari retikulum endoplasma juga memicu damage-associated molecular models (DAMPS) yang pada akhirnya menstimulasi presentasi antigen dari sel dendritik dan proliferasi limfosit T sitotoksik (sel CD8+) dalam menarget sel kanker.[29] Telah diperkirakan juga terapi fotodinamik dapat mengakibatkan shut-down pembuluh darah jaringan tumor melalui pembentukan trombosis dan konstriksi vaskular, yang mengakibatkan deprivasi oksigen serta nutrien sehingga menginduksi kematian sel kanker. [7]
Profil Keamanan Terapi Fotodinamik
Sebagai metode pengobatan yang tergolong baru, keamanan adalah salah satu pertimbangan utama dari pasien. Efek samping dilaporkan pada total delapan studi dengan nyeri serta pembengkakan sebagai komplikasi yang paling umum ditemukan pada intervensi fotodinamik (Tabel 3). Adanya nyeri merupakan tanda adanya keberhasilan efek terapeutik yang ditemukan pada hari pertama maupun kedua dengan berbagai derajat keparahan dan bertahan selama 2-4 minggu. Nyeri berhasil ditangani dengan penggunaan analgesik seperti NSAID, dengan tambahan opioid oral, transdermal, dan enteral seperti morfin sulfat serta salep anestesi topikal, patch transdermal fentanil dengan menyesuaikan kebutuhan pasien.[10,12,18-20] Studi oleh Jerjes et al., melaporkan nyeri diikuti peningkatan sementara dari konsentrasi sel darah putih, serta induksi nekrosis jaringan dan respons inflamasi akut hingga kronis.[16]
Nekrosis muncul 2-3 hari setelah iluminasi dan bertahan sekitar 10-14 hari.[10,12] Luka nekrosis post iluminasi sembuh secara komplit tanpa pembentukan bekas luka ataupun dengan formasi bekas luka minimal pada tumor jaringan lunak setelah 4-6 minggu.[13,19] Hal ini dikarenakan komponen matriks jaringan seperti kolagen dan elastin dipertahankan, sementara elemen selular dan vaskular dirusak oleh terapi fotodinamik. Preservasi dari arsitektur jaringan dianggap menyediakan scaffold yang baik untuk regenerasi jaringan normal dan menghasilkan pemulihan yang sangat baik tanpa bekas luka.[12,19] Selain itu, pembengkakan dan edema diobservasi 24 jam setelah iluminasi dan pulih setelah kurang lebih satu minggu.[10,12,20] Pembengkakan dan edema berisiko mengakibatkan obstruksi jalan napas dan dyspnea apabila lesi terletak pada basis lidah ataupun bagian posterior dari oral floor.[10]
Untuk menangani nasopharyngeal memperlancar jalan
ini, dapat digunakan
tube/tracheotomy untuk
napas. Sedangkan untuk
pemberian makanan dapat melalui nasogastric feeding tube/enteral feeding liquid dan pureed diet hingga pasien pulih. [12-14,18.20]
Tabel 3. Tabel Rangkuman Efek Samping Terapi Fotodinamik
|
Efek Samping |
Referensi |
Jumlah (%) |
|
Ikeda et al., 2013[10] |
2 (8) | |
|
I I Jerjes et al., 2011[16] |
Derajat ringan-sedang: 22(15) | |
|
I I Durbec et al., 2013[18] |
Derajat 1: 2 (13.3) | |
|
Fotosensitivitas |
I I Jerjes et al., 2011[12] |
Derajat 1: 2 (5.26) Derajat 2: 3 (7.89) Derajat 3: 1 (2.63) |
|
I I Karakullukcu et al., 2011[13] |
Derajat 2: 3 (1.76) | |
|
I I |
2 (5.9) | |
|
34 (100) | ||
|
I I Ikeda et al., 2013[10] |
25(100) | |
|
I I Rigual et al., 2013[20] |
40 (100) | |
|
Nyeri & Pembengkakan |
I I Jerjes et al., 2011[16] |
Semua derajat: 147 (100) Derajat ringan-sedang: 126 (85.7) |
|
I I Karakullukcu et al., 2012[14] |
20 (100) | |
|
I I |
15(100) | |
|
Disfagia sementara |
1 (6.67) | |
|
I I |
12 (7.05) | |
|
Diskolorasi Kulit |
9 (5.29) | |
|
Formasi Sequestrum |
4 (11.4) | |
|
Toratani et al., 2016[19] |
I | |
|
Perforasi Sinus Maxilaris |
1 (2.9) |
Efek samping signifikan lainnya yakni reaksi fotosensitisasi residual sistemik, yang dapat bertahan beberapa hari hingga minggu bergantung pada PS yang diadministrasikan n.[12] Konsentrasi minor PS pada kulit dapat berakibat pada sunburn, edema, hingga nekrosis superfisial ketika terekspos sinar atau cahaya intens. Maka dari itu, perlu dilakukan edukasi pasien terkait langkah-langkah proteksi dari eksposur cahaya.[7,10,16-18] Pada beberapa studi ditemukan pasien tidak patuh terhadap instruksi sehingga mengalami skinburn derajat 1-3 namun pulih kembali dengan penanganan konservatif, terjadi pula edema fasial yang pulih dalam waktu 1 minggu setelah administrasi steroid.[13,18-20] Penggunaan PS photofrin berisiko mengakibatkan komplikasi
fotosensitisasi karena retensi yang berkepanjangan pada kulit. PS yang ideal dapat secara cepat tereliminasi dari jaringan normal sementara dipertahankan dalam jaringan neoplastik secara selektif.[19] PS generasi kedua seperti chlorophyll analogs, talaporfin sodium, HPPH, dan temoporfin ditemukan dapat tereliminasi lebih cepat dibandingkan photofrin sehingga meminimalisir komplikasi fotosensitivitas.[7,18-20] Alternatif lainnya adalah 5-aminolevulinic acid (5-ALA), satu-satunya PS yang dapat diaplikasikan secara topikal sehingga pasien tidak harus menghindari eksposur cahaya setelah intervensi, namun efikasi terbatas pada kedalaman tumor 1-2 mm.[12]
Hasil pemeriksaan laboratorium ditemukan normal, tidak ditemukan perdarahan mayor dan tidak ada organ-related adverse reaction akibat prosedur 7.
selain yang telah disebutkan.[14,19] Prosedur terapi fotodinamik dapat diulang dan dilakukan sesuai kebutuhan tanpa kerusakan jaringan normal, toksisitas kumulatif, dan gangguan pada terapi konvensional. Tidak ditemukan interaksi obat dan intoleransi dengan terapi anti kanker lainnya.[18] 8.
Secara garis besar, tidak ditemukan masalah fungsional maupun estetik yang persisten, adapun 9.
komplikasi yang ada dapat dikendalikan dan tidak bersifat fatal.
10. SIMPULAN
Terapi fotodinamik efektif dalam tatalaksana oral cancer stadium dini dilihat dari response rate dan survival rate yang baik, dengan tingkat rekurensi pasien yang rendah. Mekanisme kerja yang melatarbelakangi yakni iluminasi PS dengan 11.
kehadiran oksigen mengakibatkan produksi ROS yang berujung destruksi sel kanker. Profil keamanan terapi baik dengan efek samping minimal dan dapat dikendalikan. Diharapkan studi ini dapat menjadi panduan dalam pertimbangan penerapan metode terapi fotodinamik sebagai opsi alternatif dalam 12.
tatalaksana oral cancer stadium dini.
Keterbatasan dari tinjauan pustaka ini adalah jumlah sampel yang relatif kecil pada beberapa studi karena keterbatasan sumber daya, etik, dan bukti 13.
dasar evidence-based medicine yang kurang adekuat untuk dilakukan dalam sampel besar dan desain RCT sehingga sebagian besar studi menggunakan desain retrospektif, selain itu metode pelaporan survival rate, jumlah intervensi dan evaluasi yang bervariasi yang berpotensi menimbulkan bias antara studi yang dibandingkan. 14.
SARAN
Diperlukan studi prospektif dan RCT dengan protokol intervensi spesifik serta sistematis untuk membuktikan efikasi dan mengoptimisasi regimen terapi fotodinamik lebih lanjut. Selain itu kami juga menyarankan agar dilakukan pengukuran dengan indikator QOL sebelum, saat dan sesudah intervensi 15.
untuk memprediksi respon pasien terhadap terapi yang diberikan.
DAFTAR PUSTAKA
-
1. Rivera C. Essentials of oral cancer. International journal of clinical and experimental pathology 2015;8(9):11884- 94. 16.
-
2. Minić I, Pejčić A. Oral Cancer: Incidence and Management. J Oral Cancer Res. 2018;2(1):23.
-
3. International Agency for Research on Cancer.
Indonesia-Global Cancer Observatory.
Globocan 2020. 2021; 858:1-2. 17.
-
4. Speight PM, Farthing PM. The pathology of oral cancer. British dental journal. 2018 Nov;225(9):841.
-
5. Golusiński W, Kubiak A, Trojanowski M, Korytowska A, Pietrysiak A, Manasterski J, Pychyński T, Golusiński P, Majchrzak E, Sówka
-
M, Szewczyk M. National Programme for 18.
Prevention and Early Detection of Head and Neck Cancer. Otolaryngologia polska= The
Polish otolaryngology. 2015 Jan 1;69(4):7-12.
-
6. Kumar M, Nanavati R, Modi TG, Dobariya C.
Oral cancer: Etiology and risk factors: A review.
Journal of cancer research and therapeutics. 2016 Apr 1;12(2):458-63
Ikeda H, Ohba S, Egashira K, Asahina I. The effect of photodynamic therapy with talaporfin sodium, a second-generation photosensitizer, on oral squamous cell carcinoma: A series of eight cases. Photodiagnosis and photodynamic therapy. 2018 Mar 1;21: 176-80
Wong TS, Wiesenfeld D. Oral cancer. Australian dental journal. 2018 Mar; 63: S91-9.
Shanti RM, O'Malley Jr BW. Surgical Management of Oral Cancer. Dental Clinics of North America. 2017 Oct 16;62(1):77-86.
Ikeda H, Tobita T, Ohba S, Uehara M, Asahina I. Treatment outcome of Photofrin-based photodynamic therapy for T1 and T2 oral squamous cell carcinoma and dysplasia. Photodiagnosis and photodynamic therapy. 2013 Sep 1;10(3):229-35.
Liu YQ, Wang XL, He DH, Cheng YX. Protection against chemotherapy-and radiotherapy-induced side effects: A review based on the mechanisms and therapeutic opportunities of phytochemicals. Phytomedicine. 2020 Oct 31:153402
Jerjes W, Upile T, Hamdoon Z, Mosse CA, Akram S, Hopper C. Photodynamic therapy outcome for oral dysplasia. Lasers in surgery and medicine. 2011 Mar;43(3):192-9.
Karakullukcu B, van Oudenaarde K, Copper MP, Klop WM, van Veen R, Wildeman M, Tan IB. Photodynamic therapy of early stage oral cavity and oropharynx neoplasms: an outcome analysis of 170 patients. European Archives of Oto-Rhino-Laryngology. 2011 Feb;268(2):281-8.
Karakullukcu B, Nyst HJ, van Veen RL, Hoebers FJ, Hamming–Vrieze O, Witjes MJ, de Visscher SA, Burlage FR, Levendag PC, Sterenborg HJ, Tan IB. mTHPC mediated interstitial photodynamic therapy of recurrent nonmetastatic base of tongue cancers: Development of a new method. Head & neck. 2012 Nov;34(11):1597-606.
de Visscher SA, Melchers LJ, Dijkstra PU, Karakullukcu B, Tan IB, Hopper C, Roodenburg JL, Witjes MJ. mTHPC-mediated photodynamic therapy of early stage oral squamous cell carcinoma: a comparison to surgical treatment. Annals of surgical oncology. 2013 Sep;20(9):3076-82.
Jerjes W, Upile T, Hamdoon Z, Alexander Mosse C, Morcos M, Hopper C. Photodynamic therapy outcome for T1/T2 N0 oral squamous cell carcinoma. Lasers in surgery and medicine. 2011 Aug;43(6):463-9.
Karakullukcu B, Stoker SD, Wildeman AP, Copper MP, Wildeman MA, Tan IB. A matched cohort comparison of mTHPC-mediated photodynamic therapy and trans-oral surgery of early stage oral cavity squamous cell cancer. European Archives of Oto-Rhino-Laryngology. 2013 Mar;270(3):1093-7.
Durbec M, Cosmidis A, Fuchsmann C, Ramade A, Céruse P. Efficacy and safety of photodynamic therapy with temoporfin in curative treatment of recurrent carcinoma of the oral cavity and oropharynx. European Archives
of Oto-Rhino-Laryngology. 2013
Mar;270(4):1433-9.
-
19. Toratani S, Tani R, Kanda T, Koizumi K, Yoshioka Y, Okamoto T. Photodynamic therapy using Photofrin and excimer dye laser treatment for superficial oral squamous cell carcinomas with long-term follow up. Photodiagnosis and photodynamic therapy. 2016 Jun 1;14: 104-10.
-
20. Rigual N, Shafirstein G, Cooper MT, Baumann H, Bellnier DA, Sunar U, Tracy EC, Rohrbach DJ, Wilding G, Tan W, Sullivan M. Photodynamic therapy with 3-(1′-hexyloxyethyl)
pyropheophorbide a for cancer of the oral cavity. Clinical Cancer Research. 2013 Dec 1;19(23):6605-13.
-
21. Agostinis P, Berg K, Cengel KA, Foster TH, Girotti AW, Gollnick SO, Hahn SM, Hamblin MR, Juzeniene A, Kessel D, Korbelik M. Photodynamic therapy of cancer: an update. CA: a cancer journal for clinicians. 2011 Jul;61(4):250-81.
-
22. Lin J, Ni G, Ding T, Lei S, Zhong L, Liu N, Pan K, Chen T, Zeng X, Xu H, Li T. Photodynamic Therapy for Oral Squamous Cell Carcinoma: A Systematic Review and Meta-Analysis. International Journal of Photoenergy. 2021 Feb 16;2021.
-
23. Sai DL, Lee J, Nguyen DL, Kim YP. Tailoring photosensitive ROS for advanced photodynamic therapy. Experimental & Molecular Medicine. 2021 Apr;53(4):495-504.
-
24. dos Santos AF, de Almeida DR, Terra LF, Baptista MS, Labriola L. Photodynamic therapy
in cancer treatment-an update review. Journal of cancer metastasis and treatment. 2019 Mar 29;5.
-
25. Benov L. Photodynamic therapy: current status and future directions. Medical Principles and Practice. 2015;24(Suppl. 1):14-28.
-
26. Hamblin MR. Upconversion in photodynamic therapy: plumbing the depths. Dalton
Transactions. 2018;47(26):8571-80
-
27. Mroz P, Yaroslavsky A, Kharkwal GB, Hamblin MR. Cell death pathways in photodynamic therapy of cancer. Cancers. 2011 Jun;3(2):2516-39.
-
28. Miki,Y.,Akimoto,J.,Moritake,K.,Hironaka,C.&Fuji wara,Y.Photodynamictherapy using talaporfin sodium induces concentration-dependent programmed necroptosis in human glioblastoma T98G cells.Lasers Med. Sci.30,1739–1745 (2015)
-
29. Hou YJ, Yang XX, Liu RQ, Zhao D, Guo CX, Zhu AC, Wen MN, Liu Z, Qu GF, Meng HX. Pathological Mechanism of Photodynamic Therapy and Photothermal Therapy Based on Nanoparticles. International Journal of Nanomedicine. 2020;15:6827.
LAMPIRAN
Lampiran 1. Tabel Karakteristik Studi
|
Penulis |
Toratani et al.[19] |
de Visscher et al.[15] |
Ikeda et al.[10] |
Ikeda et al.[7] |
|
I Tahun |
I 2016 |
I 2013 |
I I 2013 |
I 2018 |
|
I Setting/Tem pat |
I Jepang |
I Belanda |
I I Jepang |
I Jepang |
|
I Sampel (kriteria) |
I
|
I • Terdiagnosis OSCC dengan infiltrasi lesi ≤ 5 mm berdasarkan tomografi, MRI, ataupun ultrasound |
I I
• Kedalaman tumor kurang dari 5 mm |
I
OSCC
|
|
I Jumlah Sampel |
I 34 |
I
|
I I 25 |
I 8 |
|
I Gender (Male%) |
I 35.3 |
I
|
I I 92.3 |
I 33.3 |
|
I Rata-rata umur |
I 70.8 |
I
|
I I 74.5 |
I 70.8 |
|
I Jenis Laser |
Excimer dye laser |
Diode laser |
N/A |
Diode laser |
|
I Jenis PS |
I Photofrin (porfimer sodium) |
I mTHPC |
I Photofrin (porfimer sodium) |
I I Talapor fin Sodium |
|
I Wavelength (nm) |
I 630 |
I 630 |
I 630 |
I I 664 |
|
I Radiant Exposure (J/cm2) |
I 100–150 |
I 100 |
I 100 |
I I 100 |
|
I Kontrol |
N/A |
Transoral surgical resection |
N/A |
N/A |
|
I Lokasi Lesi |
I
|
I N/A |
I I
|
I
Mucosa |
|
Median: 105 bulan Follow-Up Range: 68-156 bulan |
Median Total: 48 Intervensi: 33 bulan Total: 24 bulan bulan Kontrol: 67 bulan |
|
Penulis |
Jerjes et al.[12] |
Jerjes et al.[16] |
Karakullukcu et al.[13] |
Karakullukc u et al.[14] |
|
I Tahun |
2011 |
2011 |
2011 |
I 2012 |
|
I Setting/Te mpat |
Inggris |
Inggris |
Belanda |
I Belanda |
|
I |
I • SCC | |||
|
• Lesi yang |
berulang | |||
|
didiagnosis OSCC |
nonmetastat | |||
|
Sampel |
• Lesi yang |
• Lesi yang |
menurut biopsi |
ik pada |
|
(kriteria) |
didiagnosis OSCC |
didiagnosis OSCC |
• Kedalaman tumor |
dasar lidah |
|
kurang dari sama |
setelah | |||
|
dengan 5 mm |
(kemo)radiot | |||
|
erapi | ||||
|
I Jumlah Sampel |
147 |
38 |
170 |
I 20 |
|
I Gender (Male%) |
55.7 |
68.4 |
52.9 |
I 65 |
|
I Rata-rata umur |
53 |
58 |
60.5 |
I 64 |
|
I Jenis Laser |
Diode laser |
Diode laser |
Diode laser |
Diode laser |
|
I Jenis PS |
5- ALA mTHPC |
mTHPC |
I mTHPC |
I I mTHPC |
|
I Wavelength (nm) |
I 628 652 |
652 |
I 652 |
I I 652 |
|
I Radiant Exposure |
100-200 |
10-20 |
I 20 |
I I 30 |
|
(J/cm2) | ||||
|
I Kontrol |
N/A |
N/A |
N/A |
N/A |
|
I |
I • Linguae • Palatum | |||
|
Molle | ||||
|
Lokasi Lesi |
• Linguae • Gingiva • Lower Lip |
• Linguae • Cavitas Oris Propria |
• Linguae
|
• Tonsil Linguae • Oropharynx |
|
• Buccal Mucosa |
• Buccal Mucosa |
• Prosesus Alveolaris |
• Larynx • | |
|
Hypopharyn | ||||
|
x | ||||
|
• Epiglottis |
|
Follow-Up |
Mean: 7.3 tahun Min: |
5 tahun Total: 60 bulan |
2 minggu sekali selama 2 bulan, dan sekali tiap bulannya hingga waktu kematiannya . |
|
Penulis |
Karakullukcu et al.[17] |
Durbec et al.[18] |
Rigual et al.[20] |
|
I Tahun |
2013 |
I I 2013 |
I 2013 |
|
I Setting/Temp at |
Belanda |
I I Perancis |
I Amerika |
|
I Sampel (kriteria) |
• OSCC • Tumor dengan ketebalan kurang dari 5 mm dan tanpa terdeteksi metastasis nodus leher |
I I
|
I
|
|
I Jumlah Sampel |
98 |
I I 15 |
I 41 |
|
I Gender (Male%) |
60 |
I I 66.67 |
I 68.29 |
|
I Rata-rata umur |
60 |
I I 66.67 |
I 65 |
|
Jenis Laser |
Diode laser |
Non-thermal laser dengan pancaran sinar dari diode |
I Dye laser |
|
I Jenis PS |
I mTHPC |
I mTHPC |
I HPPH |
|
I Wavelength (nm) |
I 652 |
I 652 |
I 665 |
|
I Radiant Exposure (J/cm2) |
I N/A |
I 20 |
I 75-140 |
|
Kontrol |
PDT bisa mencapai kontrol lokal OSCC stadium awal pada tingkat yang sebanding dengan reseksi trans-oral |
N/A |
I N/A |
|
Lokasi Lesi |
|
|
|
|
I Follow-Up |
Minimal 2 tahun |
I I Setiap minggu sekali pada 1 bulan pertama, dilanjutkan dengan sekali dalam 2 bulan untuk 1 tahun pertama, sekali dalam 3 bulan untuk tahun kedua dan ketiga, sekali dalam 4 bulan untuk tahun keempat dan kelima, dan setiap 2 tahun hingga kematian. |
I I Interval 3-6 bulan |
HPPH, 2-(1-hexyloxyethyl)-2-devinyl pyropheophorbide-alpha. mTHPC, meta-tetrakis (3-hydroxyphenyl) chlorin.
OSCC, Oral Squamous Cell Carcinoma. PDT, Photodynamic Therapy. PS, Photosensitizer. SCC, Squamous Cell Carcinoma. 5-ALA, 5-aminolevulinic acid
54
Discussion and feedback