PENGGUNAAN CRISPR-CAS SYSTEM SEBAGAI SOLUSI MENGHADAPI RESISTENSI ANTIMIKROBA PADA BAKTERI
on
ARTIKEL TINJAUAN PUSTAKA


Essence of Scientific Medical Journal (2020), Volume 18, Number 2:33-40 P-ISSN.1979-0147, E-ISSN. 2655-6472
TINJAUAN PUSTAKA
PENGGUNAAN CRISPR-CAS SYSTEM SEBAGAI SOLUSI MENGHADAPI RESISTENSI ANTIMIKROBA PADA BAKTERI
Robby Soetedjo1 , Leonardo Alexander1 , Nikolaus Tobian1
ABSTRAK
Pendahuluan: Resistensi antimikroba merupakan masalah global akibat pemakaian antibiotik yang berlebihan dan tidak rasional sehingga mengeliminasi kuman patogen dan flora normal dalam tubuh. Hal ini memicu terbentuknya bakteri yang multiresisten terhadap berbagai antibiotik. WHO memperkirakan angka kematian global akibat resistensi antimikroba telah mencapai 700.000/tahun dan biaya yang harus dikeluarkan agar fasilitas kesehatan bisa mengatasi resistensi antimikroba diperkirakan sekitar 1,5 miliar dollar/tahun. Selain antibiotik, banyak terapi inovatif yang dapat diterapkan dalam menghadapi bakteri AMR (Antimicrobial Resistance) contohnya adalah CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) yang telah terbukti dapat digunakan untuk menarget gen-gen dari bakteri patogen seperti mengkode formasi biofilm, faktor virulensi, atau khususnya resistensi antimikroba. Target yang dituju ini juga spesifik tanpa mempengaruhi flora normal lainnya sehingga bisa menjadi pilihan utama dalam mengobati penyakit akibat resistensi antimikroba.
Pembahasan: Studi literatur menunjukkan bahwa terapi CRISPR disertai dengan CRISPR associated protein 9 (Cas9) terbukti mampu melakukan genome editing dengan memotong gen-gen yang berperan dalam faktor virulensi, metabolisme, dan enzim resistensi antimikroba seperti gen bla, sul2, dan mcr-1 secara in vivo maupun in vitro sehingga bakteri resisten seperti Staphylococcus aureus, Escherichia coli, dan Shewanella algae dapat tereliminasi atau menjadi sensitif kembali terhadap antibiotik yang awalnya diberikan sebelum terapi CRISPR dilakukan. CRISPR-Cas9 juga berfungsi sebagai pengendali ekspresi gen dengan cara mengaktivasi atau menghambat ekspresi gen menggunakan memodifikasi Cas9 menjadi dCas9 serta dapat dijadikan aplikasi dalam metode FLASH untuk mendeteksi sequence dengan jumlah sampel yang sedikit.
Simpulan: Dengan demikian, Terapi CRISPR berbasis Cas9 berpotensi menjadi andalan untuk terapi resistensi antimikroba.
Kata kunci: CRISPR-Cas9, Infeksi, Resistensi antimikroba
ABSTRACT
Introduction: Antimicrobial resistance is a global problem due to excessive and irrational use of antibiotics so as to eliminate pathogenic germs and normal flora in the body. This triggers the formation of bacteria that are multiresistant to various antibiotics. WHO estimates that the global death rate due to antimicrobial resistance has reached 700,000/year and the costs to be incurred for health facilities to overcome antimicrobial resistance are estimated at around 1.5 billion dollars/year. In addition to antibiotics, many innovative therapies that can be applied in the face of AMR (Antimicrobial Resistance) bacteria for example are CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) which have been proven to be used to target genes from pathogenic bacteria such as encoding biofilm formation, virulence factors, or specifically antimicrobial resistance. The target is also specific without affecting other normal flora so that it can be the first choice in treating diseases due to antimicrobial resistance.
Discussion: Literature studies show that CRISPR therapy accompanied by CRISPR associated protein 9 (Cas9) has been shown to be capable of genome editing by cutting genes that play a role in virulence, metabolism, and antimicrobial resistance enzymes such as the blah, sul2, and mcr-1 genes in vivo or in vitro so that resistant bacteria such as Staphylococcus aureus, Escherichia coli, and Shewanella algae can be eliminated or become sensitive again to antibiotics that were initially given before CRISPR therapy is carried out. CRISPR-Cas9 can also function as a gene expression controller by activating or inhibiting gene expression using modifying Cas9 to dCas9 and can be used as an application in the FLASH method to detect sequences with a small number of samples.
Conclusion: Thus, it can be concluded that Cas9-based CRISPR therapy has the potential to be a mainstay for antimicrobial resistance therapy.
Keywords: Antimicrobial Resistance, CRISPR-Cas9, dan Infection
1Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Katolik Indonesia Atma Jaya
PENDAHULUAN
Antibiotik banyak digunakan di berbagai dunia secara luas sejak penemuannya oleh Alexander Fleming, tetapi karena penggunaannya yang secara spektrum luas dan tidak spesifik banyak bakteri yang sudah mengembangkan kemampuan resistensi terhadap antibiotik.[1] Penggunaan antibiotik sangat luas dan broad spectrum tidak hanya membunuh kuman patogen tetapi juga membunuh kuman komensal dalam tubuh manusia yang mengonsumsi antibiotik tersebut sehingga banyak dampak negatif dari penggunaan irasional dari antibiotik.[2] Oleh
karena itu, resistensi antimikroba menjadi masalah kesehatan utama dalam bidang kesehatan.
Dalam laporan WHO (World Health Organization), dilaporkan sudah ada 700.000 kematian secara global/tahun akibat resistensi antimikroba. USA mengupayakan pembuatan grup kesehatan untuk mengatasi penyakit infeksius dan hasilnya penyakit infeksius berkurang dari 10,7 juta menjadi 8,6 juta tetapi tidak untuk kematian akibat resistensi antimikroba.[3,4] WHO memperkirakan bahwa perawatan yang diberikan oleh fasilitas kesehatan terhadap bakteri AMR (Antimicrobial
Resistant) akan melebihi 1,5 miliar dolar tiap tahunnya.[1] Semakin banyak antibiotik yang menjadi tidak efektif akibat bakteri resisten, banyak penemuan yang merujuk pada terapi alternatif selain antibiotik. Terapi alternatif yang sudah beredar di dunia seperti bakteriofag, dan sistem imun sudah banyak sekali digunakan bahkan kemajuan dari bidang bioteknologi, genetic engineering, dan kimia sintetik akhirnya juga memunculkan banyak terapi lain seperti probiotics, lysins, peptide antimicrobial, dan terutama CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) yang merupakan inovasi baru dalam mengatasi masalah resistensi antimikroba mengingat terapi sebelumnya seperti antibiotik ini sudah banyak sekali digunakan dan bakteri-bakteri yang ada di dunia sudah semakin resisten terhadap antibiotik.[4]
Metode CRISPR ini sangat unik karena kemampuannya berbasis genome editing dalam melawan gen-gen tertentu bakteri dan spesifitasnya yang hanya menarget gen-gen dari bakteri patogen seperti mengkode formasi biofilm, faktor virulensi, atau khususnya resistensi antimikroba.[5] Dalam pembahasan kita kali ini akan mengacu pada penjelasan lebih lanjut dan secara skematis bagaimana CRISPR-Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats - CRISPR associated protein 9) ini menarget sequence tertentu dari bakteri resistensi antimikroba dan cara pengantaran gen CRISPR secara lebih terperinci.
PEMBAHASAN
Sistem CRISPR-Cas9
Bakteri memiliki genom yang di dalamnya terkandung gen-gen yang mengkode protein untuk berbagai macam hal. Protein-protein ini dapat menjadi faktor virulensi, atau pun enzim yang membantu metabolisme bakteri hingga enzim untuk menangkal kerja antibiotik. Oleh karena itu, para peneliti mencari cara untuk mengedit genom dari bakteri dengan melakukan mutasi pada DNA bakteri. Mutasi dapat dilakukan dengan menginsersi, menghapus, atau melakukan substitusi basa nitrogen pada DNA bakteri.[6]
Ada beberapa cara untuk mengedit genom yang telah dikembangkan oleh para peneliti, seperti Zinc Finger Nuclease (ZFN), dan Transcriptional Activator-like Effector Nucleases (TALENs). Namun, keduanya memiliki kelemahan dalam segi biaya dan waktu pembuatan vektor, serta kurangnya spesifik dalam menarget gen yang ingin dimutasikan. Sistem Clustered Regularly Interspaced Short Palindromic Repeat (CRISPR)-CRISPR-associated nuclease 9 (Cas9) adalah sebuah cara terbaru yang dipakai oleh peneliti untuk melakukan edit dari genom.[7] CRISPR atau bisa disebut crRNA bekerja dengan bantuan trans-activating CRISPR-RNA (tracrRNA) dan membentuk kompleks crRNA atau bisa disebut gRNA. Kompleks ini akan memandu protein Cas untuk datang ke target yang sudah ditandai secara spesifik dan akan memutasi genom tersebut sehingga tidak dapat digunakan kembali.[8]
CRISPR-Cas9 terdiri dari 2 komponen yaitu CRISPR RNAs (crRNAs) dan Cas (CRISPR associated) protein. crRNAs ini merupakan pasangan basa yang komplementer dengan DNA/RNA asing dan protein Cas ini berfungsi memotong DNA/RNA asing tersebut.[9]
Shabbir et al mengklasifikasikan CRISPR menjadi tiga subtipe berdasarkan gen khas penyusun CRISPR. Subtipe I adalah jenis CRISPR yang memakai Cas3 yang ada pada bakteri dan archaea untuk menangkal infeksi virus. Subtipe II hanya dimiliki oleh bakteri dan subtipe ini memakai Cas1, Cas2, Cas4 dan Cas9 yang jika dibandingkan dengan subtipe lainnya, subtipe ini merupakan yang paling sederhana. Hal ini dikarenakan sistem yang digunakan CRISPR-Cas9 tipe II berbasis single guided RNA (sgRNA). Single guided RNA ini dapat menghantarkan Cas9 nuclease ke sequence spesifik pada bakteri yang mengkode gen resistensi.[5] Subtipe III dibagi menjadi dua golongan, yakni golongan IIIA dan IIIB. Setiap golongan memiliki target yang berbeda, sebagai contoh target dari golongan IIIA pada Staphylococcus epidermidis adalah DNA, sedangkan target dari golongan IIIB pada Sulfolobus solfataricus adalah RNA. Subtipe III dimiliki oleh kebanyakan archaea dan memakai Cas6 dan Cas10.[7]
Dikarenakan subtipe II yang lebih sederhana dibandingkan subtipe lainnya, peneliti lebih sering memakai subtipe tersebut. CRISPR dengan subtipe II akan memotong dari genom bakteri dan menyebabkan double strand break (DSB) pada DNA bakteri. Bakteri kurang dapat memperbaharui dan mengembalikan kembali DNA yang rusak karena CRISPR. Oleh karena itu, bakteri tidak dapat bereproduksi dan mentranslasikan protein untuk menyerang manusia.[6]
De La Fuente et al menuliskan jika terdapat banyak cara untuk mentransmisikan CRISPR ke dalam bakteri. Namun, terdapat sebuah metode yang paling terbaru yang dilakukan oleh Greene et al dan Shabbir et al yakni dengan memasukkan CRISPR-Cas9 ini ke dalam bakteri yang menyerang secara intraseluler dengan menyisipkan CRISPR-Cas9 dalam genom bakteriofag. Setelah itu, bakteriofag yang sudah disisipkan CRISPR, akan dilapisi sejenis partikel silika dengan tujuan untuk tidak mengaktifkan sistem imun dan juga molekul lemak agar menstabilisasi farmakokinetik dari penyebaran obat CRISPR-Cas9 ini. Setelah itu, diberikan peptida sebagai reseptor spesifik yang dapat melekat dengan sel-sel tertentu. Bakteriofag kemudian masuk secara endogen ke dalam sel dan kemudian menginjeksi genom bakteriofag yang sudah dimodifikasi ke dalam bakteri intrasel. [7,10]
Sistem CRISPR-Cas dapat digunakan sebagai pengendali ekspresi gen. Salah satunya yang paling sering adalah modifikasi Cas9 dengan mutasi pada dua domain nuclease (HNH dan RuvC) yang disebut dengan dCas9. dCas9 dapat menghambat ataupun mengaktivasi ekspresi gen. dCas9 tidak dapat memotong gen tetapi masih memiliki kemampuan untuk menempel pada DNA. [5,9]
Pengaplikasian CRISPR-Cas9 tidak hanya sebatas untuk mengatur gen pada bakteri, tetapi dapat digunakan sebagai alat pendeteksi gen-gen resisten yang dilakukan oleh Quan et al ke Staphylococcus aureus menggunakan FLASH (Finding Low Abundance Sequence by Hybridization) yang memanfaatkan spesifitas, keefisienan, dan fleksibilitas dari CRISPR-Cas9. Memanfaatkan CRISPR-Cas9 memotong gen resisten dan mendeteksi gen yang terpotong. Dalam percobaan ini menggunakan sampel DNA S. aureus sejumlah 25 ng. FLASH-NGS dapat menemukan
dalam rata-rata 90,1% target gen yang ada dalam enam sampel DNA S. aureus dibandingkan dengan NGS (Next Generation Sequencing) yang menemukan rata-rata 0,3% gen yang tersedia dalam enam sampel karena membutuhkan jumlah sampel yang lebih banyak. Penggunaan FLASH ini menguntungkan karena bakteri yang berkebutuhan khusus sulit untuk dikultur dan penggunaan FLASH ini hanya membutuhkan sampel yang sedikit. Pendeteksian gen resisten pada bakteri penting
dikarenakan resistensi perlu diketahui dengan cepat dan tepat agar pengobatan dapat berjalan dengan baik.[12]
Selanjutnya setelah gen resistensi dideteksi dapat diaplikasikan penggunaan sistem CRISPR-Cas untuk membunuh bakteri tersebut ataupun sensitisasi terhadap antibiotik untuk mengatasi bakteri yang resisten terhadap berbagai macam antibiotik.
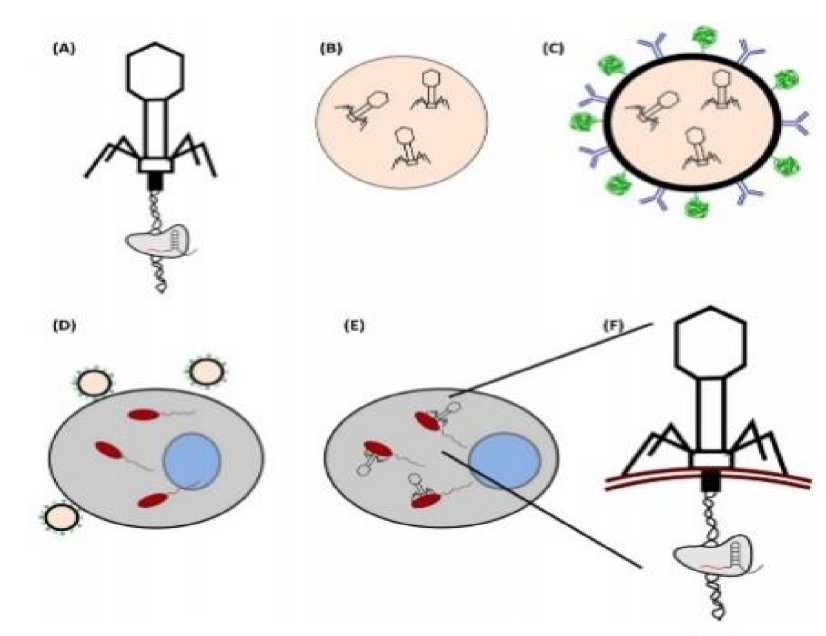
Gambar 1. Langkah-langkah transmisi CRISPR kepada bakteri intrasel
Penggunaan CRISPR-Cas9 Sebagai Pembunuh Bakteri Resisten
Pada era resistensi antimikroba CRISPR-Cas9 mulai digunakan sebagai solusi inovatif yang ampuh untuk menanggulangi resistensi antimikroba karena dapat menghilangkan gen-gen yang berpengaruh terhadap resistensi antimikroba. Sudah diadakan dua percobaan yang dilakukan oleh Bikard et al dan Park et al dengan melakukan percobaan kepada S. aureus yang resisten. Dalam percobaan ini penulis dapat membunuh dan mengimunisasi bakteri yang non-virulen terhadap transfer plasmid resisten secara efektif. Pada percobaan Bikard et al dilakukan percobaan untuk menarget koloni S. aureus pada in vitro dan in vivo pada kulit mencit menggunakan CRISPR-Cas9 yang dikirim menggunakan phagemid yang spesifik menarget ke strain yang virulen, lalu membunuh S. aureus yang virulen tetapi tidak yang non-virulen agar spesifitas CRISPR-Cas9 dapat teruji. Percobaan ini juga mengimunisasi S. aureus yang non-virulen terhadap transfer gen virulen. Studi in vitro ini dilakukan dengan menempatkan bakteri S. aureus strain RN4220 yang tak mengandung gen mecA dan USA300 yang mengandung gen mecA dalam satu media lalu diberikan dengan gen CRISPR-Cas9 yang berada dalam phagemid pDB121. Setelah itu, bakteri-bakteri ini dikultur pada
media yang mengandung antibiotik seperti kloramfenikol dan oxacillin. Hasil percobaan ini menunjukkan bahwa hanya strain USA300 saja yang ditarget. Hal ini diketahui dengan mengkultur hasil percobaan (setelah diberikan pDB121) dengan media nonselektif yang mengandung oxacillin dan terjadi pengurangan strain USA300 dari 50% menjadi 0,4%. Media non-selektif yang diberikan kloramfenikol hanya digunakan untuk mengetahui bakteri non-virulen (strain RN4220) yang tidak ditarget oleh pDB121 yang mengandung CRISPR-Cas9 ini. Oleh karena itu, terbukti bahwa CRISPR-Cas9 dapat menarget gen-gen yang berperan dalam resistensi dan dapat menarget bakteri yang virulen saja secara spesifik tanpa melibatkan bakteri non-virulen tidak seperti streptomisin (10μg/ml) yang membunuh juga S. aureus yang non-virulen. Koloni bakteri non-virulen ini sangat penting peranannya dalam tubuh manusia karena koloni bakteri ini dapat tumbuh dan menekan pertumbuhan bakteri virulen. Sistem ini juga digunakan untuk memotong gen pUSA02 yang berkontribusi terhadap resisten tetrasiklin pada S. aureus. Sama seperti percobaan sebelumnya, digunakan sistem CRISPR-Cas9 yang didesain spesifik untuk menarget gen pUSA02. Hasil percobaan membuktikan bahwa bakteri S. aureus yang sudah dipotong gen pUSA02 ini menjadi
sensitif terhadap tetrasiklin. Hal ini semakin membuktikan bahwa sistem CRISPR-Cas9 dapat membuat bakteri resisten menjadi sensitif dan terlebih lagi, sistem CRISPR-Cas9 bisa digunakan sebagai imunisasi terhadap bakteri S. aureus lain dari transmisi horizontal gen pUSA02 ini untuk resistensi tetrasiklin sehingga sistem CRISPR-Cas9 ini juga bisa digunakan sebagai profilaksis (pencegahan) akan timbulnya gen resistensi pada bakteri lain. Setelah studi in vitro, studi in vivo juga diadakan dengan menggunakan kulit punggung mencit sebagai media untuk kolonisasi S. aureus strain RNΦ yang tidak mengandung gen aph untuk reistensi kanamicin dan RNKΦ yang mengandung gen aph untuk resistensi kanamicin. Awalnya kedua strain ini dicampur dalam suatu media lalu diberikan berbagai perlakuan yaitu diberikan plasmid pDB121 yang mengandung CRISPR-Cas9, faga ΦNM1, muripocin dan streptomisin terhadap kedua strain. Hasil percobaan diletakan di dalam agar MSA (Mannitol Salt Agar) lalu diinterpretasi dengan cara melihat cahaya hijau yang dipancarkan oleh RNKΦ ketika dideteksi di bawah lampu UV. Hasil percobaan menunjukkan bahwa penggunaan pDB121 dapat mengurangi strain RNKΦ dari 50% menjadi 11,4% dan tidak mengurangi jumlah koloni strain RNΦ. Untuk perlakukan lain seperti ΦNM1, muripocin hanya mengurangi sedikit koloni dari RNKΦ. Streptomisin yang digunakan dalam percobaan ini ternyata bisa membunuh semua koloni S. aureus baik itu strain RNΦ maupun RNKΦ sehingga penggunaan streptomisin menjadi tidak spesifik berlawanan dengan prinsip terapi CRISPR-Cas9 yang hanya mengeliminasi bakteri yang membawa gen resistensi. Oleh karena itu, terbukti bahwa penggunaan CRISPR-Cas9 dapat mengeliminasi bakteri S. aureus yang membawa gen aph dengan menginisiasi pemotongan gen aph.[2]
Pada percobaan Park et al. juga melakukan hal yang serupa yaitu menggunakan CRISPR-Cas9 pada koloni S. aureus pada kulit mencit yang dikirim melalui phagemid secara in vitro maupun in vivo pada kulit mencit. Pada percobaan in vitro dan in vivo dilakukan percobaan untuk menguji spesifisitas dan efikasi hasilnya ditemukan CRISPR-Cas9 spesifik dengan menarget S. aureus dan tidak menarget mikrobiota lain, ditemukan juga dibutuhkan gen nuc yang menghasilkan nuclease dalam bakteri yang ditarget agar dapat bekerja. Untuk tes efikasi ditemukan dalam in vitro dan in vivo mampu membunuh koloni S. aureus. Langkah pertama yang dibuat adalah dengan cara menggabungkan berbagai plasmid seperti pMK4, pKS, pMAD dengan oligo sintetis yang mengandung promoter (daerah untuk memulai transkripsi), leader sequence, dan direct sequence serta dengan tracrRNA dan Cas9 dari Streptococcus pyogenes. Suatu langkah yang sistematis ini nantinya akan menghasilkan plasmid pKS5 yang akan berinteraksi dengan genom pada faga ɸSaBov RF122 menghasilkan ɸSaBov-Cas9-nuc. ɸSaBov-Cas9-nuc ini mengandung gen CRISPR-Cas9 dan juga spacer (suatu sequence berulang pada gen CRISPR) yang sesuai untuk menarget gen nuc pada S. aureus CTH96 yang memiliki gen nuc dan yang tidak memiliki gen nuc (CTH96Δnuc) secara in vitro. Hal yang sama dilakukan pada faga SaBov, sebelumnya bila ada SaBov yang memiliki spacer dari CRISPR-Cas9 (ɸSaBov-Cas9-nuc) maka ada faga ɸSaBov yang
berintegrasi dengan CRISPR-Cas9 yang didesain tanpa spacer spesifik untuk menarget gen nuc sehingga menghasilkan rekombinan ɸSaBovCas9-null. Pada percobaan ini, dilakukan pemberian ɸSaBov-Cas9-nuc dan ɸSaBovCas9-null untuk menarget gen nuc pada S. aureus dan terlihat jelas bahwa ɸSaBov-Cas9nuc memiliki kapasitas yang lebih bagus dalam mengurangi CFU (Colony Forming Unit) atau bisa disebut jumlah koloni dari S. aureus yang memiliki gen nuc dan memiliki Multiple of Infection (MOI) yang lebih bagus juga setelah 8 jam dilakukan percobaan ini dalam agar BHI (Brain Heart Infusion) (Gambar 2A dan 2B) sehingga terbukti bahwa ɸSaBov-Cas9-nuc yang memiliki spacer spesifik dan protein pemotong Cas9 dapat mengatasi gen nuc pada S. aureus dibandingkan ɸSaBov-Cas9-null yang hanya memiliki protein pemotong Cas9 untuk memotong DNA tanpa ada spacer spesifik untuk gen nuc. Selanjutnya, percobaan dilakukan pada campuran populasi CTH96 dan CTH96Δnuc pada media BHI lalu diberikan ɸSaBov-Cas9-nuc dan didapatkan hasil bahwa setelah diberikan ɸSaBov-Cas9-nuc, faga ini hanya menarget CTH96 sehingga terbukti bahwa ɸSaBov-Cas9-nuchanya menarget bakteri yang mengandung gen nuc yaitu strain CTH96 saja (Gambar 2C). Untuk mendeteksi koloni ini agar dapat memastikan faga yang diberikan dapat bekerja dengan baik maka bakteri yang ada setelah transfer faga ɸSaBovCas9-nuc dan ɸSaBov-Cas9-null selesai dilakukan ditaruh di dalam lampu UV untuk dideteksi. Bakteri S. aureus CTH96 memiliki plasmid yang akan memendarkan cahaya hijau bila terkena UV sehingga akan terlihat warna hijau pada deteksi dengan lampu UV sedangkan CTH96Δnuc tak memiliki plasmid yang dapat memendarkan cahaya hijau bila terkena UV. Setelah 8 jam dideteksi di bawah sinar UV, hasil percobaan menunjukkan koloni tanpa warna hijau sehingga kesimpulan yang bisa diambil adalah bahwa faga rekombinan ɸSaBov-Cas9-nuc ini secara selektif meniadakan bakteri S. aureus CTH96 tanpa melibatkan CTH96Δnuc. Selanjutnya pada transfer ɸSaBov-Cas9-null terhadap dua jenis bakteri CTH96 dan CTH96Δnuc, setelah 8 jam didapatkan hasil bahwa ɸSaBov-Cas9-null tidak mengeliminasi kedua jenis bakteri ini. Dari hasil percobaan yang ada maka terbukti bahwa ɸSaBov-Cas9-nuc hanya menarget bakteri CTH96 saja sehingga pada UV tidak dihasilkan cahaya hijau begitu juga dengan pemberian faga ɸSaBov-Cas9-null yang juga tidak menghasilkan cahaya hijau karena tidak mengeliminasi kedua strain CTH96 dan CTH96Δnuc (Gambar 2D). Percobaan selanjutnya dilakukan dengan menaikkan tingkatan MOI (Multiple of Infection) sampai 500 pada ɸSaBov-Cas9-nuc terhadap CTH96 dan CTH96Δnuc dalam media agar BHI (Brain Heart Infusion) dan didapatkan hasil bahwa pemberian ɸSaBov-Cas9-nuc terhadap CTH96 menghasilkan pengurangan koloni dengan menaikkan MOI dari ɸSaBov-Cas9-nuc sedangkan pada CTH96Δnuc didapatkan jumlah sama di berbagai MOI dari ɸSaBovCas9-nuc sehingga kenaikan MOI ini hanya berpengaruh pada pemberian ɸSaBov-Cas9nuc terhadap CTH96 saja (Gambar 2E).[13]
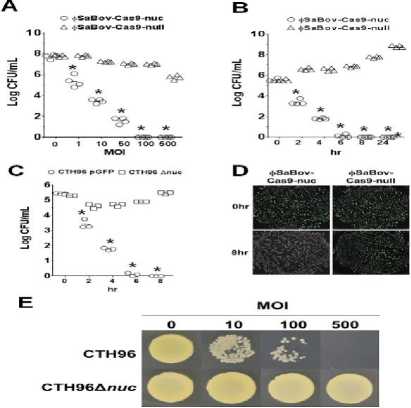
Gambar 2. (a) Hasil dari pemberian faga ɸSaBov-Cas9-nuc dan ɸSaBov-Cas9-null kepada bakteri Staphylococcus aureus CTH96 dilihat dari MOI. (b) Bila dilihat dari lamanya kerja faga. (c) Hasil dari pemberian faga ɸSaBov-Cas9-nuc dan ɸSaBov-Cas9-null kepada bakteri Staphylococcus aureus CTH96 dan CTH96Δnuc bila dilihat dari lamanya kerja faga dalam kultur agar BHI. (d) Hasil dari pemberian faga ɸSaBov-Cas9-nuc dan ɸSaBov-Cas9-null kepada bakteri Staphylococcus aureus CTH96 dideteksi di bawah lampu UV. Pada pemberian ɸSaBov-Cas9-null, bakteri dapat memendarkan cahaya hijau yang menandakan gen resistensi tidak ditarget. (e) Hasil dari pemberian faga ɸSaBov-Cas9-nuc dan ɸSaBov-Cas9-null kepada bakteri Staphylococcus aureus CTH96 dan CTH96Δnuc bila dilihat dari MOI dalam kultur agar BHI .13
Seperti yang sudah disinggung tadi, percobaan ini juga dilakukan secara in vivo pada dua mencit C57BL/6 dengan cara mencukur kulit mencit dan secara intradermal diinjeksi S. aureus CTH96. Setelah 6 jam dari infeksi bakteri, diinjeksikan ɸSaBov-Cas9-nuc dan ɸSaBov-Cas9-null dengan
A
OOOOO φSaBov- φSaBov-Cas9-null Cas9-nuc
φSaBov- φSaBov-
Cas9-null Cas9-nuc
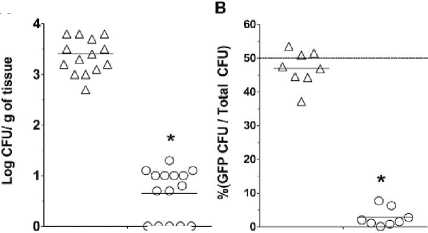
Gambar 3. (a) Hasil percobaan secara in-vivo dengan menginjeksi Staphylococcus aureus CTH96 secara intradermal lalu diberikan ɸSaBov- Cas9-nuc dan ɸSaBov-Cas9-null ke bagian yang terinfeksi.(b) Hasil percobaan yang dilakukan seperti percobaan a dengan menggunakan CTH96 dan CTH96Δnuc untuk menguji spesifitasnya . Setelah 24 jam, hasil diamati dengan agar BHI dan GelDoc.13
nilai MOI 500. Setelah 24 jam kulit mencit diinsisi lalu dikultur dalam media agar BHI dan hasilnya terjadi pengurangan jumlah koloni dari CTH96 yang diinjeksikan ɸSaBov-Cas9-nuc (Gambar 3A). Untuk menguji spesifitasnya, dilakukan juga infeksi campuran pada mencit C57BL/6
dengan CTH96 dan CTH96Δnuc lalu setelah 6 jam diinjeksi dengan ɸSaBov-Cas9-nuc dan ɸSaBov-Cas9-null pada kedua mencit. Setelah 24 jam, kulit mencit akan diinsisi dan dikultur di media agar BHI didapatkan hasil bahwa ɸSaBov-Cas9-nuc hanya mengeliminasi CTH96 (Gambar 3B). sehingga kesimpulan yang dapat diambil adalah hanya faga ɸSaBovCas9-nuc yang dapat menarget CTH96 dan faga ini spesifik hanya menarget strain CTH96 saja.[13]
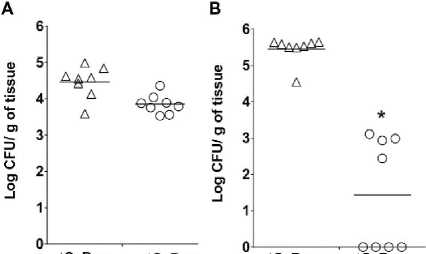
Lalu percobaan terakhir secara in vivo adalah dengan cara menginfeksi mencit di bagian kulit punggung. Kulit punggung mencit ini dipangkas, diberikan alkohol 70% dan dikolonisasi dengan CTH96. Setelah 6 jam kulit punggung ini diberikan ɸSaBov-Cas9-nuc dan ɸSaBov-Cas9-null secara dengan cara disemprotkan. Setelah 24 jam, hasil kulit ini dikultur dalam media BHI dan didapatkan hasil bahwa jumlah koloni yang diberi ɸSaBovCas9-nuc dan ɸSaBov-Cas9-null tidak berbeda jauh (Gambar 4A). Hal ini dikarenakan permukaan kulit punggung mencit yang mudah kering sehingga menghalangi aktivitas Staphylococcus aureus untuk transkripsi dan translasi sehingga CRISPR-Cas tidak dapat diekspresikan. Akhirnya pada percobaan selanjutnya dicampurkan ɸSaBov-Cas9-nuc dan ɸSaBov-Cas9-null dengan hydrogel (media yang dapat menyerap dan menyimpan air) lalu diusapkan secara topikal pada kulit punggung mencit dan hasilnya seperti yang diharapkan, meningkatkan efek eliminasi dari ɸSaBovCas9-nuc (Gambar 4B). Oleh karena itu, sangat penting sekali penggunaan media yang dapat menyerap dan menyimpan air seperti hydrogel dalam transfer CRISPR-Cas9 terhadap permukaan kulit paling luar mencit yang berada dalam kondisi kering.[13]
φSaBov- φSaBov-
Cas9-null Cas9-πuc
t∣>SaBov- φSaBov-
Cas9-null Cas9-nuc
Gambar 4. (a) Hasil percobaan secara in-vivo dengan menginfkesi bagian epidermis kulit punggung mencit dengan CTH96 dan CTH96Δnuc lalu diberikan ɸSaBov- Cas9-nuc dan ɸSaBov-Cas9-null dengan disemprotkan. (b) Hasil dari percobaan seperti percobaan a bila ditambahkan hydrogel. Setelah 24 jam, bagian punggung tersebut diteliti.13
Tabel 1. Daftar bakteri beserta gen yang berperan dalam factor resistensi antimikroba 2,8,13,14,15
Bakteri Gen ResLstensi
StaphyloctKvus aureus mecA = pengkode MRSA (Methicillin Resistant
Staphyltvoccus aureus)
pUSA02 = resistensi tetrasiklin
nuc = Nuclease yang berperan dalam resistensi antibiotik
________________________________________________aph = Resistensi kanamisin_____________________
Escherichia coli blaTEM = pembentuk ESBL (Extended Spectrum
Beta Lactamase)
blaSHV = pembentuk ESBL
CTX-M = pembentuk ESBL (resistensi seftazidim) mcr-1 = resistensi kolistin (Superbug), diteliti pada strain NJ-15-3
Shewanella algae blaOXA-55 = Pembentuk beta lactamase
Sul2 = Membentuk enzim dihidropteroat synthase
Sensitisasi terhadap antibiotik oleh CRISPR-Cas9
Sensitisasi terhadap antibiotik pada merupakan salah satu strategi untuk melawan patogen-patogen yang sudah resisten karena CRISPR-Cas9 ini bisa membuat patogenpatogen yang awalnya resisten terhadap suatu antibiotik menjadi sensitif terhadap pemberian antibiotik tersebut. Beberapa percobaan yang dilakukan oleh Kim et al, Sun et al, dan Wu et al menggunakan CRISPR-Cas9 untuk membuat menjadi bakteri sensitif terhadap antibiotik dengan menarget gen-gen resistensi. Pada percobaan Kim et al dilakukan pada E. coli BW25113 yang resisten terhadap ampisilin dan seftazidim. Dilakukan resensitisasi untuk mengembalikan kesensitifan E. coli terhadap ampisilin dan dalam percobaan ditemukan E. coli juga sensitif ke seftazidim dengan menggunakan pRESAFR (Plasmid Resensitization to Antibiotic from Resistance). Plasmid ini merupakan plasmid yang memiliki gen CRISPR yang akan aktif menjadi crRNA dan gen pengkode protein Cas9 nuclease. Metode yang digunakan oleh Kim et al. adalah metode disk diffusion (suatu metode untuk mengecek kepekaan bakteri terhadap antibiotik) dengan menggunakan tiga medium LB (Luria-Berthani) yang masing-masing diberikan antibiotik berbeda yaitu 34 μg kloramfenikol, 1 μg seftazidim, 10 μg ampisilin pada E. coli BW25113 dan E. coli BW25113 yang sudah menerima pESBL (Plasmid Extended Spectrum Beta Lactamase) dari Klebsiella pneumoniae untuk mengecek kepekaan kedua strain bakteri ini terhadap 3 jenis antibiotik tersebut. Saat E. coli diberikan pESBL dari Klebsiella pneumoniae maka akan terjadi resistensi terhadap ampisilin dan seftazidim. Kedua bakteri ini diberikan pRESAFR dan pBADCAS9 (plasmid yang hanya mengandung pCas9) sebelum dilakukan metode disk diffusion. Hasil percobaan menunjukkan bahwa bakteri yang tahan terhadap pemberian antibiotik ampisilin dan seftazidim tetap dapat tumbuh walau dengan kehadiran sebuah plasmid yang memiliki gen pengkode protein Cas9, singkatnya pCas9.
Sedangkan pemberian pRESAFR menghasilkan CFU yang hanya berkisar 0,3%. Hasil percobaan tersebut membuktikan bahwa pemberian pRESAFR dapat membuat bakteri tersebut menjadi sensitif terhadap ampisilin dan seftazidim. Pemberian pRESAFR ini terbukti menghilangkan gen pESBL setelah dideteksi dengan metode PCR (Polymerase Chain Reaction).[8]
Dalam percobaan tersebut terbukti bahwa pemberian pRESAFR yang mengandung crRNAs
dan Cas9 lebih efektif dalam menghilangkan resistensi bakteri terhadap ampisilin dan seftazidim dibandingkan pemberian plasmid yang hanya mengandung pCas9 atau single guided RNA (sgRNA) saja. Percobaan ini juga berhasil membuktikan bahwa sistem CRISPR-Cas9 bisa menarget lebih dari satu jenis gen bla contohnya gen bla yang mengkode resistensi terhadap seftazidim berbeda dengan ampisilin yaitu CTX-M dan pRESAFR ini dapat membuat bakteri E. coli menjadi sensitif terhadap ampisilin dan seftazidim.[8]
Pada percobaan Sun et al. digunakan E. coli dengan melakukan gene knockout pada mcr-1, sehingga bakteri menjadi sensitif kepada kolistin. Percobaan ini menggunakan bakteri E. coli NJ-15-3 yang memiliki gen mcr-1. Plasmid pCas::mcr dirancang dengan mengacu pada pengkodean sgRNA dan protein Cas9 yang berfungsi untuk menarget protospacer gen mcr- 1 agar terjadi double strand breaks pada gen mcr-1 dengan dibantu dua promoter T7. Setelah melakukan proses tersebut di atas, sel bakteri dikultur dalam agar LB untuk mengecek apakah terjadi penurunan jumlah koloni dan setelah diteliti ternyata terjadi penurunan jumlah CFU dari E. coli NJ15-3 baik setelah ditransfer plasmid pCas::mcr maupun pCas. Setelah itu, E.coli NJ-15-3 yang sudah ditransfer plasmid pCas::mcr maupun pCas dikultur dalam agar LB yang diberikan kloramfenikol dan agar LB yang diberikan kloramfenikol dan kolistin. Hasil percobaan memperlihatkan bahwa bakteri yang mendapat transfer plasmid pCas memiliki CFU yang sama dalam agar LB yang ditambahkan kloramfenikol maupun kloramfenikol dan kolistin sedangkan bakteri yang awalnya mendapat transfer pCas::mcr menjadi resisten terhadap kloramfenikol setelah ditempatkan di media LB ditambah dengan kloramfenikol lalu setelah diberikan kolistin, E.coli NJ-15-3 yang mendapat transfer pCas::mcr ini menjadi sensitif terhadap pemberian kolistin pada agar LB. Oleh karena itu, terbukti bahwa E. coli yang mendapat transfer pCas::mcr untuk menarget gen mcr-1 menjadi sensitif terhadap kolistin.[14]
Percobaan Wu et al. dilakukan pada Shewanella algae VGH117 yang resisten terhadap karbapenem menggunakan CRISPR-Cas9 menjadi sensitif ke imipenem dan ampisilin. Bakteri S. algae yang digunakan adalah strain VGH117, SH024 (memiliki plasmid pCCI-OriT-Cas9 yang mengandung gen pengkode protein Cas9), dan strain yang sudah dihilangkan gen-gen resistensinya seperti sul2, blaOXA-55 dengan
menggunakan rekombinan pCCI-OriT-Cas9 + sgRNA-Donor, lalu ketiga strain ini dikultur dalam agar LB yang akan diberikan berbagai macam antibiotik yaitu trimethoprim/sulfamethoxazole, ampisilin, dan imipenem. Hasilnya saat pCCI-OriT-Cas9 diberikan sgRNA, barulah CRISPR-Cas9 bisa mengeliminasi gen-gen resistensi seperti sul2, blaOXA-55 sehingga menurunkan MIC (Minimum Inhibitory Concentration) sedangkan bakteri yang memiliki plasmid pCCI-OriT-Cas9 yaitu suatu plasmid yang dapat mengkode protein efektor Cas9 untuk memotong DNA dan yang tidak memiliki plasmid ini justru menunjukkan MIC yang sama, hal ini membuktikan bahwa untuk memotong gen
resistensi dibutuhkan sgRNA dan Cas9 protein. Selain itu, gen NmcR yang awalnya diduga berperan dalam resistensi setelah di knockout dalam percobaan tidak menunjukkan perubahan MIC sehingga Wu et al. berkesimpulan bahwa NmcR ini tidak berhubungan dengan resistensi antimikroba tidak seperti Sul2, dan blaOXA-55 yang menunjukkan sensitisasi terhadap antibiotik setelah di knockout.[15]
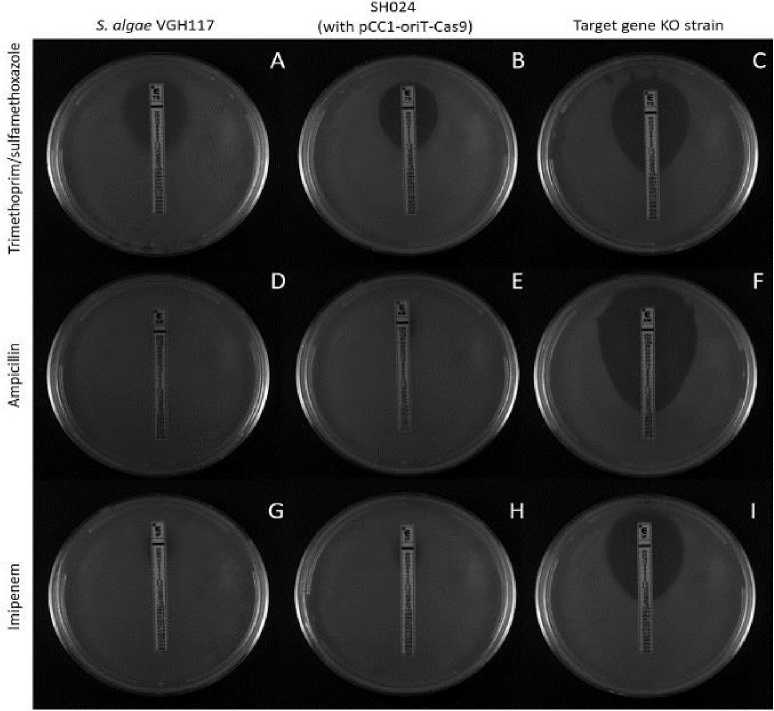
Gambar 5. Hasil percobaan E-Test pada pada bakteri Shewanella algae strain VGH117 (A,D,G), strain SH024 (B, E, H), dan Strain tanpa gen resistensi (C, F, I) dengan menggunakan berbagai antibiotik seperti Trimethoprim/sulfamethoxazole, ampisilin, dan imipenem.15
Tabel 2. Data tentang konsentrasi hambatan minimum dari berbagai antibiotik terhadap pertumbuhan berbagai strain dari Shewanella algae.15
|
Antibiotik |
Shewanella algae VGH117 |
Shewanella algae SH024 (pCCl-OriT-Cas9) |
pCCl-OriT-Cas9 + SgRNA-Donor |
|
T rimet IiopriniZsiiIfanietIioxazole |
1.5 |
1.5 |
0.38 |
|
Ampisilin |
>256 |
>256 |
0.38 |
|
Imipeneni |
>32 |
>32 |
0.38 |
SIMPULAN
Seiring waktu, resistensi antimikroba oleh bakteri menyebabkan kematian berjumlah 700.000 5.
korban jiwa per tahunnya secara global. Oleh karena itu, peneliti berusaha untuk mencari solusi untuk masalahgenting ini. CRISPR adalah salah satu mekanisme untuk mengedit genom yang dikembangkan oleh peneliti akhir-akhir ini sehingga 6.
lebih efisien dan efektif daripada pengedit genom sebelumnya. CRISPR dapat mengubah genetika bakteri agar bakteri tidak mempunyai resistensi terhadap antimikroba tersebut. Peneliti telah 7.
melakukan penelitian secara in vitro maupun in vivo menggunakan mencit. Dari hasil penelitian, didapatkan jika CFU dari bakteri dari genom yang sudah diberikan intervensi CRISPR menurun setelah diberikan antibiotik yang sebelumnya resisten, 8.
sehingga dapat disimpulkan jika CRISPR efektif untuk membuat bakteri menjadi tidak resisten terhadap antibiotik tersebut.
SARAN
Penggunaan CRISPR untuk solusi resistensi 9.
antimikroba belum diuji cobakan terhadap manusia dan belum diuji prognosis dari manusia yang terkena penyakit tersebut. Oleh karena itu, kami menyarankan agar dilakukan penelitian yang 10.
menguji efektifitas dari CRISPR ketika
diintervensikan kepada manusia dikarenakan belum maraknya karya tulis yang membahas hal tersebut. 11.
Selain itu, kami juga menyarankan agar dilakukan penelitian perbandingan prognosis pasien yang terkena penyakit oleh bakteri yang belum diintervensi dengan CRISPR dan dengan yang sudah 12.
diintervensi.
DAFTAR PUSTAKA
treatments. Future Science OA 2018;4:
FSO290.
-
32: 1146–1150.
-
3. Durand GA, Raoult D, Dubourg G. Antibiotic discovery: history, methods and perspectives. International Journal of Antimicrobial Agents 2019; 53: 371–382. 15.
-
4. Ghosh C, Sarkar P, Issa R, et al. Alternatives to Conventional Antibiotics in the Era of
Antimicrobial Resistance. Trends in
Microbiology 2019; 27: 323– 338.
de la Fuente-Núñez C, Lu TK. CRISPRCas9 technology: applications in genome
engineering, development of sequencespecific antimicrobials, and future prospects. Integrative Biology 2017; 9: 109–122.
Manghwar H, Lindsey K, Zhang X, et al. CRISPR/Cas System: Recent Advances and Future Prospects for Genome Editing. Trends in Plant Science 2019; 24: 1102– 1125.
Shabbir MAB, Shabbir MZ, Wu Q, et al. CRISPR-cas system: biological function in microbes and its use to treat antimicrobial resistant pathogens. Ann Clin Microbiol Antimicrob 2019; 18: 21.
Kim J-S, Cho D-H, Park M, et al. CRISPR/Cas9-Mediated ReSensitization of AntibioticResistant Escherichia coli Harboring
ExtendedSpectrum β-Lactamases. Journal of Microbiology and Biotechnology 2016; 26: 394– 401.
Luo ML, Leenay RT, Beisel CL. Current and future prospects for CRISPR-based tools in bacteria: CRISPR-Based Tools in Bacteria. Biotechnol Bioeng 2016; 113: 930–943.
Greene AC. CRISPR-Based Antibacterials: Transforming Bacterial Defense into Offense. Trends in Biotechnology 2018; 36: 127–130.
Trevisan M, Palù G, Barzon L. Genome editing technologies to fight infectious diseases. Expert Review of Anti-infective Therapy 2017; 15:
1001–1013.
Quan J, Langelier C, Kuchta A, et al. FLASH: a next-generation CRISPR diagnostic for multiplexed detection of antimicrobial resistance sequences. Nucleic Acids Research 2019; 47: e83– e83.
Park JY, Moon BY, Park JW, et al. Genetic engineering of a temperate phage-based delivery system for CRISPR/Cas9
antimicrobials against Staphylococcus aureus. Sci Rep 2017; 7: 44929.
Sun L, He T, Zhang L, et al. Generation of Newly Discovered Resistance Gene mcr-1 Knockout in Escherichia coli Using the CRISPR/Cas9 System. Journal of Microbiology and Biotechnology 2017; 27: 1276–1280.
Wu Z-Y, Huang Y-T, Chao W-C, et al. Reversal of carbapenem-resistance in Shewanella algae by CRISPR/Cas9 genome editing. Journal of Advanced Research 2019; 18: 61–69.
40
Discussion and feedback