CORONARY STENT COATED WITH MESENCHYMAL STEM CELLS-ANGIOGENIC GROWTH FACTOR SEBAGAI AGEN REENDOTELIALISASI DAN PENCEGAHAN RESTENOSIS
on
ARTIKEL TINJAUAN PUSTAKA

ESSENTIAL:Essence of Scientific Medical Journal (2020), Volume 17, Number 2:1-8
P-ISSN.1979-0147, E-ISSN. 2655-6472
TINJAUAN PUSTAKA
CORONARY STENT COATED WITH MESENCHYMAL STEM CELLS-ANGIOGENIC GROWTH FACTOR SEBAGAI AGEN REENDOTELIALISASI DAN PENCEGAHAN RESTENOSIS
I Nyoman Tri Pramartha1, Gede Setula Narayana1, Ni Putu Elsinthia Suryaningsih1
ABSTRAK
Pendahuluan: infark miokard akut (IMA) merupakan penyebab teratas dari mortalitas dan morbiditas kasus penyakit tidak menular dengan sekitar 17,9 juta kematian di dunia. Terdapat berbagai faktor risiko diantaranya pola diet makanan yang tidak sehat seperti tinggi lemak, perilaku sedenter, merokok dan alkohol. Patogenesis IMA diawali dengan terbentuknya lesi berupa plak aterosklerosis yang berujung pada penurunan perfusi O2 (iskemik) dan nutrisi sehingga terjadi nekrosis kardiomiosit (infark). Penanganan utama untuk mengatasi IMA adalah percutaneous coronary intervention (PCI) menggunakan bare metal stent (BMS) dengan kelemahan yaitu tingginya restenosis hingga 50%. Inovasi dengan menggunakan drug eluting stent (DES) belum efisien, menimbulkan restenosis dan rendahnya proses reendotelialisasi. Sehingga dibutuhkan modalitas baru yang lebih efektif untuk meningkatkan reendotelialisasi dan mencegah restenosis.
Pembahasan: mekanisme konstruksi dari coronary stent coated with mesenchymal stem cells (MSC) angiogenic growth factor diawali dengan pembentukan kultur MSC kemudian menggunakan sistem TALEN disisipkan gen HGF-VEGF secreting plasmid. Kemudian ditanamkan pada stent CoCr dan siap diadministrasikan. Efek kerja yang ditimbulkan yaitu mengakselerasi reendotelialisasi melalui proliferasi dan diferensiasi MSC dan penguatan tunika intima dengan meningkatkan pembentukan tight junction antar epitel. Efek kerjanya berperan dalam mencegah restenosis. Pencegahan ini diakibatkan oleh imunomodulator dan efek anti-inflamasi yang diberikan oleh angiogenic growth factor dan induksi autofagi sehingga mendaur ulang nutrisi sel debris pada lesi aterosklerosis. Simpulan: penggunaan (MSC) angiogenic growth factor sangat berpotensi sebagai terapi mutakhir IMA dengan akselerasi endotel melalui proliferasi, diferensiasi MSC dan sel progenitor serta memberikan efek pencegahan terjadinya restenosis melalui mekanisme imunomodulator dan recycle nutrition.
Kata kunci: Coronary stent, Mesenchymal stem cells, Angiogenic growth factor, Reendotelialisasi, Restenosis
ABSTRACT
Introduction: acute myocardial infarction (IMA) is the leading cause of death in non communicable disease and accounts around 17.9 million global deaths. There are various factors associated such as unhealthy food dietary like high fat diet, sedentary lifestyle, smoking and alcohol. The pathogenesis of IMA begins with the formation of lesions atherosclerotic plaque that caused in decreased O2 perfusion (ischemia) and nutrition resulting in cardiomyocyte necrosis (infarction). The main treatment for overcoming IMA nowdays is percutaneous coronary intervention (PCI) using bare metal stents (BMS) with the disadvantage of achieving up to 50% restenosis. Innovations using drug eluting stent (DES) have not been efficient, led to restenosis and low reendothelization processes. New modalities that tends to have a better effect needed to increase reendothelization and prevent restenosis.
Discussion: the construction of coronary stents coated with mesenchymal stem cells (MSC) angiogenic growth factors begins with the formation of MSC culture and then using the TALEN system inserted plasmids containing HGF-VEGF gene. Then implanted in the CoCr stent and ready to be administrated. The resulting work effect is accelerating reendothelization through the proliferation and differentiation of MSC and strengthening the intima tunica by increasing the formation of tight junctions between epithelium. The effects taken in restenosis. This prevention is caused by immunomodulators and anti-inflammatory effects provided by angiogenic growth factors and induction of autophagi, thus recycling cell nutrients in atherosclerotic lesions.
Conclusion: the use (MSC) angiogenic growth factors is needed as the latest IMA therapy with endothelial acceleration through the proliferation, differentiation of MSC and ancestral cells and the use of restenosis replacement through the use of antibacterial and nutrient recycling.
Keywords: Coronary stent, Mesenchymal stem cells, Angiogenic growth factor, Reendotheliazation, Restenosis
1Program Studi Sarjana Kedokteran dan Profesi Dokter, Fakultas Kedokteran, Universitas Udayana
PENDAHULUAN
Infark miokard akut (IMA) merupakan salah satu manifestasi tersering dari penyakit jantung kardiovaskular (PJK)
yang menyebabkan sekitar 17,9 juta kematian global di tahun 2016. Terdapat berbagai faktor risiko yang berkaitan dengan PJK diantaranya pola diet makanan tidak sehat seperti tinggi lemak, perilaku sedenter, merokok dan alkohol. Faktor risiko inilah yang menimbulkan gejala klinis seperti peningkatan tekanan darah yang berujung pada hipertensi, peningkatan lipid dan obesitas. Gejala yang timbul dan tidak diberikan penanganan yang adekuat akan
meningkatkan risiko terjadinya IMA serta berbagai komplikasi lainnya.[1]
Proses patogenesis IMA diawali dengan perubahan profil lipid dalam darah yang bersifat aterogenik. Lemak aterogenik seperti LDL-C akan teroksidasi oleh reactive oxygen species (ROS)
menjadi oxLDL-C sebagai akibat dari reaksi inflamasi. Terbentuknya oxLDL-C akan menimbulkan disfungsi pada endotel vaskular.[2] Selain itu, oxLDL-C juga menyebabkan lesi berupa fatty strpeeak yang menginisiasi proses aterogenesis sehingga menimbulkan penyempitan lumen/oklusi yang mengganggu perfusi O2 dan transfer nutrisi menuju target, salah satunya kardiomiosit. Rendahnya perfusi
menuju target mengindikasikan terjadinya iskemik jaringan yang jika berlanjut akan berujung pada nekrosis atau IMA pada jantung.[3]
Penatalaksanaan yang tersedia saat ini untuk mengatasi PJK adalah terapi medikamentosa berupa fibrinolitik, coronary artery bypass graft (CABG), dan percutaneous coronary intervention (PCI). Metode PCI merupakan pilihan utama reperfusi untuk mengatasi IMA dengan menggunakan bare metal stent (BMS).
Metode ini memiliki efektivitas yang lebih superior jika dibandingkan dengan fibrinolitik. Namun disisi lain, terdapat kelemahan yaitu kejadian restenosis sebesar 20-50% pasca PCI tergantung pada ukuran pembuluh darah, tipe lesi dan jenis BMS yang digunakan.[4] Restenosis merupakan proses penyempitan kembali diameter lumen pembuluh darah ≥ 50% setelah PCI dengan stent ataupun tanpa stent. Proses ini disebabkan oleh terbentuknya aterosklerosis kembali (neoaterosklerosis) dan proliferasi berlebih neointimal yang diamati melalui angiografi.[5,6]
Pengembangan modalitas baru yang digunakan saat ini berupa kombinasi BMS dengan lapisan obat menjadi drug eluting stent (DES). Penggunaan DES secara klinis mampu menurunkan angka restenosis hingga 10%. Namun penelitian terbaru menunjukkan penggunaan DES seperti paclitaxel eluting stent (PES) dan sirolimus eluting stent (SES) secara signifikan menyebabkan komplikasi late stent trombosis (LST) terutama pada PES jika dibandingkan dengan SES dan BMS.[7,8] Kejadian restenosis pada pasien disebabkan oleh proses reendotelialisasi yang terhambat[9] dan vasokonstriksi akibat inhibisi eNOS, dimana kedua faktor ini menyebabkan disfungsi endotel yang berujung pada LST.[10]
Berdasarkan permasalahan dan kelemahan dari intervensi PCI dengan BMS ataupun DES saat ini, dibutuhkan modalitas baru dengan efektivitas yang lebih baik terkait peningkatan proses reendotelialisasi dan minim komplikasi seperti restenosis. Penelitian terbaru menunjukkan mesenchymal stem cells (MSC) dapat menghambat hiperplasia neointimal dan migrasi dari sel otot polos menuju tunika intimal.[11] MSC, juga meningkatkan reendotelialisasi dengan berdiferensiasi menjadi sel endotel yang memperbaiki keutuhan tunika intima sehingga mencegah proses LST.[12,13] Selain itu, MSC bertindak sebagai imunomodulator[14] sehingga mencegah terjadinya restenosis. Senyawa angiogenic growth factor yaitu VEGF memiliki peran penting dalam pensinyalan vaskulogenesis dan mengakselerasi reendotelialisasi pada lesi pembuluh darah.[15] Senyawa HGF memiliki efek angiogenik dan anti-inflamasi yang berperan dalam mencegah restenosis.[16] Melalui kombinasi MSC-angiogenic growth factor dalam bentuk coated coronary stent diharapkan dapat meningkatkan efektivitas terapi reperfusi.
PEMBAHASAN
Restenosis dan Reendotelialisasi Vaskular
Penatalaksanaan PCI (Percutaneous Coronary Intervention) bertujuan untuk membuka penyempitan (stenosis) pembuluh darah arteri jantung pada kasus penyakit jantung koroner (PJK). Pasien yang telah melakukan PCI baik dengan ataupun tanpa stent dapat mengalami serangan
jantung berulang dan mengalami angina karena terjadi restenosis yang disebut In Stent Restenosis (ISR).[17] Restenosis merupakan penyempitan ≥ 50% diameter lumen pembuluh darah kembali yang menyebabkan penurunan aliran darah koroner setelah prosedur intravaskular.[5,6,17] Proses ini terjadi 6-9 bulan pasca pemasangan stent PCI.[18]
Salah satu faktor yang menyebabkan terjadinya restenosis adalah lesi pada vaskular yang mengaktifkan rangkaian kaskade inflamasi setelah intervensi PCI. Berdasarkan waktu kejadian, restenosis dapat dibagi menjadi early stenosis (hitungan hari) dan late stenosis (hitungan minggu hingga bulan). Mekanisme patologi yang mendasari restenosis dibagi menjadi tiga proses utama yaitu early elastic return (recoil), vascular Rempodeling, dan neointimal hyperplasia (NIH).[5] Tahap awal yaitu early elastic return (recoil) merupakan reaksi awal yaitu penyempitan lumen hingga 40% yang sering terjadi setelah deflasi dari kateter balon pada intervensi PCI akibat regangan yang terlalu tinggi.[5] Hal ini berkaitan dengan adanya lamina elastika interna dan eksterna pada pembuluh darah arteri. Pemasangan stent menyebabkan sel endotel tergerus karena peregangan sehingga bagian subintimal pada pembuluh darah tidak utuh. Komponen pada subintimal seperti kolagen, Von Wullebrand factor, fibronektin, dan laminin memicu perlekatan dan agregasi platelet bersama dengan fibrin dan neointimal membentuk trombus.[19] Proliferasi neointimal dan terbentuknya trombus menginduksi in stent stenosis (ISS) yang memicu migrasi dari sel otot polos yang berada pada tunika media dan adventisia menuju tunika intima. Hal ini memperparah trombus yang terbentuk pada lesi.[5] Restenosis juga berkaitan dengan respon inflamasi yang ditandai oleh IL-1, IL-6, IL-8 dan MCP-1 yang dilepaskan oleh makrofag. Serta PDGF A dan B yang menginisiasi migrasi sel otot polos dan aktivasi platelet.[5]
Proses reendotelialisasi disebabkan oleh sel endotel yang tergerus akibat cidera dan kematian sel terprogram atau apoptosis. Selain itu, aktivitas matrix metalloproteinase (MMP)-9 berkontribusi terhadap disfungsi sel dan pelepasan sel endotel dari tunika intima melalui protease activated receptor-1.[20] Tergerusnya sel endotel mengaktifkan mekanisme perbaikan melalui proliferasi sel-sel endotel lokal dan menginduksi sel progenitor baik disekitar lesi dan yang berasal dari sumsum tulang untuk melakukan regenerasi.[21] Mekanisme regenerasi diawali dengan pelepasan kemoatraktan seperti VEGF, SDF-1 atau Cxcl 12 dan MCP-1 untuk mobilisasi sel endotel progenitor sehingga berproliferasi menjadi sel endotel dan memperbaiki keutuhan lapisan tunika intima pembuluh darah.[22]
Mesenchymal Stem Cells (MSC) dan Angiogenic Growth Factor
Sel punca bisa ditemukan pada beberapa organ salah satunya umbilical cord blood (UCB) dimana sel punca mesenkimal ini dapat berdiferensiasi menjadi berbagai jenis sel seperti osteosit, miosit, adiposit, kardiomiosit, endotel pembuluh darah, dan ginjal.[23] Kemampuan sel ini dalam berdiferensiasi menjadi sel endotel dapat berperan dalam reendotelialisasi. Karakterisitik lainnya adalah sel punca mesenkimal bersifat multipoten sehingga dapat berperan sebagai imunomodulator[14], serta cenderung untuk bermigrasi
ke daerah inflamasi menjadikannya sebagai terapi mutakhir yang menjanjikan salah satunya untuk pencegahan restenosis dan memicu reendotelialisasi.[11,13,15]
Angiogenic growth factor merupakan sebuah kelompok molekul yang memiliki peran penting dalam pembentukan pembuluh darah yaitu pada proses vaskulogenesis maupun angiogenesis yang terdiri dari berbagai macam famili protein seperti VEGF dan HGF.[24] Selain fungsinya sebagai molekul yang berperan dalam proses pembentukan dan remodelling pembuluh darah, angiogenic growth factor juga memiliki peran dalam penentuan nasib sel pada organogenesis, diferensiasi organ, dan remodelling jaringan pasca kelahiran.[24]
Terdapat berbagai faktor pertumbuhan utama yang dapat menginduksi pembentukan pembuluh darah baru, salah satunya yaitu vascular endothelial growth factor (VEGF). Famili dari VEGF diberi nama VEGFA sampai dengan VEGFE dapat berikatan dengan reseptor spesifiknya dari masing-masing famili. VEGF dapat menginduksi angiogenesis melalui jalur persinyalan RAS/MAPK, yang mana juga dapat diaktivasi oleh HGF namun melalui jalur pensinyalan HGF-MET terlebih dahulu, sehingga jalur persinyalan dari VEGF dapat bersinergi dan ditingkatkan oleh faktor pertumbuhan lainnya.[25] Hepatocyte growth factor merupakan faktor pertumbuhan yang disintesis dan disekresi oleh sel-sel stroma seperti fibroblas, mesangial, dan juga makrofag dalam bentuk inaktifnya, terdiri dari dua subunit yang nantinya akan diaktivasi terlebih dahulu oleh HGF-activator sebelum nantinya dapat berikatan dengan reseptornya.[26] Berikatannya HGF dengan reseptor MET akan mengaktivasi jalur pensinyalan MAPK/ERK yang menginduksi proliferasi dari sel target, selain itu HGF juga memiliki peran dalam menginduksi angiogenesis melalui aktivasi jalur thrombospondin (TSP). Meskipun pada awal penemuannya, HGF hanya diketahui memiliki kemampuan dalam regenerasi jaringan hati yang rusak, namun penelitian selanjutnya menunjukkan bahwa HGF tersebut memiliki efek terapeutik dan morfogenesis pada organ yang berbeda.[25,26]
Mekanisme Konstruksi dan Intervensi Coronary Stent Coated with Mesenchymal Stem Cells-Angiogenic Growth Factor
Sebagai tahap awal, konstruksi mesenchymal stem cells-angiogenic growth factor eluting stent (MA-eluting stent) dengan pembentukkan kultur sel MSC. Sel diisolasi dari Umbilical Cord Blood manusia (hUCB) kemudian dikembangkan pada medium dengan KSB-3 dan 10% fetal bovine serum pada suhu 370C dalam 5% CO2. Sel ditransfeksikan dengan NEON menggunakan sistem TALEN dan HGF-VEGF secreting plasmid.[27,28] Sel-sel diinkubasi selama 12 jam untuk memungkinkan pembentukan struktur seperti tabung.[27]
Penggunaan Stent yaitu cobalt-chromium-polydopamine (CoCr-pDA) akan dicuci tiga kali menggunakan ultrasonikasi selama 10 menit. Selanjutnya stent dicuci dengan air deionisasi kemudian dikeringkan. Stent CoCr pDA ditempatkan dalam larutan FN 50-μg/mL pada 370C semalam dan dicuci selama 10 menit. NIH3T3 fibroblas pada kepadatan 1 × 104 sel/cm2, dikultur pada stent CoCr pDA-FN untuk membentuk lapisan ECM. Sel UCB-MSC yang mengekspresikan VEGF dan HGF
ditanamkan pada stent CoCr pDA-FN-ECM dan siap untuk di intervensi.[27]
Peranan Coronary Stent Coated with Mesenchymal Stem Cells-Angiogenic Growth Factor Sebagai Agen Reendotelialisasi
Mesenchymal Stem Cells (MSC) dapat meningkatkan proses reendotelialisasi melalui proliferasi[12,13] dan transdiferensiasi menjadi sel endotel yang berkaitan dengan pensinyalan ERK.[29] Proses ini didukung oleh efek MSC yang mengaktivasi jalur AMP-Activated Protein Kinase (AMPK) yang berperan penting dalam peningkatan pembentukan tight junction antar epitel[30] sehingga memperkokoh endotel yang telah terbentuk dan mencegah terjadinya disfungsi endotel. Proses autofagi mengalami peningkatan oleh MSC melalui jalur ERK1/2 atau AMPK/mTOR kemudian fosforilasi Ulk1[31] (tergantung keberadaan O2 pada lesi jaringan) untuk mendaur ulang debris sel mati yang semakin optimal karena MSC memberikan efek angiogenesis.[32] Hal ini berperan penting dalam proses daur ulang lisosom untuk retribusi nutrien dan reendotelialisasi.
HGF yang terekspresikan oleh MSC berperan dalam meningkatkan jumlah reseptor sitokin dari kemoatraktan growth factor CXCL 12 yaitu CXCR4 yang berfungsi untuk migrasi dan adhesi MSC pada lesi sehingga dapat berdiferensiasi menjadi sel endotel dan merangsang mobilisasi sel punca hematopoetik disekitarnya menuju lesi.[33] Sedangkan VEGF berperan dalam menghambat hiperplasia neointimal, menginduksi proses reendotelialisasi dan proses angiogenesis.[15]
MSC bersama angiogenic growth factor bersama-sama berperan meningkatkan sintesis endothelial nitric oxide synthase (eNOS) melalui jalur PI-3K/AKT/m-TOR/eNOS sehingga meningkatkan pelepasan NO yang berfungsi sebagai vasodilator.[34] MSC-angiogenic growth factor merupakan imunomodulator sebab mempengaruhi imunitas sel tipe bawaan ataupun adaptif yaitu menghambat aktivasi dan migrasi sel dendritik, NK (natural killer) serta sel T dan sel B. Selain itu, efek parakrinnya berfungsi sebagai antiinflamasi dengan melepaskan sitokin IL-10 sehingga menghambat apoptosis sel imun dan efek protektif bersama dengan IDO, TSG6, NO, CCL2 dan PGE2.[14,35] Mekanisme tersebut yang ditimbulkan menyebabkan perbaikan dan akselerasi proses reendotelialisasi pada vaskular.
Peranan Coronary Stent Coated with Mesenchymal Stem Cells-Angiogenic Growth Factor dalam Pencegahan Restenosis
Dewasa ini, penelitian menggunakan stent yang dikombinasikan dengan modalitas ataupun sel yang dapat mensekresikan faktor pertumbuhan agar dapat menghasilkan efek terapeutik yang lebih baik dibandingkan dengan penggunaan bare metal stent mulai meningkat jumlahnya. Mekansime Mesenchymal Stem Cells (MSC) yang mengekspresikan Angiogenic Growth Factor seperti VEGF dan HGF memiliki berbagai efek farmakologi seperti anti-tumorgenic, anti-trombotik, anti-proliferatif dan imunomodulator.[14,27] Efek anti-inflamasi yang dimiliki HGF secara signifikan menurunkan ekspresi sitokin proinflamasi seperti IFN-γ,[36] monocyte chemotactic protein (MCP-1), IL-6, dan tumor necrosis factor-α (TNF-α).[37] Stress oksidatif yang terjadi dihambat melalui NF-KB dan Nrf2 yang
diregulasi oleh axis HGF-MET. Axis ini juga meningkatkan pelepasan sitokin antiinflamasi seperti IL-4 dan IL-10.[36] Efek serupa oleh MSC sebagai imunomodulator bekerja dengan menurunkan kadar sitokin proinflamasi seperti IL-1β, IFN-γ, IL-6 dan macrophage inflamatory protein (MIP)-1α.[35]
Proliferasi dari otot polos vaskular ditekan melalui penghambatan ERK1/2. Caveolin-1 merupakan protein yang berfungsi mengatur
permeabilitas dan transport pada sel endotel, dalam hal ini kaitannya dengan vesikel transporter kolesterol intraseluler.[38] Protein caveolin-1 secara signifikan dihambat ekspresinya oleh MSC yang mengekspresikan angiogenic growth factor sehingga mencegah terjadinya akumulasi kolesterol dan pembentukan trombus sehingga mencegah terjadinya restenosis seperti terlihat pada Gambar 1.B.[39]
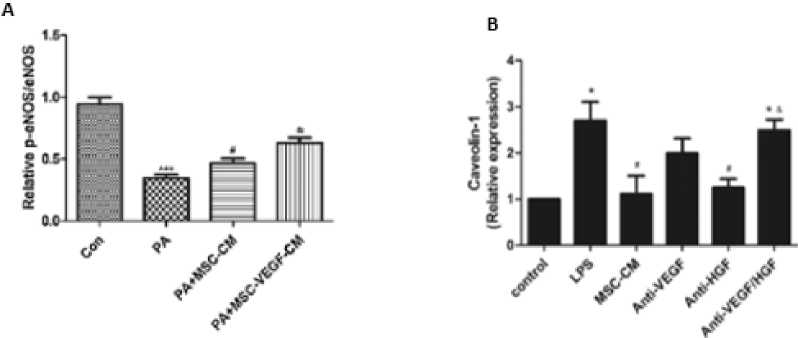
Gambar 1. A: Kadar eNOS pada Penelitian in vitro. [39]
Keterangan: ***P < 0.001 vs. control group, #P < 0.05, ##P < 0.01 vs. PA treated. Con: control group; PA: palmitate treated group; MSC: mesenchymal stem cells; CM: conditioned medium; VEGF: vascular growth facrtor.[34]
B: Ekspresi caveolin-1 pada penelitian in vitro *P < 0.05 vs.control group,&P < 0.05 vs.MSC-CM group. Keterangan= LPS: lipopolysaccharide; MSC: mesenchymal stem cells; CM: conditioned medium; VEGF: vascular endothelial growth factor; HGF: hepatocyte growth factor.
Efek klinis Coronary Stent Coated with Mesenchymal Stem Cells-Angiogenic Growth Factor
Penelitian yang dilakukan oleh Tianwei Xu dkk menunjukkan bahwa MSC yang mengekspresikan angiogenic growth factor yaitu VEGF secara signifikan meningkatkan ekspresi protein eNOS, dimana eNOS memiliki peran penting dalam restenosis dan reendotelialisasi yang terlihat pada Gambar 1A.[34] Penelitian lain yang dilakukan oleh Chang et al. (2018) menunjukkan bahwa stent yang disisipkan dengan human umbilical cord blood-derived mesenchymal stem cells (U-Ms) yang mensekresikan HGF (HGF/U-Ms) memberikan hasil berupa pembentukan stenosis paling rendah dibandingkan dengan stent model lainnya pada percobaan selama dua minggu yang terlihat pada Gambar 2.[27] Stent yang disisipkan dengan U-Ms yang mensekresikan VEGF (VEGF/U-Ms) saja memberikan hasil yang sebaliknya yaitu berupa peningkatan oklusi vaskular, yang mana kemungkinan disebabkan oleh proliferasi vascular smooth muscle cell (VSMC) sehingga menutupi lumen dari pembuluh darah. [27] Penelitian lain juga mendapatkan hasil berupa peningkatan oklusi
vaskuler akibat tingginya kadar VEGF saja.[40] Kombinasi dari VEGF dan HGF sangatlah baik dalam hal pembentukan pembuluh darah baru (angiogenesis) dengan mengaktivasi jalur persinyalan intrasel.[41] Namun, untuk dapat menghasilkan efek yang maksimal tersebut, penggunaan sel sekretorik untuk VEGF dan HGF masih harus dikalibrasi dan dibuatkan perbandingan. Hal ini disebabkan oleh jumlah molekul VEGF yang dihasilkan jauh lebih besar (50 ng / 2 x 106 sel dalam sehari) dibandingkan dengan molekul HGF yang dihasilkan (2,2 ng / 2 x 106 sel dalam sehari).[28,42] Hasil percobaan selanjutnya yang dilakukan oleh Chang et al. (2018) menunjukkan bahwa stent yang menggunakan kombinasi antara HGF/U-Ms dan VEGF/U-Ms (HGF + VEGF/U-Ms) dengan menggunakan perbandingan 5:1 serta diinduksi menggunakan doxycycline (Dox) memberikan hasil berupa peningkatan pembentukan pembuluh dan cabang dari pembuluh darah terlihat pada Gambar 3.[27] Kombinasi HGF + VEGF/U-Ms dengan perbandingan 5:1 memberikan hasil yang lebih baik pula pada reduksi restenosis vaskular jika dibandingkan dengan bare metal stent atau stent yang hanya disisipkan dengan U-Ms seperti pada Gambar 4.[27]
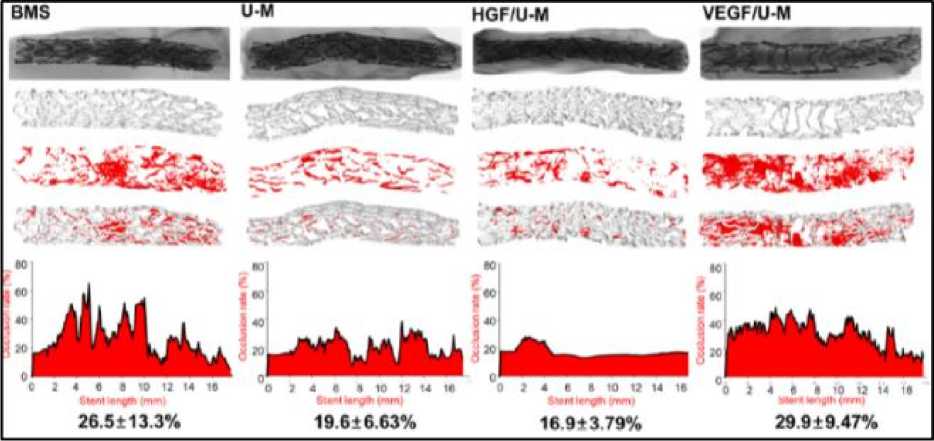
Gambar 2. Analisis MicroCT pada 50kV/200μA dan resolusi spasial 17-μm unit untuk menunjukkan mulusnya permukaan dan neointima area. [27]
Keterangan: BMS: bare metal stent; U-M: human umbilical cord blood-derived mesenchymal stem cell; HGF: hepatocyte growth factor; VEGF: vascular endothelial growth factor.
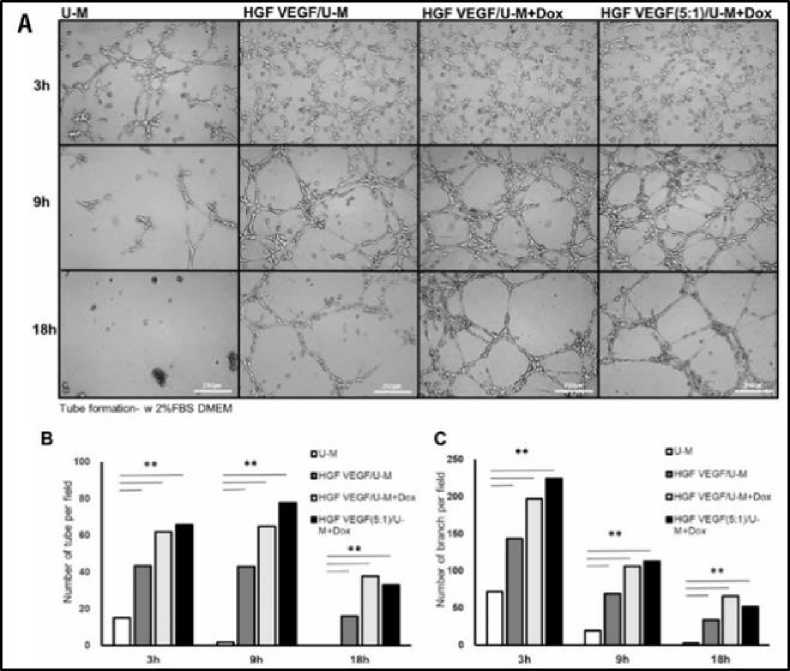
Gambar 3. A: Gambaran jumlah cabang pembuluh darah yang dihasilkan dari setiap kombinasi faktor pertumbuhan. B: Perbandingan jumlah pembuluh darah yang dihasilkan dan C: Perbandingan jumlah cabang yang dihasilkan. [27]
Keterangan: **P < 0.01. BMS: bare metal stent; U-M: human umbilical cord blood-derived mesenchymal stem cell; HGF: hepatocyte growth factor; VEGF: vascular endothelial growth factor.
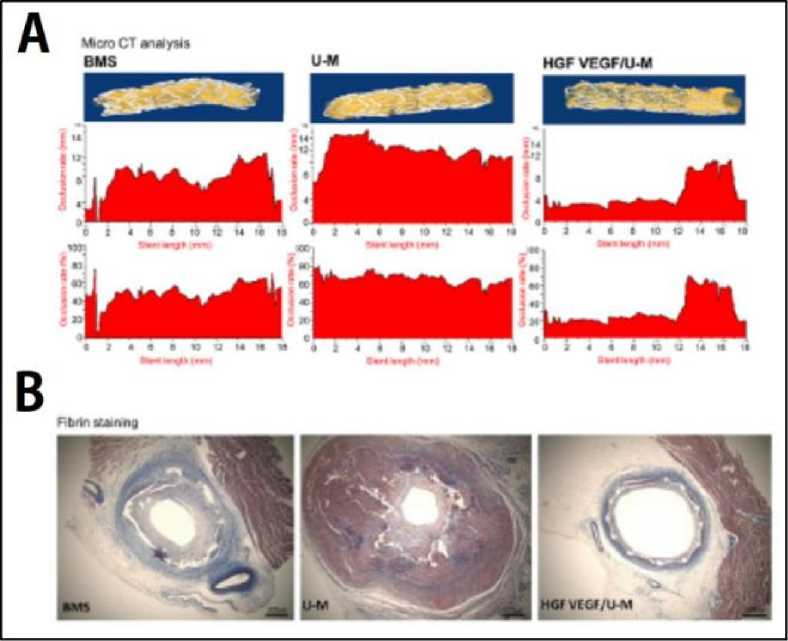
Gambar 4. A: Perbandingan gambaran microCT pada vaskular. B: perbandingan ukuran restenosis dan ukuran lumen dari vaskular yang diberikan perlakuan. [27]
Keterangan: BMS: bare metal stent; U-M: human umbilical cord blood-derived mesenchymal stem cell; HGF: hepatocyte growth factor; VEGF: vascular endothelial growth factor.
SIMPULAN
Penggunaan coronary stent coated with 2.
mesenchymal stem cells-angiogenic growth factor dapat disimpulkan sebagai sebuah mekanisme terapi mutakhir yang potensial dalam mengatasi penyakit jantung, khususnya restenosis pasca-PCI. Kombinasi 3.
ini dapat mengatasi permasalahan yang tidak dapat diselesaikan oleh terapi lini pertama saat ini yaitu penggunaan drug eluting stent. Mekanisme kerjanya meliputi induksi reendotelialisasi melalui proliferasi dan diferensiasi MSC serta penguatan tunika intima dengan meningkatkan pembentukan tight junction 4.
antar epitel. Selain itu, efek kerjanya berperan dalam mencegah restenosis yang merupakan komplikasi tersering pasca pemasangan stent pada tindakan
PCI. Pencegahan ini ditimbulkan melalui efek 5.
imunomodulator dan anti-inflamasi yang diberikan oleh angiogenic growth factor dan induksi autofagi sehingga mendaur ulang nutrisi sel debris pada lesi aterosklerosis. Penelitian terkait seperti clinical trial dibutuhkan untuk dapat mengevaluasi lebih lanjut 6.
mekanisme kerja, kemungkinan efek samping, dan efektivitas yang dihasilkan.
7.
UCAPAN TERIMAKASIH
Penulis ingin menyampaikan ucapan
terimakasih kepada segenap pihak dan dosen pembimbing dr. I Gede Putu Supadmanaba, S.Ked yang telah bersedia memberikan kritik dan saran dalam penyusunan karya ini. 8.
DAFTAR PUSTAKA
1. World Health Organization. Cardiovascular
diseases (CVDs) [Internet]. 2016 [cited 2019 Sep 9];Available from: https://www.who.int/health- 9.
topics/cardiovascular-diseases/
Chistiakov DA, Bobryshev Y V., Orekhov AN. Macrophage-mediated cholesterol handling in atherosclerosis. J Cell Mol Med 2016;20(1):17– 28.
Otsuka F, Kramer miranda C., Woudstra P, Yahagi K, Ladich E, Finn aloke V., et al. Natural Progression of Atherosclerosis from Pathologic Intimal Thickening to Late Fibroatheroma in Human Coronary Arteries: A Pathology Study. Atherosclerosis 2016;241(2):772–82.
Kastrati A, Mehilli J, Dirschinger J, Pache J, Ulm K, Schühlen H, et al. Restenosis after coronary placement of various stent types. Am J Cardiol 2001;87(1):34–9.
Buccheri D, Piraino D, Andolina G, Cortese B. Understanding and managing in-stent restenosis: A review of clinical data, from pathogenesis to treatment. J Thorac Dis 2016;8(10):E1150–62.
Pleva L, Kukla P, Hlinomaz O. Treatment of coronary in-stent restenosis: A systematic review. J Geriatr Cardiol 2018;15(2):173–84.
Daemen J, Wenaweser P, Tsuchida K, Abrecht L, Vaina S, Morger C, et al. Early and late coronary stent thrombosis of sirolimus-eluting and paclitaxel-eluting stents in routine clinical practice: data from a large two-institutional cohort study. Lancet 2007;369(9562):667–78.
Stettler C, Wandel S, Allemann S, Kastrati A, Morice MC, Schömig A, et al. Outcomes associated with drug-eluting and bare-metal stents: a collaborative network meta-analysis. Lancet 2007;370(9591):937–48.
Ertaş G, Van Beusekom HM, Van Der Giessen
WJ. Late stent thrombosis,endothelialisation and drug-eluting stents. Netherlands Hear J 2009;17(4):177–80.
-
10. Shin D Il, Kim PJ, Seung K-B, Kim D Bin, Kim MJ, Chang K, et al. Drug-Eluting Stent Implantation Could Be Associated With Long-Term Coronary Endothelial Dysfunction. Int Heart J 2007;48(5):553–67.
-
11. Iso Y, Usui S, Toyoda M, Spees JL, Umezawa A, Suzuki H. Bone marrow-derived mesenchymal stem cells inhibit vascular smooth muscle cell proliferation and neointimal hyperplasia after arterial injury in rats. Biochem Biophys Reports 2018;16(October):79–87.
-
12. Wang C, Li Y, Yang M, Zou Y, Liu H, Liang Z, et al. Efficient Differentiation of Bone Marrow Mesenchymal Stem Cells into Endothelial Cells in Vitro. Eur J Vasc Endovasc Surg [Internet] 2018;55(2):257. Available from:
https://doi.org/10.1016/j.ejvs.2017.10.012
-
13. Wu X, Wang G, Tang C, Zhang D, Li Z, Du D, et al. Mesenchymal stem cell seeding promotes reendothelialization of the endovascular stent. J Biomed Mater Res - Part A 2011;98 A(3):442–9.
-
14. Wang M, Yuan Q, Xie L. Mesenchymal stem cellbased immunomodulation: Properties and
clinical application. Stem Cells Int 2018;2018.
-
15. Wu X, Zhao Y, Tang C, Yin T, Du R, Tian J, et al. Re-Endothelialization Study on Endovascular Stents Seeded by Endothelial Cells through Up-or Downregulation of VEGF. ACS Appl Mater Interfaces 2016;8(11):7578–89.
-
16. Huang C, Zheng X, Mei H, Zhou M. Rescuing Impaired Re-endothelialization of Drug-Eluting Stents Using the Hepatocyte Growth Factor. Ann Vasc Surg [Internet] 2016;36:273–82. Available from:
http://dx.doi.org/10.1016/j.avsg.2016.07.001
-
17. Kraitzer A, Kloog Y, Zilberman M. Approaches for Prevention of Restenosis. 2007;1(c):583– 603.
-
18. Chen C-H, Kirtane AJ. Stents, Restenosis, and Stent Thrombosis [Internet]. Fourth Edi. Elsevier Inc.; 2018. Available from:
http://dx.doi.org/10.1016/B978-0-323-47671-3.00006-5
-
19. Bennett MR. In-stent stenosis: Pathology and implications for the development of drug eluting stents. Heart 2003;89(2):218–24.
-
20. Florence JM, Krupa A, Booshehri LM, Allen TC, Kurdowska AK. Metalloproteinase-9 contributes to endothelial dysfunction in atherosclerosis via protease activated receptor-1. PLoS One 2017;12(2):1–24.
-
21. Versari D, Lerman L, Lerman A. The Importance of Reendothelialization After Arterial Injury. Curr Pharm Des 2007;13(17):1811–24.
-
22. Noels H, Zhou B, Tilstam P V., Theelen W, Li X, Pawig L, et al. Deficiency of endothelial Cxcr4 reduces reendothelialization and enhances neointimal hyperplasia after vascular injury in atherosclerosis-prone mice. Arterioscler Thromb Vasc Biol 2014;34(6):1209–20.
-
23. Ohishi M, Schipani E. Bone marrow mesenchymal stem cells. J Cell Biochem 2010;109(2):277–82.
-
24. Crivellato E. The role of angiogenic growth factors in organogenesis. Int J Dev Biol 2011;55(4–5):365–75.
-
25. Ferrara N. Vascular Endothelial Growth Factor.
Arterioscler Thromb Vasc Biol [Internet] 2009;2008–10. Available from:
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?d b=pubmed&cmd=Retrieve&dopt=AbstractPlus&l ist_uids=19164810
-
26. Nakamura T, Mizuno S. The discovery of Hepatocyte Growth Factor (HGF) and its significance for cell biology, life sciences and clinical medicine. Proc Japan Acad Ser B Phys Bol Sci 2010;86(6):588–610.
-
27. Chang HK, Kim PH, Kim DW, Cho HM, Jeong MJ, Kim DH, et al. Coronary stents with inducible VEGF/HGF-secreting UCB-MSCs reduced restenosis and increased re-endothelialization in a swine model. Exp Mol Med [Internet] 2018;50(9). Available from:
http://dx.doi.org/10.1038/s12276-018-0143-9
-
28. Cho HM, Kim PH, Chang HK, Shen YM, Bonsra K, Kang BJ, et al. Targeted genome engineering to control VEGF expression in human umbilical cord blood-derived mesenchymal stem cells: Potential implications for the treatment of myocardial infarction. Stem Cells Transl Med 2017;6(3):1040–51.
-
29. Almalki SG, Agrawal DK. ERK signaling is required for VEGF-A / VEGFR2-induced differentiation of porcine adipose-derived mesenchymal stem cells into endothelial cells. 2017;1–14.
-
30. Rowart P, Erpicum P, Krzesinski JM, Sebbagh M, Jouret F. Mesenchymal Stromal Cells Accelerate Epithelial Tight Junction Assembly via the AMP-Activated Protein Kinase Pathway, Independently of Liver Kinase B1. Stem Cells Int 2017;2017:11–6.
-
31. Kim J, Kundu M, Viollet B, Guan K. AMPK and mTOR regulate autophagy through direct
phosphorylation of Ulk1. Nat Publ Gr [Internet] 2011;13(2):132–41.Available from:
http://dx.doi.org/10.1038/ncb2152
-
32. Hu C, Zhao L, Wu D, Li L. Modulating autophagy in mesenchymal stem cells effectively protects against hypoxia- or ischemia-induced injury. Stem Cell Res Ther 2019;10(1):1–13.
-
33. Becker A De, Riet I Van. Homing and migration of mesenchymal stromal cells : How to improve the efficacy of cell therapy? 2016;8(3):73-87.
-
34. Xu T, Lv Z, Chen Q, Guo M, Wang X, Huang F. Vascular endothelial growth factor overexpressed mesenchymal stem cells-conditioned media ameliorate palmitate-induced diabetic endothelial dysfunction through PI-3K/AKT/m-TOR/eNOS and p38/MAPK signaling pathway. Biomed Pharmacother [Internet]
2018;106(April):491–8. Available from:
https://doi.org/10.1016/j.biopha.2018.06.129
-
35. Iyer SS, Rojas M. Anti-infl ammatory effects of mesenchymal stem cells: novel. Expert Opin Biol Ther 2008;8(5):569–82.
-
36. Gallo S, Sala V, Gatti S, Crepaldi T. Cellular and
molecular mechanisms of HGF / Met in the
cardiovascular system. 2015;1173–93.
-
37. Kusunoki H, Taniyama Y, Otsu R, Rakugi H,
Morishita R. Anti-inflammatory effects of hepatocyte growth factor on the vicious cycle of macrophages and adipocytes. 2014;37(6):500–
-
6. Available from:
http://dx.doi.org/10.1038/hr.2014.41
-
38. Qin L, Zhu N, Ao B, Liu C, Shi Y, Du K, et al. Caveolae and Caveolin-1 Integrate Reverse
Cholesterol Transport and Inflammation in Atherosclerosis. 1:1–17.
-
39. Yang Y, Chen Q, Liu A, Xu X, Han J, Qiu H. Synergism of MSC-secreted HGF and VEGF in stabilising endothelial barrier function upon
lipopolysaccharide stimulation via the Rac1
pathway. Stem Cell Res Ther [Internet] 2015;1– 14. Available from:
http://dx.doi.org/10.1186/s13287-015-0257-0
-
40. Yang L, Kwon J, Popov Y, Gajdos GB, Ordog T, Brekken RA, et al. Vascular endothelial growth factor promotes fibrosis resolution and repair in
mice. Gastroenterology [Internet]
2014;146(5):1339-1350.e1. Available from: http://dx.doi.org/10.1053/j.gastro.2014.01.061
-
41. Han ZC, Plouet J, Sulpice E, Ding S, Berg M. Cross-talk between the VEGF-A and HGF signalling pathways in endothelial cells. 2009;101:525–39.
-
42. Chang H, Kim P, Cho H, Yum S, Choi Y, Son Y, et al. Inducible HGF-secreting Human Umbilical Cord Blood-derived MSCs Produced via TALEN-mediated Genome Editing Promoted
Angiogenesis. :1–11.
8
Discussion and feedback