KOMBINASI IPSC-DNSC BERBASIS ?CPP 3D-PRINTED BIOMIMETIC SCAFFOLDS DAN ANTI-HMGB1 MAB: INOVASI TERAPI REGENERATIF TERBARU BAGI PARA PENDERITA SPINAL CORD INJURY
on
ARTIKEL TINJAUAN PUSTAKA

ESSENTIAL:Essence of Scientific Medical Journal (2019), Volume 17, Number 1:16-24
P-ISSN.1979-0147, E-ISSN. 2655-6472
TINJAUAN PUSTAKA
KOMBINASI IPSC-DNSC BERBASIS μCPP 3D-PRINTED BIOMIMETIC SCAFFOLDS DAN ANTI-HMGB1 MAB: INOVASI TERAPI REGENERATIF TERBARU BAGI PARA PENDERITA SPINAL CORD INJURY
Glenardi,1a Ghea Mangkuliguna,1 Caroline Tanadi,1
ABSTRAK
Pendahuluan: Spinal cord injury (SCI) atau cedera tulang belakang merupakan sebuah kondisi patologis yang disebabkan akibat terjadinya kerusakan pada medula spinalis. Kondisi ini telah menjadi salah satu permasalahan kesehatan global yang paling kompleks karena tidak hanya menyebabkan kelainan neurologis, tetapi juga menimbulkan beban psikis dan sosial yang berat bagi para penderitanya. Baru-baru ini, sebuah terapi berbasis sel punca telah berhasil dikembangkan dan dapat menjadi solusi bagi permasalahan kesehatan yang satu ini. Sebuah sel punca berjenis iPSC-dNSC telah terbukti tidak hanya efektif dalam menginisiasi regenerasi sel neuron pada lokasi lesi SCI, tetapi juga dapat meredakan kondisi inflamasi yang terjadi pasca-trauma. Selanjutnya, untuk dapat menjaga kestabilan dan efek regeneratif dari iPSC-dNSCs, peneliti kemudian menggunakan sebuah media yang bernama μCPP 3D-printed biomimetic scaffolds untuk menjadi wadah bagi sel punca tersebut. Sedangkan, untuk dapat meningkatkan efektifitas dari iPSC-dNSCs agar lebih poten lagi, peneliti mengkombinasikan terapi ini dengan sebuah terapi neuroprotektif terbaru bernama anti-HMGB1 mAb.
Pembahasan: Studi literatur ini menunjukan bahwa terapi kombinasi iPSC-dNSC berbasis μCPP 3D-printed biomimetic scaffolds dan anti-HMGB1 mAb telah terbukti mampu mengembalikan fungsi lokomotor hingga mendekati normal kembali, dengan didapatkannya nilai skor ~7 pada pemeriksaan dengan teknik skoring Basso Mouse Scale (BMS).
Simpulan: Dengan demikian, dapat disimpulkan bahwa terapi kombinasi iPSC-dNSC berbasis μCPP 3D-printed biomimetic scaffolds dengan anti-HMGB1 mAb memiliki potensi yang menjanjikan untuk menjadi terapi utama bagi para penderita SCI diseluruh dunia
Kata Kunci: Anti-HMGB1 mAb, iPSC-dNSC, NSC, SCI, μCPP
ABSTRACT
Introduction: Spinal cord injury (SCI) is a pathologic condition due to trauma at the medulla spinalis. This condition has been considered as one of the most complex medical problems due to the fact that it does not only cause neurological defects, but also place a heavy burden on one’s psychology and mental health. Recently, a stem cell therapy has been successfully developed and could potentially be the solution for this medical problem. Among many different stem cells, only iPSC-dNSC, was proven to be effective not only in initiating neural regeneration, but also in mitigating inflammation post-trauma. In order to maintain the stability and therapeutic effects of iPSC-dNSC, researchers came up with the idea of using μCPP 3D-printed biomimetic scaffolds as a vehicle for the stem cells. To further increase the therapy’s potency, researchers combined the previous therapy with a novel neuroprotective therapy known as anti-HMGB1 mAb.
Discussion: This literature review yields results that the combination of iPSC-dNSC loaded in μCPP 3D-printed biomimetic scaffolds, with anti-HMGB1 mAb is able to reverse the motoric function post-SCI back to normal with a Basso Mouse Scale (BMS) score of ~7.
Conclusion: In conclusion, the combination of iPSC-dNSC loaded in μCPP 3D-printed biomimetic scaffolds, with anti-HMGB1 mAb has shown promise as the main therapy for treating SCI patients.
Keywords: Anti-HMGB1 mAb, iPSC-dNSC, NSC, SCI, μCPP
1Program Studi Pendidikan Dokter, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Katolik Indonesia Atma Jaya
aEmail: glenardihalim@ gmail.com
PENDAHULUAN
Spinal cord injury (SCI) atau cedera tulang belakang merupakan kondisi dimana terjadinya kerusakan pada medula spinalis yang diikuti dengan hilangnya kemampuan motorik maupun sensorik seseorang secara sementara atau permanen. Penyakit ini telah menjadi salah satu permasalahan kesehatan global yang paling kompleks karena tidak hanya menyebabkan kecacatan fisik, tetapi juga menyebabkan masalah psikis dan sosial yang berat bagi para penderita serta keluarganya.[1] Masalah ini kemudian menjadi semakin serius dengan ditemukannya pelonjakan jumlah kasus SCI secara drastis di dunia dalam 6 tahun terakhir. Pada tahun 2018 sendiri, diperkirakan terdapat sekitar 1,69 juta kasus SCI baru. Menurut World Health Organization (WHO), jumlah tersebut meningkat hingga 3 kali lipat, jika dibandingkan dengan jumlah kasus SCI
pada tahun 2013 lalu yang hanya berada di angka 500.000 kasus. Di Indonesia sendiri, jumlah penderita SCI juga mengalami peningkatan yang cepat setiap tahunnya, dimana pada tahun 2018 diperkirakan terdapat sekitar 58.740 kasus.[1,2] Dengan angka insidensi yang terus meningkat dan besarnya dampak yang diberikan pada para penderitanya, kebutuhan akan suatu terapi yang efektif telah menjadi suatu urgensi global yang harus segera ditangani.Namun nyatanya, pengobatan yang tersedia pada saat ini bagi para penderita SCI hanyalah berupa pengobatan suportif, seperti obat anti-inflamasi dan analgesik yang tidak dapat menyembuhkan atau bahkan sekadar menghambat perkembangan dari penyakit ini. Pengobatan lain yang dapat diberikan bagi para penderita SCI merupakan prosedur invasif, yaitu dengan tindakan operasi pada lokasi lesi. Namun sayangnya,
walaupun telah dilakukan tindakan yang tidak mudah dan invasif sekali ini pun, kerusakan yang telah terjadi pada medula spinalis tetap tidak dapat dikembalikan seperti semula.[3]
Penyebab utama parahnya manifestasi klinis yang terjadi pada penderita SCI adalah rendahnya kemampuan sel-sel neuron pada medula spinalis dalam melakukan regenerasi dirinya sendiri. Berangkat dari permasalahan tersebut, para peneliti kemudian mulai mengembangkan terapi-terapi baru yang berfokus untuk meningkatkan kemampuan regenerasi sel-sel neuron di sana. Obat-obatan baru yang pertama kali dikembangkan adalah obat-obatan yang berjenis neurotrophic factor dan growth factor.[5-8] Namun sayangnya, walaupun telah dikembangkan selama beberapa dekade terakhir, obat-obatan jenis ini tetap tidak menunjukan hasil yang memuaskan. Berbagai penelitian telah menemukan bahwa obat-obatan neurotropik ini memiliki hasil terapeutik yang tidak konsisten dan tidak signifikan sehingga tidak dapat dilakukan uji lebih lanjut pada fase klinis.
Selanjutnya, para peneliti mulai mengembangkan terapi lain yang berfokus dalam penekanan aktivitas dari molekul-molekul yang bertindak sebagai growth inhibitor pada sel-sel neuron SSP. Namun anehnya, walaupun obat-obatan tersebut telah berhasil dikembangkan dan terbukti mampu melakukan tugasnya sebagai penghambat aktivitas dari molekul-molekul growth inhibitor SSP, proses regenerasi dari sel-sel neuron di SSP masih saja tidak meningkat secara signifikan.[7,8]
Baru-baru ini, beberapa penelitian telah mengungkapkan bahwa ternyata penyebab utama rendahnya kemampuan regenerasi sel-sel neuron di SSP pada kondisi SCI adalah buruknya keadaan microenviroment pada lokasi lesi SCI itu sendiri. Proses infiltrasi sel-sel imun ke tempat luka telah membuat kadar sitokin-sitokin proinflamasi disana menjadi sangat tinggi.[4] Menurut beberapa penelitian, sitokin-sitokin proinflamasi tidak hanya mampu menyebabkan kerusakan lebih lanjut pada sel-sel neuron setempat, tetapi juga mampu menghambat proses regenerasinya dan bahkan menginisiasi terjadinya kematian sel neuron secara permanen. Untuk mengatasi kondisi tersebut, para peneliti kemudian mulai mengembangkan beberapa obat neuroprotektif bagi sel-sel neuron. Namun sayangnya, efek terapeutik dari obat-obatan tersebut tidaklah cukup efektif dikarenakan masih belum ditemukannya target terapi yang utama pada para penderita SCI sehingga terapi ini perlu dikembangkan lebih lanjut.[5]
Serangkaian kegagalan yang telah dialami ini, kemudian mendorong para peneliti untuk mengubah cara pandangnya dalam mengatasi rendahnya kemampuan regenerasi sel-sel neuron pada kondisi SCI. Kendati hanya berfokus pada bagaimana cara meningkatkan kemampuan regenerasi sel neuron setempat, para peneliti pada saat ini lebih fokus dengan bagaimana caranya kita dapat menggantikan sel-sel neuron yang sudah rusak atau apoptosis tersebut. Dengan cara pandang yang baru ini, peneliti kemudian mulai mengembangkan terapi berbasis sel punca untuk menangani kasus SCI.[9] Terapi dengan sel punca sangatlah menjanjikan karena tidak hanya dapat menggantikan sel-sel neuron yang rusak, tetapi juga mampu mensekresikan faktor-faktor pertumbuhan
bagi sel neuron sekitar dan memberikan efek neuroprotektif pada lokasi lesi.[10,11]
Terdapat berbagai jenis sel punca yang telah diuji coba pada kondisi SCI. Namun, dari berbagai jenis sel punca yang ada, induced pluripotent stem cell-derived neural stem cell (iPSC-dNSCs) merupakan satu-satunya sel punca yang telah terbukti paling cocok dan efektif dalam menangani kondisi SCI.[11-14] Berbeda dengan sel-sel punca jenis lainnya, iPSC-dNSCs dapat berdiferensiasi menjadi 3 jenis sel neuron yang berbeda dan telah terbukti tidak hanya mampu meregenerasi sel-sel neuron medula spinalis yang telah rusak, tetapi juga mampu mengembalikan fungsi sensorik maupun motorik pasien kembali menjadi normal hanya dalam waktu beberapa minggu.[12,15,16] Selanjutnya, untuk dapat menjaga kestabilan dan efek regeneratif dari iPSC-dNSCs, peneliti kemudian menggunakan sebuah media biomimetic 3D-printed terbaru yang bernama Microscale Continuous Projection Printing (μCPP) 3D-printed biomimetic scaffolds untuk menjadi wadah bagi sel-sel punca tersebut. Media ini berfungsi untuk menciptakan microenviroment yang baik bagi sel-sel iPSC-dNSCs, agar dapat berdiferensiasi dan bekerja secara efektif pada lesi SCI.[17-20]
Selain itu, baru-baru ini para peneliti juga telah berhasil menemukan target terapi terbaru yang efektif dalam mengurangi kondisi inflamasi pasca-trauma SCI dan telah mengembangkan terapinya. Sebuah antibodi monoklonal bernama anti-High-Mobility Group Box 1 monoclonal antibody (anti-HMGB1 mAb) telah terbukti menjadi obat neuroprotektif terbaru yang paling efektif hingga saat ini.[21-25] Selanjutnya, untuk dapat meningkatkan efektivitas dari iPSC-dNSCs agar lebih poten lagi, peneliti mengkombinasikannya dengan anti-HMGB1 mAb dan telah terbukti memberikan hasil yang maksimal. Kedua jenis terapi ini ditemukan dapat bekerja secara sinergis, dimana anti-HMGB1 mAb berperan dalam meminimalisir kematian sel neuron lebih lanjut pasca-trauma dan iPSC-dNSCs melakukan regenerasi pada sel-sel neuron yang telah mengalami kerusakan atau kematian tersebut.[25,26] Pada studi literatur ini, kami akan menjabarkan kemampuan dari terapi kombinasi iPSC-dNSCs berbasis μCPP 3D-printed scaffolds dengan anti-HMGB1 dalam melakukan regenerasi sel-sel neuron dan potensinya dalam menjadi terapi utama bagi semua penderita SCI di dunia.
PEMBAHASAN
Perkembangan Terapi Berbasis Sel Punca sebagai Terapi Terbaru bagi Penderita Spinal Cord Injury (SCI)
Tingginya angka insidensi maupun mortalitas dari SCI, tidak lepas dari ketidakmampuan pengobatan SCI yang ada dalam menangani penyakit tersebut. Terapi SCI yang tersedia pada saat ini hanyalah berupa terapi suportif biasa yang tidak dapat menyembuhkan kondisi ini. Selain itu, pengembangan terapi SCI terbarunya pun selama beberapa dekade terakhir hanyalah terbatas pada bagaimana cara meningkatkan kemampuan regenerasi sel-sel neuron yang sudah ada melalui pemberian neurotrophic factor ataupun anti-growth inhibitor, namun tidak dengan menginisiasi proses pembentukan sel-sel neuron yang baru. Setelah diuji coba selama beberapa tahun belakangan, semua terapi-terapi jenis ini dinilai kurang efektif dan tidak
konsisten.[9] Oleh karena itu, akhir-akhir ini, para peneliti mulai beralih untuk mengembangkan terapi berbasis sel punca karena dinilai lebih menjanjikan. Secara umum, terapi berbasis sel punca lebih menjanjikan karena terapi ini tidak hanya dapat membantu proses regenerasi yang sudah terjadi secara fisiologis, tetapi terapi ini juga dapat mengembalikan kerusakan sel-sel neuron yang sudah terjadi sebelumnya menjadi normal kembali. Terapi berbasis sel punca ini bekerja melalui 5 mekanisme utama pada kondisi SCI, yaitu neuroproteksi, imunomodulasi, regenerasi akson, membentuk relay formation, dan myelinisasi.[9,27,28,29] Sampai saat ini, terdapat 5 jenis sel punca yang berpotensi untuk terapi SCI, yaitu oligodendrocyte precursor cells (OPC), olfactory ensheathing cells (OEC), Schwann cells, mesenchymal stem cell (MSC) serta neural stem cells (NSC). Namun, dari sekian jenis sel punca tersebut hanya NSC-lah yang telah terbukti mampu menunjukan hasil yang efektif dan maksimal karena dapat menginduksi ke-5 efek terapeutik tersebut pada sel-sel neuron pada medula spinalis.[9,27]
NSC merupakan sel multipoten yang dapat ditemukan pada zona subventrikular, zona subgranular pada gyrus dentatus hipokampus, bulbus olfaktorius, septum, striatum, serta medula spinalis.[29,30] Sel punca ini dapat berdiferensiasi menjadi 3 jenis sel neuron, yaitu sel oligodendrosit, sel astrosit, dan sel neurit (akson) dan baru-baru ini ditemukan dapat menjadi terapi regeneratif terbaru bagi penderita SCI.[29,31] NSC terbukti mampu menginduksi regenerasi sel-sel neuron pada kondisi SCI secara efektif pada fase akut, subakut maupun kronik.[15,32-36] Dengan menjadi sel oligodendrosit, NSC dapat melakukan remyelinisasi pada sel-sel neuron yang telah mengalami demyelinisasi akibat cedera primer/sekunder dan juga dapat melakukan myelinisasi pada NSC yang berdiferensiasi menjadi akson/neuron baru. Hal tersebut telah dibuktikan oleh penelitian dari Yasuda dkk. yang menemukan bahwa NSC telah terbukti mampu melakukan remyelinisasi pada sel-sel neuron di tempat lesi.[37] Selain itu, kemampuan NSC dalam berdiferensiasi menjadi sel neurit (akson) juga telah dibuktikan oleh studi yang dilakukan oleh Sharp dkk., yang mana pada penelitian tersebut NSC telah ditemukan mampu menginduksi pertumbuhan akson hingga sepanjang 15 mm pada sisi rostral maupun kaudal lesi.[33] Hasil penelitian tersebut, juga didukung oleh Curtis dkk., dimana pada penelitian ini didapatkan bahwa pertumbuhan akson yang berasal dari terapi NSC tetap berlangsung secara signifikan di atas maupun di bawah tingkat lesi hingga pada bulan ke-9 setelah transplantasi NSC.[15] Bahkan, NSC juga telah terbukti mampu melakukan relay formation pada lokasi lesi dengan cara menghubungkan akson host dengan graft sehingga terbentuk suatu jalur alternatif bagi akson-akson yang mengalami kerusakan sehingga penghantaran impuls tetap
terjadi.[35] Bukan hanya itu saja, penelitian in vivo dari Levi dkk. juga menunjukkan hasil yang menakjubkan. Pada penelitian tersebut NSC telah terbukti mampu memperbaiki fungsi sensorik maupun motorik model tikus SCI secara signifikan dan tanpa dijumpai adanya efek samping yang berbahaya.[38,39]
Dengan berbagai kemampuan yang dimiliki NSC, baru-baru ini, Food and Drug Administration (FDA) telah menyetujui penggunaan NSC untuk diuji coba secara klinis pada manusia. Persetujuan ini merupakan kejadian bersejarah dalam perkembangan terapi SCI, karena NSC merupakan satu-satunya sel punca yang telah disetujui oleh FDA dalam penggunaannya sebagai terapi bagi para penderita SCI. Dengan begitu dapat dibuktikan bahwa, NSC memiliki potensi yang menjanjikan untuk menjadi terapi SCI terbaru.
Potensi Induced Pluripotent Stem Cell-derived Neural Stem Cell (iPSC-dNSC) sebagai Terapi Regeneratif Terbaru bagi Penderita SCI
Meskipun NSC telah menunjukkan kemampuannya yang sangat luar biasa, akan tetapi NSC masih memiliki satu kekurangan, yaitu terbatasnya jumlah sel punca yang dapat diambil dari jaringan otak.[12,13,40,41,42] Belakangan, peneliti telah berhasil menangani masalah tersebut dengan cara menggunakan sel punca jenis induced pluripotent stem cells (iPSC) untuk dijadikan bahan dasar dalam pembuatan NSC, sehingga NSC yang dihasilkan disebut juga dengan Induced Pluripotent Stem Cell-derived Neural Stem Cell (iPSC-dNSC). iPSC berasal dari sel-sel somatik manusia sendiri yang diinduksi dengan faktor transkripsi seperti Oct4, Sox2, Klf4, dan c-Myc untuk menjadi sel pluripoten (iPSC) yang dapat memperbaharui diri (selfrenewing) dan berdiferensiasi menjadi NSC.[12,14]
iPSC-dNSC terbukti memiliki kemampuan diferensiasi yang sama dengan NSC pada umumnya. Pada studi in vivo yang dilakukan oleh Lu dkk., iPSC-dNSC telah ditemukan berdiferensiasi menjadi oligodendrosit dengan ditemukannya terjadi proses myelinisasi pada akson sekitar lesi (Gambar 1a).[40] Selanjutnya, iPSC-dNSC juga berhasil menghubungkan akson yang mengalami kerusakan dengan membentuk suatu relay formation. Studi in vivo yang dilakukan oleh Lu dkk. menunjukkan bahwa iPSC-dNSC mampu menginduksi pertumbuhan akson baru dari sisi rostral hingga mencapai kaudal yang panjangnya bisa mencapai kurang lebih 9 cm. Studi yang sama juga memperlihatkan pertumbuhan akson host menuju ke graft meningkat hingga 6 kali lipat lebih tinggi dibandingkan dengan kelompok kontrol pada mencit yang ditransplantasikan dengan iPSC-dNSC (Gambar 1b,c).[40] Hasil tersebut mengindikasikan bahwa pemberian iPSC-dNSC dapat membentuk hubungan resiprokal antara host-graft dan graft-host.
ESSENTIAL:Essence of Scientific Medical Journal (2019), Volume 17, Number 1:16-24
P-ISSN.1979-0147, E-ISSN. 2655-6472
Gambar 1. Kemampuan iPSC-dNSC untuk Menginduksi (a) Remyelinisasi dan (b,c) Pertumbuhan host-graft[40]
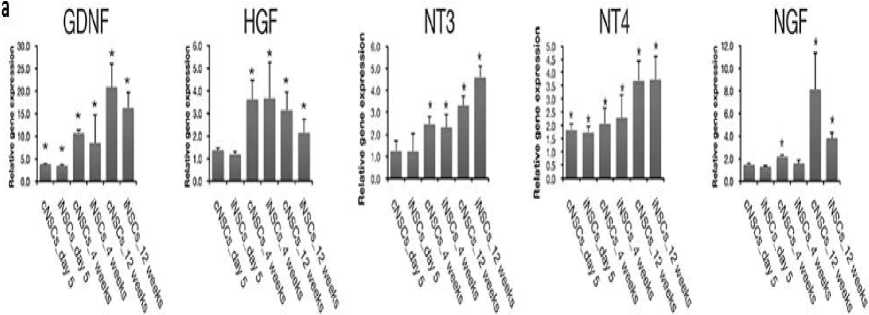
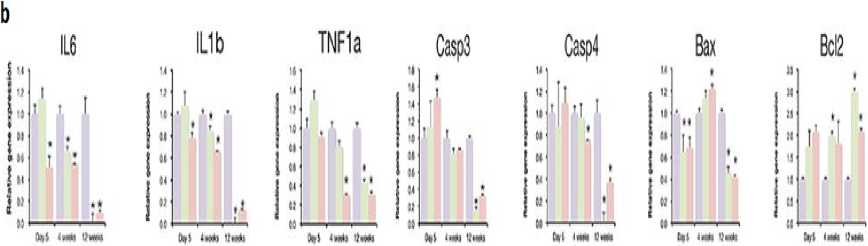
Selain itu, iPSC-dNSC juga ternyata telah ditemukan mampu mensekresikan berbagai jenis neurotrophic factor, seperti BDGF, NT3, NGF, dan faktor lainnya (Gambar 2a) serta memberikan efek imunomodulasi dan neuroproteksi pada sekitar lesi SCI, dengan ditemukannya penurunan produksi TNF-α hingga 5 kali lipat, IL-1β 10 kali lipat, dan IL-6
10 kali lipat lebih rendah dibandingkan kontrol (Gambar 2b).[40] Hasil tersebut menunjukan bahwa, iPSC-dNSC ternyata tidak hanya dapat meningkatkan jumlah sel neuron, tetapi juga dapat membuat kondisi microenvironment di tempat lesi menjadi lebih mendukung sehingga perbaikan sel neuron menjadi cepat.
Wiicls cNSCs INSCs
Gambar 2. Kemampuan iPSC-dNSC untuk (a) Sekresi Neurotrophic Factor dan (b) Imunomodulasi[42]
Dengan segala kemampuan yang dimiliki iPSC-dNSC tersebut, para peneliti kemudian mencari tahu lebih lanjut mengenai kemampuan sel punca ini untuk memperbaiki gangguan neurologis yang terjadi pasca SCI. Menurut penelitian yang dilakukan oleh Salewski dkk., iPSC-dNSC telah terbukti mampu meningkatkan kemampuan fungsi lokomotor pasien SCI secara signifikan. Hal tersebut
Basso Mouse Scale
dapat dilihat dari nilai skor BMS yang didapatkan oleh kelompok iPSC-dNSC, dimana kelompok tersebut berhasil mendapatkan skor 4 disaat kelompok kontrol hanya mendapatkan skor 2 (Gambar 3).[14] Hasil tersebut menunjukan bahwa, pemberian iPSC-dNSC tidak hanya dapat meningkatkan jumlah sel-sel neuron baru di tempat lesi SCI saja, tetapi juga dapat menghasilkan sel-sel neuron yang dapat bekerja dengan sangat baik di tempat lesi.
Gambar 3. Kemampuan iPSC-dNSC untuk Mengembalikan Fungsi Motorik.[14]
Peran Microscale Continuous Projection Printing (μCPP) 3D-printed biomimetic scaffolds sebagai Media Transplantasi bagi iPSC-dNSC
Seperti yang sudah dibahas sebelumnya, terapi berbasis sel punca memang telah terbukti efektif dalam menangani kasus SCI. Namun, penggunaan sel punca tanpa adanya struktur penunjang yang baik dapat menyebabkan sel-sel neuron yang dihasilkan menjadi tumbuh secara tidak beraturan dan gagal melakukan perbaikan. Selain itu, keadaan microenvironment yang buruk, seperti tingginya kadar sitokin proinflamasi pada lokasi lesi juga membuat efektifitas kerja sel punca menjadi menurun. Untuk mengatasi masalah ini, para peneliti kemudian mengembangkan scaffold sebagai media untuk terapi berbasis sel punca.[44-46] Terdapat dua jenis bahan scaffold yang biasa digunakan, yaitu bahan alami dan bahan sintetik. Namun dari semua bahan yang ada, hanya poly(lactic-co-glycolic acid) (PLGA) lah yang terbukti paling baik karena selain memiliki kekuatan mekanik yang besar dan fleksibilitas yang tinggi, PLGA juga dapat membawa faktor-faktor neurotropik.[47-49] Pada umumnya, scaffold dibuat dengan teknik 3D printing agar mampu membuat biomimetic scaffold yang menyerupai matriks ekstrasel sehingga mampu memfasilitasi distribusi sel yang merata dan terstruktur.[49,50] Beberapa studi telah mengungkapkan bahwa penggunaan 3D biomimetic scaffold tidak hanya dapat mengurangi inflamasi, pembentukkan glial scar, dan membuat
microenvironment menjadi lebih mendukung, tetapi juga dapat memaksimalkan penutupan rongga pada lesi.
Namun, permasalahan yang timbul dengan metode pencetakan saat ini adalah ketidakmampuannya untuk membuat suatu kerangka yang cocok untuk semua jenis lesi. Baru-baru ini, peneliti telah menemukan suatu metode pencetakan baru yang memungkinkan para peneliti untuk membuat kerangka 3D biomimetic scaffold yang dapat disesuaikan (customized) dengan berbagai jenis jenis lesi pada semua penderita SCI. Metode pencetakan ini disebut juga dengan microscale continuous projection printing method (μCPP).[17] Dengan metode pencetakan 3D biomimetic scaffold yang baru ini, peneliti telah menemukan bahwa efektivitas dari iPSC-dNSC dapat meningkat secara drastis.
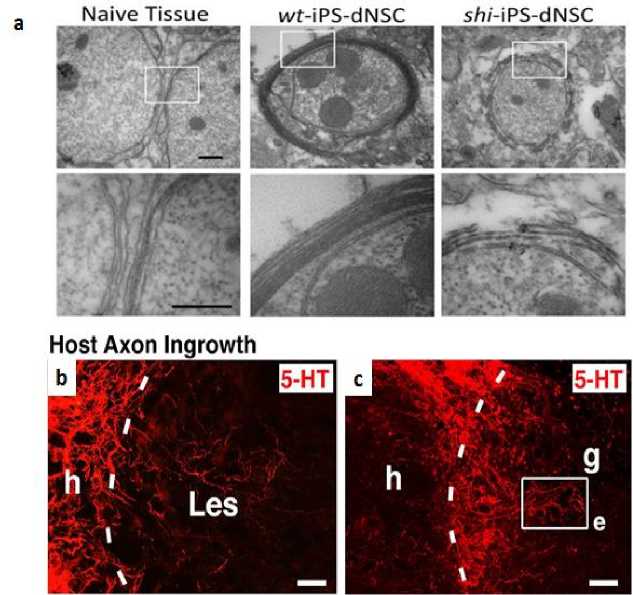
Hasil penelitian dari Koppler dkk. pada awal tahun 2019 ini menunjukkan bahwa, penggunaan μCPP 3D-printed biomimetic scaffold untuk menghantarkan iPSC-dNSC terbukti mampu memfasilitasi pertumbuhan akson dan sel neuron lain secara beraturan/linier hanya dalam 4 minggu (Gambar 4a,b). Selain itu, 3D biomimetic scaffold terbaru ini juga telah ditemukan mampu meningkatkan efektifitas iPSC-dNSC dalam memperbaiki fungsi lokomotor pasien, dengan ditemukannya nilai skor Basso, Beattie and Bresnahan (BBB) hingga mencapai 7.2, disaat terapi lain yang menggunakan 3D-printed scaffold biasa hanya mendapatkan skor ~1.8 (Gambar 4c).
Selanjutnya, untuk mengevaluasi relay formation yang terbentuk pada lokasi lesi, dilakukan pengukuran motor evoked potential (MEP). Hasilnya pun sangat memuaskan dimana pada kelompok yang diterapi dengan iPSC-dNSC berbasis μCPP 3D-printed biomimetic scaffolds ditemukan terjadi
pembentukan relay formation hingga 10 kali lipat lebih tinggi dibandingkan kelompok kontrol (Gambar 4d,e). Berdasarkan hasil-hasil tersebut, dapat disimpulkan bahwa penggunaan μCPP 3D-printed biomimetic scaffolds mampu meningkatkan efektivitas terapi iPSC-dNSC.[17]
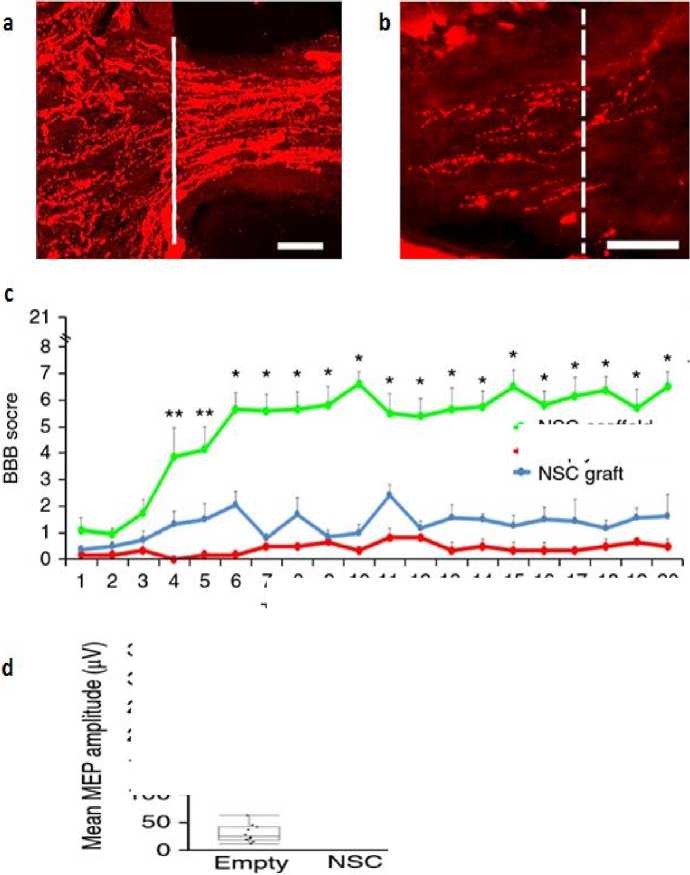
* NSC-scaffold
*- Empty scaffold
scaffold
7 8 9 10 11 12 13 14 15 16 17 18 19 20
Time post implant (weeks)
350 -300 -250 -200 -
150 -
1OO -
Gambar 4. (a,b) Pertumbuhan Akson dan Sel Neuron lain di Lokasi Lesi; (c) BBB motor score; (d) Mean MEP amplitude[17]
Potensi Anti-high-mobility group box 1 monoclonal antibody dalam Meningkatkan Efektifitas iPSC-dNSC sebagai Terapi SCI Terbaru
Meskipun berdasarkan hasil-hasil penemuan sebelumnya sudah menetapkan terapi berbasis sel punca sebagai terapi yang paling menjanjikan bagi para penderita SCI. Akan tetapi, sebuah terapi tunggal dengan iPSC-dNSC saja tidaklah cukup untuk mengembalikan kondisi pendenderita SCI menjadi normal kembali. Sebuah antibodi monoklonal bernama anti-HMGB1 mAb telah ditemukan mampu meningkatkan efektifitas dari terapi iPSC-dNSC hingga 2 kali lipat jika diberikan secara kombinasi.[21,25,26]
Berbeda dengan terapi neuroprotektif generasi sebelumnya, antibodi monoklonal yang satu ini telah diketahui mampu bekerja pada sebuah biomolekul bernama High-Mobility Group Box 1 (HMGB1) yang merupakan komponen utama
penyebab terjadinya cedera sekunder dalam proses patogenesis SCI. Pada kondisi pasca-trauma, cedera dapat terjadi sebagai kelanjutan dari kerusakan medula spinalis yang sudah terjadi sebelumnya dan cedera ini disebut juga dengan cedera sekunder.[21] Walaupun cedera primer pada penderita SCI tidak dapat kita hindari, tetapi cedera sekunder pada kondisi ini dapat kita cegah. Selama ini, belum ada terapi yang mampu mencegah terjadinya cedera sekunder pada para penderita SCI dikarenakan belum diketahuinya mekanisme utama terjadinya proses inflamasi pada fase sekunder tersebut. Namun setelah ditemukannya HMGB-1, mencegah terjadinya kerusakan lebih lanjut pasca-trauma bukanlah hal yang mustahil lagi.[23,24,25]
HMGB-1 secara khusus disekresikan ke ekstraseluler oleh sel-sel neuron pada medula spinalis yang mengalami kerusakan atau apoptosis akibat cedera primer. Biomolekul ini kemudian akan menempel pada sel-sel mikroglia, sel astrosit, dan
sel-sel imun sekitar melalui reseptor-reseptor, seperti TLR4, TLR2, dan RAGE untuk menginduksi translokasi dari NF-κB ke dalam nukleus sel dan menginisiasi pelepasan sitokin-sitokin pro-inflamasi pada lokasi sekitar lesi primer.[21,22] Proses inflamasi inilah yang kemudian menyebabkan terjadinya cedera sekunder pada SCI dan pada akhirnya dapat memperparah serta mempersulit proses regenerasi kerusakan neurologi yang sudah terjadi sebelumnya.[21]
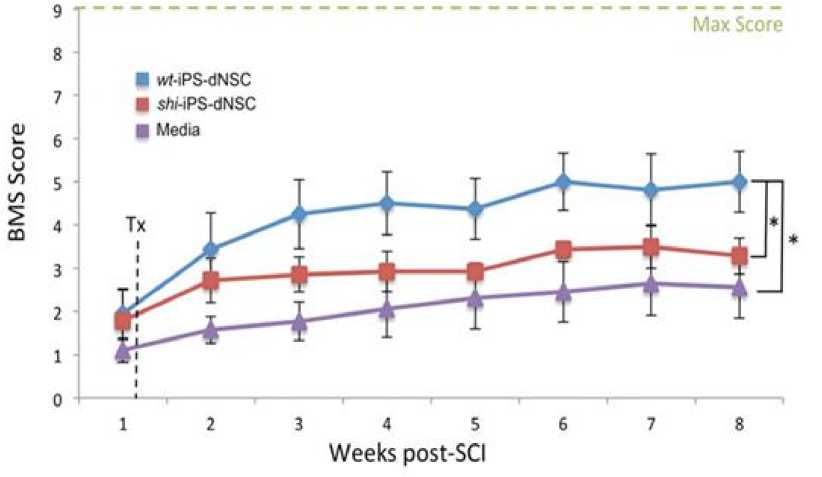
Terapi dengan menggunakan anti-HMGB1 mAb telah terbukti mampu mampu mencegah terjadinya kerusakan pada blood-spinal cord barrier (BSCB) dan menghambat terjadinya edema pada medula spinalis selama cedera sekunder sehingga sel-sel di sekitar lesi pun dapat dipertahankan dan dicegah kematiannya.[23,24] Dengan kemampuan anti-HMGB1 mAb dalam menghambat terjadinya cedera sekunder dan kemampuan iPSC-dNSC dalam melakukan diferensiasi serta regenerasi sel-sel neuron ditempat lesi, membuat kombinasi kedua terapi ini menjadi terapi SCI yang paling poten hingga saat ini. Hal tersebut didukung oleh hasil penelitian dari Uezono dkk. pada tahun 2018, dimana fungsi lokomotor model mencit SCI yang diterapi kombinasi dapat meningkat hingga 2 kali lipat lebih baik dibanding dengan terapi tunggal sel punca. Pada pemeriksaan fungsi lokomotor tungkai atas dengan teknik skoring Basso Mouse Scale (BMS), didapatkan bahwa skor BMS mencit SCI tersebut berada di angka ~7, yang mengindikasikan fungsi lokomotor hampir mendekati normal (Gambar 5a). Menariknya, nilai skor BMS tersebut merupakan nilai skor yang paling tinggi yang pernah dicapai dalam sejarah perkembangan terapi SCI selama ini. Selain itu, peneliti juga menilai posisi kaki mencit SCI tersebut selama melangkah untuk mengevaluasi fungsi motoriknya. Hasilnya pun menunjukan bahwa mencit yang diberikan dengan terapi kombinasi iPSC-dNSC dan anti-HMGB1 mAb telah mengalami perbaikan fungsi motorik yang paling baik diantara kelompok lainnya, dengan didapatkannya sudut rotasi kaki mencit yang sangat kecil. Hal tersebut mengindikasikan bahwa mencit SCI tersebut sudah dapat mengendalikan serta menopang kakinya sendiri selama melangkah dan tidak menyeret kakinya, seperti yang terjadi pada kelompok mencit yang tidak diterapi (Gambar 5b,c). Selanjutnya, untuk mengevaluasi kemampuan motorik halus, peneliti kemudian melakukan uji grid walking test pada mencit SCI tersebut. Hasilnya pun menunjukan bahwa kelompok mencit yang diberikan dengan terapi kombinasi memiliki kemampuan motorik halus yang paling baik diantara semua kelompok, karena dapat melakukan koordinasi dan penempatan kaki yang tepat serta akurat selama dilakukan uji tersebut (Gambar 5d).[26]
SIMPULAN
Dengan terus meningkatnya angka insidensi SCI setiap tahunnya, kebutuhan akan suatu terapi yang efektif harus segera direalisasikan. Baru-baru ini, sebuah terapi kombinasi baru telah berhasil dikembangkan dan terbukti mampu memberikan hasil terapeutik yang maksimal. Terapi kombinasi iPSC-dNSC berbasis μCPP 3D-printed biomimetic scaffolds dan anti-HMGB1 mAb telah terbukti secara in vitro dan in vivo tidak hanya mampu menginisiasi regenerasi sel-sel neuron pada lokasi lesi SCI, tetapi juga mampu memberikan perbaikan fungsi
neurologis yang signifikan pada berbagai jenis penderita.
Dengan kemampuan anti-HMGB1 mAb yang dapat menghambat terjadinya cedera sekunder pasca-trauma dan kemampuan iPSC-dNSC dalam melakukan regenerasi sel-sel neuron, membuat terapi kombinasi ini menjadi terapi SCI yang paling poten yang pernah dikembangkan hingga saat ini. Selain itu, μCPP 3D-printed biomimetic scaffolds yang digunakan sebagai media penghantar juga mampu membuat terapi ini dapat digunakan oleh semua jenis penderita SCI sehingga dapat dijadikan terapi utama bagi seluruh penderita SCI di dunia. Dengan demikian, dapat disimpulkan bahwa terapi kombinasi iPSC-dNSC berbasis μCPP 3D-printed biomimetic scaffolds dengan anti-HMGB1 mAb memiliki potensi yang menjanjikan untuk menjadi solusi nyata bagi permasalahan SCI pada saat ini.
SARAN
Penemuan iPSC-dNSC sebagai terapi berbasis sel punca yang dapat menginduksi remyelinisasi, regenerasi akson, dan pembentukan relay formation sekaligus memperbaiki
microenvironment pasca SCI. Oleh karena itu, kami menyarankan agar dilakukan penelitian lebih lanjut mengenai topik ini, terutama mengenai kombinasi iPSC-dNSC dengan anti-HMGB1 mAb sebagai terapi SCI terbaru. Selain itu, kami juga menyarankan agar dilakukan penelitian lebih lanjut mengenai μCPP 3D-printed biomimetic scaffolds sebagai media yang efektif bagi kombinasi terapi ini, sehingga dapat memaksimalkan efek terapeutik yang ada sekaligus menjadi terapi utama bagi para penderita SCI di masa yang akan mendatang.
DAFTAR PUSTAKA
-
1. Stucki G, Bickenbach J. The International Spinal Cord Injury Survey and the Learning Health System for Spinal Cord Injury. American journal of physical medicine & rehabilitation. 2017 Feb 1;96(2):S2-4.
-
2. Kang Y, Ding H, Zhou H, Wei Z, Liu L, Pan D, et al. Epidemiology of worldwide spinal cord injury: a literature review. Journal of
Neurorestoratology. 2017 Dec 29;6:1-9.
-
3. Raspa A, Pugliese R, Maleki M, Gelain F. Recent therapeutic approaches for spinal cord injury. Biotechnology and bioengineering. 2016 Feb;113(2):253-9.
-
4. Silver J, Schwab ME, Popovich PG. Central nervous system regenerative failure: role of oligodendrocytes, astrocytes, and microglia. Cold Spring Harbor perspectives in biology. 2015 Mar 1;7(3):a020602.
-
5. Ahuja CS, Fehlings M. Concise review: bridging the gap: novel neuroregenerative and
neuroprotective strategies in spinal cord injury. Stem cells translational medicine. 2016 Jul
1;5(7):914-24.
-
6. Hodgetts SI, Harvey AR. Neurotrophic factors used to treat spinal cord injury. InVitamins and hormones. Academic Press. 2017;104:405-57.
-
7. Wilems TS, Pardieck J, Iyer N, Sakiyama-Elbert SE. Combination therapy of stem cell derived neural progenitors and drug delivery of anti-inhibitory molecules for spinal cord injury. Acta biomaterialia. 2015 Dec 31;28:23-32.
-
8. Wilems TS, Sakiyama-Elbert SE. Sustained dual drug delivery of anti-inhibitory molecules for
treatment of spinal cord injury. Journal of Controlled Release. 2015 Sep 10;213:103-11.
-
9. Assinck P, Duncan GJ, Hilton BJ, Plemel JR, Tetzlaff W. Cell transplantation therapy for spinal cord injury. Nature neuroscience. 2017
May;20(5):637.
-
10. Yousefifard M, Rahimi-Movaghar V,
Nasirinezhad F, Baikpour M, Safari S, Saadat S, et al. Neural stem/progenitor cell transplantation for spinal cord injury treatment; A systematic review and meta-analysis. Neuroscience. 2016 May 13;322:377-97.
-
11. Stenudd M, Sabelström H, Frisén J. Role of endogenous neural stem cells in spinal cord injury and repair. JAMA neurology. 2015 Feb 1;72(2):235-7.
-
12. Lee-Kubli CA, Lu P. Induced pluripotent stem cell-derived neural stem cell therapies for spinal cord injury. Neural regeneration research. 2015 Jan;10(1):10.
-
13. Khazaei M, Ahuja CS, Rodgers CE, Chan P, Fehlings MG. Generation of Definitive Neural Progenitor Cells from Human Pluripotent Stem Cells for Transplantation into Spinal Cord Injury. InNeural Stem Cells. 2019:25-41.
-
14. Salewski RP, Mitchell RA, Li L, Shen C, Milekovskaia M, Nagy A, et al. Transplantation of induced pluripotent stem cell‐ derived neural stem cells mediate functional recovery following thoracic spinal cord injury through remyelination of axons. Stem cells translational medicine. 2015 Jul 1;4(7):743-54.
-
15. Curtis E, Martin JR, Gabel B, Sidhu N, Rzesiewicz TK, Mandeville R, et al. A First-inHuman, Phase I Study of Neural Stem Cell Transplantation for Chronic Spinal Cord Injury. Cell stem cell. 2018 Jun 1;22(6):941-50.
-
16. Romanyuk N, Amemori T, Turnovcova K, Prochazka P, Onteniente B, Sykova E, et al. Beneficial effect of human induced pluripotent stem cell-derived neural precursors in spinal cord injury repair. Cell transplantation. 2015 Sep 14;24(9):1781-97.
-
17. Koffler J, Zhu W, Qu X, Platoshyn O, Dulin JN, Brock J, et al. Biomimetic 3D-printed scaffolds for spinal cord injury repair. Nat Med. 2019 Feb 1;25(2):263–9.
-
18. Shin JE, Jung K, Kim M, Hwang K, Lee H, Kim IS, et al. Brain and spinal cord injury repair by implantation of human neural progenitor cells seeded onto polymer scaffolds. Experimental & molecular medicine. 2018 Apr 20;50(4):39.
-
19. Kang PH, Kumar S, Schaffer DV. Novel biomaterials to study neural stem cell mechanobiology and improve cell-replacement therapies. Current opinion in biomedical engineering. 2017 Dec 1;4:13-20.
-
20. Führmann T, Anandakumaran PN, Shoichet MS. Combinatorial therapies after spinal cord injury: how can biomaterials help?. Advanced healthcare materials. 2017 May;6(10):1601130.
-
21. Papatheodorou A, Stein A, Bank M, Sison CP, Gibbs K, Davies P, et al. High-mobility group box 1 (HMGB1) is elevated systemically in persons with acute or chronic traumatic spinal cord injury. Journal of neurotrauma. 2017 Feb 1;34(3):746-54.
-
22. Kigerl KA, Lai W, Wallace LM, Yang H, Popovich PG. High mobility group box-1 (HMGB1) is increased in injured mouse spinal cord and can
elicit neurotoxic inflammation. Brain, behavior, and immunity. 2018 Aug 1;72:22-33.
-
23. Sun L, Li M, Ma X, Feng H, Song J, Lv C, et al. Inhibition of HMGB1 reduces rat spinal cord astrocytic swelling and AQP4 expression after oxygen-glucose deprivation and reoxygenation via TLR4 and NF-κB signaling in an IL-6-dependent manner. Journal of
neuroinflammation. 2017 Dec;14(1):231.
-
24. Sun L, Li M, Ma X, Zhang L, Song J, Lv C, et al. Inhibiting high mobility group box-1 reduces early spinal cord edema and attenuates astrocyte activation and aquaporin-4 expression after spinal cord injury in rats. Journal of neurotrauma. 2018 Jun 21(ja).
-
25. Nakajo M, Uezono N, Nakashima H, Wake H, Komiya S, Nishibori M, et al. Therapeutic time window of anti-high mobility group box-1 antibody administration in mouse model of spinal cord injury. Neuroscience research. 2018 Mar 28.
-
26. Uezono N, Zhu Y, Fujimoto Y, Yasui T, Matsuda T, Nakajo M, et al. Prior Treatment with Anti‐ High Mobility Group Box‐ 1 Antibody Boosts Human Neural Stem Cell Transplantation‐ Mediated Functional Recovery After Spinal Cord Injury. Stem Cells. 2018 May;36(5):737-50.
-
27. Oh SK, Jeon SR. Current Concept of Stem Cell Therapy for Spinal Cord Injury: A Review. Korean J Neurotrauma. 2016;12(2):40-46.
-
28. Fischer I, Hou S. Using Neural Stem Cells to Enhance Repair and Recovery of Spinal Circuits After Injury. Oxford Research Encyclopedia of Neuroscience. 2018.
-
29. Zhu Y, Uezono N, Yasui T, Nakashima K. Neural stem cell therapy aiming at better functional recovery after spinal cord injury. Dev Dyn.
2018;247:75-84.
-
30. Rugnetta M. Neural stem cell | biology. [Diakses 2019 Feb 9]. Dari:
https://www.britannica.com/science/neural-stem-cell
-
31. Bond AM, Ming GL, Song H. Adult Mammalian Neural Stem Cells and Neurogenesis: Five Decades Later. Cell Stem Cell. 2015;17(4):385-95.
-
32. Iwai H, Nori S, Nishimura S, Yasuda A, Takano M, Tsuji O, et al. Transplantation of neural
stem/progenitor cells at different locations in mice with spinal cord injury. Cell Transplant. 2014;23(11):1451-64. doi:
10.3727/096368913X670967
-
33. Sharp KG, Yee KM, Steward O. A re
assessment of long distance growth and connectivity of neural stem cells after severe spinal cord injury. Exp Neurol. 2014;257:186-204.
-
34. Cheng Z, Zhu W, Cao K, Wu F, Li J, Wang G, et al. Anti-inflammatory mechanism of neural stem cell transplantation in spinal cord injury. Int. J. Mol. Sci. 2016;17:1380.
-
35. Rosenzweig ES, Brock JH, Lu P, Kumamaru H, Salegio EA, Kadoya K, Weber JL, et al.
Restorative effects of human neural stem cell grafts on the primate spinal cord. Nature medicine. 2018 Apr;24(4):484.
-
36. Xiong LL, Zou Y, Shi Y, Zhang P, Zhang RP, Dai XJ, et al. Tree shrew neural stem cell
transplantation promotes functional recovery of tree shrews with a hemi‐ sectioned spinal cord injury by upregulating nerve growth factor
expression. International journal of molecular medicine. 2018 Jun 1;41(6):3267-77.
-
37. Yasuda A, Tsuji O, Shibata S, Nori S, Takano M, Kobayashi Y, et al. Significance of remyelination by neural stem/progenitor cells transplanted into the injured spinal cord. Stem Cells. 2011
Dec;29(12):1983-94.
-
38. Ghobrial GM, Anderson KD, Dididze M, Martinez-Barrizonte J, Sunn GH, Gant KL, et al. Human Neural Stem Cell Transplantation in Chronic Cervical Spinal Cord Injury: Functional Outcomes at 12 Months in a Phase II Clinical Trial. Neurosurgery. 2017;64:87-91.
-
39. Levi AD, Anderson KD, Okonkwo DO, Park P, Bryce TN, Kurpad SN. Clinical outcomes from a multi-center study of human neural stem cell transplantation in chronic cervical spinal cord injury. J Neurotrauma. 2018.
-
40. Lu P, Woodruff G, Wang Y, et al. Long-distance axonal growth from human induced pluripotent stem cells after spinal cord injury. Neuron. 2014;83(4):789-96.
-
41. Fan L, Liu C, Chen X, Zou Y, Zhou Z, Lin C, et al. Directing induced pluripotent stem cell derived neural stem cell fate with a threedimensional biomimetic hydrogel for spinal cord injury repair. ACS Appl Mater Interfaces. 2018;10(21):17742-5.
-
42. Hong JY, Lee SH, Lee SC, Kim JW, Kim KP, Kim SM, et al. Therapeutic potential of induced
neural stem cell for spinal cord injury. J Biol Chem. 2014;289(47):32512-25.
-
43. Gomes ED, Silva NA, Salgado AJ. Combinatorial therapies for spinal cord injury: strategies to induce regeneration. Neural Regen Res. 2019;14(1):69-71.
-
44. Shrestha B, Coykendall K, Li Y, Moon A, Priyadarshani P, Yao L. Repair of injured spinal cord using biomaterial scaffolds and stem cells. Stem Cell Res Ther. 2014;5(4):91.
-
45. Li X, Liu D, Xiao Z, Zhao Y, Han S, Chen B, et al. Scaffold-facilitated locomotor improvement post complete spinal cord injury: motor axon regeneration versus endogenous neuronal relay formation. 2019;197:20-31.
-
46. Ai J, Kiasat-Dolatabadi A, Ebrahimi-Barough S, Ai A, Lotfibakhshaiesh N, et al. Polymeric Scaffolds in Neural Tissue Engineering: A Review, Arch Neurosci. 2014 ; 1(1):15-20. doi: 10.5812/archneurosci.9144.
-
47. Zhang Q, Shi B, Ding J, Yan L, Thawani JP, Fu C, et al. Polymer scaffolds facilitate spinal cord injury repair. Acta Biomaterialia. 2019.
-
48. Zhao W, Li J, Jin K, Liu W, Qiu X, Li C. Fabrication of functional PLGA-based electrospun scaffolds and their applications in biomedical engineering. Materials Science and Engineering:C. 2016;59:1181-94.
-
49. Do AV, Khorsand B, Geary SM, Salem AK. 3D Printing of Scaffolds for Tissue Regeneration Applications. Adv Healthc Mater.
2015;4(12):1742-62.
-
50. Hsieh F, Hsu S. 3D bioprinting: A new insight into the therapeutic strategy of neural tissue regeneration. Organigenesis. 2015;11(4):153-8
24
Discussion and feedback