i-LEPRA: POTENSI MIKROSFER KOMBINASI FUKOIDAN DAN MIP SPESIFIK ANTIGEN ML0405 SEBAGAI INOVASI VAKSIN Mycobacterium leprae
on

TINJAUAN PUSTAKA
i-LEPRA: POTENSI MIKROSFER KOMBINASI FUKOIDAN DAN MIP SPESIFIK ANTIGEN ML0405 SEBAGAI INOVASI VAKSIN Mycobacterium leprae
Agung Bagus Sista Satyarsa1, Haikal Hamas Putra Iqra 1, Gede Made Cahya Trisna Pratama1, Prima Sudarsa2, Luh Made Mas Rusyati dan I Made Swastika2 1Program Studi Pendidikan Dokter, Fakultas Kedokteran, Universitas Udayana, Denpasar 2Bagian Kulit dan Kelamin, Rumah Sakit Umum Sanglah,
Denpasar
ABSTRAK
Pendahuluan: Lepra merupakan penyakit infeksi kronik dari M. leprae dengan target utama yaitu kulit dan sistem saraf. Berdasarkan data statistik WHO, jumlah penderita lepra di dunia saat ini diperkirakan sekitar 12 juta orang, 80% diantaranya berasal dari daerah tropis. Lepra saat ini masih menjadi masalah besar di dunia, baik pada kesehatan maupun kondisi sosial pasien. Hal tersebut membuat penyakit lepra menjadi kompleks dan harus dieradikasi. Pencegahan infeksi M. leprae menjadi strategi mutakhir dalam upaya eradikasi lepra. Salah satunya adalah dengan vaksinasi. Kelemahan dari vaksin saat ini adalah hanya mampu mencegah kejadian lepra < 70%. Maka, diperlukan pengembangan vaksin yang lebih spesifik agar dapat meningkatkan respon tubuh dalam membentuk antibodi terhadap M. leprae.
Metode: Metode yang digunakan adalah literature review menggunakan database www.pubmed.com dan scholar.google.com yang memenuhi kriteria inklusi. Dari 108 jurnal, diperoleh 78 jurnal.
Pembahasan: Vaksin yang efektif dan telah mencapai uji percobaan fase III yakni MIP dengan komponen antigen ML0405 dari M. leprae, yang unggul dalam meningkatkan respon sel T dan antibodi spesifik terhadap M. leprae. Kombinasi MIP dengan fukoidan yang memiliki bioaktivitas imunomodulator serta sebagai bentukan mikrosfer untuk enkapsulasi dengan target ke makrofag menunjukkan potensi yang baik. Bentukan mikrosfer kombinasi fukoidan dan MIP spesifik ML0405 yakni i-LEPRA.
Simpulan: Vaksin i-LEPRA dapat menjadi inovasi vaksin efektif dan efisien serta memiliki proteksi efektif yang tinggi terhadap M. leprae. Belum terdapat penelitian yang membahas tentang vaksin i-LEPRA. Diharapkan i-LEPRA dapat dikembangkan lebih lanjut sebagai vaksin M. leprae di masa depan.
Kata kunci: Mycobacterium leprae, MIP, Antigen ML0405, Fukoidan, Vaksin Lepra
ABSTRACT
Introduction: Leprosy is a chronic infectious disease that caused by M. leprae, which has predilections to skin and peripheral nerve. WHO predicts that there are aproximately 12 million people world-wide suffered from leprosy, and almost 80% come from tropical countries. Nowadays, leprosy becomes main problem from medical and social views. Prevention of leprosy appears to be a promising strategy in order to eradicate leprosy. In this case, vaccination is the most suitable strategy. Unfortunately, these day vaccines only have protective efficacy less than 70%. More proactive strategies are necessary in order to develop specific vaccine which enhance immune system against M. leprae.
Method: This study used literature reviews, using database from www.pubmed.com and scholar.google. com that met the inclusion criteria. From 108 journals, we obtained 78 journals.
Discussion: MIP is well-known to be an effective vaccine that has been through clinical trial test phase III. MIP has shown some cross-reactive component antigen which can enhance T cell response to M. leprae. Furthermore, the combination with fucoidan microsphere and antigen specific ML0405 which has predilection for machrophage and as immunomodulator, can maximize the ability of MIP as vaccine to prevent leprosy. Product of combination MIP specific antigen ML0405 and fucoidan microsphere called i-LEPRA. Conclusion: However, further research is needed to identify i-LEPRA efficacy and efficiency. Therefore, i-LEPRA is expected to be effective and efficient as an innovative vaccine against M. leprae in the future.
Keywords: Micobacterium leprae, MIP, ML0405 Antigen, Fucoidan, Leprosy Vaccine
PENDAHULUAN
Lepra atau penyakit Hansen merupakan penyakit infeksi kronik dengan target utama yakni kulit dan sistem saraf.[1] Penyakit lepra merupakan masalah kesehatan masyarakat di dunia dan khususnya negara yang sedang berkembang. Hal ini bukan disebabkan karena jumlah penderita di dunia, tetapi dampak sosial-psikologis dari penyakit ini. Jumlah penderita lepra di dunia saat ini diperkirakan sekitar 12 juta, 80% diantaranya berasal dari daerah tropis.[2] Sekitar 1,6 miliar penduduk dunia tinggal di daerah endemik dengan prevalensi lebih dari 1 per 1.000, sehingga
mereka dianggap mempunyai risiko tinggi untuk tertular penyakit lepra.[1] Berdasarkan data dari World Health Organization (WHO) pada tahun 2012, Indonesia berada di peringkat ke-4 dunia dengan kasus lepra sebanyak 345.000 orang yang terdiagnosis, dan di tahun 2013, Indonesia menduduki peringkat ke-3 dunia setelah India dan Brazil dengan laporan baru kasus lepra sebanyak 18.994 orang.[3]
Lepra disebabkan oleh Mycobacterium leprae (M. leprae). Penularan M. leprae dapat terjadi melalui udara dan kontak dengan penderita.[4] M. leprae dapat bertahan dan berkembang di sel Schwann dan makrofag (Mφ). Inkubasi M. leprae diketahui selama 2-

10 tahun. Berdasarkan karakteristiknya, lepra dapat diklasifikasikan menjadi dua kutub, yaitu Tuberculoid Leprosy (TT) yang bersifat pausibasiler dan Lepromatous Leprosy (LL) yang bersifat multibasiler. Kejadian LL terjadi sebanyak 60% dari seluruh kasus baru di dunia.[5] LL merupakan kondisi kronik dari penyakit lepra yang memiliki tingkat mortalitas tertinggi. Terjadi reaksi hipersensivitas tipe-I pada LL dengan menginduksi imunitas humoral yakni T-helper (Th)-2 dan melibatkan Interleukin (IL)-4 dan IL-10. Selain itu,
LL juga menurunkan imunitas seluler seperti mekanisme inflamasi dari Th-1 yang melibatkan IL-2, Interferon (IFN)-γ, dan Tumor Necrosis Factor (TNF)-α.[4] Manifestasi klinis utama meliputi kerusakan kulit, kerusakan saraf, dan kelenturan progresif. Lepra memiliki dua bentuk umum, tuberkuloid dan lepromatosa, keduanya menghasilkan lesi kulit.[6] Lepra lepromatosa adalah bentuk yang paling parah, yang menyebabkan penyakit umum, biasanya dengan banyak papula, nodul, atau plak yang mengandung M. leprae dalam jumlah yang melimpah dan mempengaruhi area kulit yang luas. Untuk itu perlu penatalaksanaan secara holistik dan komprehensif dalam mencapai keberhasilan eradikasi penyakit lepra.[6,7]
Saat ini, WHO telah mencanangkan eradikasi M. leprae di dunia pada tahun 2020.[8] Program pemberantasan penyakit lepra masih didasarkan pada strategi pencegahan sekunder berupa deteksi dini dan pemberian kemoterapi untuk mendeteksi semua kasus lepra.[9] Cara ini mempunyai beberapa kendala, misalnya: deteksi dini penyakit lepra tidak mudah, terbukti sebagian besar kasus baru muncul dari individu yang tidak ada kontak sebelumnya. Disamping itu, kuatnya stigma sosial terhadap penyakit lepra menyebabkan penderita enggan berobat sampai stadium lanjut.[10] Masalah lain dalam deteksi dini adalah belum ada cara deteksi dini M. leprae yang tepat. Pada kemoterapi juga terjadi beberapa masalah, yaitu resistensi kuman terhadap Diamino Diphenyl Sulphone (DDS).[9,10] Kejadian resistensi ini terjadi karena lamanya waktu terapi dan tidak taatnya pasien dalam mengkonsumsi obat yang akhirnya mengakibatkan resistensi M. leprae. Walapun masalah ini dapat diatasi dengan Multy Drug Therapy (MDT) yang mencakup kombinasi dapsone, clofazimine, dan rifampicin.[8] MDT dapat mengobati lepra pausibasiler dalam waktu 6 bulan dan multibasiler dalam waktu 2 sampai 3 tahun, namun insiden kasus baru belum mengalami perubahan. Oleh karena itu, usaha pencegahan primer berupa imunisasi atau vaksinasi masih diperlukan dalam pemberantasan penyakit lepra.[10]
Program ini telah menarik perhatian para ahli, sehingga sejak tahun 1975, melalui program IMMLEP/TDR, WHO menetapkan pengembangan vaksin lepra sebagai tujuan utama.[10] Strategi ini bertujuan untuk mengurangi tingkat kasus baru dengan cacat kelas 2 per 100.000 populasi setidaknya 35% pada akhir 2015, dibandingkan dengan data pada akhir 2010.[11] Meskipun peran pencegahannya tampaknya terbatas, vaksin lepra tampaknya efektif dalam meningkatkan kekebalan yang dimediasi sel pada lepra multibasiler. Peran vaksinasi Bacillus Calmette-Guerin
(BCG), tanpa intervensi atau plasebo, secara signifikan mengurangi tingkat lepra. Namun, tingkat perlindungan dari M. leprae bervariasi dari satu negara ke negara
lain. Banyak ahli yang menduga vaksin lepra
mungkin memiliki peran terapeutik bila diberikan bersamaan dengan MDT. Teorinya adalah vaksin tersebut dapat mengurangi keparahan penyakit lepra multibasiler. Perkembangan vaksin terbaru saat ini yakni Mycobacterium indicus pranii (MIP) dengan antigen yang spesifik pada M. leprae.[12,13]
MIP memiliki antigen yang spesifik dan menyerupai M. leprae, dengan strain yang sama dapat meningkatkan spesifitas vaksin terhadap M. leprae. Berdasarkan penelitian Whitty et al., MIP dapat menurunkan kejadian lepra sebesar 39% dan bila di kombinasikan dengan BCG dapat meningkatkan efektivitas sebesar 64%.[13,14] Namun, BCG memiliki kelemahan yakni tidak memiliki booster atau penguatan reaksi imunitas, maka diperlukan zat atau marker yang juga dapat meningkatkan imunitas dan juga spesifitas terhadap Mφ. Salah satunya[15a]dalah zat aktif dari rumput laut coklat yakni fukoidan.
Fukoidan merupakan zat aktif dari rumput laut coklat yang memiliki bioaktivitas sebagai antibakteri, antiinflamasi, proapoptotik, dan dapat meningkatkan respon sel Natural Killer (NK) pada tubuh, serta meningkatkan sistem imunitas baik Mφ dan sel T dalam eradikasi invasi benda asing di tubuh. , Fukoidan juga memiliki manfaat sebagai selaput pembungkus atau coat yang memiliki ukuran mikrometer yang disebut sebagai mikrosfer, dengan kerja spesifik ke sel target berupa Mφ dalam tubuh.[18,19]
Melihat keseluruhan potensi dari mikrosfer fukoidan dan MIP spesifik antigen ML0405 sebagai vaksin M. leprae yaitu i-LEPRA, maka diperlukan tinjauan pustaka yang membahas dari c
Maka, potensi i-LEPRA dapat menjadi terobosan baru inovasi vaksin M. Leprae dengan proteksi efektifitas yang tinggi. Dengan demikian, diharapkan vaksin i-LEPRA dapat dibuktikan secara in vitro dan in vivo, agar menjadi vaksin yang efektif dan efisien serta dapat digunakan dalam program pencegahan dan eradikasi penyakit lepra di masa depan.
METODE
Penulisan karya ilmiah tinjauan pustaka ini menggunakan metode studi pustaka yang didasarkan atas hasil studi terhadap berbagai literatur yang telah teruji validitasnya, berhubungan satu sama lain, serta mendukung uraian atau analisis pembahasan. Studi pustaka (literature review) menggunakan database www.pubmed.com dan scholar.google.com dengan
menggunakan kata kunci: “M. leprae, MIP, Antigen ML0405, Fukoidan, dan Vaksin Lepra”. Metode studi pustaka hanya diperuntukkan kepada jurnal ilmiah yang menggunakan bahasa Inggris, bahasa Indonesia, dan memiliki abstrak dalam jurnal ilmiah tersebut. Judul dan abstrak akan menjalani proses pemindaian (scanning) untuk mengeksklusi jurnal ilmiah yang bersifat tidak relevan terhadap M. leprae, MIP, Antigen ML0405, Fukoidan, dan Vaksin Lepra. Setelah melewati proses eksklusi, maka jurnal ilmiah akan dibaca secara keseluruhan untuk menjalani proses inklusi berdasarkan kriteria yang telah ditetapkan oleh penulis. Selanjutnya, daftar pustaka pada jurnal ilmiah yang telah berhasil melewati kriteria inklusi dan eksklusi akan menjalani proses pemindaian kembali untuk mengetahui adanya publikasi tambahan mengenai M.
leprae, MIP, Antigen ML0405, Fukoidan, dan Vaksin Lepra.
Dalam tinjauan pustaka ini, kami menggunakan seluruh jurnal ilmiah yang membahas mengenai analisis manfaat, mekanisme kerja, dan efek proteksi dari i-LEPRA sebagai inovasi vaksin terhadap M. leprae. Jurnal ilmiah akan menjalani proses eksklusi jika tahun publikasi atau tahun terbit jurnal telah melebihi 10 tahun, kecuali apabila jurnal merupakan jurnal yang memuat informasi mendasar yang masih relevan. Terdapat 108 artikel atau jurnal ilmiah yang sesuai dengan topik yang dibahas, namun hanya 78 jurnal atau publikasi yang memenuhi kriteria inklusi dan eksklusi yang telah ditetapkan oleh penulis.
PEMBAHASAN
Patogenesis M. leprae
Hingga saat ini, dipercaya bahwa penularan lepra terjadi akibat kontak yang dekat dan berkepanjangan antara individu yang rentan dan pasien yang terinfeksi basilus akibat menghirup basil yang terkandung dalam sekret hidung atau tetesan Flügge. Rute transmisi [20 21 22]
utama lepra ialah mukosa hidung. , , M. leprae
lalu masuk ke dalam tubuh subjek melalui getah bening maupun pembuluh darah, menuju targetnya, yaitu sel Schwann. M. leprae memasuki sel Schwann dengan berikatan pada domain G pada rantai a2 dari laminin 2, suatu komponen pada basal lamina sel Schwann. Bentuk laminin ini secara khusus terdapat pada saraf tepi, hal itulah yang menjelaskan sifat tropisme spesifik yang dimiliki oleh M. leprae. Sel Schwann menelan M. leprae yang masuk dengan fagosom yang dimiliki, namun tidak dapat menghancurkannya karena jumlah enzim lisosomal sel Schwann yang tidak mencukupi. Alhasil, M. leprae bertahan hidup di dalam sel Schwann, terlindung dari Mφ, dan akhirnya terus berkembang biak. Pada pasien LL, seiring waktu, basil akan keluar dan berkembang di luar saraf (di dalam lapisan dermis, di sekitar pleksus pembuluh darah superfisial) pada daerah dengan suhu yang lebih rendah. Mφ memakan basil, namun tidak dapat sepenuhnya menghancurkan M. leprae oleh karena adanya penurunan fosfolipase lisosomal, menghasilkan informasi antigenik yang tidak lengkap dan akumulasi fospolipid mikobakteri sebagai droplet sitoplasma. Lesi kulit akan muncul sebagai [a2k3i]bat akumulasi progresif M. leprae dan Mφ pada kulit.
Pertahanan pertama tubuh terhadap infeksi M. leprae adalah sistem imunitas bawaan (innate immunity), yang terepresentasi oleh ingtegritas epitel, sekresi, dan permukaan dari immunoglobulin-A (IgA). Selain itu, Sel NK, limfosit T sitotoksik, dan Mφ teraktivasi juga memiliki peranan yang penting dalam membunuh basil. Respon imun bawaan oleh antigen-presenting cells (APCs) yang efektif, ditambah virulensi lemah oleh M. leprae, harusnya dapat menjadi dasar
pertahanan dan kekebalan tubuh terhadap perkembangan manifestasi klinis penyakit lepra. Namun, ketika tahap awal infeksi, respon imun tubuh inang umumnya masih bersifat tidak pasti. Regulasi sitokin dan kemokin dapat mengarah pada proliferasi dari limfosit Th1 atau Th2, yang mana akan menginduksi respon imun seluler atau pun respon imun humoral terhadap M. leprae. Hal inilah yang nantinya dapat menentukan evolusi penyakit menjadi [20,24,25]
bentuk tuberkuloid maupun lepromatus.
ESSENTIAL ∖Eιseπce of Scientific ∕ XMtdIcoI Journal/
Penyakit lepra dan manifestasi klinisnya dipercaya merupakan hasil dari proses interaksi dinamis antara M. leprae dan cell-mediated immunity (CMI) dari subjek yang memiliki kecenderungan genetik, yang mana nantinya akan berimbas kepada perkembangan dan pola dari penyakit lepra itu sendiri. Subjek dengan respon imun predominan Th1 akan memiliki tingkat CMI yang tinggi, disertai dengan pembentukan granuloma epiteloid yang akan menghancurkan seluruh bacilli, hingga berujung pada kesembuhan, atau perkembangan penyakit yang terlokalisasi (lepra tuberkuloid; TT). Sebaliknya, individu dengan respon predominan Th2 cenderung memiliki tingkat CMI yang lemah, tidak membentuk respon granulomatous yang cukup, dan akan meningkatkan respon imunitas humoral: basili akan bertahan dan tetap bereplikasi, hingga pada akhirnya menyebabkan penyakit sistemik (lepra lepromatus; LL).[23]
Respon CMI merupakan aspek yang penting dalam pertahanan tubuh inang terhadap infeksi mikobakteria dan diduga secara ketat diregulasi oleh keseimbangan antara sitokin tipe 1, termasuk di dalamnya, IL-2, IFN-γ, TNF-α, dan IL-12, serta sitokin tipe 2, seperti, IL-4, IL-6, dan IL-10. Interleukin-12 memiliki peranan dalam menginduksi diferensiasi Th1 dan pelepasan IFN-γ dari Th1 dan sel NK. Interferon-γ mengaktivasi Mφ yang memiliki peran kunci dalam respon imun antimikrobakterial. Tumor necrosis factor-α berperan dalam berbagai aktivitas pro-inflamasi, termasuk juga salah satunya aktivasi Mφ. ,
Melalui pemeriksaan terhadap pasien LL, ditemukan beberapa ciri pembeda dari TT secara immunohistochemical yang berperan dalam
patogenesis lepra lepromatus diantaranya: 1) Terdapat predominansi populasi limfosit T CD8+ dengan rasio CD4:CD8 = 0,6:1 ; 2) berbeda dengan TT, pada
granuloma lepromatus, sel CD8+ (T suppressor phenotype) bergabung dengan Mφ dan sel CD4+; 3) klon dari sel CD8+ menghasilkan suppressor cytokines terhadap aktifitas Mφ, IL-4, IL-5, dan IL-10 dalam
konsentrasi yang tinggi, sedangkan IFN-γ dalam
konsentrasi rendah; 4) pada LL terdapat peningkatan jumlah transforming growth factor (TGF)-β, yang menekan aktivasi Mφ dan menghambat produksi TNF-α dan IFN-γ, menyebabkan infeksi yang lebih parah; 5) pada LL terdapat peranan IL-13 dalam menurunkan [20] respon sistem imun.
Peranan Mφ dalam Patogenesis M. leprae
Mφ merupakan sel inang utama untuk M. leprae. Meski demikian, Mφ juga memiliki peranan yang amat penting dalam mekanisme perlindungan inang terhadap M. leprae, baik dalam respon imun bawaan maupun respon imun adaptif. Pembentukan dan presentasi antigen, sekresi sitokin/ kemokin, dan aktivitas mikrobisidal merupakan fungsi-fungsi utama dari Mφ. Telah didemonstrasikan dalam berbagai penelitian, bahwa Toll-Like Receptors (TLRs) dapat menginduksi diferensiasi monosit menjadi Mφ antimikrobial atau pun antigen-presenting dendritic cells. Melalui aktivasi TLR2 oleh antigen mikobakteria, monosit pada pasien TT akan terdiferensiasi menjadi Mφ DC-SIGN+ dan sel Dendritik CD1b+, sedangkan monosit pada pasien LL akan terdiferensiasi menjadi Mφ DC-SIGN+, namun tidak menjadi sel Dendritik CD1b+, menunjukkan bahwa, meski monosit dari kedua pasien TT dan LL menghasilkan respon imun bawaan yang sama

IFN-γ dan IL-2 merupakan salah salah satu mediator
mempengaruhi patogenesis dari M.
terhadap M. leprae, pasien LL tidak dapat menghasilkan CMI yang efektif dibandingkan pasien TT.[ , ]
Meskipun M. leprae dapat bertahan hidup pada Mφ murin normal, Mφ teraktivasi IFN-γ terbukti dapat secara signifikan menghambat atau bahkan membunuh M. leprae secara in vitro. Dalam Mφ normal, fusi fagosom-lisosom dihambat oleh M. leprae hidup, tapi tidak dengan M. leprae mati. Di sisi lain, pada Mφ teraktivasi yang menyimpan M. leprae di dalamnya, fagosom ditemukan dapat bergabung dengan lisosom sekunder.[23]
Potensi MIP sebagai Kandidat Vaksin M. leprae
Mycobacterium indicus pranii (MIP) atau yang secara konvensional dikenal dengan Mycobacterium w. (M. w) merupakan bakteri atipikal saprofit non-patogenik yang termasuk dalam Runyon golongan 4 (Rapid grower) 29,30 bersamaan dengan M. fortuitum dan M. vaccae. MIP
bekerja dengan mengindukasi CD4+, Th-1, respon sel untuk melepaskan sitokin, IL-2, IL-5, dan IFN-γ dalam
rangka meningkatkan imunitas mediasi sel. MIP digunakan dalam penatalaksan3a0an banyak penyakit salah satunya adalah penyakit lepra.
Imunisasi MIP dapat meningkatkan kadar Leukocyte Migration Inhibition (LMI) pada leukosit. LMI sendiri berkorelasi dengan Delayed-type Hypersensitivity (DTH) dan tidak dengan antibodi yang merespon antigen.31,32 Terdapat beberapa antigen MIP yang bertanggung jawab terhadap respon imunitas perbaikan pada penderita LL, diantaranya: antigen dengan berat molekul 15-19 kDA, 26-31 kDa, dan 57 kDa. Antigen ini mampu membuat respon positif lepromin tes yang sebelumnya negatif pada penderita
LL. Pada fase Borderline Lepromatous Leprosy (BL) antigen yang bertanggung jawab pada respon tersebut adalah antigen dengan berat molekul 28-33 kDa dan 3942 kDa. Sedangkan pada kelompok tuberkuloid pecahan antigen yang berpengaruh adalah antigen dengan berat molekul 16-42 kDa dan 49 kDa, dan pada umumnya Bone Mineral Content (BMC) perifer pada orang yang sehat merespon fraksi antigen dengan berat molekul 14-16 kDa, 19 kDa, dan 24-26 kDa.[33] Fraksi molekul dengan berat molekul 14-40 kDa merupakan antigen yang paling kuat direspon oleh PBMC.[34-38] Penelitian ini juga menunjukkan penurunan Bacteriological Index (BI) dan perbaikan signifikan secara histopatologis pada penderita lepra.[33]
Pada studi yang dilaksanakan oleh Mehra et al menunjukkan bahwa antigen pada MIP dengan berat molekul 30 kDa dikenali oleh antibodi dalam berbagai kelompok bahkan LL dengan respon imunitas lemah. Antigen MIP dengan berat molekul 30 kDa mampu mengenali antigen M. leprae. Antigen ini mampu memberikan respon antibodi yang baik tanpa respon sel T pada kondisi LL respon imunitas lemah. Sedangkan fase TT, LL, dan HC respon imunitas baik menunjukkan tidak hanya respon antibodi yang baik namun juga diikuti dengan respon sel T dan sel B yang baik pula terhadap antigen ini. Selain itu juga pada guinea pig yang diinjeksi antigen 30 kDa menunjukkan respon DTH terhadap M. w, M. leprae, dan M. tuberculosis.[39] Pada penelitian yang dilakukan oleh Singh et al., menunjukkan bahwa sel T yang telah diinduksi M. w mampu memproduksi IFN-γ dan IL-2 yang konsisten.
alami leprae.
[4y0a]ng
Identifikasi antigen yang reaktif terhadap sel T dapat menunjukkan protein yang merupakan bagian dari respon perlindungan leprosy. ML0405 merupakan salah satu protein yang merangsang respon spesifik lepra dan humoral. Berdasarkan penelitian yang dikonduksikan oleh
ML0405 memiliki sel T epitop yang dikenali oleh 50 dari 51 alel HLA-DR bersaamaan dengan potensi 24 epitop pada sel B. ML0405 juga dibuktikan mampu menginduksi respon IFN-γ kuat pada pasien TT/BT dan serum IgG pada pasien LL. Rendahnya respon IFN-γ pada fase LL diakibatkan oleh terbatasnya antigen penjamu atau sel T suppressor untuk mencegah kerusakan saraf oleh mediasi sel T pada sel Schwann yang telah terinfeksi M. [41] leprae.
Mekanisme Konstruksi i-LEPRA: Mikrosfer
Kombinasi Fukoidan dan MIP spesifik ML0405
Fukoidan adalah polisakarida tersulfatasi yang umumnya tersedia yaitu glikosaminoglikan (GAGs) berupa F-fukoidan.[42] Terdapat lebih dari 95% fukoidan di laut yang tersusun dari ester tersulfatasi L-fucose dan U-Fukoidan, serta tersusun sekitar 20% asam glukoronat.[43] Fulkan tersulfatasi yang merupakan karakteristik utama fukoidan tersedia pada Gambar 1. , , Fukoidan memiliki fungsi sebagai polimer alami yang membentuk mikrosfer polimer dari karbohidrat. Pertama, melakukan ekstraksi fukoidan dari rumput laut coklat untuk memperoleh dosis efektif sebesar 20 µm/mL. Pembentukan mikrosfer dari komponen fukoidan dengan cara aerosolisasi dengan komponen sebesar 50 µm.[44]
M. leprae memiliki kelemahan yakni sulit untuk dibiakkan secara in vitro, dengan demikian dipilih materi genetik yang mirip dengan M. leprae.[45] MIP merupakan salah satu antigen yang menyerupai M. leprae. MIP memiliki struktur yang mirip dengan M. leprae (16 kDa, 65 kDa, 13 kDa, 21 kDa, dan 30 kDa). Beberapa antigen MIP yang protektif berupa polipeptida dapat dideteksi secara imunologis dan dibuat dengan teknologi rekombinan. Selanjutnya dilakukan elektroforesis hingga berat molekul protein 30 kDa yang dibuktikan efektif sebagai antigen protektif. Selanjutnya dengan antibodi monoklonal dari protein antigen tersebut dilanjutkan dengan teknologi rekombinan DNA genom MIP diekspresikan pada E. coli dengan sistem faga lamda (λgt11).[11] Hasilnya berupa antigen sebagai bahan aktif dari vaksin. Antigen MIP akan dispesifikasi lagi dengan ML0405, yang mana memiliki protein spesifik dari M. leprae. Proses pembuatannya melalui identifikasi epitop M. leprae. Selanjutnya, antigen ML0405 dikombinasi dengan antigen MIP melalui proses purifikasi sehingga diperoleh MIP spesifik antigen ML0405.[46] Kemudian, tahap karakteristik sel T yang mana akan menginduksi pembentukan antibodi oleh antigen tersebut. Dengan demikian bahan aktif dari MIP spesifik ML0405 siap dikombinasi dengan mikrosfer dari fukoidan menjadi vaksin i-LEPRAE, terenkapsulasi mikrosfer dari fukoidan dan MIP spesifik ML0405. Dengan demikian, vaksin i-LEPRAE dapat diberikan secara intravena dan digunakan sesuai dosis
50μg/dL.[11,45,46]
i-LEPRA: Mekanisme Proteksi Fukoidan dan MIP Spesifik ML0405 Terhadap M. leprae (In Vitro)
Gambar 1. Fukoidan dari Rumput Laut Coklat. (a) Struktur Kimia Fukoidan, (b) Mikrosfer dari rumput laut
coklat.[16,18,19]
pada inkubasi M. leprae di Mφ sebelum timbulnya gejala klinis seperti lesi pada kulit.[ ] Fukoidan juga memiliki
bioaktivitas sebagai neuroprotektif karena fukoidan juga merupakan antioksidan yang melindungi lapisan myelin dari degenerasi.[ ] Hal ini akan membantu proteksi sel Shcwann dari invasi dan degenerasi myelin oleh M. lerpae melaui reseptor TN-α2. Dengan demikian, fukoidan dapat mencegah invasi dan inkubasi M. leprae di Mφ dan sel Schwann.[ , , ]
WQQWWr WQQQQW δ∂δδδδδ∂δ δδ∂δ∂δδδ
Macrophage membrane J
i-LEPRA dari kombinasi mikrosfer kombinasi fukoidan dan MIP spesifik ML0405 dapat menjadi potensi yang menjanjikan sebagai inovasi vaksin. Pembentukan mikrosfer tersebut membantu
bioviabilitas obat menjadi 100% dalam mencapai sel target.[47] Vaksin i-LEPRA diberikan dengan cara Intravena (IV) agar dapat menginduksi sel imun lebih baik dan meningkatkan sensitifitas mikrosfer fukoidan dengan sel Mφ.[48] Didukung dengan hasil penelitian oleh Sezer dan Akbuga, sensitifitas fukoidan pada Mφ sangat baik dengan rute administrasi intravena.[49] Fukoidan dalam sistem vaskuler sistemik tidak mudah difagositosis karena memilki target kepada Mφ serta tidak memiliki efek toksik sehingga tidak menimbulkan efek samping dari pemberian secara intravena.[50]
Setelah memasuki vaskuler sistemik, mikrosfer fukoidan dengan bahan vaksin akan menuju sel target. Target utama fukoidan dalam vaksin adalah sel Mφ, sel B, dan sel T. Berdasarkan penelitian Teruya et al., fukoidan akan mengaktivasi Mφ melalui TLR-4, Cluster of Diferentation (CD14), Competent Reseptor (CR)-3, dan scavenging reseptor (SR).[51] Setelah aktivasi tersebut, fukoidan masuk ke dalam sel dengan endositosis. Masuknya mikrosfer fukoidan akan melepaskan zat aktif fukoidan dan MIP spesifik ML0405. Fukoidan memiliki bioaktivitas sebagai imunomodulasi. Fukoidan akan menginduksi jalur intrasel lewat Mitogen-Activated Protein Kinase (MAPK). Jalur MAPK ini penting pada inkubasi dan proliferasi M. leprae. Dengan fukoidan yang meningkatkan aktivitas Mφ, juga akan meningkatkan fungsi Mφ untuk melisis benda asing, salah satunya M. leprae yang sulit dilisis oleh Mφ karena jalur MAPK ini. Didukung dengan hasil penelitian Zhang et al., bahwa peran MAPK dalam inkubasi dan invasi M. leprae dalam Mφ sangat berpengaruh sebelum menginvasi sel Schwann.[52] Selain itu, fukoidan dapat menekan faktor pro-inflamasi seperti TNF-α dan INF-γ yang terlihat
Gambar 2. Peranan fukoidan dalam mengaktivasi Mφ. Fukoidan akan menginduksi Jalur MAPK yang akan meningkatkan proteksi oleh Mφ sebagai [51] imunomodulator.
MIP yang keluar dari fukoidan terdisintegrasi akan mengalami kontak langsung dengan Mφ secara intraselular.[55] MIP akan menginduksi CD4+, Th-1,
respon sel untuk melepaskan sitokin, IL-2, IL-5, IL-12,
DTH, LMI dan IFN-γ. Antigen dengan fraksi molekul 14-40 kDa terutama fraksi molekul antigen dengan berat molekul 30 kDa pada MIP mampu dikenali oleh Th-1.[56] Sehingga respon pelepasan sitokin dapat terjadi. Th-1 akan mensekresikan IFN-γ dan IL-2 dalam jumlah yang cukup tinggi yang akan menstimulasi Mφ untuk mendegradasi MIP intraselular.[56,57] Mφ yang telah teraktivasi akan meningkatkan fusi lisosom dan fagosom, produksi oksigen radikal dan nitrogen monoksida, sintesis peptida anti mikoroba, ekspresi CD40 dan reseptor TNF, serta sekresi TNF-α dan protease.[58] Hal ini juga akan meningkatkan fungsi Mφ sebagai sel penjamu dengan tujuan untuk meningkatkan respon sel Th-1 lainnya.[59]
Terdapatnya MIP spesifik ML0405 pada Mφ akan menginduksi pembentukan APCs pada Mφ. Proses pembentukan APCs tersebut akan menginduksi sel T memori sehingga mengaktifkan sel B memori untuk menghasilkan vaksin terhadap M. leprae, dikarenakan antigen pada ML0405 akan membentuk antibodi yang spesifik pada LL.60 Didukung oleh penelitian yang dilakukan oleh Sampaio et al., bahwa antigen ML0405 akan meningkatkan sensitifitas sel T pada LL dari tes lepromin.[41] Dijelaskan juga bahwa proteksi efektif dari antibodi yang terbentuk hingga 88%. Selain itu, hasil penelitian Sampagio et al. juga menjelaskan bahwa antigen ML0405 memiliki efek juga terhadap TT.[61] Maka dapat dibentuk vaksin yang efektif dalam

Keterbatasan i-LEPRA sebagai Vaksin M. leprae
pencegahan secara holistik pada M. leprae. Dengan demikian, vaksin i-LEPRA akan meningkatkan upaya pencegahan dari inkubasi lebih lanjut serta invasi M. leprae ke jaringan kulit dan sel Schwann pada tahap awal.[52,53,62]
Keunggulan Vaksin sebagai Upaya Pencegahan Lepra: i-LEPRA sebagai Kandidat Vaksin M. leprae
Vaksin merupakan penelitian yang sangat berkembang pesat karena potensinya yang besar dalam eradikasi morbiditas dan mortalitas penyakit.[63,64,65] Vaksin menawarkan terapi pencegahan dengan memberikan perlindungan yang dimulai dari dalam tubuh manusia itu sendiri.[66] Sistem imunitas yang diinduksi juga dapat bertahan selama bertahun-tahun bahkan seumur hidup. Mengingat prinsip herd community yang menjelaskan bahwa semakin besar proporsi individu dalam masyarakat yang kebal terhadap infeksi, maka semakin kecil risiko bagi mereka yang tidak kebal di dalam populasi tersebut untuk terkena penyakit. Dengan kata lain, proteksi secara tidak langsung diberikan oleh mereka yang sudah kebal terhadap mereka yang belum. Sesuai dengan pernyataan ini maka dengan bantuan vaksin lepra, sitem kekebalan tubuh manusia akan meningkat dan semakin kecil risiko terjangkitnya [67,68] penyakit.
Vaksin i-LEPRA memiliki keunggulan yakni membentuk antibodi IgG yang spesifik pada M. leprae dan meningkatkan proteksi pada infeksi M. leprae.[43,49]
Didukung oleh penelitian terdahulu yang menunjukkan bahwa terdapat 36 protein sangat imunogenik yang terbagi antara MIP dan M. leprae dan tidak ditemukan pada M. bovis BCG.[33,69] Diantaranya adalah MIP0340 dan MIP5962 yang merupakan anggota Heat Shock Protein (HSP)-20 dan mirip dengan HSP pada M. leprae dengan berat 18 kDa. Protein ini memiliki beberapa epitop sel T dan menginduksi sel T CD4+.[42,44] Protein MIP7697 yang merupakan homologi protein MLep2649 berfungsi untuk mengkode protein yang menstimulasi sel [35,70,71]
T dengan baik. Dengan banyaknya
immunodominant dan produksi antigen, MIP berpotensi dalam ekspresi antigen yang lebih baik daripada BCG.[72]
Sedangkan pada bakteri BCG memiliki efek yang tidak dapat diprediksi kepada inangnya, hal ini diakibatkan BCG hanya akan bekerja pada keadaan [73 74]
hidup. , Berlawanan dengan MIP yang tetap akan memberikan efek signifikan walaupun dalam keadaan mati. , [56H] al ini dapat dilihat pada Tabel 1 di bagian lampiran.
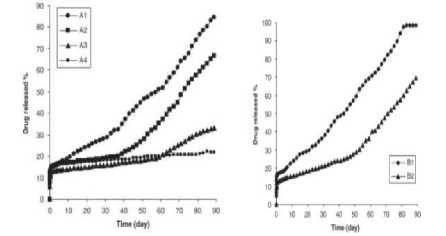
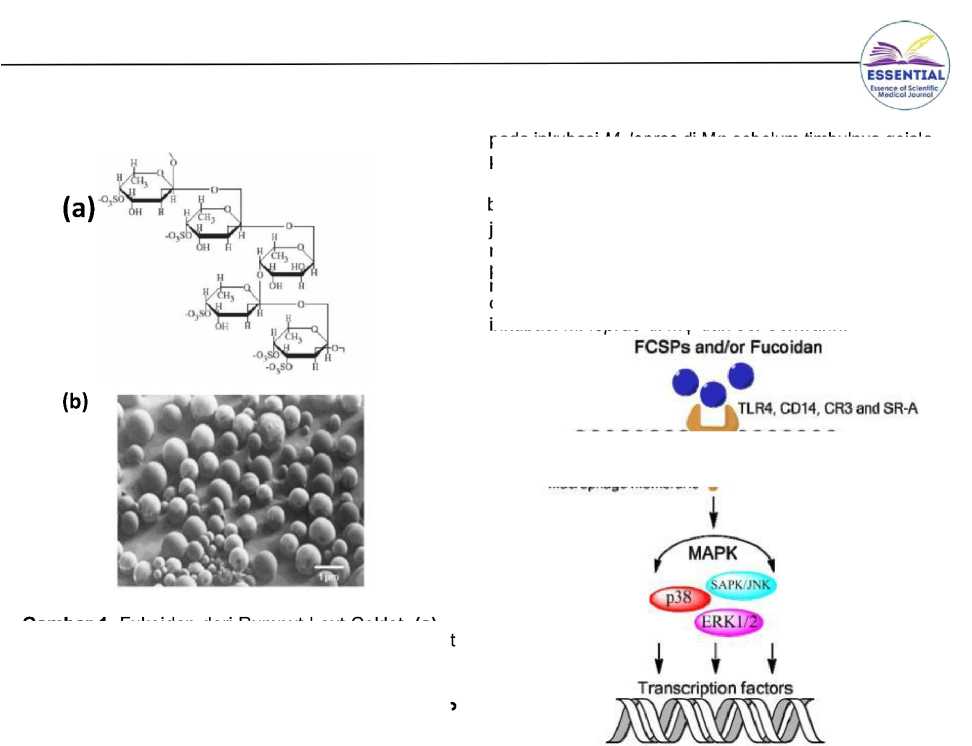
Gambar 3. Keunggulan mikrosfer fukoidan dalam tubuh. (a) Potensi sebagai karier vaksin dan lama mikrosfer dalam tubuh yakni 90 hari. (b) Mikrosfer juga [16,42]
spesifik pada Mφ.
Keterbatasan dari vaksin i-LEPRAE ini terletak pada MIP yang pada beberapa kasus menunjukkan indurasi dan ulserasi selama 15 hari dengan pengeluaran eksudat seropurulent selama 1-2 bulan, dan pada hampir semua kasus luka ini mengalami penyembuhan secara sendirinya selama 8-10 minggu dengan meninggalkan luka. Hanya 0-16% pasien mengalami penundaan penyembuhan.[37] Tetapi hal ini mampu diatasi dengan enkapsulasi dari mikrosfer fukoidan, sehingga risiko dapat diminimalkan.[50,76]
Pada studi yang dilakukan oleh Sharma, Mukherjee dan Talwar menunjukkan bahwa setelah 78 tahun terhitung dari waktu vaksinasi, angka efikasi perlindungan turun sehingga menyebabkan
diperlukannya vaksinasi booster yang bertujuan untuk meningkatkan dan mempertahankan efek vaksin
terhadap mediasi sel terhadap imunitas dalam tujuan
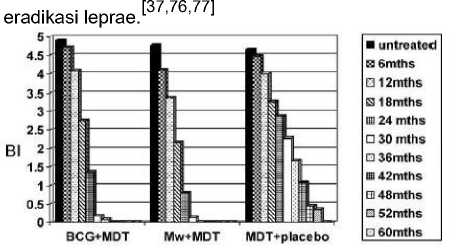
Gambar 4. Tingkat penurunan BI pada penderita BL/LL dengan intervensi BCG+MDT, Mw+MDT, dan
MDT+Placebo[18,75,78
SIMPULAN
i-LEPRA memiliki potensi yang menjanjikan sebagai vaksin M. leprae. Berdasarkan spesifisitasnya, ML0405 dan potensi proteksi dari MIP meningkatkan proteksi efektif dari vaksin ini. Ditambah lagi dengan peranan mikrosfer fukoidan yang spesifik dalam mengaktivasi Mφ serta imunomodulator dan neuroprotektif untuk meningkatkan proteksi dari invasi dan inkubasi M. leprae di tubuh. Dengan demikian, diharapkan i-LEPRA dapat menjadi vaksin yang efisien dan efektif untuk pencegahan dan eradikasi M. leprae di masa depan.
SARAN
Diperlukan penelitian mengenai i-LEPRA secara in vitro dan in vivo untuk mengetahui efektivitas proteksi i-LEPRA sebagai vaksin penyakit leprae.
UCAPAN TERIMA KASIH
Kami megucapkan terima kasih kepada Prof. Dr. dr. I Made Swastika, Sp.KK (K) dan dr. I Made Primasudarsa, Sp.KK yang memberikan bimbingan dalam penulisan literature review kami.
DAFTAR PUSTAKA
-
1. Sehgal VN. Clinical Leprosy, 4th edn. New Delhi, India: JP Brothers, 2004; 178.
-
2. WHO Expert Committee on Leprosy. 7th Report. Technical Report Series 874. Geneva: WHO, 1998.

-
3. World Health Organization. Leprosy weekly epidemiological record [Internet]. World Health Organization. 2013 [diakses pada tanggal 27 Mei 2017]. Tersedia di:
http://www.who.int/wer/2013/wer8835/en/
-
4. Sehgal VN, Sharma V. Reactions in leprosy – a prospective study of clinical, bacteriological, immunological and histopathological parameters in thirty-five Indians. J Dermatol. 1988; 15: 412 – 419.
-
5. Lastória JC, de Abreu MAMM. Leprosy: review of the epidemiological, clinical, and etiopathogenic aspects - Part 1. Anais Brasileiros de Dermatologia. 2014;89(2):205-218.
doi:10.1590/abd1806-4841.20142450.
-
6. Sehgal VN, Srivastava G, Sundharam JA. Immunology of reactions in leprosy. Int J Dermatol 1988; 27: 396 – 399.
-
7. Sehgal VN, Sardana K. Lepra vaccine. Skin Med. 2004; 3: 167–168.
-
8. World Health Organization. Global leprosy strategy 2016 – 2020: accelerating towards a leprosy-free world [Internet]. New Delhi World Health Organization Regional Office for SouthEast Asia. 2016 [diakses pada tanggal 27 Mei 2017]. Tersedia di:
http://www.wpro.who.int/leprosy/documents/globa lleprosystrategy2016-2020.pdf
-
9. Kaur I, Dogra S, Kumar B, et al. Combined 12-month WHO/ MDT MB regimen and Mycobacterium w. vaccine in multibacillary leprosy: a follow-up of 136 patients. Int J Lepr Other Mycobact Dis. 2002; 70: 174 – 181.
-
10. Bhattacharya SN, Sehgal VN. An re-appraisal of drifting scenario of leprosy multi-drug therapy (MDT): a proposal for fresh approach in the new millennium. Int J Dermatol. 2002; 41: 321 – 326.
-
11. Soebono, Hardyanto. Pengembangan vaksin lepra. 1991:1-49.
-
12. Whitty C. Mycobacterium w. immunotherapy in leprosy. Lepr Rev. 1998;69:222-224.
-
13. Zaheer SA, Beena KR, Kar HK, et al. Addition of immunotherapy with Mycobactreium w vaccine to multidrug therapy benefits multibacillary patients. Vaccine. 1995; 13: 1102 – 1110.
-
14. Karonga Prevention Trial Group. Randomized controlled trial of single BCG, repeated BCG, or combined BCG and killed Mycobacterium leprae vaccine for prevention of leprosy and tuberculosis in Malawi. Lancet. 1996; 348: 17 – 24.
-
15. Sehgal VN, Gautam RK, Sharma VK. Immunoprofile of reaction in leprosy. Int J Dermatol. 1986; 25: 240 – 244.
-
16. Fitton, J. Therapies from fucoidan; multifunctional marine polymers. Mar. Drugs. 2011;9: 1731–1760.
-
17. Ohshiro T, Ohmoto Y, Ono Y, Ohkita R, Miki Y, Kawamoto H, Izumi Y. Isolation and characterization of a novel fucoidandegrading microorganism. Biosci Biotechnol Biochem. 2011;74 (8):1729–1732.
-
18. Fitton, J.H.; Dell’Acqua, G.; Gardiner, V.A.; Karpiniec, S.S.; Stringer, D.N.; Davis, E. Topical benefits of two fucoidan-rich extracts from marine macroalgae. Cosmetics. 2015;2:66–81.
-
19. Zhou S, Deng X, Li X. Investigation on a novel corecoated microspheres protein delivery system. Journal of Controlled Release. 2001;75:27–36.
-
20. Naafs B, Silva E, Vilani-Moreno F, et al. Factors influencing the development of leprosy: an overview. Int J Lepr. 2001;69(1):26-33.
-
21. Martins A, Miranda A, Oliveira M, Bührer-Sékula S, Martinez A. Nasal mucosa study of leprosy contacts with positive serology for the phenolic glycolipid 1 antigen. Brazilian Journal of Otorhinolaryngology. 2010;76(5):579-587.
-
22. Job CK, Jayakumar J, Kearney M, Gillis TP. Transmission of leprosy: a study of skin and nasal secretions of household contacts of leprosy patients using PCR. 2008;78(3):518-21.
-
23. Nunzi E, Massone C. Leprosy: A Practical Guide. 1st ed. Milan: Springer; 2012.
-
24. Masaki T, McGlinchey A, Cholewa-Waclaw J, Qu J, Tomlinson SR, Rambukkana A. Innate Immune Response Precedes Mycobacterium leprae– Induced Reprogramming of Adult Schwann Cells. Cellular Reprogramming. 2014;16(1):9-17.
-
25. Pinheiro RO, de Souza Salles J, Sarno EN, Sampaio EP. Mycobacterium leprae–host-cell interactions and genetic determinants in leprosy: an overview. Future microbiology. 2011;6(2):217-230. doi:10.2217/fmb.10.173.
-
26. Parameswaran N, Patial S. Tumor Necrosis Factor-α Signaling in Macrophages. Critical reviews in eukaryotic gene expression. 2010;20(2):87-103.
-
27. Yang D, Shui T, Miranda J, Gilson D, Song Z, Chen J et al. Mycobacterium leprae-Infected Macrophages Preferentially Primed Regulatory T Cell Responses and Was Associated with Lepromatous Leprosy. PLOS Neglected Tropical Diseases. 2016;10(1):e0004335.
-
28. Bhat RM, Prakash C. Leprosy: An Overview of Pathophysiology. Interdisciplinary Perspectives on Infectious Diseases. 2012;2012:181089.
-
29. Talwar GP, Ahmed N, Saini V. The use of the name Mycobacterium w for the leprosy immunotherapeutic bacillus creates confusion with M. tuberculosis-W (Beijing strain): A
suggestion. Infect Genet Evol. 2007.
-
30. Zaheer SA, Mukherjee R, Ramkumar B, Misra RS, Sharma AK, et al. Combined multidrug and Mycobacterium w vaccine therapy in patients with multibacillary leprosy. J Infect Dis.
1993;167(2):401–410.
-
31. Gershons, R. K. A disquisition on suppressor T cells. Transplant Rev. 1975;26:170-185.
-
32. David, J. R., Al-askari, S., Lawrence, H. S. and Timms, L. Delayed hypersensitivity in vitro. I.The specificity of inhibition of cell migration byantigens. J. Immunol. 1964;93:264-273.
-
33. Mendez-Samperio P. Lamb J. Bothamley G. et al. Molecular study of T cell repertoire in family contacts and patients with leprosy. J Immunol. 1989; 142:3599-604.
-
34. David, J. R. and David, R. R. Cellular hypersensitivity and immunity. Inhibition of macrophage migration and the lymphocyte mediators. Prog. Allergy. 1972;16:300-449.
-
35. OttenhoffTMH. Converse P.I. Gebre N. Wondimu A. Bhrenberg JP, Kiessling R. T ceil responses to fractionated Mycobacterium ieprac antigens in leprosy. The lepromatous nonresponder defect can be overcome in vitro by stimulation with
ESSENTIAL
∖ Essence ot Scientific ∕ ∖Medlcαl JOucnaI∕
fractionated M. leprae components. Eur J Immtinol. 1989;19:707-13,
-
36. Converse PJ, OttenhofTTHM. Gebre N. Ehrenberg JM. Kiessling R, Ceilular, Humoral,
and gamma interferon responses to Mycobacterium leprae and BCG antigens in
healthy individuals exposed to leprosy. Scand J Immunol. 1988:27:515-25.
-
37. Dockrol HM, Sloker NG, Lee SP. et id. T-cell recognition of the IX-Ki!odallon antigen of Mycobacterium leprae. Infect Immun. 1989:57:1979 83.
-
38. Mehra V. Bloom BR, Torigian VK. et al. Charactherization of Mycobacterium leprae cell wall-associated proteins with the use of T
lymphocyte clones. J Immunol. l959;|42:2873-8.
-
39. Mehra, V., L. H. Mason, W. Rothman, E.
Reinherz, S. F. Schlossman, and B. R. Bloom. 1980. Delineation of a human T cell subset responsible for lepromin induced suppression in leprosy patients. J. Immunol. 125:1183-1188.
-
40. Yamamura M, Uyemura K, Deans RJ, Weinberg K, Rea T, Bloom BR, Modlin R. Defining protective responses to pathogens: Cytokine profiles in leprosy lesions. Science. 254;1991:277-279
-
41. Sampaio L, Stefani M, Oliveira R, Sousa A, Ireton G, Reed S et al. Immunologically reactive M. leprae antigens with relevance to diagnosis and vaccine development. BMC Infectious Diseases. 2011;11(1).
-
42. Kim WJ, Kim SM, Lee YH, Kim HG, Kim HK, Moon SH, Suh HH, Jang KH, Park YI. Isolation and characterization of marine bacterial strain degrading fucoidan from Korean Undaria pinnatifida sporophylls. J Microbiol Biotechnol. 2008;18(4):616–623.
-
43. Chevolot L, Mulloy B, Ratiskol J, Foucault A, Colliec-Jouault SA. Disaccharide repeat unit is the major structure in fucoidans from two species of brown algae. Carbohydrate Research 2001;330:529–535.
-
44. Janes KA, Cavlo P, Alonso MJ. Polysaccharide colloidal particles as delivery systems for macromolecules. Advanced Drug Delivery Reviews. 2001;47:83–97.
-
45. Walia R, Sarathchandra KG, Pandey RM et al. Field trials on the use of Mycobacterium w vaccine in conjunction with multi drug therapy in leprosy patientsforimmunotherapeuticand immunoprophylactic purposes. Lep Rev 1993;64:302– 311.
-
46. Nerland AH, Mustafa AS, Sweetser D, Godal T, Young RA. A protein antigen of Mycobacterium leprae is related to a family of small heat shock proteins. J. Bacteriol. 1988;170:5919–5921
-
47. Fitton, J.H.; Dell’Acqua, G.; Gardiner, V.A.;
Karpiniec, S.S.; Stringer, D.N.; Davis, E. Topical benefits of two fucoidan-rich extracts from marine macroalgae. Cosmetics. 2015;2:66–81.
-
48. Zhang W, Oda T, Yu Q, Jin JO. Fucoidan from macrocystis pyrifera has powerful immune-modulatory effects compared to three other fucoidans. Mar. Drugs. 2015;13:1084–1104.
-
49. Sezer AD, Akbug˘a J. Release characteristics of chitosan treated alginate beads I: Sustained release of a macromolecular drug from chitosan
treated alginate beads. Journal of Microencapsulation 1999;16:195–203.
-
50. Irhimeh MR, Fitton JH, Lowenthal RM, Kongtawelert P. A quantitative method to detect fucoidan in human plasma using a novel antibody.
Methods Find. Exp. Clin. Pharmacol. 2005;27:705–710.
-
51. Teruya, T.; Tatemoto, H.; Konishi, T.; Tako, M. Structural characteristics and in vitro macrophage activation of acetyl fucoidan from Cladosiphon okamuranus. Glycoconj. J. 2009, 26, 1019–1028.
-
52. Zhang W, Oda T, Yu Q, Jin JO. Fucoidan from macrocystis pyrifera has powerful immune-modulatory effects compared to three other fucoidans. Mar. Drugs. 2015;13:1084–1104.
-
53. Geluk A, Klein MR, Franken K, van Meijgaarden KE, Wieles B, Pereira KC, Bührer-Sékula S, Klatser PR, Brennan PJ, Spencer JS, et al. Postgenomic approach to identify novel Mycobacterium leprae antigens with potential to improve immunodiagnosis of infection. Infect. Immun. 2005;73:5636–5644.
-
54. Ale MT, Mikkelsen JD, Meyer AS. Important determinants for fucoidan bioactivity: A critical review of structure-function relations and
extraction methods for fucose-containing sulfated polysaccharides from brown seaweeds. Mar. Drugs. 2011;9: 2106–2130.
-
55. Talwar G, Singh P, Atrey N, C Gupta J. Making of a highly useful multipurpose vaccine. Journal of Translational Science. 2016;2(1).
-
56. Sharma P, Mukherjee R, Talwar P et al. Immunoprophylactic effects of anti-leprosy vaccine in household contacts of leprosy patients: clinical field trials with a follow-up of 8-10 years. Lepr Rev. 2005;76:127-43.
-
57. Britton WJ, Martin E, Kamath AT et al. Immunoprophylaxis against Mycobacterium leprae infection with subunit vaccines. Lepr Rev. 2000;71:176–181.
-
58. Gupte MD, Vallishayee RS, Anantharaman DS et al. Comparative leprosy vaccine trail in South India. Ind J Lepr. 1998; 70:369– 388.
-
59. Sharma P, Kar HK, Kaur H et al. Induction of lepromin positivity and immunoprophylaxix in household contacts of multibacillary leprosy patients: a Pilot study with a candidate vaccine Mycobacterium w. Int J Lepr. 2000;68:136–142.
-
60. Fine PE. South Indian leprosy vaccine trial: important lessons for mycobacterial immunology. Lepr Rev. 1999;70:247–249.
-
61. Walia R, Sarathchandra KG, Pandey RM et al. Field trials on the use of Mycobacterium w vaccine in conjunction with multi drug therapy in leprosy patientsforimmunotherapeuticand immunoprophylactic purposes. Lep Rev 1993;64:302– 311.
-
62. De Sarkar A, Kaur I, Radotra BD, Kumar B. Impact of combined Mycobacterium w vaccine and 1 year MDT on multibacillary leprosy patients. Int J Lepr other Mycobact Dis. 2000;69:187–194.
-
63. Katoch K, Katoch VM, Natrajan M et al. Treatment of bacilliferous BL/LL cases with combined chemotherapy and immunotherapy. Int J Lepr other Mycobact Dis. 1995;63:202–-212.
-
64. Sharma P, Misra RS, Kar HK et al. Mycobacterium w vaccine, a useful adjuvant to multidrug therapy
in multibacillary leprosy: a report on hospital based trials with a follow-up of 1–7 years after treatment. Lepr Rev. 2000; 71:179–192.
-
65. Talwar GP, Mukherjee R, Zaheer SA et al. Present approaches to immunotherapy and
immunoprophylaxis in leprosy. In: Talwar GP (ed) Progress in Vaccinology, vol. II. Springer-Verlag, New York, 1989, pp. 301–311.
-
66. Talwar GP, Zaheer SA, Mukherjee R et al. Immunotherapeutic effects of a vaccine based on a saprophytic cultivable mycobacterium, Mycobacterium w, in multibacillary leprosy patients. Vaccine. 1990;8:121–129.
-
67. Raghavendran, H.R.; Srinivasan, P.; Rekha, S. Immunomodulatory activity of fucoidan against aspirin-induced gastric mucosal damage in rats. Int. Immunopharmacol. 2011;11:157–163.
-
68. Andrade LR, Salgado LT, Farina M, Pereira MS, Mour PAS, Amado FGM. Ultrastructure of acidic polysaccharides from the cell walls of brown algae. Journal of Structural Biology. 2004;145:216–225.
-
69. Vandenberg GW, Nou¨ e J. Evaluation of protein release from chitosan-alginate microcapsules produced using external or internal gelation. Journal of Controlled Release 2001;18:433–441.
-
70. Mitrasinovic OM, Murphy GM Jr. Accelerated phagocytosis of amyloid-beta by mouse and human microglia overexpressing the macrophage colony-stimulating factor receptor. J Biol Chem. 2002;277:29889–29896.
-
71. Trinchero J, Ponce NMA, Córdoba OL, Flores ML, Pampuro S, Stortz CA, Salomón H, Turk G. Antiretroviral activity of fucoidans extracted from the brown seaweed Adenocystis utricularis. Phytother Res. 2009; 23:707–712.
-
72. Rvantseva AM, Bakunina IIu, Nedashkovskaia OI, Kim SB, Zviagintseva TN. Distribution of intracellular fucoidan hydrolases among marine bacteria of the family Flavobacteriaceae. Prikl Biokhim Mikrobiol. 2006;42(5):552–559.
-
73. Wang J, Zhang Q, Zhang Z, Song H, Li P. Potential antioxidant and anticoagulant capacity of low molecular weight fucoidan fractions extracted from Laminaria japonica. Int J Biol Macromol. 2010;46: 6–12.
-
74. Wang J, Wang F, Zhang Q, Zhang Z, Shi X, Li P. Synthesized different derivatives of low molecular fucoidan extracted from Laminaria japonica and their potential antioxidant activity in vitro. Int J Biol Macromol. 2009;44(5):379–384.
-
75. Wang J, Zhang Q, Zhang Z, Zhang J, Li P. Synthesized phosphorylated and aminated derivatives of fucoidan and their potential antioxidant activity in vitro. Int J Biol Macromol. 2008;44:170–174.
-
76. Tokita, Y.; Nakajima, K.; Mochida, H.; Iha, M.; Nagamine, T. Development of a fucoidan-specific antibody and measurement of fucoidan in serum and urine by sandwich elisa. Biosci. Biotechnol. Biochem. 2010;74:350–357.
-
77. Silchenko AS, Kusaykin MI, Kurilenko VV, Zakharenko, AM, Isakov VV, Zaporozhets TS, Gazha AK, Zvyagintseva TN. Hydrolysis of fucoidan by fucoidanase isolated from the marine bacterium, formosa algae. Mar. Drugs. 2013;11:2413–2430.
-
78. Pomin, V.H. Sea, carbohydrates and clotting: A triad on the road of drug discovery. Mini Rev. Med. Chem. 2014;14:717–724.

[37]
LAMPIRAN
Tabel 1. Penurunan angka efikasi proteksi dari MIP selama 10 tahun
|
No. |
Status Vaksinasi |
Waktu peninjauan | ||||||||
|
Peninjauan 1 (3-4 tahun) |
Peninjauan 2 (6-8 tahun) |
Peninjauan 3 (9-10 tahun) | ||||||||
|
P-value |
Odds ratio (95% ci) |
pg** (%) |
P-value |
Odds ratio (95% ci) |
PE e⅛ |
P-value |
Odds ratio (95% CI) |
PE (%) | ||
|
1. |
P4C4*, P3C3* |
0,00005 |
0,32 (0,170,58) |
68 |
0,000003 |
0,4 (0,2750,613) |
60 |
0,001 |
0,72 (0,5470,948) |
28 |
|
2. |
PlCl*, P3C3 |
0,00006 |
0,314 (0,6180,579) |
68,6 |
0,000006 |
0,41 (0,2780,619) |
59 |
0,0003 |
0,607 (0,4580,804) |
39,3 |
|
3. |
P2C2*. P3C3 |
0,02 |
(0,571 (0,394 0,934) |
42,9 |
0,03 |
0,69 (0,4950,969) |
31 |
0,833 |
0,87 (0,751,24) |
3 |
Keterangan
PE: Protective efficacy
95% CI: 95% confidence interval
P1C1: pasien memperoleh MDT + plasebo, kontak memperoleh vaksin P2C2: pasien memperoleh MDT + vaksin, kontak memperoleh plasebo P3C3: pasien memperoleh MDT + plasebo, kontak memperoleh plasebo
P4C4: pasien memperoleh MDT + vaksin, kontak memperoleh vaksin
Discussion and feedback