POTENSI NANOPARTIKEL EKSTRAK ETANOL BUNGA MARIGOLD (TAGETES ERECTA L.) TERENKAPSULASI POLYLACTIC-CO-GLYCOLIC ACID (PLGA) SEBAGAI AGEN PENCEGAH AGE-RELATED MACULAR DEGENERATION
on
ARTIKEL TINJAUAN PUSTAKA
Essence of Scientific Medical Journal (2023), Volume 21, Number 1:80-89 P-ISSN.1979-0147, E-ISSN. 2655-6472

TINJAUAN PUSTAKA
POTENSI NANOPARTIKEL EKSTRAK ETANOL BUNGA MARIGOLD (TAGETES ERECTA L.) TERENKAPSULASI POLYLACTIC-CO-GLYCOLIC ACID (PLGA) SEBAGAI AGEN PENCEGAH AGE-RELATED MACULAR DEGENERATION
I Komang Wira Ananta Kusuma1, Ni Kadek Yudit Erawati1, I Made Angga Sayoga1, Desak Made Wihandani2
ABSTRAK
Pendahuluan: Age-Related Macular Degeneration (AMD) merupakan penyakit yang banyak diderita para lansia ditandai dengan adanya degenerasi makula pada retina. Pencegahan perlu dilakukan, salah satunya menggunakan bahan alam yaitu bunga marigold dengan kandungan lutein. Lutein memiliki bioavailabilitas yang rendah sehingga diperlukan formulasi enkapsulasi nanopartikel PolyLactic-co-Glycolic Acid (PLGA).
Pembahasan: Age-Related Macular Degeneration (AMD) dapat diakibatkan oleh akumulasi Reactive Oxygen Species (ROS) di bagian makula pada retina yang kemudian menyebabkan terjadinya stres oksidatif. Lutein pada bunga marigold bekerja dengan cara bereaksi dengan zat ROS sehingga mencegah terjadinya akumulasi dan stres oksidatif pada retina. Lutein aman dikonsumsi sebagai suplemen namun memiliki bioavailabilitas yang rendah sehingga diperlukan formulasi enkapsulasi nanopartikel PolyLactic-co-Glycolic Acid (PLGA). Lutein dengan formulasi ini memiliki efek klinis pada AMD, yaitu meningkatkan konsentrasi plasma dari lutein, kemudian meningkatkan skor Macular Pigment Density, dan meningkatkan Contrast Sensitivity serta Glare Sensitivity.
Simpulan: Lutein sebagai antioksidan yang kemudian terenkapsulasi nanopartikel PolyLactic-co-Glycolic Acid (PLGA) memiliki efek potensi untuk dijadikan agen pencegahan AMD. Diperlukan penelitian terkait dosis efektif, tingkat efikasi dalam pencegahan, serta efek samping dari lutein yang terenkapsulasi PLGA.
Kata Kunci: Age-Related Macular Degeneration, Lutein, Marigold, Nanopartikel, PolyLactic-co-Glycolic Acid.
ABSTRACT
Introduction: Age-Related Macular Degeneration (AMD) is a disease that mostly affects the elderly, characterized by macular degeneration of the retina. Prevention needs to be done, one of which is using natural ingredients, namely marigold flowers with lutein content. Lutein has low bioavailability, so an encapsulated formulation of PolyLactic-co-Glycolic Acid (PLGA) nanoparticles is needed.
Discussion: Age-Related Macular Degeneration (AMD) can be caused by the accumulation of Reactive Oxygen Species (ROS) in the macula on the retina which then causes oxidative stress. Lutein in marigolds works by reacting with ROS substances to prevent accumulation and oxidative stress on the retina. Lutein is safe for consumption as a supplement but has low bioavailability, so an encapsulated formulation of PolyLactic-co-Glycolic Acid (PLGA) nanoparticles is needed. Lutein with this formulation has clinical effects on AMD, namely increasing plasma concentrations of lutein, then increasing Macular Pigment Density scores, and increasing Contrast Sensitivity and Glare Sensitivity. Conclusion: Lutein as an antioxidant which is then encapsulated by PolyLactic-co-Glycolic Acid (PLGA) nanoparticles has a potential effect as an AMD prevention agent. Research is needed regarding the effective dose, level of efficacy in prevention, and side effects of lutein.
Keywords: Age-Related Macular Degeneration, Lutein, Marigold, Nanoparticles, PolyLactic-co-Glycolic Acid
I Komang Wira Ananta Kusuma1, Ni Kadek Yudit Erawati1, I Made Angga Sayoga1, Desak Made Wihandani2
PENDAHULUAN
Age-Related Macular Degeneration (AMD) merupakan suatu penyakit yang ditandai dengan adanya makulopati pada retina yang kemudian menyebabkan hilangnya penglihatan secara progresif dan irreversibel.[1,2] Klasifikasi klinis AMD terbagi menjadi empat yaitu tahap asimtomatik, tahap
awal, tahap menengah, dan tahap akhir. Keempat tahap tersebut dibagi berdasarkan lesi zat sisa pada bawah retina yang disebut drusen.[3,4] Progresivitas penyakit AMD ini disebabkan beberapa faktor risiko seperti halnya usia, jenis kelamin, nutrisi diet, aktivitas fisik, merokok dan bahkan faktor genetik.[3–5] Dalam studi review mengungkapkan bahwa prevalensi global AMD dengan rentang usia
45-85 tahun sekitar 8,7%.[6] Studi lainnya menunjukkan bahwa penyakit AMD masih menjadi beban yang besar di negara-negara berkembang.[7] Di Indonesia, belum ada data pasti terkait prevalensi, insidensi, dan morbiditas terkait AMD. Namun dalam suatu penelitian di Manado, mendapatkan bahwa pasien AMD paling banyak yaitu dengan rentang usia berkisar 61-70 tahun sebanyak 39%.[8] Kemudian penelitian di Bali, mendapatkan persebaran umur AMD berkisar antara 66-83 tahun sebanyak 61,63%.[9] Kedua penelitian ini menyatakan hal yang sama dimana AMD lebih banyak terjadi pada populasi lansia dengan usia di atas 60 tahun. Dalam suatu data dari United Nation mengenai World Population Ageing pada tahun 2019, diprediksikan bahwa populasi lansia dengan umur 65 tahun ke atas akan semakin meningkat pada tahun 2050 dengan persentase 120%.[10] Dengan demikian peluang terjadinya kejadian AMD juga akan semakin meningkat di masa depan. Hal penting lainnya yaitu AMD dapat menyebabkan menurunnya kualitas hidup, risiko disabilitas fungsional, serta diasosiasikan dengan penyakit lain seperti katarak, alzheimer, diabetes, penyakit ginjal kronis, dan lain sebagainya.[2,5]
Tatalaksana untuk penyakit AMD bergantung kepada jenisnya. Terdapat dua jenis AMD yaitu dry age-related macular degeneration dan wet age-related macular degeneration.[11] Saat ini tidak ada pengobatan yang efektif untuk mengurangi perkembangan dry AMD. Namun, terdapat literatur yang menyatakan bahwa beberapa molekul seperti lampalizumab dan eculizumab masih diteliti untuk dijadikan sebagai agen terapi untuk dry AMD, walaupun molekul tersebut menunjukkan efek yang tidak signifikan untuk menghambat perkembangan dry AMD.[12] Pada treatment wet AMD saat ini sudah dikembangkan terapi dengan mempergunakan anti-VEGF secara injeksi sebagai gold standard untuk penanganan wet AMD.[13] Namun, pemberian obat tersebut memerlukan suntikan dalam jangka panjang dan dapat menyebabkan ketidakpatuhan pasien, dan peningkatan risiko cedera iatrogenik, seperti perdarahan, ablasi retina, dan bahkan endoftalmitis.[12]
Terdapat literatur yang menyatakan bahwa lutein menunjukkan hasil yang signifikan memperbaiki kepadatan pigmen makula dan fungsi visual pada pasien AMD yang masih dalam tahap awal.[14] Lutein yang termasuk kedalam golongan karotenoid yang terdapat dalam bahan makanan seperti sayuran berdaun hijau tua, jagung dan telur.[15,16] Salah satu bahan alam yang memiliki kadar lutein yang tinggi yaitu bunga marigold (gemitir). Marigold dalam kondisi kering mengandung kadar lutein yang tinggi
hingga mencapai 13,88 mg/gram.[17] Kadar lutein pada bunga marigold lebih tinggi dibandingkan dengan jagung dan telur.[18] Namun, bioavailabilitas lutein tergolong rendah karena memerlukan lemak untuk dapat diserap sehingga diperlukan sediaan dalam bentuk nanopartikel agar dapat terserap dan stabil.[19] Nanopartikel adalah material berskala nano yang mempunyai ukuran antara 1-100 nanometer.[20] Berdasarkan sebuah kajian literature review, pemanfaatan nanopartikel sangat cocok dalam tatalaksana AMD karena dengan partikel yang kecil dengan mudah dapat menembus ke retina saat diberikan secara sistemik.[21] Pemanfaatan nanopartikel dalam metode penghantaran obat di dalam tubuh dapat memberikan beberapa keuntungan seperti meningkatkan bioavaibilitas, mempercepat distribusi obat, dan memperbaiki targeting dan releasing obat, sehingga dapat meningkatkan efektivitas dan efikasi obat, serta mengurangi efek samping yang mungkin ditimbulkan.[22]
Dalam meningkatkan solubilitas modalitas dan melindungi modalitas dari degradasi melewati saluran gastrointestinal, nanopartikel ekstrak etanol bunga marigold akan dienkapsulasi dengan PolyLactic-co-Glycolic Acid (PLGA). Kelebihan dari nanopartikel tersebut disebabkan karena modalitas yang telah terbungkus tidak masuk ke dalam aliran darah vena porta hepatika, melainkan akan langsung menuju ke sistem limfatik usus.[23] Melihat keseluruhan potensi lutein pada bunga marigold dan nanopartikel PLGA sebagai inovasi terbaru dalam pencegahan AMD dan karena pada saat ini belum terdapat literatur yang secara komprehensif membahas penggunaan nanopartikel ini pada modalitas yang diangkat, oleh karena itu penulis tertarik untuk membahas lebih lanjut mengenai modalitas ini.
PEMBAHASAN
Patogenesis Age-Related Macular Degeneration (AMD) Akibat Stres Oksidatif
Patogenesis dari AMD melibatkan banyak aspek fisiologis dan aspek biomolekuler. Salah satunya adanya faktor kerusakan/disfungsi mitokondria yang kemudian ditambah dengan adanya akumulasi stres oksidatif.[24,25] Kedua skenario tersebut mengarah pada kerusakan DNA pada mitokondria yang kemudian menghasilkan kelebihan produksi ROS (Reactive Oxygen Species) dan terjadi terus menerus. Sebagai akibat hal tersebut, terjadilah defisit energi dan gangguan pada fungsi sel, termasuk proses dasar seperti replikasi dan transkripsi. Jika sistem pertahanan seluler, yang juga dipengaruhi oleh peningkatan konsentrasi
ROS, tidak mampu mengimbangi perubahan yang merugikan akibat disfungsi mitokondria, sel retina mengakumulasi perubahan patologis dan akhirnya mati. Selain itu, akumulasi ROS juga dapat menginduksi respons adaptif terhadap stres oksidatif, sehingga sel retina dapat berfungsi lebih lanjut namun dalam keadaan patologis, sel tersebut akan tidak bekerja efektif karena efek senescence yang kemudian terjadi degenerasi retina dan mengarah pada AMD.[26] Stres oksidatif kronis dan ROS menimbulkan kesalahan lipatan protein dalam sel retina. Heat-Shock Proteins (HSPS) mencoba untuk melipat kembali protein yang rusak, tetapi apabila tidak berhasil, maka protein yang salah pelipatan tersebut akan melalui proses ubikuitinasi dan aktivitas pembersihan proteasomal. Namun demikian, apabila aktivitas proteasomal menurun atau kapasitasnya terlampaui, protein mulai berkumpul dan terdegradasi melalui autophagy.[24]
Selain stres oksidatif, faktor patogenesis lainnya yang berperan dalam AMD yaitu efek senescence. Degenerasi sel retina yang persisten dan progresif pada AMD dihasilkan dari Stress-Induced Premature Senescence (SIPS). SIPS dapat diinduksi oleh ROS, yang mana pada sel tua, pelepasan ROS akan menciptakan stres oksidatif lokal. Kemudian, ROS ekstraseluler ini dapat menginduksi SIPS di sel tetangga lainnya yang dapat melepaskan ROS yang pada akhirnya menghasilkan perubahan stres oksidatif lokal menjadi keseluruhan sel.[26] Dengan demikian hal ini mengarah pada serangkaian peristiwa yang menghasilkan progresivitas AMD sebagai akibat peningkatan jumlah sel retina yang mengalami degenerasi. Ilustrasi patogenesis AMD akibat stress oksidatif dapat dilihat pada Gambar 1.
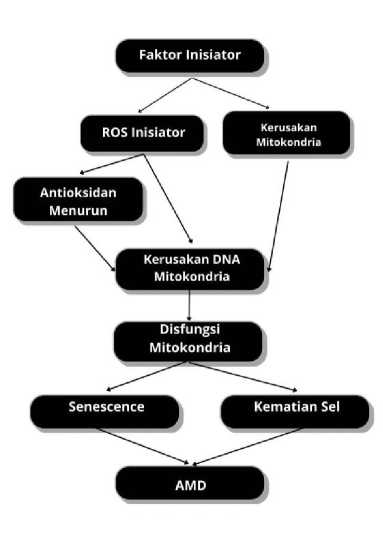
Gambar 1. Mekanisme Patogenesis AMD Akibat Stres Oksidatif.
Lutein pada Bunga Marigold (Tagetes erecta L.)
Bunga marigold (Tagetes erecta L.) menjadi salah satu sumber lutein yang tinggi. Bunga marigold kering mengandung 0,1-0,2% karotenoid dan 80% diantaranya adalah lutein diester.[27,28] Lutein memiliki aktivitas antioksidan dan bereaksi dengan ROS, menghasilkan produk degradasi yang aktif secara biologis. Peran lain dari lutein dapat menghambat peroksidasi membran fosfolipid dan mengurangi pembentukan lipofuscin.[29] Lutein merupakan salah satu zat yang dapat terakumulasi pada mata, hati dan jaringan yang bersifat lipofilik. Beberapa literatur menyebutkan bahwa bioavailabilitas lutein pada bunga marigold dipengaruhi oleh solubilitas sistem pencernaan dan bioavailabilitasnya hanya mencapai 10-15% yang cenderung sangat rendah. Begitu juga dengan stabilitas kandungan lutein pada bunga marigold dapat dipengaruhi oleh berbagai macam faktor salah satunya adalah suhu pengolahan. Stabilisasi lutein pada bunga marigold ditemukan mengalami penurunan pada suhu 100oC selama 40 menit menunjukkan 69% menggunakan medium chain triaglycerols (MCT) dan 27% menggunakan orange oil sehingga diperlukan strategi enkapsulasi yang baik untuk meningkatkan stabilitas lutein pada bunga marigold untuk dijadikan sebagai suplemen oral.[30] Penyerapan suplementasi lutein secara oral yang rendah disebabkan hidrofobisitas yang tinggi dari struktur karbon
isoprenoid dari lutein sehingga membuatnya larut pada cairan pencernaan. Pada aspek keamanan, belum terdapat penelitian yang menyatakan efek samping genotoksisitas pada formulasi lutein.[31] Selain itu belum terdapat bukti suplementasi lutein dalam jangka panjang memiliki efek yang tidak diinginkan pada manusia. Hal ini juga dibuktikan dengan pemberian lutein dengan dosis yang lebih tinggi yaitu 30 mg dan 40 mg/kgBB didapatkan hasil masih dalam kategori aman. Mengenai dosis dari lutein, jika dikategorikan berdasarkan berat badan yaitu 2 mg/kgBB/hari.[32,33]
Mekanisme Kerja Lutein pada Age-Related Macular Degeneration (AMD)
Lutein merupakan bagian dari komponen pigmen makula dan memiliki peranan untuk melindungi makula dari kerusakan fotooksidatif dan meningkatkan fungsi visual.[34] Lutein sebagai antioksidan berperan dalam menurunkan singlet oxygen dan lipid peroxy radicals. Selain itu, lutein juga dapat menghambat aktivasi dari STAT3 dan IL-6 yang terekspresi pada retina.[35] Lutein dapat mengurangi tingkat ROS dan menekan apoptosis dengan mempengaruhi siklus sel pada fase G2/M melalui aktivasi cycline-dependent kinase 1 dan cell division cycle 25C pada sel epitel pigmen retina yang terpapar hidrogen peroksida.[36,37] Lutein juga menekan produksi lipopolisakarida yang dimediasi oleh IL-6 dan TNF-a di sel epitel pigmen retina dan makrofag.[38] Oleh karena itu, suplementasi lutein sangat efektif untuk mengembalikan antioksidan yang dibutuhkan oleh tubuh untuk mencegah age-related maculopathy dan age-related macular degeneration. Secara skematis mekanisme lutein dalam mengurangi ROS yang menjadi penyebab utama AMD dapat dilihat pada Gambar 2.
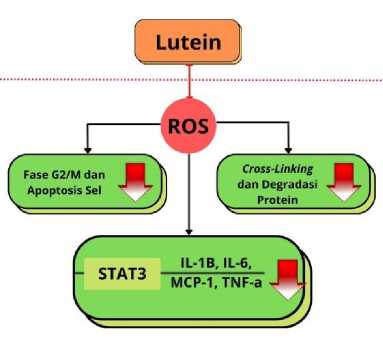
Gambar 2. Mekanisme Lutein pada Penyakit AMD.
Karakterisasi Nanopartikel PLGA dan Aplikasinya pada AMD
Polyester PLGA merupakan sebuah gabungan kopolimer dari polyglycolic acid (PGA) dan poly lactic acid (PLA).[39] PLGA adalah sebuah singkatan dari asam poli D, L-laktat co-glikolat dan memiliki rasio yang sama pada bentuk bentuk asam laktat D- dan L-. PLGA tidak dapat larut dalam air, namun dapat larut dalam diklorometana, etil asetat, hexafluoro isopropanol, aseton, dan kloroform.[40] Adanya laktida dalam jumlah yang banyak menyebabkan kopolimer PLGA membuatnya lebih hidrofobik karena adanya gugus metal di PLA. Sifat fisik PLGA tergantung dari beberapa faktor, seperti jumlah rasio laktida, paparan air, suhu penyimpanan, dan berat molekul.[41] PLGA sebagai polimer biodegradable yang telah disetujui oleh FDA memiliki sifat fisik kuat dan sangat biokompatibel. Penggunaan PLGA sebagai polimer biodegradable dikarenakan memiliki karakteristik degradasi yang menguntungkan dan dapat meningkatkan waktu paruh obat dalam waktu yang lama. Pemanfaatan nanopartikel sangat cocok dalam tatalaksana AMD karena dengan partikel yang kecil dengan mudah dapat menembus ke retina saat diberikan secara sistemik dengan beberapa keunggulan seperti pelepasan lambat, penetrasi jaringan yang lebih baik, dan peredaran obat yang lebih tinggi, dapat membantu memantau, mengendalikan, dan menyembuhkan penyakit.[42]
Mekanisme Konstruksi Nanopartikel PLGA Ekstrak Etanol Bunga Marigold sebagai Agen Pencegah Age-Related Macular Degeneration (AMD)
Pembuatan modalitas diawali dengan pembuatan simplisia bunga marigold melalui proses pencucian, pengeringan, penghalusan dan pengayakan. Selanjutnya, simplisia akan diekstraksi menggunakan metode Microwave-Assisted Extraction (MAE) secara duplo. Simplisia dimasukkan kedalam erlenmeyer dan ditambahkan etanol, kemudian dimasukkan kedalam microwave dengan daya 800 watt selama 6 menit. Larutan kemudian diradiasi dalam oven secara berkala 1 menit dan 2 menit dimatikan yang bertujuan untuk menjaga suhu tetap pada 80 °C. Larutan hasil radiasi didiamkan pada suhu kamar, disaring dan hasil filtrat diuapkan menggunakan rotary evaporator hingga menjadi ekstrak yang berbentuk kental. Pengeringan ekstrak dapat dilakukan menggunakan vacuum dryer sehingga didapatkan ekstrak yang siap dilakukan enkapsulasi. Enkapsulasi nanopartikel PLGA ekstrak bunga marigold dilakukan dengan menggunakan teknik
penguapan pelarut emulsi ganda. Ekstrak bunga marigold dilarutkan dalam air sebagai fase air. Kemudian, pada saat yang bersamaan, polimer dan lipid dilarutkan dalam pelarut seperti etil asetat yang nantinya akan mewakili fase organik. Kedua fase ini nantinya akan digabungkan dalam satu botol untuk disonifikasi sehingga membentuk emulsi primer. Lalu, emulsi yang telah diperoleh diteteskan ke dalam air dengan surfaktan seperti Polyvinyl Alcohol (PVA). Hal ini bertujuan untuk menstabilkan emulsi sehingga dapat dilanjutkan pada sonifikasi tahap kedua sehingga membentuk emulsi sekunder. Emulsi yang terbentuk dipindahkan ke air sambil diaduk sehingga memungkinkan nanopartikel memadat dan pelarutnya menguap. Fungsi lipid kationik yang dicampurkan bersama dengan polimer yaitu untuk mengunci molekul ekstrak bunga marigold yang terdapat di dalam nanopartikel.[43] Ilustrasi mengenai mekanisme konstruksi modalitas dapat dilihat pada Gambar 3.
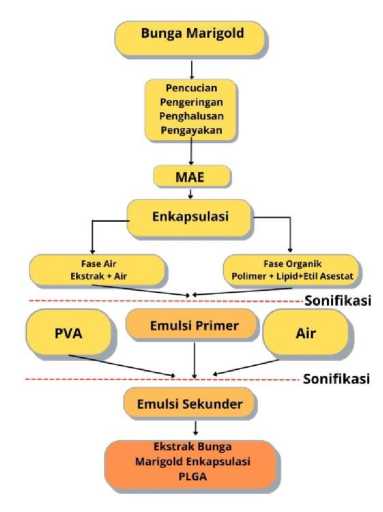
Gambar 3. Skema Mekanisme Konstruksi Modalitas
Farmakokinetik Nanopartikel PLGA Ekstrak Etanol Bunga Marigold sebagai Agen Pencegah Age-Related Macular Degeneration (AMD)
Formulasi nanopartikel PLGA menunjukkan peningkatan 3,42 kali lipat dalam bioavailabilitas oral dibandingkan dengan konsumsi oral biasa.[44] Lutein yang terdapat dalam bunga marigold yang telah dikonsumsi akan diserap dalam usus manusia, kemudian lutein ditransportasikan melalui
lumen intestinal. Lutein akan mencapai sirkulasi pembuluh darah secara bertahap dimetabolisme oleh hati.[19] Sistem penghantaran obat menggunakan nanopartikel PLGA dapat menyebabkan modalitas dapat diserap melalui jalur enterosit dan bioavailabilitas dari modalitas yang terenkapsulasi nanopartikel PLGA dapat mencegah adanya first pass metabolism di hati.[45] Kelebihan dari nanopartikel tersebut disebabkan karena modalitas yang telah terenkapsulasi tidak masuk ke dalam aliran darah vena porta hepatika, melainkan akan langsung menuju ke sistem limfatik usus. Pada manusia, LDL dan HDL mentransportasi lutein melalui sirkulasi sistemik pada jaringan yang spesifik, yaitu dari hati menuju ke sirkulasi pembuluh darah, hingga akhirnya akan didistribusikan ke jaringan, organ, hingga terkonsentrasi pada retina dan makula mata.[46] Lutein yang telah kehilangan fungsi biologis aktifnya akan diekskresikan melalui asam empedu sekitar 70 % dan sebanyak 30% dalam bentuk urin yang diproses di ginjal.[45] Ilustrasi lebih lengkap terkait profil farmakokinetik dari lutein dapat dilihat pada Gambar 4.
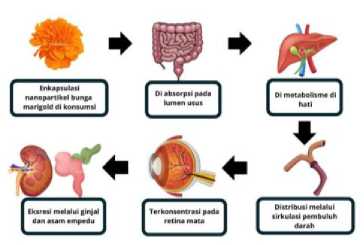
Gambar 4. Skema Profil Farmakokinetika
Lutein
Farmakodinamik Nanopartikel PLGA Ekstrak Etanol Bunga Marigold sebagai Agen Pencegah Age-Related Macular Degeneration (AMD)
Lutein melindungi retina dengan menyaring blue light dan bertindak sebagai antioksidan. Struktur lutein yang terdiri dari ikatan rangkap membuat karotenoid mampu menyerap cahaya maupun kelebihan energi dari molekul lainnya.[47] Lutein juga menekan ROS dan produksi mediator inflamasi yang dimediasi oleh IL-6 dan TNF-a di sel epitel pigmen retina dan makrofag, serta lutein juga menurunkan regulasi NADPH oksidase subunit Nox4. Dalam penelitian secara in vitro, lutein melindungi sel retina ARPE-19 dari penuaan seluler yang diinduksi stres oksidatif, dengan pendinginan singlet oxygen. Sifat antioksidan membuat lutein dapat memperlambat perkembangan AMD, mengurangi gejala serta mencegahnya.[48]
Selanjutnya pada penelitian lainnya, senyawa lutein yang terdapat dalam kandungan bunga marigold dapat menurunkan risiko perkembangan hingga AMD neovaskular lanjut sebesar 10%. Potensi tersebut sejalan dengan hasil adanya penurunan 26% dalam risiko perkembangan penyakit AMD pada pasien yang memiliki asupan makanan lutein.[49] Pasien yang menggunakan formulasi AREDS dengan lutein tanpa beta-karoten mengalami penurunan 18% dalam risiko mengembangkan AMD tingkat lanjut dibandingkan dengan menggunakan formulasi AREDS dengan beta-karoten tanpa lutein, serta penurunan 22% dalam perkembangan menjadi AMD neovaskular.[50]
Efek Klinis Suplemen Lutein dalam Peningkatan Skor Macular Pigment Density (MPOD)
Pada sebuah penelitian yang dilakukan oleh Liwen Feng et al mengenai efek suplementasi lutein pada AMD menunjukkan hasil bahwa suplementasi lutein (10 atau 20 mg per hari) dapat meningkatkan skor MPOD (perbedaan rata-rata 0,07; 95% CI 0,03 hingga 0,10), ketajaman visual (perbedaan rata-rata 0,28; 95% CI 0,06 hingga 0,50) dan sensitivitas kontras (perbedaan rata-rata 0,26; 95% CI 0,22 hingga 0,30). Berdasarkan hal tersebut menunjukkan bahwa diet lutein bermanfaat bagi pasien AMD dan dosis yang lebih tinggi dapat membuat MPOD meningkat dalam waktu yang lebih singkat.[51] Rata-rata awal MPOD±SE pada 39 pasien adalah 0,450±0,022 DU. Setelah asupan lutein, rata-rata MPOD±SE adalah 0,457±0,023 DU pada 3 bulan dan 0,470±0,023 DU pada 6 bulan. MPOD secara bertahap meningkat seiring waktu, namun tidak meningkat secara signifikan (p=0,0699).[24] Selanjutnya berdasarkan studi lain juga didapatkan hasil yang sama yaitu suplementasi lutein selama 2 tahun dapat meningkatkan skor MPOD, konsentrasi serum lutein, dan fungsi visual pada pasien AMD. Efek suplementasi lutein
dalam peningkatan skor MPOD dapat dilihat pada Gambar 5.
0.52
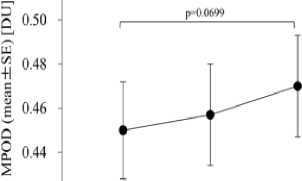
0.42
0.40
baseline 3 months 6 months
Gambar 5. Efek Suplementasi Lutein dalam
Peningkatan Skor MPOD.[52]
Efek Klinis Suplemen Lutein dalam Peningkatan Konsentrasi Lutein Plasma
Pada sebuah penelitian yang dilakukan oleh Miki Sawa et al, sebelum pemberian suplementasi, konsentrasi lutein plasma rata-rata ± SE pada 39 pasien adalah 59,5±6,9 ng/mL. Setelah diberikan suplementasi lutein, konsentrasi lutein plasma rata-rata ± SE adalah 137,4±13,4 ng/mL pada 3 bulan dan 170,3±23,9 ng/mL pada 6 bulan.[52] Selanjutnya pada penelitian yang dilakukan oleh Jean et al, konsentrasi lutein plasma meningkat dari 0,38 menjadi 0,58 mol/L untuk lutein, sedangkan tidak signifikan pada kelompok placebo. Kadar plasma lutein tetap meningkat selama bulan ke-6 setelah pemberian dan kemudian menurun ke nilai dasar di bulan ke-9 setelah penghentian pengobatan. Perbedaan antara kelompok perlakuan secara statistik signifikan pada bulan ke-3 dan bulan ke-6.[53] Rangkuman efek suplementasi lutein dapat dilihat pada Tabel 1.
Tabel 1. Efek Suplementasi Lutein dalam Peningkatan Lutein Plasma.[53]
|
Variabel |
L (n=60) |
Placebo (n=60) |
Between-Group Difference | |
|
Estimate (95% Cl) |
P Value | |||
|
Total Lutein, µmol/L | ||||
|
Baseline concentration |
(n = 59) |
(n = 59) | ||
|
Mean (SD) |
0.38 (0.15) |
0.37 (0.16) |
NA |
NA |
|
Mean change from baseline | ||||
|
M3 minus D0 |
(n = 59) |
(n = 57) | ||
|
Mean (SD) |
0.58 (0.41) |
-0.02 (0.09) |
0.609 (0.501 to 0.716) |
< .001 |
|
M6 minus D0 |
(n = 59) |
(n = 55) | ||
|
Mean (SD) |
0.59 (0.39) |
-0.04 (0.12) |
0.0634 (0.528 to 0.740) |
< .001 |
|
M9 minus D0 |
(n = 59) |
(n = 56) | ||
|
Mean (SD) |
0.02 (0.10) |
-0.02 (0.12) |
0.048 (0.008 to 0.088) |
.02 |
|
M12 minus D0 |
(n = 59) |
(n = 55) | ||
|
Mean (SD) |
0.01 (0.10) |
-0.02 (0.11) |
0.033 (-0.005 to 0.072) |
.09 |
Efek Klinis Lutein dalam Peningkatan Contrast Sensitivity dan Glare Sensitivity
Pasien dengan ketajaman visual normal dapat mengeluh adanya penglihatan yang buruk apabila memiliki contrast sensitivity dan glare sensitivity yang buruk.[54] Pada sebuah penelitian yang dilakukan oleh Naomichi et al, didapatkan hasil adanya perbaikan dalam MPOD, contrast sensitivity dan glare sensitivity pada pemberian 12 mg lutein selama 16 minggu. Pada penelitian ini didapatkan perbandingan antara kelompok placebo dan kelompok lutein. Pada minggu ke-16 pemberian, kelompok lutein
menunjukkan contrast sensitivity yang jauh lebih tinggi daripada kelompok placebo pada ukuran target 6,3 (p = 0,0012) dan 4,0 (p = 0,047). Pada minggu ke 16, kelompok dengan pemberian lutein menunjukkan glare sensitivity yang jauh lebih tinggi daripada kelompok placebo pada ukuran indeks dari 4,0◦ (p = 0,014) dan 2,5◦ (p = 0,020).[55] Perbandingan skor contrast sensitivity dan glare sensitivity pada kelompok placebo dan lutein dapat dilihat pada Gambar 6. Pemberian lutein dapat memberikan perbaikan dalam MPOD, yang nantinya dapat mengurangi efek buruk dari gangguan silau, hamburan cahaya, dan penyimpangan warna, sehingga meningkatkan contrast sensitivity dan glare sensitivity dan menghambat penurunan fungsi visual yang disebabkan oleh silau dari cahaya.[55]
Contrast sensitivity with significant difference between groups

{l S 16 (Weeks) 0 S 16 (Weeks)
Glare sensitivity with significant difference between groups
Figure. 3c Figure. 3d
^ 1.6® ⅞ 15®

0 8 16 (Weeks) 0 8 16 (Weeks)
Gambar 6. Contrast Sensitivity dan Glare Sensitivity pada kelompok placebo dan kelompok lutein.[55]
SIMPULAN
Lutein dari bunga marigold sebagai agen pencegahan AMD memiliki bioavailabilitas yang rendah, sehingga perlu diformulasikan dengan nanopartikel PolyLactic-co-Glycolic Acid (PLGA) yang dapat meningkatkan bioavailabilitas serta memperbaiki profil farmakokinetika dari lutein. Lutein dengan formulasi ini memiliki beberapa efek klinis pada AMD ini, yaitu meningkatkan konsentrasi plasma dari lutein, kemudian meningkatkan skor Macular
Pigment Density, dan meningkatan Contrast Sensitivity serta Glare Sensitivity dari mata. Dengan efek-efek tersebut, enkapsulasi nanopartikel PolyLactic-co-Glycolic Acid (PLGA) ekstrak etanol bunga Marigold dapat dimanfaatkan sebagai Agen Pencegah Age-Related Macular Degeneration (AMD).
SARAN
Kajian pustaka ini memerlukan pengembangan penelitian yang bisa dilakukan yaitu untuk mengetahui terkait dosis efektif, tingkat efikasi dalam mencegah, efek samping, serta hal lain terkait pemanfaatan lutein terenkapsulasi PLGA dalam pencegahan AMD.
DAFTAR PUSTAKA
-
1. Salimiaghdam N, Riazi-Esfahani M,
Fukuhara PS, Schneider K, Kenney MC. Age-related Macular
Degeneration (AMD): A Review on its Epidemiology and Risk Factors. Open Ophthalmol J 2020;13(1):90–9.
-
2. Mitchell P, Liew G, Gopinath B, Wong
TY. Age-related macular
degeneration. Lancet
2018;392(10153):1147–59.
-
3. García-Layana A, Cabrera-López F,
García-Arumí J, Arias-Barquet L, Ruiz-Moreno JM. Early and intermediate age-related macular degeneration: Update and clinical
review. Clin Interv Aging
2017;12:1579–87.
-
4. Al-Zamil WM, Yassin SA. Recent
developments in age-related macular degeneration: A review. Clin Interv Aging 2017;12:1313–30.
-
5. Heesterbeek TJ, Lorés-Motta L,
Hoyng CB, Lechanteur YTE, den Hollander AI. Risk factors for progression of age-related macular degeneration. Ophthalmic Physiol
Opt 2020;40(2):140–70.
-
6. Jonas JB, Cheung CMG, Panda-
Jonas S. Updates on the epidemiology of age-related macular degeneration. Asia-Pacific J
Ophthalmol 2017;6(6):493–7.
-
7. Xu X, Wu J, Yu X, Tang Y, Tang X,
Shentu X. Regional differences in the global burden of age-related macular degeneration. BMC Public Health 2020;20(1):1–9.
-
8. Tany CE, Sumual V, Saerang JSM.
PREVALENSI AGE RELATED MACULAR DEGENERATION DI POLIKLINIK MATA BLU RSUP Prof. Dr. R. D. KANDOU MANADO PERIODE JANUARI 2013 –
OKTOBER 2015. e-CliniC 2016;4(1).
-
9. Kristianto B, Andayani A, Agung A,
Putrawati M, Made N, Suryathi A, et al. Clinical characteristics and demographics figures of patients with age-related macular degeneration at a tertiary-level hospital in Denpasar , Bali. Intisari Sains Medis
2021;12(1):298–301.
-
10. United Nations Department of
Economic and Social Affairs Population Division. World Population Ageing 2019. 2019.
-
11. Ammar MJ, Hsu J, Chiang A, Ho AC,
Regillo CD. Age-related macular degeneration therapy: a review. Curr Opin Ophthalmol 2020;31(3):215–21.
-
12. Gil-Martínez M, Santos-Ramos P,
Fernández-Rodríguez M, Abraldes MJ, Rodríguez-Cid MJ, Santiago-Varela M, et al. Pharmacological Advances in the Treatment of Age-related Macular Degeneration. Curr Med Chem 2020;27(4):583–98.
-
13. Ricci F, Bandello F, Navarra P,
Staurenghi G, Stumpp M, Zarbin M. Neovascular age-related macular degeneration: Therapeutic
management and new-upcoming approaches. Int J Mol Sci 2020;21(21):1–40.
-
14. Ma L, Yan SF, Huang YM, Lu XR,
Qian F, Pang HL, et al. Effect of lutein and zeaxanthin on macular pigment and visual function in patients with early age-related macular
degeneration. Ophthalmology
2012;119(11):2290–7.
-
15. Lem DW, Davey PG, Gierhart DL,
Rosen RB. A systematic review of carotenoids in the management of age-related macular degeneration.
Antioxidants 2021;10(8):1–37.
-
16. Eisenhauer B, Natoli S, Liew G, Flood
VM. Lutein and zeaxanthin — Food sources, bioavailability and dietary variety in age‐related macular degeneration protection. Nutrients 2017;9(2).
-
17. Kurniawan JM, Yusuf MM, Heriyanto
-
H, Panintingjati Brotosudarmo TH. Telaah Literatur Potensi Lutein dari Bunga Marigold Lokal sebagai Suplemen Kesehatan. Media Penelit dan Pengemb Kesehat
2020;30(2):147–62.
-
18. Kurniawan JM, Yusuf MM, Azmi SS,
Salim KP, Utami Prihastyanti MN, Indrawati R, et al. Effect of drying treatments on the contents of lutein and zeaxanthin in orange- and yellow-cultivars of marigold flower and its application for lutein ester encapsulation. IOP Conf Ser Mater Sci Eng 2019;509(1).
-
19. Bhat I, Yathisha UG, Karunasagar I,
Mamatha BS. Nutraceutical approach to enhance lutein bioavailability via nanodelivery systems. Nutr Rev 2020;78(9):709–24.
-
20. Zylberberg C, Gaskill K, Pasley S,
Matosevic S. Engineering liposomal nanoparticles for targeted gene therapy. Gene Ther 2017;24(8):441– 52.
-
21. Xuefeng Chen, et al 2011.
Fenofibrate-Loaded Biodegradable Nanoparticles for the Treatment of Experimental Diabetic Retinopathy and Neovascular Age-Related
Macular Degeneration. Physiol Behav 2019;176(10):139–48.
-
22. Yani MV, Anjani IAW, Narayana IGS,
Wihandani DM, Supadmanaba IGP. Combination of Cisplatin-Withaferin Based on PEGylated Liposome Nanoparticles as Alternative Therapy for Ovarian Cancer. J Med Heal 2020;2(5):111–27.
-
23. Bhupendra Pradhan, Narendra
Kumar, Suman Saha AR, Columbia Institute of Pharmacy, Tekari, Raipur, Chhattisgarh I. LIPOSOME:
METHOD OF PREPARATION, ADVANTAGES, EVALUATION AND ITS APPLICATION Bhupendra Pradhan*, Narendra Kumar, Suman Saha, Amit Roy Columbia Institute of Pharmacy, Tekari, Raipur,
Chhattisgarh, India. J Appl Pharm Res 2015;3(2348).
-
24. Kaarniranta K, Uusitalo H, Blasiak J,
Felszeghy S, Kannan R, Kauppinen A, et al. Mechanisms of mitochondrial dysfunction and their impact on age-related macular degeneration. Prog Retin Eye Res 2020;79(October
2019):100858.
-
25. Kaarniranta K, Pawlowska E,
Szczepanska J, Jablkowska A, Blasiak J. Role of mitochondrial dna damage in ros-mediated
pathogenesis of age-related macular degeneration (Amd). Int J Mol Sci 2019;20(10).
-
26. Blasiak J. Senescence in the
pathogenesis of age-related macular degeneration. Cell Mol Life Sci 2020;77(5):789–805.
-
27. Šivel M, Kráčmar S, Fišera M, Klejdus
-
B, Kubáň V. Lutein content in marigold flower (Tagetes erecta L.) concentrates used for production of food supplements. Czech J Food Sci 2014;32(6):521–5.
-
28. Maleta HS, Indrawati R, Limantara L,
Brotosudarmo THP. Ragam Metode Ekstraksi Karotenoid dari Sumber Tumbuhan dalam Dekade Terakhir. J
Rekayasa Kim Lingkung
2018;13(1):40–50.
-
29. Bernstein PS, Li B, Vachali PP,
Gorusupudi A, Shyam R, Henriksen BS, et al. Lutein, zeaxanthin, and meso-zeaxanthin: The basic and
clinical science underlying
carotenoid-based nutritional
interventions against ocular disease. Prog Retin Eye Res 2016;50(October 2017):34–66.
-
30. Khalil M, Raila J, Ali M, Islam KMS,
Schenk R, Krause JP, et al. Stability and bioavailability of lutein ester
supplements from Tagetes flower
prepared under food processing conditions. J Funct Foods
2012;4(3):602–10.
-
31. Yao Y, Qiu Q hua, Wu XW, Cai Z
yuan, Xu S, Liang X qing. Lutein supplementation improves visual performance in Chinese drivers: 1-year randomized, double-blind, placebo-controlled study. Nutrition [Internet] 2013;29(7):958–64.
Available from:
https://www.sciencedirect.com/scien ce/article/pii/S0899900712004285
-
32. Vishwanathan R, Neuringer M,
Snodderly DM, Schalch W, Johnson EJ. Macular lutein and zeaxanthin are related to brain lutein and zeaxanthin in primates. Nutr Neurosci
2013;16(1):21–9.
-
33. Fatani AJ, Al-Rejaie SS,
Abuohashish HM, Al-Assaf A, Parmar MY, Ahmed MM. Lutein dietary supplementation attenuates
streptozotocin-induced testicular
damage and oxidative stress in diabetic rats. BMC Complement Altern Med 2015;15:204.
-
34. Addo EK, Gorusupudi A, Allman S,
Bernstein PS. The Lutein and Zeaxanthin in Pregnancy (L-ZIP) study—carotenoid supplementation during pregnancy: ocular and
systemic effects—study protocol for a randomized controlled trial. Trials 2021;22(1):1–13.
-
35. Beatty S, Chakravarthy U, Nolan JM,
Muldrew KA, Woodside J V, Denny F, et al. Secondary outcomes in a clinical trial of carotenoids with coantioxidants versus placebo in early age-related macular
degeneration. Ophthalmology
2013;120(3):600–6.
-
36. Roberts JE, Dennison J. The
Photobiology of Lutein and Zeaxanthin in the Eye. J Ophthalmol 2015;2015.
-
37. Liu H, Liu W, Zhou X, Long C, Kuang
-
X, Hu J, et al. Protective effect of
lutein on ARPE-19 cells upon H2O2-induced G2/M arrest. Mol Med Rep 2017;16(2):2069–74.
-
38. Kamoshita M, Toda E, Osada H,
Narimatsu T, Kobayashi S, Tsubota K, et al. Lutein acts via multiple antioxidant pathways in the photostressed retina. Sci Rep
2016;6:30226.
-
39. Kapoor DN, Kaur R, Sharma R,
Dhawan S. PLGA: a unique polymer for drug delivery. J Heal Educ 2015;6:41–58.
-
40. Ding D, Zhu Q. Recent advances of
PLGA micro/nanoparticles for the delivery of biomacromolecular therapeutics. Mater Sci Eng C [Internet] 2018;92:1041–60. Available from:
https://doi.org/10.1016/j.msec.2017.1 2.036
-
41. Gonzalez-pizarro R, Silva-abreu M,
Calpena AC, Egea A, Espina M, García ML. Development of Fluorometholone-loaded PLGA
Nanoparticles for Treatment of Inflammatory Disorders of Anterior and Posterior Segments of the Eye. Int J Pharm 2018;
-
42. Rozaria A, Pontillo N, Detsi A.
Nanoparticles for ocular drug delivery: modified and non-modified chitosan as a promising
biocompatible carrier. J Cell Biochem 2019;14:1889–909.
-
43. Judul H, Farmasi PS, Matematika F,
Ilmu DAN, Alam P, Indonesia UI. FORMULASI DAN KARAKTERISASI NANOPARTIKEL PLGA ( Poly Lactic-co-Glycolic Acid ) EKSTRAK KULIT MANGGIS ( Garcinia mangostana L .) DENGAN VARIASI PVA ( Polyvinyl Alcohol ) FORMULASI DAN KARAKTERISASI NANOPARTIKEL PLGA ( Poly Lactic-co-Glycolic Acid ) EKSTRAK. 2017;
-
44. Wilson LM, Tharmarajah S, Jia Y,
Semba RD, Schaumberg DA, Robinson KA. The Effect of Lutein / Zeaxanthin Intake on Human Macular Pigment Optical Density: A
Systematic Review and MetaAnalysis. J Cell Mol Med 2021;(4):2244–54.
-
45. Hashemi M, Shamshiri A, Saeedi M,
Tayebi L, Yazdian-robati R. Aptamer-conjugated PLGA nanoparticles for delivery and imaging of cancer therapeutic drugs. Arch Biochem Biophys 2020;691(July):108485.
-
46. Salama HA, Ghorab M, Mahmoud
AA, Hady MA. Research Article PLGA Nanoparticles as
Subconjunctival Injection for
Management of Glaucoma. 2017;(6).
-
47. Ghosh AK, Thapa R, Hariani HN,
Volyanyuk M, Ogle SD, Orloff KA, et al. Poly ( lactic-co-glycolic acid ) Nanoparticles Encapsulating the Prenylated Flavonoid , Xanthohumol , Protect Corneal Epithelial Cells from Dry Eye Disease-Associated
Oxidative Stress. J Cell Mol Med 2021;
-
48. Stringham JM, Stringham NT,
O’Brien KJ. Macular Carotenoid Supplementation Improves Visual Performance, Sleep Quality, and Adverse Physical Symptoms in Those with High Screen Time Exposure. J Chem Inf Model 2017;1– 13.
-
49. Khoo HE, Ng HS, Yap W sum, Ji H,
Goh H, Yim HS. Nutrients for Prevention of Macular Degeneration and Eye-Related Diseases. J Cell Mol Med 2019;1–16.
-
50. Obana A, Gohto Y, Nakazawa R,
Moriyama T, Gellermann W, Bernstein PS. Effect of an antioxidant supplement containing high dose lutein and zeaxanthin on macular pigment and skin carotenoid levels. J Pineal Res 2020;1–12.
-
51. Feng L, Nie K, Jiang H, Fan W.
Effects of lutein supplementation in agerelated macular degeneration. PLoS One 2019;14(12):1–13.
-
52. Sawa M, Shunto T, Issei N,
Yokoyama A, Shigeta R. Effects of Lutein Supplementation in Japanese Patients with Unilateral Age-Related Macular Degeneration: The Sakai Lutein Study. J Heal Educ 2020;1–11.
-
53. Sánchez-lópez E, Egea MA, Davis
BM, Guo L, Espina M, Silva AM, et al. Memantine-Loaded PEGylated
Biodegradable Nanoparticles for the Treatment of Glaucoma.
2017;1701808:1–12.
-
54. Huang Y mu, Dou H liang, Huang F
fei, Xu X rong, Zou Z yong, Lin X ming. Effect of Supplemental Lutein and Zeaxanthin on Serum , Macular Pigmentation , and Visual
Performance in Patients with Early Age-Related Macular Degeneration. J Heal Educ 2015;2015.
-
55. Machida N, Kosehira M, Kitaichi N.
nutrients Clinical E ff ects of Dietary Supplementation of Lutein with High Bio-Accessibility on Macular Pigment Optical Density and Contrast Sensitivity: A. J Heal Educ 2020;1-12.
89
Discussion and feedback