POTENSI KOMBINASI RUXOLITINIB DENGAN INHIBITOR PI3K/mTOR BEZ235 TERENKAPSULASI NANOKRISTAL KALSIUM KARBONAT PADA PENDERITA POLISITEMIA VERA
on
ARTIKEL TINJAUAN PUSTAKA
Essence of Scientific Medical Journal (2023), Volume 21, Number 1:64-72
P-ISSN.1979-0147, E-ISSN. 2655-6472

TINJAUAN PUSTAKA
POTENSI KOMBINASI RUXOLITINIB DENGAN INHIBITOR PI3K/mTOR BEZ235 TERENKAPSULASI NANOKRISTAL KALSIUM KARBONAT PADA PENDERITA POLISITEMIA VERA
I G Mahapraja Divasta,1 I Wayan Tegar Raharja Ariawan,1 Putu Ayu Pradnya Gita Maharani1
ABSTRAK
Pendahuluan: Polisitemia vera (PV) merupakan kondisi di mana janus kinase 2 (JAK2) pada sel hematopoietik mengalami hiperaktivasi sehingga terjadi fosforilasi signal transducer and activator of transcription 5 (STAT5) tanpa adanya ligan yang berikatan pada reseptor. Kondisi tersebut menyebabkan terjadinya produksi sel darah yang berlebihan, terutama eritrosit. Hiperaktivasi tersebut disebabkan oleh adanya mutasi V617F pada JAK2 yang mengganggu interaksi domain jak homology 1 (JH1) dengan jak homology 2 (JH2). Polisitemia vera dapat menyebabkan komplikasi berupa thrombosis, hipertensi, dan splenomegaly. Jika berkepanjangan, polisitemia vera dapat berkembang menjadi mielofibrosis. Selain itu, hiperaktivasi JAK2 juga menyebabkan meningkatnya aktivitas phosphatidylinositol 3-kinase (PI3K) yang juga berujung pada fosforilasi STAT5.
Pembahasan: Saat ini, terapi polisitemia vera yang banyak digunakan adalah ruxolitinib. Namun, ruxolitinib memiliki kekurangan, yaitu tidak dapat menghambat fosforilasi STAT5 secara sempurna dan dapat meningkatkan risiko reaktivasi herpes zoster yang dapat dihambat oleh inhibitor PI3K. Oleh karena itu, diperlukan suatu terapi alternatif, yaitu kombinasi ruxolitinib dengan PI3K inhibitor, salah satunya adalah dengan BEZ235. BEZ235 merupakan inhibitor PI3K/Mammalian Target of Rapamycin (mTOR) yang berpotensi untuk dikombinasikan dengan ruxolitinib. BEZ235 mampu mencegah inhibisi fosforilasi STAT5 yang tidak sempurna. Akan tetapi, BEZ235 memiliki
bioavailibilitas yang rendah sehingga perlu dilakukan upaya enkapsulasi, salah satunya dengan menggunakan nanokristal CaCO3. Secara keseluruhan, kombinasi ruxolitinib dengan BEZ235
menunjukkan hasil yang lebih baik dibandingkan dengan pemberian obat tanpa kombinasi.
Simpulan: Oleh karena itu, penulis ingin mengkaji lebih dalam mengenai potensi BEZ235
terenkapsulasi nanokristal CaCO3 yang dikombinasikan dengan ruxolitinib terhadap potensinya sebagai terapi polisitemia vera.
Kata Kunci: BEZ235, nanokristal CaCO3, PI3K/Akt/mTOR pathway, polisitemia vera, ruxolitinib
ABSTRACT
Introduction: Polycythemia vera (PV) is a condition in which janus kinase 2 (JAK2) in hematopoietic cells experiences hyperactivation resulting in phosphorylation of signal transducer and activator of transcription 5 (STAT5) in the absence of a ligand binding to the receptor. This condition causes excessive production of blood cells, especially erythrocytes. The hyperactivation was caused by a V617F mutation in JAK2 which disrupted the interaction of the jak homology 1 (JH1) and jak homology 2 (JH2) domains. Polycythemia vera can cause complications such as thrombosis, hypertension, and splenomegaly. If prolonged, polycythemia vera can develop into myelofibrosis. In addition, JAK2 hyperactivation also causes an increase in phosphatidylinositol 3-kinase (PI3K) activity which also leads to STAT5 phosphorylation.
1Fakultas Kedokteran, Universitas Udayana, Bali
Discussion: Currently, the most widely used therapy for polycythemia vera is ruxolitinib. However, ruxolitinib has drawbacks, namely it cannot completely inhibit STAT5 phosphorylation and can increase the risk of reactivation of herpes zoster which can be inhibited by PI3K inhibitors. Therefore, an alternative therapy is needed, namely a combination of ruxolitinib with PI3K inhibitors, one of which is BEZ235. BEZ235 is a PI3K/Mammalian Target of Rapamycin (mTOR) inhibitor which has the potential to be combined with ruxolitinib. BEZ235 was able to prevent incomplete inhibition of STAT5 phosphorylation. However, BEZ235 has low bioavailability, so encapsulation efforts need to be made, one of which is by using CaCO3 nanocrystals. Overall, the combination of ruxolitinib with BEZ235 showed better results than the administration of the drug without the combination.
Conclusion: Therefore, the authors want to examine more deeply the potential of BEZ235 encapsulated CaCO3 nanocrystals combined with ruxolitinib for its potential as a therapy for polycythemia vera.
Keywords: BEZ235, CaCO3 nanocrystals, PI3K/Akt/mTOR pathway, polycythemia vera, ruxolitinib.
PENDAHULUAN
Polisitemia vera (PV) merupakan penyakit hematologis dengan angka kesakitan yang cukup tinggi. Studi menunjukkan bahwa PV terjadi pada 2,5 – 30,3 per 100.000 individu di dunia [1–4]. Suatu riset juga menemukan PV dominan terjadi pada kelompok umur 55 – 65 tahun dengan persentase sebesar 46,7%, tetapi tidak menutup kemungkinan juga individu dengan umur 30 – 60 tahun
mengalaminya dengan kemungkinan sebesar 18,3% [4,5]. Selama lebih dari 125 tahun, PV menjadi salah satu permasalahan dunia kesehatan dikarenakan belum terdapat terapi yang memberikan hasil yang memuaskan [3]. Di Indonesia sendiri, tercatat penderita PV mencapai 1,9 per 100.000 populasi dalam setahun. Bahkan pada periode 2015 – 2019 penderita PV di Indonesia menyentuh angka 313 kasus [6]. Sampai saat ini PV tergolong penyakit yang memiliki mortalitas tinggi yaitu mencapai 90% pada penderita dengan kormobiditas yang didominasi pasien lansia [5].
Polisitemia vera tergolong di dalam salah satu penyakit myeloproliferative neoplasms (MPNs) yang memiliki fenotipe negatif BCR-ABL1. Hal ini menunjukkan PV terjadi dengan adanya aktivitas abnormal multiplikasi sel punca hematopoietik sehingga menyebabkan produksi dan akumulasi sel-sel darah yang berlebihan [7]. Akibatnya, penderita dapat mengalami penyakit terkait kardiovaskular yang salah satunya berupa trombosis. Hal itu dipicu juga oleh eritrositosis yang menyebabkan kondisi hiperviskositas darah. Gejala tahap akhir secara progresif akan dapat mengakibatkan splenomegali, Acute Myeloid Leukimia (AML), dan myelofibrosis. Timbulnya komplikasi tersebut mengakibatkan usia harapan hidup pasien menjadi lebih singkat [5,8–10] .
Pada 95% populasi PV, terdapat adanya mutasi pada JAK2 ekson 12 atau JAK2V617F. Janus Kinase 2 (JAK2) merupakan salah satu protein yang berperan penting sebagai aktivasi jalur sinyal unuk memicu aktivitas Signal Transducers and Activators of Transcription (STAT) yang berperan dalam proliferasi, pertumbuhan dan diferensiasi sel [11]. Jalur aktivasi JAK2/STAT5 memiliki peranan penting dalam patogenesis polisitemia vera karena jalur tersebut berperan dalam perkembangan abnormal sel-sel
hematopoietik [12]. Selain pada STAT5 pathway, ternyata mutasi JAK2V617F juga dapat mengaktivasi jalur lain, yaitu PI3K/Akt/m-TOR pathway. Dimana pada
protein terakhir, mTOR, dapat melakukan fosforilisasi residu tertentu yang
mengakibatkan reaktivasi pada jalur STAT5 [13]. Oleh karenanya, diperlukan suatu agen inhibitor yang dapat bekerja pada daerah JAK2
dan juga PI3K pathway untuk mengurangi tingkat keparahan dari polisitemia vera.
Salah satu terapi yang digunakan adalah ruxolitinib. Ruxolitinib merupakan inhibitor non-selektif JAK1/JAK2 yang terbukti dapat mengurangi gejala klinis dari polisitemia vera. Terapi dengan ruxolitinib juga dianjurkan kepada pasien yang tidak dapat diberikan hydroxyurea (HU) yang merupakan sejenis obat PV dengan efek samping yang lebih berat [3,14]. Namun setelah diteliti lebih lanjut, ruxolitinib ternyata tidak dapat melakukan inhibisi secara maksimal dikarenakan hanya bekerja untuk mengurangi fosforilasi residu Y694 dan Y699 pada STAT [15]. Oleh karenanya dibutuhkan suatu zat pendamping untuk memaksimalkan kerja ruxolitinib.
Inhibitor PI3K/mTOR ditemukan dapat membantu kerja inhibisi fosforilisasi residu lain yang mempengaruhi kerja STAT, yaitu residu S731 dan S193 yang terdapat pada STAT5 subunit b [15]. Kombinasi antara ruxolitinib dengan inhibitor PI3K/mTOR juga telah ditemukan memiliki efek yang sinergi [16]. Salah satu zat lain yang memiliki efek inhibitor
PI3K/mTOR adalah BEZ235. Saat ini, obat tersebut digunakan untuk terapi limfoma,
Alzheimer, dan hypopharyngeal squamous cell carcinoma (HSCC).[17–19] Meskipun memiliki keunggulan di dalam efek sinergisnya, ternyata ruxolitinib dan juga BEZ235 tidak memiliki solubilitas dalam air yang baik. Selain dari itu, pada saat diberikan secara oral, bioavailibilitas dalam tubuh juga sangat rendah [20] .
Enkapsulasi menjadi salah satu metode yang paling tepat untuk meningkatkan solubilitas dan bioavailibitas suatu zat [21]. Nanokristal kalsium karbonat (CaCO3) menjadi salah satu pilihan bahan yang tepat dikarenakan sifatnya yang kompatibel dan produk sampingan Ca2+ dan CO3- aman dalam tubuh. Kalsium karbonat (CaCO3) juga memiliki sifat biodegradabilitas rendah, struktur stabil, dan pori pelekatan obat yang baik sehingga sangat tepat dalam meningkatkan solubilitas dan bioavailibitas suatu obat [22]. Oleh karena itu, penulis tertarik untuk mengkaji lebih dalam hubungan dan pengaruh dari kombinasi obat ruxolitinib dan BEZ235 yang terenkapsulasi nanokristal CaCO3 kepada penderita Polisitemia Vera (PV) secara lebih dalam melalui tulisan ini ini.
MATERIAL DAN METODE
Penulisan dilakukan dengan metode kajian pustaka. Penulis menggunakan kata kunci BEZ235, nanokristal CaCO3,
PI3K/Akt/mTOR pathway, polisitemia vera, ruxolitinib dengan logika Boolean “AND” dalam pencarian jurnal ilmiah internasional untuk mengerucutkan hasil pencarian. Pencarian 53 jurnal dilakukan pada laman database PubMed, Sciencedirect Elsevier, NCBI,
Google Scholar, dan PLOS One dengan batasan tahun publikasi tidak lebih dari 10 tahun. Informasi yang didapatkan disusun sesuai dengan topik masalah yang dibahas, disertai kriteria inklusi dan eksklusi.
PEMBAHASAN
Polisitemia Vera
Polisitemia vera adalah gangguan bersifat kronis klonal BCR-ABL1-negatif myeloproliferative neoplasms (MPNs) yang terkait dengan mutasi sel induk hematopoietik somatik yang mengarah pada aktivasi pensinyalan JAK2-STAT5 yang berlebihan tanpa adanya ligan yang berikatan dengan reseptor.[23] Polisitemia vera menyebabkan produksi yang berlebihan pada semua sel darah, terutama eritrosit.[24] Produksi eritrosit yang berlebihan dapat mengarah ke risiko terjadinya thrombosis.[24] Polisitemia vera dapat berkembang menjadi myelofibrosis (MF), yaitu suatu kondisi di mana jaringan sumsum tulang berubah menjadi jaringan fibrosa/scar tissue.[24] Penelitian telah menunjukkan bahwa mutasi V617F pada gen JAK2 menyebabkan hiperaktivasi dari jalur pensinyalan dan transkripsi janus kinase (JAK2-STAT5), yang mengatur pertumbuhan dan diferensiasi sel.[25]
Gejala dari polisitemia vera bervariasi dan tidak selalu menunjukkan kelainan walaupun telah diketahui melalui tes laboratorium. Gejala awal yang sering terjadi adalah sakit kepala, mudah lelah, tekanan darah tinggi, hingga pruritus (gatal). Pada penderita polisitemia vera, sekitar 30% gejala ditandai dengan splenomegali, yaitu pembesaran limpa akibat produksi eritrosit yang berlebihan.[24]
Saat ini, penatalaksanaan dari polisitemia vera dapat dikatakan belum optimal. Flebotomi, merupakan pengobatan lini pertama dari polisitemia vera yang harus dilakukan secara rutin berulang dengan cara mengeluarkan darah melalui vena yang memiliki tujuan untuk mempertahankan hematokrit ≤42% pada perempuan, dan ≤47% pada pria.[24,26] Tetapi, terapi flebotomi hanya dapat mempertahankan kondisi hematokrit sementara sehingga harus dilakukan secara rutin yang dapat membuat pasien merasa tidak nyaman. Ruxolitinib merupakan pengobatan polisitemia vera dari segi farmakologis yang banyak digunakan. Ruxolitinib bekerja dengan cara menghambat JAK2 sehingga aktivasi tidak dapat terjadi serta menghambat fosforilasi STAT5[27]. Namun, ruxolitinib tidak dapat sepenuhnya menghambat STAT5 dan dapat memicu reaktivasi herpes virus yang dorman pada beberapa kasus sehingga dapat menjadi pertimbangan untuk menemukan alternatif maupun kombinasi yang sinergis.[28]
Patofisiologis dan Patogenesis Polisitemia
Peran aktivitas JAK2 V617F dalam progresivitas polisitemia vera
Protein JAK2 merupakan komponen yang penting dalam perjalanan penyakit penderita polisitemia vera. Sekitar 95% pasien polisitemia vera memiliki protein JAK2 dengan mutasi V617F pada sel hematopoietiknya.[24] Mutasi V617F adalah mutasi yang terjadi pada ekson ke-14 yang membuat berubahnya valin menjadi fenilalanin pada urutan ke-617.[29] Mutan JAK2 V617F berperan dalam progresivitas polisitemia melalui hiperaktivasi jalur JAK2/STAT.
JAK2 memiliki struktur-struktur yang berperan dalam jalur JAK2/STAT. Struktur tersebut antara lain: domain FERM (4.1 Protein, Ezrin, Radixin, Moesin), domain SH2 (Src homology), domain pseudokinase JH2 (JAK Homology 2), dan domain kinase C-terminal tirosin JH1. [30] Domain pseudokinase (JH2) ini adalah struktur yang bertanggung jawab atas terpicunya fosforilasi STAT. Pada keadaan normal tanpa adanya ligan yang berikatan pada reseptor, JH2 berada dalam keadaan yang menginhibisi JH1 untuk memfosforilasi STAT sehingga tidak terpicunya diferensiasi sel hematopoietik.[31]
Pada mutan JAK2 V617F, domain pseudokinase tersebut kehilangan kemampuan inhibisinya. Mutasi V617F terjadi pada domain pseudokinase (JH2) yang mempengaruhi interaksi antara JH2 dengan JH1 melalui 2 cara.[30] Pertama, struktur alpha-C dari domain JH2 mengalami kekakuan akibat mutasi V617F sehingga kehilangan kemampuan untuk menjaga JH1 dalam kondisi inaktifnya. Kedua, mutasi V617F menghilangkan kemampuan JH2 untuk memfosforilasi S523 dan Y570 yang berakibat pada terganggunya interaksi JH2 dengan JH1.[25,30,32]
Hiperaktivasi oleh JAK2 V617F juga disebabkan oleh perubahan konformasi dari JH2 αC karena terbentuknya tumpukan cincin aromatik pada domain JH2 αC. Tumpukan ini disebabkan oleh triad F-F-F (F595, F594, dan F617).[33] Selain perubahan konformasi, mutasi V617F juga menyebabkan hiperaktivasi dengan cara mengganggu mekanisme triad F-F-V (F537, F595, V617). Interaksi antara F595 dengan F617 akan membebaskan residu F537. Terbebasnya residu F537 bersama-sama dengan berubahnya struktur SH2-JH2 akan membuat domain kinase JH1 menjadi teraktivasi yang akan berlanjut menjadi hiperaktivasi dan memfosforilasi STAT5.[33,34]
Peran aktivitas PI3K/Akt/mTOR akibat hiperaktivasi oleh JAK2 V617F dalam progresivitas polisitemia vera
Hiperaktivasi oleh JAK2 V617F tidak hanya mengaktivasi jalur JAK2/STAT5, tetapi
juga jalur-jalur lain seperti PI3K/Akt/mTOR yang berperan penting dalam diferensiasi eritrosit.[35] PI3K merupakan protein kinase yang memegang peranan penting dalam jalur persinyalan yang berasal dari reseptor membran. Saat teraktivasi, subunit regulator dari PI3K akan menuju reseptor, sedangkan subunit katalitik akan mengkatalisis pembentukan phosphatidylinositol 3,4,5-triphosphate (PIP3). Pembentukan PIP3 ini selanjutnya akan merekrut Akt (protein kinase B) ke membran sel.[13] Fosforilasi Akt pada membran sel selanjutnya akan mengaktivasi mTOR. mTOR memiliki dua subunit, yaitu mTORC1 dan mTORC2. mTORC1 yang berperan dalam regulasi translasi memiliki Raptor dan Pras40, sedangkan mTORC2 yang berperan dalam fosforilasi Akt pada residu S473 memiliki Rictor, Protor, dan SIN-1. Aktivasi mTOR tersebut akan meregulasi fosforilasi STAT5.[35]
Signal transducer and activator of transcription 5 (STAT5) merupakan bagian dari jalur JAK2/STAT5 yang sangat penting terhadap proliferasi, diferensiasi, dan keberlangsungan hidup sel.[36] Terdapat dua tipe STAT5, yaitu STAT5a dan STAT5b. Masing-masing tipe STAT tersebut memiliki residu yang jika difosforilasi akan mengaktivasi STAT tersebut. Residu tersebut adalah Y694 untuk STAT5a serta residu Y699, S193, dan S731 untuk STAT5b. Residu-residu ini menjadi target dalam penanganan polisitemia vera.[36,37]
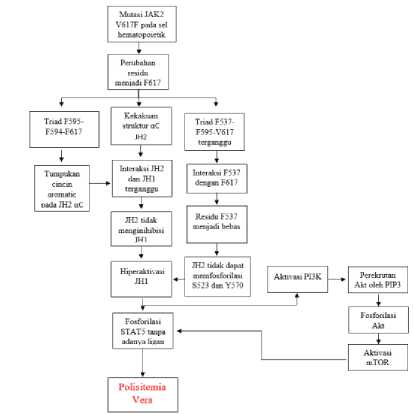
Gambar 1. Patogenesis Polisitemia Vera[37,38]
Penggunaan PI3K/Akt/mTOR Inhibitor dan JAK2 Inhibitor dalam Menginhibisi Fosforilasi STAT5
Penggunaan inhibitor JAK2, ruxolitinib, merupakan salah satu terapi polisitemia vera. Penelitian yang dilakukan oleh Bartalucci et al. (2017) menunjukkan bahwa ruxolitinib mampu mengurangi fosforilasi dari residu Y694 pada STAT5a dan residu Y699 pada STAT5b. Akan
tetapi, ruxolitinib tidak mampu mengurangi fosforilasi dari residu S731 dan S193 milik STAT5b yang merupakan residu penting dalam aktivasi STAT5b sehingga terjadi inhibisi STAT5b yang tidak sempurna.[37] Inhibisi yang tidak sempurna ini akan menyebabkan terjadinya resistensi ruxolitinib yang menyebabkan sel hematopoietik dengan mutasi JAK2 V617F tetap dapat mengalami hiperaktivasi meskipun telah diberikan ruxolitinib.
Penelitian yang sama juga meneliti mengenai efek dari PI3K/mTOR inhibitor terhadap fosforilasi residu STAT5. BKM120, salah satu PI3K inhibitor, mampu mengurangi fosforilasi dari residu S731 dan S193 milik STAT5b yang sebelumnya tidak mampu diinhibisi oleh ruxolitinib. Akan tetapi, PI3K/mTOR inhibitor tidak mampu mengurangi fosforilasi residu Y694 milik STAT5a. Hal tersebut terjadi melalui mekanisme penurunan jumlah CIP2A (cancerous inhibitor of PP2A) sehingga meningkatkan jumlah PP2A.[37] CIP2A merupakan enzim yang meregulasi PP2A (protein phospatase 2A) agar tetap inaktif. PP2A adalah enzim yang berperan dalam mekanisme pengurangan fosforilasi residu S731 dan S139 dari STAT5b. [37] Dalam hal ini, ruxolitinib diketahui tidak mampu menurunkan jumlah CIP2A. Selain itu, penelitian yang dilakukan oleh Celik (2023) mengenai efek terapi kombinasi ruxolitinib dengan MK-2206, salah satu PI3K/Akt inhibitor, pada sel kanker payudara menunjukkan hasil yang serupa. Sel yang diterapi oleh kombinasi tersebut mengalami penurunan aktivitas JAK2 serta hilangnya ekspresi STAT5.[16]
Di lain sisi, reaktivasi herpes virus yang merupakan salah satu efek dari ruxolitinib dapat dihambat dengan PI3K inhibitor.[39] Hal tersebut dikarenakan saat virus dalam fase dorman, jalur PI3K/Akt teraktivasi untuk menghindari apoptosis pada sel yang terinfeksi virus. Selain itu, virus yang berhasil direaktivasi juga akan semakin meningkatkan aktivitas PI3K/Akt, terutama saat replikasi.[28] Melihat dari kekurangan dan kelebihan dari JAK2 inhibitor dan PI3K/mTOR inhibitor yang saling melengkapi, terapi polisitemia vera menggunakan kombinasi kedua inhibitor tersebut layak dipertimbangkan. BEZ235 merupakan salah satu inhibitor ganda PI3K/mTOR (bisa menghambat PI3K dan mTOR) yang berpotensi untuk digunakan sebagai terapi kombinasi dengan ruxolitinib pada polisitemia vera. BEZ235 saat ini digunakan sebagai terapi pada limfoma, alzheimer, hingga hypopharyngeal squamous cell carcinoma (HSCC).[17–19,40]
Mekanisme Konstruksi dan Administrasi Kombinasi Ruxolitinib dengan BEZ235
Terenkapsulasi Nanopartikel Kalsium Karbonat
Enkapsulasi nanopartikel merupakan salah satu pendekatan dalam sistem penghantaran obat di dalam tubuh karena dapat memberikan beberapa keuntungan seperti peningkatan efektivitas serta bioavailibilitas. Nanopartikel CaCO3 merupakan salah satu metode dalam penghantaran obat yang memanfaatkan kristal CaCO3 yang memiliki morfologi berpori-pori.[41,42] Nanokristal CaCO3 digunakan sebagai metode penghantaran obat karena memiliki keuntungan berupa tingkat biodegradabilitas yang rendah, struktur yang stabil, permukaan berpori sebagai tempat pelekatan obat, hingga luas permukaan yang spesifik. Selain itu, material yang digunakan, yaitu CaCO3, memiliki kesamaan dengan jaringan pada tubuh sehingga memiliki biokompatibilitas yang tinggi. Nanokristal CaCO3 juga aman pada tubuh karena produk sampingannya berupa ion Ca2+ dan CO3-yang merupakan ion normal pada darah.[43]
Pembuatan kombinasi ini dimulai dengan sintesis nanokristal CaCO3 menggunakan metode spraying atau atomisasi. Langkah pertama yang dilakukan adalah mencampurkan larutan natrium bikarbonat (NaHCO3) dan kalsium klorida (CaCl2) dengan perbandingan masing-masing 2:1. Untuk memudahkan dalam mengontrol laju aliran, kedua larutan tersebut dicampurkan menggunakan dua pompa. Selanjutnya, campuran tersebut memasuki proses pengatoman menggunakan aliran udara bersuhu 140°C yang menyebabkan penguapan yang cepat sehingga didapatkan serbuk CaCO3 dan produk sampingan berupa natrium klorida (NaCl). Proses enkapsulasi obat dengan nanokristal CaCO3 dilakukan dengan pertama-tama melarutkan ruxolitinib dan BEZ235 pada larutan DMSO yang kemudian disimpan pada suhu -80 °C. Selanjutnya, larutan tersebut dicampurkan dengan larutan yang berisi nanokristal CaCO3. Campuran larutan tersebut diaduk selama 24 jam dalam suhu ruangan. Setelah itu, campuran disentrifugasi dan didapatkan kombinasi ruxolitinib dengan BEZ235 terenkapsulasi nanokristal CaCO3.[40] Dalam 2 jam setelah pemberian BEZ235 terenkapsulasi nanokristal CaCO3 pada limfoma sel T, konsentrasi intraseluler BEZ235 mencapai 0.67 nmol/106 sel. Hal ini sangat berbeda dengan BEZ235 tanpa terenkapsulasi, yaitu hanya mencapai konsentrasi intraseluler sebesar 0.23 nmol/106 sel dalam 24 jam setelah pemberian obat.[40]
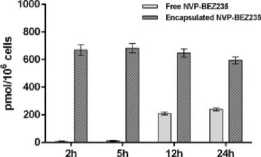
Gambar 2. Perbandingan Konsentrasi Intraselular BEZ235 Terenkapsulasi CaCO3 dengan BEZ235 Bebas[40]
Pemberian kombinasi modalitas ini dapat dilakukan dengan berbagai cara, salah satunya adalah jalur pemberian per oral. Pemberian per oral memiliki keunggulan dalam kenyamanan pemberian, tidak menyakitkan, dan biaya yang diperlukan sangat minimal. Sistem penghantaran obat menggunakan nanokristal CaCO3 secara per oral mengakibatkan modalitas dapat diserap melalui jalur intraselular melalui enterosit. Penggunaan nanokristal CaCO3 dapat membuat modalitas menghindari efluks P-Glikoprotein serta mencegah modalitas mengalami first pass metabolism di hati.[44]
Efek Klinis Kombinasi Ruxolitinib dengan BEZ235 Terenkapsulasi Nanopartikel Kalsium Karbonat
BEZ235 merupakan inhibitor ganda PI3K/mTOR yang sangat berpotensial untuk dijadikan terapi polisitemia vera. Akan tetapi, BEZ235 memiliki bioavailibilitas dan kelarutan dalam air yang rendah sehingga perlu dilakukan enkapsulasi.[20] Pada sel hematopoietik yang mengalami hiperaktivasi karena mutasi JAK2 V617F, aktivitas jalur JAK2/STAT5 dan PI3K/Akt/mTOR mengalami peningkatan. Penggunaan PI3K/mTOR inhibitor dapat menghambat fosforilasi STAT5b, sedangkan ruxolitinib menghambat fosforilasi STAT5a.
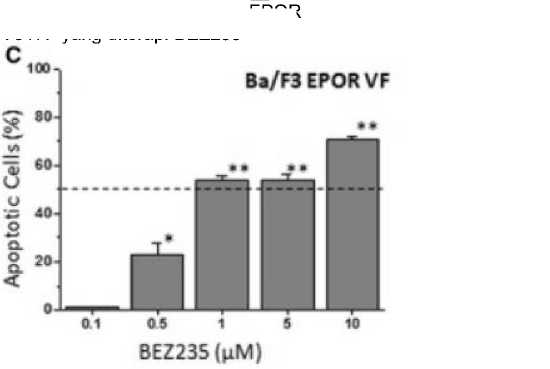
Penelitian yang dilakukan oleh Bartalucci et al. (2017) menunjukkan bahwa BEZ235 secara drastis dapat menurunkan konsentrasi CIP2A yang merupakan mekanisme untuk mengurangi fosforilasi residu S731 dan S193 milik STAT5b.[37] Selanjutnya, kombinasi ruxolitinib dengan BEZ235 memiliki sinergisme pada sel hematopoietik dengan mutasi JAK2 V617F. Kombinasi ruxolitinib dengan BEZ235 dengan dosis masing-masing 80nM dan 30nM dapat mencapai tingkat inhibisi pada sel Ba/F3-EPOR V617F sebesar 50% dibandingkan dengan pemberian obat secara individu.[38] Selain itu, kombinasi ruxolitinib dengan BEZ235 mampu menginhibisi pembentukan koloni GFU-GM dan BFU-E oleh sel CD34+. Hal ini berkaitan dengan kemampuan BEZ235 untuk menginduksi apoptosis pada sel CD34+.[38,45] Fosforilasi mTOR dan STAT5, bagian dari jalur PI3K/mTOR yang dihambat oleh
BEZ235, mengalami tingkat inhibisi yang lebih tinggi jika diterapi dengan kombinasi ruxolitinib dan BEZ235 dibandingkan dengan BEZ235 secara individu.[38]
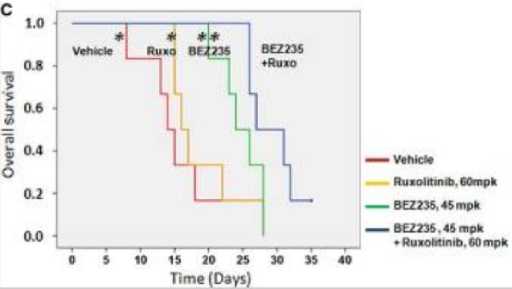
Selain menginhibisi beberapa sel maupun jalur terkait polisitemia vera, kombinasi ruxolitinib dengan BEZ235 mampu meningkatkan tingkat kelangsungan hidup. Tikus dengan mutasi JAK2 V617F yang diterapi dengan kombinasi ruxolitinib 60mpk dan BEZ235 45mpk memiliki tingkat kelangsungan hidup yang lebih tinggi dibandingkan dengan pemberian obat secara individu.[38] Di lain sisi, kombinasi ruxolitinib dengan BEZ235 dapat secara drastis mengurangi splenomegali dibandingkan dengan pemberian obat secara individu. Tikus yang diterapi dengan obat kombinasi selama 7 hari memiliki mean spleen index sebesar 1.4, sedangkan yang diterapi dengan obat secara individu memiliki mean spleen index sebesar 3.5 untuk BEZ235 dan 3.4 untuk ruxolitinib. Hal tersebut menunjukkan bahwa kombinasi ruxolitinib dengan BEZ235 sangat berpotensi untuk dijadikan terapi polisitemia vera.[38]
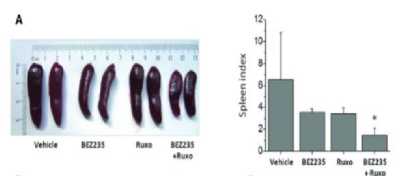
Gambar 3. Perbandingan Pemberian Obat secara Individu dan Kombinasi terhadap Splenomegali[38]
KESIMPULAN
Berdasarkan kajian literatur yang telah dipaparkan oleh penulis, dapat diketahui potensi dari kombinasi ruxolitinib dengan BEZ235 terenkapsulasi nanopartikel CaCO3 yang dapat meningkatkan efektivitas terapi penderita PV. Kombinasi antara ruxolitinib dengan BEZ235 dapat bekerja dengan sinergis dikarenakan ruxolitinib memiliki potensi kerja yang efektif dengan PI3K/mTOR inhibitor. Adanya ruxolitinib yang bekerja pada jalur STAT5a dan BEZ235 pada jlaur STAT5b memiliki potensi untuk memaksimalkan kerja obat dalam pengobatan PV. Kombinasi ini juga terbukti dapat menurunkan splenomegali dibandingkan secara mandiri. Sebagai tambahan, adanya teknik enkapsulasi nanopartikel CaCO3 terhadap kombinasi ruxolitinib dan BEZ235 dapat meningkatkan solubilitas dan juga bioavailibitas dari obat karena bahan kalsium karbonat (CaCO3) yang memiliki biodegradabilits yang stabil menjadi suatu keuntungan utama sehingga dapat diberikan secara oral. Oleh karena itu, enkapsulasi nanopartikel kombinasi ruxolitinib dan BEZ235 dengan kalsium karbonat
(CaCO3) memiliki potensi besar sebagai terapi penderita PV.
SARAN
Penelitian lebih lanjut dibutuhkan di dalam mengkaji beberapa faktor terkait dengan kemanan dan juga dosis yang tepat terhadap individu yang berbeda-beda. Pengujian toksisitas secara spesifik kombinasi BEZ235 dan ruxolitinib masih diperlukan meskipun terbukti sinergis. Selain itu, penghitungan yang tepat terhadap dosis obat masih diperlukan dalam penyesuaiannya dengan umur, jenis kelamin, ataupun kondisi tertentu dari pasien untuk mencapai therapeutic dose yang tepat terhadap pasien.
DAFTAR PUSTAKA
-
1. Titmarsh GJ, Duncombe AS, Mcmullin MF, O’Rorke M, Mesa R, De Vocht F, et al. How common are myeloproliferative neoplasms? A systematic review and meta-analysis. Am J Hematol 2014;89(6):581–7.
-
2. Moulard O, Mehta J, Fryzek J, Olivares R, Iqbal U, Mesa RA. Epidemiology of myelofibrosis, essential thrombocythemia,
and polycythemia vera in the European
Union. Eur J Haematol 2014;92(4):289–97.
-
3. Spivak JL. Polycythemia Vera. Curr Treat Options Oncol 2018;19(2).
-
4. Barbui T, Thiele J, Gisslinger H, Kvasnicka HM, Vannucchi AM, Guglielmelli P, et al. The 2016 WHO classification and diagnostic criteria for myeloproliferative neoplasms: document summary and in-depth discussion. Blood Cancer J 2018;8(2):15.
-
5. Dores GM, Curtis RE, Linet MS, Morton LM. Cause-specific mortality following
polycythemia vera, essential
thrombocythemia, and primary myelofibrosis in the US population, 2001–2017. Am J Hematol 2021;96(12):E451–4.
-
6. Cahyanur R, Rinaldi I. Pendekatan Klinis Polisitemia. Jurnal Penyakit Dalam Indonesia 2019;6(3):156.
-
7. Tefferi A, Barbui T. Polycythemia vera and essential thrombocythemia: 2021 update on diagnosis, risk-stratification and
management. Am J Hematol
2020;95(12):1599–613.
-
8. Cuthbert D, Stein BL. Polycythemia vera-associated complications: Pathogenesis,
clinical manifestations, and effects on outcomes. J Blood Med 2019;10:359–71.
-
9. Mahariski PA, Meilani NM, Dharmayuda TG. Polisitemia Vera. Simdos Unud
2016;15(2):65–70.
-
10. Tefferi A, Vannucchi AM, Barbui T. Polycythemia vera: historical oversights,
diagnostic details, and therapeutic views. Leukemia 2021;35(12):3339–51.
-
11. de Freitas RM, da Costa Maranduba CM. Myeloproliferative neoplasms and the JAK/STAT signaling pathway: An overview.
Rev Bras Hematol Hemoter 2015;37(5):348– 53.
-
12. Recio C, Guerra B, Guerra-Rodríguez M, Aranda-Tavío H, Martín-Rodríguez P, de Mirecki-Garrido M, et al. Signal transducer and activator of transcription (STAT)-5: an opportunity for drug development in oncohematology. Oncogene
2019;38(24):4657–68.
-
13. Gerds AT, Bartalucci N, Assad A, Yacoub A. Targeting the PI3K pathway in
myeloproliferative neoplasms. Expert Rev Anticancer Ther 2022;22(8):835–43.
-
14. Vannucchi AM, Kiladjian JJ, Griesshammer M, Masszi T, Durrant S, Passamonti F, et al. Ruxolitinib versus Standard Therapy for the Treatment of Polycythemia Vera. New England Journal of Medicine
2015;372(5):426–35.
-
15. Materials S. Inhibitors of the PI3K / mTOR pathway prevent STAT5 phosphorylation in JAK2V617F mutated cells through PP2A / CIP2A axis. Oncotarget Supplementary Materials 2017;1:1.
-
16. Guvenir Celik E, Eroglu O. Combined treatment with ruxolitinib and MK-2206
inhibits the JAK2/STAT5 and PI3K/AKT
pathways via apoptosis in MDA-MB-231
breast cancer cell line. Mol Biol Rep 2023;50(1):319–29.
-
17. Bellozi PMQ, Gomes GF, De Oliveira LR, Olmo IG, Vieira ÉLM, Ribeiro FM, et al. NVP-BEZ235 (dactolisib) has protective effects in a transgenic mouse model of Alzheimer’s disease. Front Pharmacol [Internet] 2019 [cited 2023 Mar 9];10. Available from: /pmc/articles/PMC6864823/
-
18. Hsu CM, Lin PM, Tsai Y Te, Tsai MS, Tseng CH, Lin SF, et al. NVP-BEZ235, a dual PI3K-mTOR inhibitor, suppresses the growth of FaDu hypopharyngeal squamous cell carcinoma and has a synergistic effect with Cisplatin. Cell Death Discovery 2018 4:1
[Internet] 2018 [cited 2023 Mar 9];4(1):1–10. Available from:
https://www.nature.com/articles/s41420-018-0060-7
-
19. Civallero M, Cosenza M, Pozzi S, Bari A, Ferri P, Sacchi S. Activity of BKM120 and BEZ235 against Lymphoma Cells. Biomed Res Int [Internet] 2015 [cited 2023 Mar 9];2015. Available from: /pmc/articles/PMC4628710/
-
20. Wise-Draper TM, Moorthy G, Salkeni MA, Karim NA, Thomas HE, Mercer CA, et al. A Phase Ib Study of the Dual PI3K/mTOR Inhibitor Dactolisib (BEZ235) Combined with Everolimus in Patients with Advanced Solid Malignancies. Target Oncol 2017;12(3):323– 32.
-
21. Esmaeili A, Asgari A. In vitro release and biological activities of Carum copticum essential oil (CEO) loaded chitosan nanoparticles. Elsevier B.V.; 2015.
. Zhao P, Tian Y, You J, Hu X, Liu Y. Recent Advances of Calcium Carbonate
Nanoparticles for Biomedical Applications. Bioengineering 2022;9(11):691.
. Bryan JC, Verstovsek S. Overcoming treatment challenges in myelofibrosis and polycythemia vera: the role of ruxolitinib. Cancer Chemotherapy and Pharmacology 2016 77:6 [Internet] 2016 [cited 2023 Mar 9];77(6):1125–42. Available from:
https://link.springer.com/article/10.1007/s002 80-016-3012-z
. Lu X, Chang R. Polycythemia Vera. Treasure Island (FL): 2022.
. Chen E, Mullally A. How does JAK2V617F contribute to the pathogenesis of myeloproliferative neoplasms? Hematology (United States) 2014;2014(1):268–76.
. Marcellino BK, Hoffman R. Recent advances in prognostication and treatment of polycythemia vera. Fac Rev [Internet] 2021 [cited 2023 Mar 9];10. Available from: /pmc/articles/PMC8009192/
. Arya Y, Syal A, Gupta M, Gaba S. Advances in the Treatment of Polycythemia Vera: Trends in Disease Management. Cureus [Internet] 2021 [cited 2023 Mar 9];13(3). Available from: /pmc/articles/PMC8084584/
. Sadjadian P, Wille K, Griesshammer M. Ruxolitinib-Associated Infections in
Polycythemia Vera: Review of the Literature, Clinical Significance, and Recommendations. Cancers (Basel) [Internet] 2020 [cited 2023 Mar 9];12(11):1–14. Available from: /pmc/articles/PMC7693745/
. Akram AM, Kausar H, Chaudhary A, Khalid AM, Shahzad MM, Akhtar MW, et al. Detection of Exon 12 and 14 Mutations in Janus Kinase 2 Gene Including a Novel Mutant in V617F Negative Polycythemia Vera Patients from Pakistan. J Cancer [Internet] 2018 [cited 2023 Mar 9];9(23):4341–5. Available from: http://www.jcancer.org
. Hammarén HM, Ungureanu D, Grisouard J, Skoda RC, Hubbard SR, Silvennoinen O. ATP binding to the pseudokinase domain of JAK2 is critical for pathogenic activation. Proc Natl Acad Sci U S A [Internet] 2015 [cited 2023 Mar 9];112(15):4642–7. Available from: https://www.pnas.org/doi/abs/10.1073/pnas.1 423201112
. Puleo DE, Kucera K, Hammarén HM, Ungureanu D, Newton AS, Silvennoinen O, et al. Identification and Characterization of JAK2 Pseudokinase Domain Small Molecule Binders. ACS Med Chem Lett [Internet] 2017 [cited 2023 Mar 9];8(6):618–21. Available from: /pmc/articles/PMC5467198/
. Karim S, Malik IR, Nazeer Q, Zaheer A, Farooq M, Mahmood N, et al. Molecular analysis of V617F mutation in Janus kinase 2 gene of breast cancer patients. Saudi J Biol Sci 2019;26(6):1123–8.
-
33. Leroy E, Balligand T, Pecquet C, Mouton C, Colau D, Shiau AK, et al. Differential effect of inhibitory strategies of the V617 mutant of JAK2 on cytokine receptor signaling. Journal of Allergy and Clinical Immunology 2019;144(1):224–35.
-
34. Leroy E, Dusa A, Colau D, Motamedi A, Cahu X, Mouton C, et al. Uncoupling JAK2 V617F activation from cytokine-induced signalling by modulation of JH2 αC helix. Biochemical Journal [Internet] 2016 [cited 2023 Mar 9];473(11):1579. Available from:
/pmc/articles/PMC4888464/
-
35. Bartalucci N, Guglielmelli P, Vannucchi AM. Rationale for targeting the PI3K/Akt/mTOR pathway in myeloproliferative neoplasms. Clin Lymphoma Myeloma Leuk [Internet] 2013 [cited 2023 Mar 9];13 Suppl 2(SUPPL. 2). Available from:
https://pubmed.ncbi.nlm.nih.gov/24290217/
-
36. Maurer B, Kollmann S, Pickem J, Hoelbl-Kovacic A, Sexl V. STAT5A and STAT5B— Twins with Different Personalities in Hematopoiesis and Leukemia. Cancers (Basel) [Internet] 2019 [cited 2023 Mar
9];11(11). Available from:
/pmc/articles/PMC6895831/
-
37. Bartalucci N, Calabresi L, Balliu M, Martinelli S, Rossi MC, Villeval JL, et al. Inhibitors of the PI3K/mTOR pathway prevent STAT5 phosphorylation in JAK2V617F mutated cells through PP2A/CIP2A axis. Oncotarget [Internet] 2017 [cited 2023 Mar
9];8(57):96710–24. Available from:
https://pubmed.ncbi.nlm.nih.gov/29228564/
-
38. Bartalucci N, Tozzi L, Bogani C, Martinelli S, Rotunno G, Villeval JL, et al. Co-targeting the PI3K/mTOR and JAK2 signalling pathways produces synergistic activity against myeloproliferative neoplasms. J Cell Mol Med [Internet] 2013 [cited 2023 Mar
9];17(11):1385. Available from:
/pmc/articles/PMC4117551/
-
39. Liu XQ, Cohen JI. The Role of PI3K/Akt in Human Herpesvirus Infection: from the Bench to the Bedside. Virology [Internet] 2015 [cited 2023 Mar 9];0:568. Available from: /pmc/articles/PMC4424147/
-
40. Vergaro V, Civallero M, Citti C, Cosenza M, Baldassarre F, Cannazza G, et al. CellPenetrating CaCO3 Nanocrystals for Improved Transport of NVP-BEZ235 across Membrane Barrier in T-Cell Lymphoma. Cancers 2018, Vol 10, Page 31 [Internet] 2018 [cited 2023 Mar 9];10(2):31. Available from: https://www.mdpi.com/2072-
6694/10/2/31/htm
-
41. Trushina DB, Borodina TN, Belyakov S, Antipina MN. Calcium carbonate vaterite particles for drug delivery: Advances and challenges. Mater Today Adv
2022;14:100214.
-
42. Kamba AS, Ismail M, Azmi Tengku Ibrahim T, Zakaria ZAB. Biocompatibility of bio based calcium carbonate nanocrystals aragonite polymorph on NIH 3T3 fibroblast cell line. African Journal of Traditional,
Complementary and Alternative Medicines [Internet] 2014 [cited 2023 Mar 9];11(4):31–8. Available from:
https://www.ajol.info/index.php/ajtcam/article/ view/106316
-
43. Wang CQ, Gong MQ, Wu JL, Zhuo RX, Cheng SX. Dual-functionalized calcium carbonate based gene delivery system for efficient gene delivery. RSC Adv [Internet] 2014 [cited 2023 Mar 9];4(73):38623–9. Available from:
https://pubs.rsc.org/en/content/articlehtml/20 14/ra/c4ra05468g
-
44. Idris SB, Abdul Kadir A, Abdullah JFF, Ramanoon SZ, Basit MA, Abubakar MZZA. Pharmacokinetics of Free Oxytetracycline and Oxytetracycline Loaded Cockle Shell Calcium Carbonate-Based Nanoparticle in BALB/c Mice. Front Vet Sci [Internet] 2020 [cited 2023 Mar 9];7. Available from: /pmc/articles/PMC7308650/
-
45. 45. Gao YY, Hu LS, Han HJ, Song CY,
Huang YX, Guo KY. [NVP-BEZ235 inhibits proliferation and colony-forming capability of CD34(+)CD38(-) human acute myeloid leukemia stem cells]. Zhongguo Shi Yan Xue Ye Xue Za Zhi [Internet] 2013 [cited 2023 Mar 9];21(2):334–8. Available from:
https://pubmed.ncbi.nlm.nih.gov/23628027/
1.
Jalur Patogenesis yang dihambat oleh Ruxolitinib dan BEZ235[35,37]
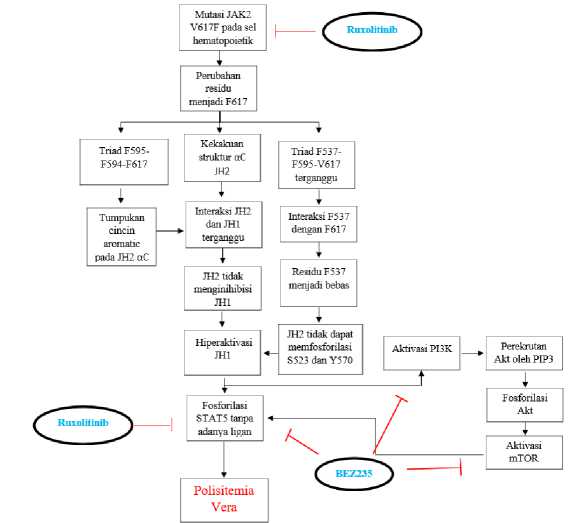
Tingkat Apoptosis Sel Ba/F3 EPOR V617F yang diterapi BEZ235[38]
2.
3.
Tingkat Kelangsungan Hidup Tikus yang diterapi Ruxolitinib dan BEZ235[38]
72
Discussion and feedback