ANALISIS PENCEMARAN Cr(VI) DI SUNGAI BADEK, KOTA MALANG DENGAN MENGGUNAKAN BIOFILM
on
Analisis Pencemaran Cr(VI) di Sungai Badek, Kota Malang Dengan Menggunakan Biofilm
[Andi Kurniawan,dkk.]
ANALISIS PENCEMARAN Cr(VI) DI SUNGAI BADEK, KOTA MALANG DENGAN MENGGUNAKAN BIOFILM
Andi Kurniawan1,2*), Lutfi Ni’matus Salamah2), Putri Dwiyan Jayati1)
1)Fakultas Perikanan dan Ilmu Kelautan, Universitas Brawijaya 2)Pusat Studi Pesisir dan Kelautan, Universitas Brawijaya
*Email: andi_k@ub.ac.id
ABSTRACT
ANALYSIS OF CR(VI) CONTAMINATION USING BIOFILM IN BADEK RIVER, MALANG CITY
One of the most severe environmental problems is heavy metal pollution such as Cr(VI) in aquatic ecosystems. Cr(VI) is toxic and carcinogenic heavy metals pollutants that persistent and easily accumulated through the food web. Accumulation of Cr(VI) concentration in the aquatic ecosystem gradually increases with the increases of industrial activity. Therefore, Cr(VI) concentration in aquatic ecosystems should be monitored continuously, and thus, suitable and accuracy monitoring technologies are necessary. This study analyzed the utilization of biofilm as a biomonitoring agent of Cr(VI) in the Badek River, Malang City. The concentration of Cr(VI) inside the biofilm and the surrounding water of biofilm were investigated. The results revealed that the concentrations of Cr(VI) inside the biofilms were hundred times higher than the surrounding water. The biofilm may accumulate Cr(VI) from the surrounding water resulting in the Cr(VI)-rich microenvironment inside the biofilm. The adsorbed Cr(VI) is retained mostly in the interstitial water of the biofilm matrices. The findings in this study suggested that the biofilm can be used as a potential biological agent to monitor of Cr(VI) pollutant in the river ecosystems.
Keywords: biofilm, biomonitoring, Cr(VI), water pollution, river ecosystem
Pencemaran lingkungan, terutama di ekosistem perairan, adalah salah satu masalah lingkungan terpenting pada saat ini. Pencemaran dalam ekosistem perairan disebabkan oleh berbagai polutan seperti logam berat termasuk Cr(VI) (Duruibe et al., 2007; Kyzas et al., 2014; Guan et al., 2018). Pencemaran pada ekosistem perairan menyebabkan degradasi ekosistem perairan secara bertahap. Hal inilah yang sering mengakibatkan kesadaran tentang degradasi ekosistem perairan muncul ketika dampaknya sudah mencapai tingkat yang parah (Kurniawan et al., 2018).
Aktivitas industri seperti industri penyamakan kulit dapat memberikan masukan limbah yang mengandung Cr(VI) ke ekosistem perarian karena Cr(VI) adalah salah satu bahan yang penting dalam proses penyamakan kulit. Cr(VI) adalah polutan logam berat beracun dan karsinogenik yang
ECOTROPHIC ∙ 13(1):11- 19 p-ISSN: 1907-5626,e-ISSN:2503-3395
persisten dan mudah terakumulasi melalui jaring makanan (Sukandar and Kurniawan, 2017). Lebih dari itu, logam berat ini dapat menyebabkan berbagai masalah kesehatan bagi manusia. Bahaya kesehatan utama yang disebabkan oleh Cr(VI) antara lain adalah asma bronkial, alergi kulit, dan kanker (Jobby et al., 2018). Akumulasi Cr(VI) dalam ekosistem perairan akan terus-menerus meningkat seiring dengan meningkatnya aktivitas industri. Oleh karena itu, konsentrasi Cr(VI) dalam ekosistem perairan sangat penting untuk dipantau secara terus menerus (Chen et al., 2017), termasuk pada Sungai Badek di Kota Malang dimana terdapat industri-industri penyamakan kulit di sekitar daerah aliran sungainya.
Berbagai usaha telah dilakukan untuk memantau keberadaan logam berat seperti Cr(VI) di ekosistem perairan (Vijayaraghavan and Balasubramanian, 2015). Salah satu metode yang dipercaya dapat menjadi alternatif adalah biomonitoring (Chojnacka, 11
2010). Biomonitoring adalah metode untuk memantau polutan dalam ekosistem menggunakan agen biologis (Kirman et al., 2018). Pemilihan agen biologis adalah salah satu kunci sukses utama dalam biomonitoring. Agen biologis dalam biomonitoring harus dapat mengakumulasi polutan dengan efektif, mudah ditemukan di ekosistem perairan dan mudah terbentuk. Penelitian kami terdahulu mengeksplorasi penggunaan biofilm sebagai agen biomonitoring logam berat di ekosistem perairan (Kurniawan et al., 2019; Kurniawan, 2019; Sukandar and Kurniawan, 2017). Pada penelitian ini, biofilm digunakan untuk mengevaluasi kondisi pencemaran Cr(VI) di Sungai Badek di Kota Malang. Penelitian ini juga menganalisis komponen biofilm yang menjadi tempat penyimpanan terbesar untuk Cr(VI) sebagai lanjutan penelitian sebelumnya.
Biofilm telah diketahui sebagai bentuk dominan habitat mikroba di ekosistem perairan.(Costerton et al., 1995; Fabbri et al., 2018). Hampir seluruh mikroba (>95%) yang hidup ada di alam hidup dengan membentuk biofilm (Flemming and Wingender, 2010). Biofilm melimpah di lingkungan akuatik dan memerankan berbagai fungsi penting termasuk akumulasi dan pemurnian bahan pencemar (Tsuchiya et al., 2009). Dengan demikian, pemanfaatan biofilm sebagai agen biomonitoring adalah salah satu teknologi yang menjanjikan untuk digunakan dalam pemantauan bahan pencemar seperti Cr(VI) di ekosistem perairan (Donlan, 2002; Stoodley et al., 1997).
Penelitian sebelumnya telah mengindikasikan kalau biofilm dapat digunakan sebagai agen biomonitoring untuk beberapa logam berat seperti Pb, Cu, dan Zn dalam ekosistem perairan. Hanya saja, penelitian terkait penggunaan biofilm sebagai agen biomonitoring terutama Cr(VI) di ekosistem perairan di Indonesia masih sangat jarang dilakukan. Penelitian ini bertujuan untuk menganalisis lebih lanjut pemanfaatan biofilm sebagai agen biomonitoring
pencemaran Cr(VI) di ekosistem sungai. Hasil penelitian ini menunjukkan bahwa kandungan Cr(VI) didalam biofilm yang tumbuh di ekosistem sungai dapat dijadikan indikator untuk memonitor keberadaan Cr(VI) di ekosistem ini dimana Cr(VI) tersimpan sebagian besar dalam interstitial water dari biofilm.
Sungai Badek merupakan anak Sungai Metro yang alirannya melewati daerah Kelurahan Ciptomulyo, Kota Malang. Beberapa industri penyamakan kulit berdiri di sekitar sungai ini. Industri tersebut ditenggarai membuang limbah penyamakan kulit ke aliran Sungai Badek. Sungai ini termasuk sungai kecil, tidak dalam, kondisi alirannya stabil dan tenang dan diduga mengalami penurunan kualitas air akibat masukan limbah dari berbagai aktivitas yang ada di sekitar daerah aliran sungai.
Sampel dalam penelitian ini adalah biofilm dan air di sekitar biofilm yang diambil dari Sungai Badek. Biofilm dan air di sekitar biofilm dikumpulkan dari 3 titik pengambilan sampel di Daerah Aliran Sungai (DAS) Sungai Badek (Gambar 1), yaitu: area dekat dengan outlet pembuangan limbah industri penyaman kulit (Stasiun 1), area di hilir Sungai Badek sebelum sungai ini bergabung dengan sungai lain (Stasiun 3) dan area diantara Stasiun 1 dan 3 (Stasiun 2).
Biofilm yang digunakan dalam penelitian ini adalah biofilm yang secara alami tumbuh pada batu. Biofilm pada permukaan batu diambil dengan menggunakan metode brushing dan disuspensikan ke dalam 100 mL akuades yang telah disterilkan.Air di sekitar biofilm (kurang lebih 15 cm dari biofilm) juga diambil sebagai sampel. Kesemua sampel dibawa ke laboratorium dalam wadah plastik (suhu ± 4ºC).

A) Stasiun 1
B) Stasiun 2
C) Stasiun 3
Gambar 1.
Stasiun pengambilan sampel di Sungai Badek (A adalah stasiun 1, B adalah stasiun 2, dan C adalah stasiun 3).
Parameter lingkungan yang diukur dalam penelitian ini adalah suhu, pH air, kecepatan arus, kedalaman sungai dan oksigen terlarut (DO). Suhu dan DO diukur dengan Termometer terintegrasi dengan DO Meter Lutron PDO-520 (Lutron Electronics, Taiwan). Kecepatan arus diukur dengan menggunakan Floating Method. Kedalaman sungai diukur menggunakan penggaris besi. pH diukur menggunakan pH meter digital (Kriwbow, Indonesia). Pengukuran diulang sebanyak tiga kali secara independen.
Konsentrasi Cr(VI) di suspensi biofilm dipandang sebagai konsentrasi Cr(VI) di dalam biofilm yang terencerkan dan
digunakan untuk menganalisis konsentrasi Cr(VI) dalam biofilm. Selain di dalam biofilm, konsentrasi Cr(VI) di dalam air di sekitar biofilm juga dianalisis dalam penelitian ini. Konsentrasi Cr(VI) di sampel-sampel tersebut diukur dengan menggunakan UV-Vis Spectrophotometer (Shimadzu, Jepang) menggunakan Metode APHA (3500-Cr B) (APHA, AWWA and WEF, 1992). Untuk memisahkan pelet biofilm dan interstitial water dari biofilm, suspensi biofilm disentrifugasi (10 menit, 8.000 x g).
Hasil pengukuran kualitas lingkungan Sungai Badek dalam penelitian ini ditunjukkan pada Tabel 1. Kisaran suhu air Sungai Badek adalah 25,86 – 31,66 °C, kedalaman sungai adalah 0,15 – 0,24 m, kecepatan arus adalah 0,04 – 0,07 m/s, pH berkisar 6,37 – 6,54 dan DO adalah 4,66 – 7,13 mg/L. Suhu perairan di Sungai Badek menujukkan nilai yang tergolong optimum untuk pertumbuhan organisme termasuk mikroba pembentuk biofilm di lingkungan perairan (±30°C) (Kurniawan, 2018). Tingkat kedalaman air di Sungai Badek menunjukkan kalau sungai ini tergolong sungai dangkal dan tidak dalam (Susmarkanto, 2002). Pendangkalan sungai dapat disebabkan oleh adanya pembuangan limbah industri dan rumah tangga secara kontinyu ke dalam sungai.
Berdasarkan kecepatan arus di Sungai Badek, sungai ini termasuk kedalam kategori sungai berarus sangat lambat (Mason, 1981). Kisaran pH air sungai di Sungai Badek menunjukkan nilai yang masih tergolong memenuhi standar baku mutu air menurut Peraturan Menteri Lingkungan Hidup No 5 Tahun 2014. Berdasarkan nilai DO yang diperoleh, tingkat pencemaran di Sungai Badek tergolong kedalam kategori rendah karena rata-rata kadar oksigen terlarutnya lebih besar dari 5 mg/L (Mahyudin et al., 2015).
Tabel 1. Parameter Lingkungan Sungai Badek
Parameter Lingkugan
|
Stasiun |
Suhu (ºC) |
Kedalaman (m) |
Kecepatan Arus (m/s) |
pH |
DO (mg/L) |
|
1 |
29,33 |
0,20 |
0,05 |
6,45 |
6,26 |
|
2 |
31,66 |
0,15 |
0,04 |
6,37 |
4,66 |
|
3 |
25,86 |
0,24 |
0,07 |
6,54 |
7,13 |
Konsentrasi Cr(VI) dalam air sungai di sekitar biofilm di Sungai Badek dianalisis dalam penelitian ini (Gambar 2). Rata-rata konsentrasi Cr(VI) pada air sungai di stasiun 1 adalah 0,016 ppm, stasiun 2 adalah 0,015 ppm dan stasiun 3 adalah 0,012 ppm. Standar baku mutu air limbah bagi kawasan industri menurut Peraturan Gubernur Jatim No 72 Tahun 2013 menyatakan bahwa kadar maksimum Cr(VI) di air yang masih aman untuk kesehatan manusia adalah 0,05 ppm. Hal ini berarti konsentrasi Cr(VI) dalam air sungai di sekitar biofilm pada saat sampling dilakukan masih berada di bawah kadar maksimum yang ditetapkan.
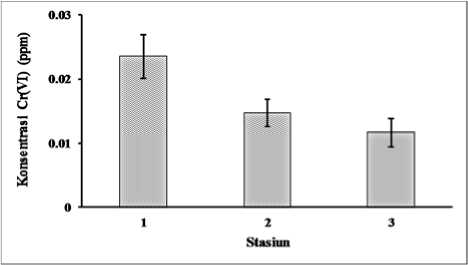
Gambar 2.
Kosentrasi Cr(VI) pada air di sekitar biofilm (Bar menunjukkan nilai standar eror)
Nilai konsentrasi Cr(VI) dalam perairan yang terukur dalam penelitian ini sangat dipengaruhi oleh banyaknya masukan limbah yang dibuang saat pengambilan sampel air. Tinggi rendahnya konsentrasi logam berat di perairan merupakan hasil dari seberapa banyak jumlah masukan limbah logam berat ke perairan tersebut. Pengukuran konsentrasi Cr(VI) dalam air Sungai Badek dalam
penelitian ini mengindikasikan kalau pada saat pengambilan sampel dilakukan, pasokan limbah yang mengandung Cr(VI) tidak membuat Cr(VI) di air Sungai Badek melewati ambang batas kualitas air. Hanya saja, walaupun konsentrasi Cr(VI) dalam air sungai masih berada di bawah standar baku mutu kualitas air, keberadaan Cr(VI) di air Sungai Badek mengindikasikan adanya masukan limbah mengandung Cr(VI) kedalam sungai ini.
Mengingat logam berat seperti Cr(VI) akan sangat mudah terakumulasi dan mengalami bioaugmentasi melalui rantai makanan (Jobby et al., 2018), maka masukan Cr(VI) ke dalam Sungai Badek harus selalu di monitor dan dikontrol. Terlebih lagi apabila dilihat secara fisik, warna air Sungai Badek telah berwarna coklat kehitaman, berbau, serta terjadi pendangkalan dan penyempitan badan sungai sehingga daya tampung dan alirannya terganggu. Ciri-ciri tersebut merupakan ciri-ciri fisik sungai yang telah tercemar (Idrus, 2015).
Hasil pengukuran Cr(VI) di air Sungai Badek yang disajikan pada Gambar 2 menunjukkan bahwa terjadi penurunan konsentrasi Cr(VI) dalam air seiring dengan semakin bertambahnya jarak dari outlet pembuangan limbah industri penyamakan kulit. Konsentrasi Cr(VI) tertinggi berada di lokasi yang paling dekat dengan pipa pembuangan limbah cair pabrik penyamakan kulit yaitu sebesar 0,016 ppm (Stasiun 1). Limbah cair yang dibuang dari outlet yang berada di dekat stasiun satu ini akan dibawa oleh aliran air menuju ke Stasiun 2 hingga Stasiun 3. Bersamaan dengan aliran air ini, Cr(VI) dapat terakumulasi ke dalam berbagai komponen ekosistem termasuk biofilm (Kurniawan et al., 2012) yang ada di
sepanjang aliran sungai. Proses akumulasi ini dapat mengakibatkan penurunan konsentrasi dalam air sungai seiring dengan bertambahnya jarak dari sumber masukan Cr(VI) seperti yang teramati dalam penelitian ini.
Konsentrasi Cr(VI) di dalam biofilm di Sungai Badek juga dianalisis dalam penelitian ini (Gambar 3). Nilai rata-rata konsentrasi Cr(VI) di dalam biofilm pada stasiun 1, stasiun 2 dan stasiun 3 secara berturut-turut adalah 0,78ppm, 2,06ppm dan 1,5 ppm. Hasil pengukuran ini menunjukkan bahwa konsentrasi Cr(VI) di dalam biofilm mencapai ratusan kali lebih tinggi dibandingkan dengan konsentrasi Cr(VI) di air Sungai Badek. Konsentrasi Cr(VI) dalam biofilm yang terukur di Sungai Badek dalam penelitian ini menunjukkan nilai yang telah melebihi tingkat konsentrasi aman dan dapat bersifat racun bagi organisme ataupun manusia (>0,05 ppm) (Kartohardjono et al., 2009).
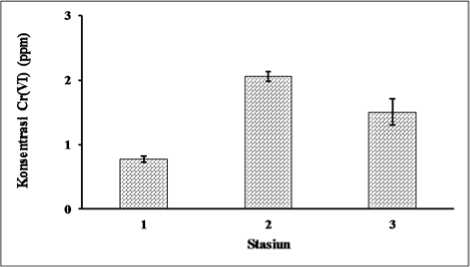
Gambar 3.
Konsentrasi Cr(VI) di dalam biofilm (Bar menunjukkan nilai standar eror)
Konsentrasi Cr(VI) yang tinggi di dalam biofilm bisa diakibatkan oleh akumulasi Cr(VI) dari air sungai ke dalam biofilm (Kurniawan et al., 2015, Kurniawan and Yamamoto, 2013). Mekanisme adsorpsi Cr(VI) ke dalam biofilm dapat terjadi melalui interaksi muatan listrik dan mekanisme pertukaran ion (Hirakiet al., 2009). Extracelullar polymeric substances (EPS) atau sering disebut dengan polimer biofilm memegang peranan penting dalam proses adsorpsi logam berat dalam biofilm. Peranan ini dikarenakan situs bermuatan listrik yang
berfungsi sebagai situs pengikat dan penarik Cr(VI) ke dalam biofilm sebagian besar berada dalam substansi ini. EPS kaya akan grup-grup fungsional yang memiliki muatan listrik positif sehingga memungkinkan matriks biofilm untuk mengadsorpsi Cr(VI) yang dalam air dapat hadir dalam bentuk CrO42- atau Cr2O72- (Sukandar and Kurniawan, 2017). Cr(VI) dapat tersimpan di dua area dalam matriks biofilm, yaitu pada situs bermuatan listrik dan diantara polimer-polimer biofilm (Kurniawan et al., 2012).
Konsentrasi Cr(VI) tertinggi di dalam biofilm di Sungai Badek ditemukan terdapat pada Stasiun 2 (2,06 ppm), diikuti pada stasiun 1 (1,5 ppm) dan stasiun 3 (0,78 ppm). Tingginya konsentrasi Cr(VI) pada stasiun 2 mengindikasikan kalau proses adsorpsi Cr(VI) kedalam biofilm di stasiun ini terjadi lebih banyak dibandingkan dengan stasiun lainnya. Lebih banyaknya adsorpsi ini bisa diakibatkan karena pada area ini kecepatan arus lebih lambat dari stasiun yang lain sehingga memungkinkan waktu kontak antara Cr(VI) di air dan biofilm menjadi lebih lama. Bertambahnya waktu kontak ini membuat lebih banyak Cr(VI) dapat terakumulasi di dalam biofilm (Freifelder, 1985).
Walaupun stasiun 1 adalah area yang paling dekat dengan outlet pembuangan industri penyamakan kulit, aliran air membuat tidak semua Cr(VI) yang terkandung di air dapat diadsorpsi secara optimum oleh biofilm, sehingga konsentrasi Cr(VI) didalam biofilm di stasiun ini lebih rendah dari stasiun 2. Tingkat akumulasi logam berat ke dalam biofilm sangat tergantung waktu kontak atau seberapa lama Cr(VI) bersinggungan dengan biofilm (Kurniwan et al., 2012). Lebih rendahnya konsentrasi Cr(VI) pada biofilm di stasiun 3 dibandingkan dengan stasiun 2 bisa disebabkan karena konsentrasi Cr(VI) di air sungai di stasiun 3 lebih rendah dari stasiun 2. Tingginya akumulasi Cr(VI) kedalam biofilm di stasiun 2 juga dapat berkontribusi kepada lebih rendahnya konsentrasi Cr(VI) dalam air di stasiun 3 ini.
Faktor lain yang kemungkinan juga mempengaruhi tingginya konsentrasi Cr(VI) di biofilm yang tumbuh di stasiun 2 adalah lebih rendahnya DO di stasiun ini dibandingkan dengan stasiun yang lain. DO
yang rendah memicu penurunan kelarutan Cr(VI) di perairan sehingga cenderung lebih mudah untuk mengendap atau terkumpul di dasar perairan. Kondisi ini membuat Cr(VI) akan lebih mudah untuk terakumulasi pada biofilm yang tumbuh di permukaan batu di dasar perairan. Selain itu, pH yang relatif netral menyebabkan reduksi Cr(VI) menjadi Cr(III) tidak optimal sehingga akumulasi Cr(VI) dalam biofilm dapat menjadi tinggi (Jobby et al., 2018).
Matriks biofilm terdiri dari tiga komponen utama, yaitu mikroba, extracellular polymeric substances (EPS) dan interstitial water (Tsuchiya et al., 2012). Untuk menganalisis besarnya akumulasi Cr(VI) di dalam komponen biofilm, maka pelet biofilm dan interstitial water dari Sungai Badek dalam penelitian ini dipisahkan dengan metode sentrifugasi. Pelet yang didapatkan merupakan gabungan antara mikroba dan EPS sedangkan supernatan yang didapatkan adalah interstitial water. Konsentrasi Cr(VI) yang terukur dalam supernatan merupakan konsentrasi Cr(VI) di interstitial wateryang terencerkan.
Kandungan Cr(VI) pada masing-masing komponen matriks biofilm tersebut diukur dan dibandingkan (Tabel 2).
Tabel 2. Kandungan Cr(VI) di dalam pelet biofilm (gabungan mikroba dan EPS) dan Interstitial water di dalam biofilm (± adalah nilai standar eror)
|
Stasiun |
Konsentrasi Cr(VI) | |
|
Pelet (ppm) |
Interstitial water (ppm) | |
|
1 |
0,001 ± 0,0001 |
0,777 ± 0,05 |
|
2 |
0,002 ± 0,0001 |
2,057 ± 0,07 |
|
3 |
0,001 ± 0,0001 |
1,499 ± 0,2 |
Sebagian besar Cr(VI) yang terdapat di dalam matriks biofilm berada di interstitial water dari biofilm. Hal ini disebabkan karena bagian terbesar dari matriks biofilm (sampai dengan 98%) adalah interstitial water (Else et al., 2003; Flemming, 2010). Cr(VI) yang teradsorpsi ke dalam matriks biofilm tidak seluruhnya menempel pada situs bermuatan listrik, tapi dapat tertahan dalam ruang antar polimer dalam biofilm. Dalam proses ini,
Cr(VI) tertahan di interstitial watersebagai hasil interaksi elektrostatis antara Cr(VI) dengan muatan listrik yang ada pada biofilm. Hasil ini mengindikasikan bahwa logam berat yang teradsorpsi dalam biofilm sangat mungkin dilepaskan kembali ke air sekitar biofilm tergantung pada konsentrasi keseimbangan logam berat antara biofilm dan air di sekitar biofilm (Kurniawan et al., 2015). Apabila konsentrasi keseimbangan Cr(VI) antara biofilm dan air di sekitarnya menurun, maka Cr(VI) akan terdesorpsi dari biofilm.
Berdasarkan perbandingan kadar Cr(VI) pada air dan biofilm di Sungai Badek menunjukkan bahwa pada seluruh stasiun, nilai konsentrasi Cr(VI) dalam biofilm ratusan kali lebih tinggi dibandingkan nilai konsentrasi Cr(VI) dalam air.Keberadaan Cr(VI) di air sungai menunjukkan kalau terdapat masukan limbah mengandung Cr(VI) kedalam Sungai Badek walaupun kandungan Cr(VI) di Sungai Badek masih dalam ambang batas aman. Hal ini mengindikasikan kalau terdapat aktivitas yang membuang limbah mengandung Cr(VI) ke dalam Sungai Badek.
Sering kali pengukuran kandungan logam berat termasuk Cr(VI) di air sungai tidak dapat mencerminkan kondisi pencemaran ataupun masukan limbah ke dalam sungai. Hal ini terutama dikarenakan pada ekosistem air mengalir seperti sungai limbah yang dibuang akan segera mengalir seiring dengan pergerakan air. Apabila pembuangan limbah dilakukan pada waktu yang sulit untuk terditeksi seperti pada tengah malam atau saat hujan, pengukuran kandungan pada air sungai tidak dapat mendeteksi keberadaan limbah yang dibuang.
Untuk memonitor kandungan bahan pencemar di dalam sungai, diperlukan monitoring yang bisa merepresentasikan kejadian masukan limbah ke dalam sungai walaupun terjadi lama sebelum pengambilan sampel dilakukan. Monitoring seperti ini bisa dilakukan dengan memanfaatkan komponen ekosistem yang ada di sungai baik komponen biotik maupun abiotik (Kurniawan, 2018). Salah satu alternatif yang potensial untuk
dikembangkan adalah penggunaan mikroba sebagai agen biomonitoring.
Hasil penelitian ini menunjukkan kalau akumulasi Cr(VI) di dalam biofilm lebih banyak tersimpan di dalam interstitial water dari biofilm (Tabel 2).Hal ini berkonsekuensi kalau Cr(VI) yang tersimpan dalam biofilm bisa dilepaskan kembali ke perairan pada saat konsentrasi Cr(VI) di perairan menurun. Oleh karena itu, kandungan Cr(VI) dalam biofilm tidak hanya bisa berbahaya melalui proses bioakumulasi dan bioaugmentasi lewat rantai makanan, tapi juga lewat pelepasan Cr(VI) dari biofilm. Hasil penelitian ini semakin memperkuat justifikasi kalau untuk memonitor kualitas perairan dan keberadaan logam berat seperti Cr(VI) di ekosistem akuatik, biofilm merupakan alternatif agen biomonitoring yang potensial.
Hasil penelitian ini menunjukkan bahwa konsentrasi Cr(VI) di dalam biofilm di Sungai Badek, Kota Malang ratusan kali lebih tinggi daripada air sungai. Biofilm dapat mengakumulasi Cr(VI) dari air di sekitarnya.Kandungan Cr(VI) di air Sungai Badek masih dibawah ambang batas aman (< 0,05 ppm). Kandungan Cr(VI) di dalam biofilm di Sungai Badek melebihi ambang batas aman untuk kesehatan manusia (0,78 – 2,06 ppm). Kandungan Cr(VI) di dalam biofilm dan air sungai di sekitar biofilm mengindikasikan adanya aktivitas yang membuang limbah mengandung Cr(VI) ke dalam Sungai Badek di Kota Malang. Semua komponen biofilm dapat mengakumulasi Cr(VI), hanya saja logam berat ini tersimpan sebagian besar dalam interstitial water dari biofilm. Hal ini mengindikasikan kalau Cr(VI) dalam biofilm akan sangat mungkin kembali terlepas kembali ke air di sekitar biofilm. Hasil penelitian ini menunjukkan kalau biofilm sangat potensial untuk digunakan sebagai agen biologis dalam memonitor keberadaan logam berat seperti Cr(VI) di ekosistem perairan mengalir seperti Sungai Badek di Kota Malang.
Perlunya dilakukan penelitian lebih lanjut mengenai tingkat kemampuan akumulasi berbagai logam berat oleh biofilm di berbagai ekosistem perairan. Selain itu diperlukan juga perbandingan akumulasi antara Cr(III) dan Cr(VI) sehingga penggunaan biofilm untuk memonitor kromium di perairan dapat dianalisis lebih lanjut. Mengingat kemampuan biofilm untuk mengakumulasi Cr(VI) dan biofilm terlibat aktif dalam rantai makanan, maka penelitian lebih lanjut diperlukan untuk dapat menetapkan nilai standar baku mutu konsentrasi logam berat dalam biofilm sebagai acuan untuk mengevaluasi tingkat kesehatan ekosistem perairan.
DAFTAR PUSTAKA
APHA, AWWA and WEF. 1992. APHA
Methods 3500-MG: Standard Methods for the Examination of Water and Wastewater, 18th Edition. Washington DC: American Public Health Association, American Water Works Association, Water Environment Federation.
Chen, H., Dou, J., Xu, H. 2017. Removal of Cr(VI) ions by sewage sludge compost biomass from aqueous solutions: Reduction to Cr(III) and biosorption. Applied Surface Science, 425: 728–735.
Chojnacka, K. 2010. Biosorption and bioaccumulation - the prospects for practical applications. Environment International, 36(3): 299–307.
Costerton, J.W., Lewandowski, Z., Caldwell, D.E., Korber, D.R., Lappin, S.H.M. 1995. Microbial biofilm. Annual Review Microbiology, 49: 711–745.
Donlan, R.M. 2002. Biofilms: Microbial life on surfaces. Emerging Infectious Diseases, 8(9): 881–890.
Duruibe, J.O., Ogwuegbu, M.O.C., Egwurugwu, J.N. 2007. Heavy metal pollution and human biotoxic effects. International Journal of Physical Sciences, 2(5): 112–118.
Else, T.E., Pantle, C.R., Amy, P.S. 2003. Boundaries for biofilm formation: humidity and temperature. Applied and Enviromental Microbiology, 69(8): 5006–5010.
Fabbri, S., Dennington, S.P., Price, C., Stoodley, P., Longyear, J. 2018. A marine biofilm flow cell for in situ screening marine fouling control coatings using optical coherence tomography. Ocean Engineering, 170: 321-328.
Flemming, H.C., Wingender, J. 2010. The biofilm matrix. Nature Reviews Microbiology, 8: 623-633.
Freifelder, D. 1985. Principles of physical chemistry with application to the biological sciences. 2nd ed. Boston: USA: Jones and Bartlett Publishers. 809 pp.
Guan, J., Wang, J., Pan, H., Yang, C., Qu, J., Lu, N., Yuan, X. 2018. Heavy metals in Yinma River sediment in a major Phaeozems zone, Northeast China: Distribution, chemical fraction, contamination assessment and source apportionment. Scientific Reports, 8: 12231.
Hiraki, A., Tsuchiya, Y., Fukuda, Y., Yamamoto, T., Kurniawan, A., Morisaki, H. 2009. Analysis of how a biofilm forms on the surface of the aquatic macrophyte Phragmites australis. Microbes and Environments, 24(3): 265272.
Idrus, S.W.A. 2015. Analisis pencemaran air menggunakan metode sederhana pada Sungai Jangkuk, Kekalik dan Sekarbela Kota Mataram. Jurnal Pijar MIPA, 10(2): 37-42.
Jobby, R., Jha, P., Yadav, K., Desai, N. 2018. Biosorption and biotransformation of hexavalent chromium [Cr(VI)]: a comprehensive review. Chemosphere,207: 255-266.
Kartohardjono, S., Lukman, M.A., Manik, G.P. 2009. Biosorption of Cr(VI) by Psidium guajava. Global Journal of Environmental Research, 3(3): 149-154.
Kirman, C.R., Belknap, A.M., Webster, A.F., Haysa, S.M. 2018. Biomonitoring Equivalents for cyanide. Regulatory Toxicology Pharmacology, 97: 71-81.
Kurniawan, A. 2018. Ekologi Sistem Akuatik; Fundamen dalam pemanfaatan dan pelestarian lingkungan perairan.
Malang: UB Press. 173 pp.
Kurniawan, A. 2019. Biofilm matrices as biomonitoring agent and biosorbent for Cr(VI) pollution in aquatic ecosystems. Journal of Environmental Engineering and Sustainable Technology, 5(2): 6167.
Kurniawan, A., Salamah, L.N., Susanti, Y. D., Damaika, M.A., Guspinta, Y.R.P., Lestari, W. A., Ulfa, S.M. 2019. Analysis of biofilms as biomonitoring agent for Cu2+ and Pb2+ pollution in the lotic ecosystem. IOP Conference Series: Earth and Environmental Science, 239: 012026.
Kurniawan, A., Sukandar, Satriya, C., Guntur. 2018a. Biofilm as a bioindicator of Cr VI pollution in the Lotic Ecosystems. IOP Conference Series: Earth and Environmental Science, 137: 012062.
Kurniawan, A., Tsuchiya, Y., Eda, S., Morisaki, H. 2015. Characterization of the internal ion environment of biofilms based on charge density and shape of ion. Colloids and Surfaces B: Biointerfaces,136: 22-26.
Kurniawan, A., Yamamoto, T. 2013. Biofilm polymer for biosorption of pollutant ions. Procedia Environmental Sciences, 17: 179-187.
Kurniawan, A., Yamamoto, T., Tsuchiya, Y., Morisaki, H. 2012. Analysis of the ion adsorption–desorption characteristics of biofilm matrices. Microbes and environments, 27 (4): 399-406.
Kyzas, G., Fu, J., Matis, K. 2014. New Biosorbent Materials: Selectivity and Bioengineering Insights. Processes, 2(2): 419–440.
Mahyudin, Soemarno dan Prayogo, T.B. 2015. Analisis kualitas air dan strategi pengendalian pencemaran air Sungai Metro di Kota Kepanjen Kabupaten Malang. J-PAL. 6(2): 105-114.
Mason, C.F. 1981. Biology of freshwater pollution. London: Longman Group Limited. 250 pp.
Stoodley, P., Boyle, J.D., Dodds, I., Lappin-Scott, H.M. 1997. Consensus model of biofilm structure. In: Biofilms: community interactions and control, pp. 1–9. Edited by Wimpenny, J.W.T., Handley, P.S., Gilbert, P., Lappin-Scott, H.M., and Jones, M. BioLine, Cardiff, UK.
Sukandar, Kurniawan, A. 2017. Biosorption of Cr(VI) using rice straw waste. Ponte, 73(4): 185-190.
Susmarkanto. 2002. Pencemaran lingkungan perairan sungai salah satu faktor penyebab banjir di Jakarta. Jurnal Teknologi Lingkungan, 3(1): 13-16.
Tsuchiya, Y., Ikenaga, M., Kurniawan, A., Hiraki, A., Arakwa, T., Kusakabe, R., Morisaki, H. 2009. Nutrient-Rich Microhabitats within Biofilms Are Synchronized with the External Environment. Microbes and Environment, 24(1): 43-51.
Vijayaraghavan, K., Balasubramanian, R. 2015. Is biosorption suitable for decontamination of metal-bearing wastewaters? A critical review on the state-of-the-art of biosorption processes and future directions. Journal of Environmental Management, 160: 283296.
19
Discussion and feedback