Laju Pertumbuhan Rotifera (Branchionus plicatilis) di Media Kultur Berdasarkan Jenis Pakan Kombinasi
on
Current Trends in Aquatic Science II(1), 93-100 (2019)
Laju Pertumbuhan Rotifera (Branchionus plicatilis) di Media Kultur Berdasarkan Jenis Pakan Kombinasi
Reza Yunita Sari, Ni Luh Watiniasih, Suprabadevi Ayumayasari
Program Studi Manajemen Sumberdaya Perairan, Fakultas Kelautan dan Perikanan, Universitas Udayana, Badung, Bali-Indonesia
Penulis koresponden. Tel.: +62-895-368-997-689
Alamat e-mail: rezayunita11@gmail.com
Diterima (received) 21 November 2018; disetujui (accepted) 22 Februari 2019
Abstract
Availability of Rotifera natural food needs to be increased in line with the increasing need for larvae feed in fish hatchery production activities. This study aims to analyze the effect of different feeds on the growth rate of Rotifers (Branchionus plicatilis). This research was conducted in December 2018 to February 2019 at the Jepara Brackishwater Aquaculture Center. This study used a completely randomized design with 4 treatments and 3 repetitions, namely control (Nannochloropsis ocullata), treatment 1 (Nannochloropsis ocullata+bread yeast), treatment 2 (Nannochloropsis ocullata+scott emultion), treatment 3 (Nannochloropsis ocullata+fish powder). The dosages of each feed were 170,000 cells/ind Nannochloropsis ocullata, 0.5 g/106 Rotifera bread yeast per day, 6 µg/ind scott emultion, and 0.3 g/106/ind fish powder. Feeding was done twice a day in the morning and evening. The test plankton used was 15 ind/ml Branchionus plicatilis. Rotifera culture was carried out for 5 days and the population of rotifers was observed every day before feeding. Analysis of water quality was also carried out including DO, salinity, pH, temperature, and ammonia. The Rotifera growth rate was analyzed through the number of individuals produced during the culture period. The best value of the growth rate of Branchionus plicatilis after feeding was obtained in treatment media 3 (Nannochloropsis ocullata+fish powder) with a growth rate of 1.395 ind/ml/ day. The results of the ANOVA test showed that different feeding variations for each treatment had a significant effect (P<0.05) on the Rotifera growth rate.
Keywords: culture; proximate; different feeds; growth
Abstrak
Ketersediaan pakan alami Rotifera perlu ditingkatkan seiring dengan meningkatnya kebutuhan pakan larva dalam kegiatan produksi pembenihan ikan Penelitian ini bertujuan untuk menganalisis pengaruh pemberian pakan yang berbeda terhadap laju pertumbuhan Rotifera (Branchionus plicatilis).Penelitian ini dilakukan pada bulan Desember 2018 sampai dengan Februari 2019 bertempat di Balai Besar Perikanan Budidaya Air Payau Jepara. Penelitian ini menggunakan rancangan acak lengkap dengan 4 perlakuan dan 3 kali pengulangan, yaitu kontrol (Nannochloropsis ocullata), perlakuan 1 (Nannochloropsis ocullata+ragi roti), perlakuan 2 (Nannochloropsis ocullata+scott emultion), perlakuan 3 (Nannochloropsis ocullata+tepung ikan). Dosis masing-masing pakan yaitu Nannochloropsis ocullata sebanyak 170.000 sel/ind, ragi roti sebanyak 0,5 g/106 ind Rotifera per hari, scott emultion sebanyak 2 µg/ind, dan tepung ikan sebanyak 0,3 g/106 ind. Pemberian pakan dilakukan 2 kali sehari pada waktu pagi dan sore hari. Plankton uji yang digunakan adalah Branchionus plicatilis sebanyak 15 ind/ml. Kultur Rotifera dilakukan selama 5 hari dan pertambahan populasi Rotifera diamati setiap hari sebelum dilakukan pemberian pakan. Dilakukan juga analisa kualitas air meliputi DO, salinitas, pH, suhu, dan ammonia. Laju pertumbuhan Rotifera dianalisa melalui jumlah individu yang dihasilkan selama masa kultur. Nilai terbaik laju pertumbuhan Branchionus plicatilis setelah pemberian pakan diperoleh pada media perlakuan 3 (Nannochloropsis ocullata+tepung ikan) dengan nilai laju pertumbuhan sebesar 1,395 ind/ml/hari. Hasil uji ANOVA menunjukkan bahwa variasi pemberian pakan yang berbeda pada tiap perlakuan berpengaruh nyata (P<0,05) terhadap laju pertumbuhan Rotifera.
Kata Kunci: kultur; proksimat; perbedaan pakan; pertumbuhan
Budidaya perikanan laut merupakan salah satu usaha perikanan yang dapat dijadikan sebagai sumber pendapatan Negara. Kegiatan budidaya perikanan laut yang berkembang saat ini harus diimbangi dengan ketersediaan larva atau benih ikan yang berkualitas baik. Pembenihan ikan laut merupakan langkah pertama dari upaya pengembangan budidaya perikanan. Keberhasilan produksi benih ikan laut sangat dipengaruhi oleh penyediaan pakan dan manajemen pakan untuk larva ikan laut secara tepat dan efisien (Suastika dan Sumiarsa, 2011). Salah satu faktor yang menyebabkan penting dalam pemeliharaan larva tersebut adalah pakan alami yang berupa fitoplankton dan zooplankton dengan kualitas yang baik. Hal ini dikarenakan pakan alami memiliki kandungan gizi yang baik untuk benih ikan dan berperan dalam menjaga kualitas perairan (Widjaja, 2004). Rotifera merupakan salah satu jenis zooplankton yang digunakan pada pembenihan ikan laut karena memiliki kandungan gizi yang tinggi dan peranannya hingga sekarang belum dapat tergantikan (Astuti et al., 2012).
Brachionus plicatilis merupakan makanan yang sangat baik sekali untuk larva ikan karena mempunyai ukuran yang sangat kecil, kecepatan berenangnya lambat, kebiasaan hidup di kolom air, dapat dikultur pada kepadatan tinggi yaitu 2000 ind/ml, siklus reproduksinya cepat, dan juga Rotifera sangat mudah diperkaya dengan asam lemak, antibiotik serta digunakan untuk transfer substansi larva (Rukka, 2011).
Kultur Rotifera dapat dilakukan dengan cara inokulan Rotifera yang diberi pakan berupa fitoplankton. Fitoplankton yang biasa dijadikan pakan adalah Nannochloropsis ocullata (Nannochloropsis ocullata). Kultur Nannochlorpsis ocullata sudah banyak dilakukan, namun diketahui rentan terhadap perubahan lingkungan. Maka dari itu perlu dilakukan penelitian tentang berbagai jenis pakan pengganti yang dapat dijadikan kombinasi dengan Nannochloropsis ocullata. Pakan pengganti ini diharapkan mampu meningkatkan laju pertumbuhan Rotifera.
Penelitian ini dilaksanakan pada bulan Desember 2018–Februari 2019 di Unit Pakan Hidup Skala Massal Rotifera, Balai Besar Perikanan Budidaya Air Payau Jepara. Pengamatan dan analisis Rotifera dilaksanakan di Laboratorium Mikroalga, Unit Pakan Hidup Balai Besar Perikanan Budidaya Air Payau Jepara.
-
2.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah ember kerucut, gelas ukur, filter bag, timbangan analitik (Shimadzu UX 4200H), pipet tetes, aerasi, sedgewick rafter, hand counter, haemocytometer, object glass, mikroskop (Olympus, CX-21), botol infus, dan alat pengukuran kualitas air pH (Digital Instrumen), refraktometer (Atago, Master-S/MIIM), dan DO meter (Digital Instrumen). Sedangkan bahan yang digunakan meliputi inokulan Rotifera, air laut, scott emultion, Nannochloropsis ocullata, ragi roti, tepung ikan, klorin, Sodium thiosulfate, dan formalin.
-
2.3 Prosedur Penelitian
Pengambilan sampel Rotifera ini menggunakan metode eksperimental dengan analisis rancangan acak lengkap (RAL) dengan 4 perlakuan dan 3 kali pengulangan, yakni sebagai berikut:
Tabel 1
Perlakuan pakan
|
No |
Pakan Kombinasi |
Perlakuan |
|
1. |
Nannochloropsis ocullata |
Kontrol |
|
2. |
Nannochloropsis ocullata + ragi roti |
P1 |
|
3. |
Nannochloropsis ocullata + scott emultion |
P2 |
|
4. |
Nannochloropsis ocullata + tepung ikan |
P3 |
-
2.4 Pengambilan Sampel
Pengambilan data kepadatan individu Rotifera dilakukan setiap sehari sekali selama 5 hari masa kultur. Ada beberapa tahapan dalam kegiatan kultur Rotifera yaitu persiapan wadah dan penyiapan air media, penebaran bibit, perhitungan kepadatan Rotifera selama masa kultur, manajemen dan pemeliharaan kultur Rotifera (manajemen pemberian pakan, pemeliharaan, dan pertumbuhan), dan pemanenan.
-
2.4.1. Persiapan Wadah dan Persiapan Air Media
Wadah dan air yang digunakan telah bersih dari kotoran dan tidak terkontaminasi, serta diaerasi. Pembersihan wadah kultur ini menggunakan klorin dengan dosis 60 ppm dan Sodium thiosulfate dengan dosis 30 ppm.
-
2.4.2. Penebaran bibit
Penebaran bibit awal sebanyak 15 ind/ml pada setiap wadahnya. Penghitungan bibit awal ini dilakukan dengan pengambilan sampel Rotifera sebanyak 1 ml dan kemudian dihitung dibawah mikroskop menggunakan alat bantu hitung sedgewick rafter.
-
2.4.3. Perhitungan Kepadatan Rotifera
Untuk mengetahui pertumbuhan Rotifera dilakukan perhitungan kepadatan individu di laboratorium selama masa kultur yaitu mulai dari awal penebaran bibit hingga pemanenan (0-5 hari). Perhitungan kepadatan individu dilakukan menggunakan sedgewick rafter di bawah mikroskop.
-
2.4.4. Manajemen Kualitas Air
Pertumbuhan Rotifera sangat dipengaruhi oleh sifat fisika kimia perairan seperti suhu, derajat keasaman (pH), oksigen terlarut dan salinitas. Pengecekan kondisi air media pemeliharaan sangat diperlukan. Parameter tersebut akan diukur setiap hari pada pagi dan sore untuk mengetahui kondisi air dalam media pemeliharaan. Penyaringan kotoran hasil endapan pakan juga dilakukan setiap hari pada pagi hari sebelum pemberian pakan. Hal ini dilakukan agar kandungan ammonia yang berasal dari endapan sisa pakan tidak tinggi sehigga pertumbuhan Rotifera bisa optimal.
-
2.4.5. Manajemen Pemberian Pakan
Pada penelitian ini 4 jenis pakan yang digunakan yaitu Nannochloropsis ocullata dengan dosis sebanyak 17.104 sel/ind Rotifera, ragi roti dengan dosis sebanyak 0,5 g/106 ind Rotifera, scott emultion dengan dosis sebanyak 2 µg/ind Rotifera, dan tepung ikan dengan dosis sebanyak 0,3 g/106 ind Rotifera. Pakan diberikan 2 kali setiap hari selama kultur. Pakan diberikan dengan cara metode tetes.
Pakan yang akan ditambahkan pada media kultur sebelumnya akan diencerkan menggunakan air media sesuai dosis yang telah ditentukan. Setelah itu, pakan yang telah diencerkan diletakkan dalam botol infus yang kemudian pakan akan diteteskan sedikit demi sedikit ke dalam media kultur.
-
2.5 Analisis Data
Data yang diperoleh kemudian dianalisis secara deskriptif kuantitatif dengan menghitung kepadatan Rotifera selama kultur. Setelah mendapatkan data kepadatan Rotifera, selanjutnya laju perkembangan Rotifera dihitung dengan mengikuti rumus dari Fogg (1975), sebagai berikut:
K ln( Nt - No)
t
dimana K adalah laju pertumbuhan (ind/ml/hari); Nt adalah jumlah individu hari ke t; No adalah jumlah individu hari kenol; dan t adalah waktu pengamatan.
Data yang diperoleh selanjutnya dianalisis menggunakan One Way Analisis of Variance (ANOVA) dengan selang kepercayaan 95% yang merupakan pengujian terhadap perbedaan laju perkembangan pada setiap perlakuan pemberian pakan, jika hasil uji F menunjukan perbedaan yang signifikan (p<0,05) maka akan dilanjutkan dengan uji beda rata-rata Duncan Multiple Range Test (DMRT).
Rotifera dikultur selama 5 hari dan pertumbuhan Rotifera yang dikultur mengalami tiga fase pertumbuhan yaitu, fase adaptasi, fase eksponensial, dan fase kematian. Puncak kepadatan Rotifera pada semua perlakuan terjadi pada hari keempat (Gambar 1). Rata-rata pertambahan jumlah individu Rotifera dengan pemberian pakan yang berbeda selama 5 hari sangat bervariasi, dimana jumlah total pertambahan rata-rata individu tertinggi pada masa puncak pertumbuhan terdapat pada perlakuan 3 (P3) yaitu sebesar 142 ind/ml, diikuti oleh perlakuan 1 (P1) yaitu sebesar 85 ind/ml, kemudian perlakuan 2 (P2) yaitu sebesar 70 ind/ml, dan yang terendah terdapat pada kontrol (K) yaitu sebesar 65 ind/ml.
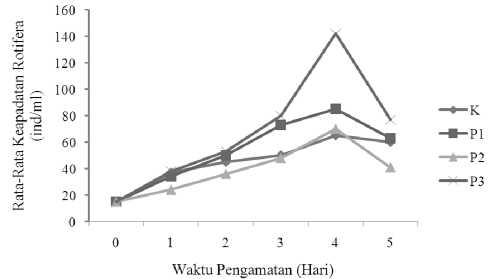
Gambar 1. Rata-Rata Kepadatan Rotifera
-
3.2 Laju Pertumbuhan Rotifera
Hasil analisis data penelitian didapatkan laju pertumbuhan populasi Branchionus plicatilis pada beberapa media perlakuan dengan pemberian pakan yang berbeda selama waktu pengamatan sangat bervariasi. Secara keseluruhan menunjukkan adanya perbedaan laju pertumbuhan pada setiap perlakuan tersebut.
Nilai laju pertumbuhan yang tertinggi adalah 1,395 ind/ml/hari diperoleh pada perlakuan 3 dan diikuti oleh nilai laju pertumbuhan pada perlakuan 1, kontrol, dan perlakuan 2. Nilai yang terendah 1,087 ind/ml/hari yaitu perlakuan perlakuan 2. Hasil uji ANOVA menunjukkan bahwa kombinasi pemberian pakan ragi roti, scott emultion, dan tepung ikan pada tiap perlakuan memberikan pengaruh nyata (P<0,05) terhadap laju pertumbuhan populasi Rotifera. Hasil uji tersebut yang terbaik ditunjukkan pada perlakuan 3.
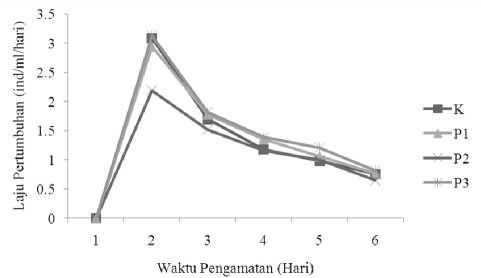
Gambar 2. Laju pertumbuhan populasi Branchionus plicatilis selama penelitian
Setelah dilihat pada hasil uji statsitika ANOVA dengan taraf signifikan sebesar 0,05 menunjukkan bahwa laju pertumbuhan Rotifera berbeda secara signifikan terhadap semua perlakuan yang diberikan (F hitung= 68,32 dan p= 0,000).
Selanjutnya karena hasil uji F menunjukan perbedaan yang signifikan (p<0,05) maka dilanjutkan dengan uji beda rata-rata Duncan. Uji beda rata-rata Duncan menunjukkan bahwa rata-rata perlakuan pakan yang dapat meningkatkan laju pertumbuhan yang berbeda adalah perlakuan 1 dan perlakuan 3.
-
3.3 Kandungan Nutrisi pada Pakan
Pada penelitian ini dilakukan uji proksimat terhadap bahan pakan yang digunakan. Tepung ikan yang digunakan pada penelitian ini mengandung beberapa nutrisi yang penting bagi pertumbuhan Rotifera yaitu meliputi kadar air sebesar 19,94%, abu 24,97%, lemak kasar 7,33%, serat kasar 12,06%, dan protein kasar 36,76%. Sedangkan ragi roti yang digunakan dalam penelitian ini mengandung air 6,66%, abu 4,99%, lemak kasar 1,27%, serat kasar 8,23%, dan protein kasar 41,79%.
Scott emultion yang digunakan pada penelitian ini mengandung omega 3 berupa DHA sebesar 480 mg dan EPA sebesar 255 mg. Selain itu juga mengandung vitamin A sebesar 43% dan vitamin D sebesar 14%.
-
3.4 Kualitas Air
Rata-rata pengukuran suhu di media kultur Rotifera yang diberikan perlakuan yang berbeda yaitu berkisar antara 26,2-27,2oC. Rata-rata derajat keasamana (pH) pada media kultur Rotifera pada perlakuan yang berbeda berkisar antara 7,36-7,80. Salinitas pada media kultur Rotifera pada perlakuan yang berbeda selama pengamatan memiliki nilai salinitas yang sama yaitu sebesar 34 ppt. Dissolved Oxygen (DO) pada media kultur Rotifera berkisar antara 6,62-7,46 mg/l, dan kandungan ammonia yang dilakukan pada awal kultur dan akhir kultur sebesar 1,30-7,54 mg/l.
Pertambahan populasi Rotifera pada semua perlakuan meningkat secara kontinyu dari hari ke 0 sampai hari ke 4, kemudian turun secara drastis pada hari ke 5. Penurunan paling drastis terjadi pada perlakuan 3 dari 142 ind/ml di hari ke 4 turun menjadi 77 ind/ml dihari ke 5. Penurunan ini kemungkinan terjadi karena Rotifera mengalami beberapa fase pertumbuhan yaitu fase adaptasi, fase eksponensial, fase stasioner, dan fase kematian.
Fase stasioner terjadi pada hari ke 5, dan fase kematian terjadi pada hari ke 6. Pada fase kematian jumlah populasi menurun, dan pada fase ini ditandai dengan berubahnya kondisi optimum yang dipengaruhi oleh beberapa faktor kualitas air dan kondisi lingkungan lainnya. Hagiwara et al., (2017) menjelaskan bahwa toksisitas media air pemeliharaan Rotifera meningkat seiring dengan akumulasi bahan organik terlarut dalam media dan dapat berakibat pada penurunan populasi rotifer. Perlakuan 3 mengalami penurunan populasi Rotifera sangat drastis kemungkinan karena kandungan ammonia pada media ini sangat tinggi yaitu 7,54 mg/l. Kandungan ammonia lebih tinggi pada perlakuan ini dikarenakan sisa pakan mengalami degradasi sehingga merusak media, serta utamanya karena pada perlakuan ini terjadi laju pertumbuhan yang lebih cepat, sehingga bahan organik yang dihasilkan juga lebih banyak (Astuti et al., 2012).
Nannochloropsis ocullata yang digunakan sebagai pakan pada penelitian ini sebanyak 170.000 sel/ind/hari. Dosis ini merupakan dosis terbaik bagi Rotifera, karena menurut (Fukusho, 1989) laju rata-rata pemangsaan Rotifera terhadap Nannochloropsis ocullata diperkirakan sebanyak 100.000–150.000 sel/ind/hari. Sehingga dengan jumlah pakan Nannochloropsis ocullata sebanyak 170.000 sel/ind/hari merupakan dosis yang baik. Hal ini dimungkinkan dengan jumlah tersebut Rotifera dapat memenuhi kebutuhan akan pakannya, dan ketika kebutuhannya telah tercukupi (100.000– 150.000 sel/ind/hari), di dalam media kultur masih terdapat sisa pakan kurang lebih sebanyak 20.000 sel/ind/hari sehingga tidak sampai kekurangan pakan. Sedangkan untuk ragi roti diberikan sebanyak 0,5 g/106 ind/hari, scott emultion sebanyak 2 µg/ind/hari, dan tepung ikan sebanyak 0,3 g/106 ind/hari.
Rata-rata pertambahan jumlah individu Rotifera tertinggi pada masa puncak pertumbuhan terjadi pada perlakuan 3 sebesar 142 ind/ml dan yang terendah terdapat pada kontrol yaitu sebesar 65 ind/ml. Tingginya rata-rata pertambahan individu pada perlakuan ke 3 disebabkan karena tepung ikan memiliki kandungan nutrisi yang tinggi dan baik untuk pertumbuhan Rotifera.
Perlakuan 3 (Nannochloropsis ocullata+tepung ikan) dapat menghasilkan kepadatan puncak individu Rotifera tertinggi mencapai 142 ind/ml, hal ini dapat disebabkan karena tepung ikan mengandung nutrisi yaitu berupa protein 36,76%,
lemak 7,33%, kadar air 19,94%, dan kadar abu 24,97%. Lemak tinggi yang dimiliki oleh tepung ikan dapat digunakan oleh Rotifera sebagai sumber energi. Hal ini didukung oleh pernyataan Widianingsih et al., 2011 bahwa lemak memiliki peranan sebagai sumber energi yang lebih baik dibandingkan karbohidrat dan protein. Selain sebagai sumber energi, lemak juga berperan dalam proses reproduksi, perkembangan, dan kebutuhan energi jangka panjang (Leaver et al., 2008). Dalam tubuh Rotifera, lemak menyediakan energi dua kali lebih besar dibandingkan protein (Sargent et al., 2002).
Perlakuan tertinggi yang kedua terjadi pada perlakuan 1 dengan jumlah kepadatan Rotifera 85 ind/ml. Hal ini dapat disebabkan karena ragi roti memiliki kandungan nutrisi berupa protein 41,79%, lemak 1,27%, kadar air 19,94%, dan kadar abu 4,99%. Protein dan karbohidrat yang terdapat pada ragi roti baik bagi pertumbuhan Rotifera (Roosharoe, 2006). Namun kandungan lemak pada ragi roti lebih rendah dibandingkan tepung ikan, sehingga pertumbuhan Rotifera pada perlakuan ini lebih rendah dibandingkan perlakuan 3.
Kepadatan Rotifera pada perlakuan 2 hanya sebesar 70 ind/ml. Scott emultion merupakan asam lemak yang berasal dari emulsi minyak ikan yang mengandung EPA dan DHA yang tinggi. Penggunaan scott emultion untuk pakan tambahan Rotifera ini dapat memberikan dampak positif terdapat kepadatan Rotifera. Scott emultion mengandung lemak yang sangat penting dalam pertumbuhan Rotifera (Pangkey, 2011). Selain itu lemak pada scott emultion juga penting dalam sistem reproduksi dan energi (Leaver et al., 2008). Namun kepadatan pada perlakuan ini tidak sebagus perlakuan yang lain. Hal ini dikarenakan scott emultion yang diberikan selama kultur sebagian menggumpal sehingga Rotifera tidak menyerap scott emultion secara maksimal.
Populasi kepadatan Rotifera terendah tercatat pada kontrol yaitu sebesar 75 ind/ml. Pelakuan kontrol tidak diberikan pakan tambahan sehingga pertumbuhan Rotifera tidak sebaik perlakuan yang diberikan pakan tambahan. Karena pakan tambahan yang digunakan dalam kultur Rotifera memiliki beberapa kandungan nutrisi yang dapat menunjang pertumbuhan Rotifera.
Laju pertumbuhan Branchionus plicatilis secara keseluruhan terlihat tidak jauh berbeda. Laju pertumbuhan populasi Rotifera terhadap semua
perlakuan didapatkan bahwa pada perlakuan 3 memiliki nilai laju pertumbuhan yang paling tinggi sebesar 1,395 ind/ml/hari, sedangkan laju pertumbuhan populasi terendah terdapat pada perlakuan 2 sebesar 1,087 ind/ml/hari. Setelah dianalisa menggunakan uji statsitika ANOVA dengan taraf signifikan sebesar 0,05 menunjukkan bahwa laju pertumbuhan Rotifera berbeda secara signifikan terhadap semua perlakuan yang diberikan (F hitung= 68,32 dan p= 0,000). Selanjutnya karena hasil uji F menunjukan perbedaan yang signifikan (p<0,05) maka dilanjutkan dengan uji beda rata-rata Duncan, dan pada uji beda rata-rata Duncan menunjukkan bahwa rata-rata perlakuan pakan yang dapat meningkatkan laju pertumbuhan yang berbeda adalah perlakuan 1 dan perlakuan 3.
Kondisi ini dapat menunjukkan bahwa pakan tambahan pada perlakuan 1 dan perlakuan 3 yaitu ragi roti dan tepung ikan memiliki nutrien yang baik untuk mendukung kehidupan dan perkembangbiakan Rotifera. Perlakuan lain yang diberikan selama kultur dapat meningkatkan populasi Rotifera juga, namun tidak sebaik perlakuan 1 dan perlakuan 3. Hal ini mungkin dikarenakan pakan tambahan yang berbeda pada setiap media perlakuan memiliki nutrisi yang berbeda juga untuk pertumbuhan Rotifera. Cahyaningsih (2006) menyatakan bahwa pertumbuhan plankton sangat bergantung pada nutrisi atau unsur hara yang terkandung dalam media kultur. Sehingga apabila terjadi kekurangan nutrisi dalam media dapat menyebabkan penurunan laju pertumbuhan populasinya atau bahkan mengalami kematian secara massal.
Sedangkan terjadinya penurunan laju pertumbuhan pada perlakuan kontrol disebabkan oleh bahan makanan yang tersedia memiliki nilai gizi yang tidak sebaik perlakuan lainnya. Sehingga tidak mampu mendukung terjadinya laju pertumbuhan secara optimal. Dengan demikian laju pertumbuhan pada perlakuan kontrol memiliki nilai yang lebih rendah daripada perlakuan lainnya. Hal ini sesuai dengan pernyataan Priyambodo (2001), bahwa dalam mengkultur Rotifera ketersediaan pakan sangat menentukan terhadap laju pertumbuhan populasinya, apabila terjadi kekurangan nutrien dalam bahan media dapat menyebabkan penurunan laju pertumbuhannya juga.
Pada penelitian ini juga didapatkan bahwa hasil rata-rata pengukuran suhu di media kultur Rotifera
yang diberikan perlakuan yang berbeda selama masa kultur yaitu sebesar 26,2-27,2oC. Suhu optimum untuk Rotifera adalah 25oC, walaupun dapat hidup pada suhu 15–31oC (Jusadi, 2003). Hasil rata-rata pH yang diukur di media kultur Rotifera pada setiap perlakuan yang berbeda yaitu sebesar 7,36-7,80. Derajat keasaman (pH) optimum untuk pertumbuhan dan reproduksi berkisar antara 7,5-8,0 (Isnansetyo dan Kurniastuty, 1995). Selanjutnya pengukuran salinitas pada media kultur Rotifera dengan perlakuan yang berbeda memiliki nilai salinitas yang sama yaitu sebesar 34 ppt. Menurut Isnansetyo dan Kurniastuty (1995), salinitas optimal bagi kelangsungan hidup Rotifera adalah 10-35 ppt. Hasil pengukuran DO pada media kultur Rotifera yang diberikan perlakuan yang berbeda yaitu berkisar antara 6,62-7,99 mg/l.
Menurut (Delut, 1996) dalam Sumartini (2002), Rotifera tetap hidup pada kandungan DO di bawah 2 mg/l, akan tetapi tidak kurang dari 1,5 mg/l, dan kandungan DO yang optimum bagi Rotifera adalah 5-7 mg/l. Nilai ammonia di media kultur berbeda didapatkan pada setiap perlakuan pakan. Pada media dengan pakan mikroalga (perlakuan 1) nilai ammonia awal adalah 2,86 mg/l dan nilai ammonia pada saat akhir masa kultur sebesar 3,84 mg/l, perlakuan 2 nilai ammonia adalah 1,79 mg/l dan nilai ammonia pada saat akhir masa kultur sebesar 4,93 mg/l, perlakuan 3 nilai ammonia adalah 1,88 mg/l dan nilai ammonia pada saat akhir masa kultur sebesar 1,30 mg/l, sedangkan pada media dengan pakan tepung ikan nilai ammonia awal kultur sebesar 2,10 mg/l dan nilai ammonia pada akhir kultur sebesar 7,54 mg/l.
Senyawa nitrogen berupa ammonia (NH3) yang terdapat pada media kultur diduga dapat menjadi penghambat utama dalam kultur Rotifera. Nilai ammonia pada media kultur memiliki nilai yang berbeda pada setiap perlakuan pakan. Penggunaan bahan pakan yang digunakan dalam penelitian ini diduga akan meningkatkan kandungan ammonia dalam media karena tersusun dari asam amino (protein) yang akan terurai dalam media kultur. Kadar ammonia hasil penelitian ini lebih tinggi dari batas kandungan ammonia untuk kultur Rotifera yaitu 1 mg/l (Fulks dan Main, 1991). Namun dari hasil penelitian ini penggunaan bahan pakan yang digunakan ternyata mampu dimanfaatkan untuk pertumbuhan populasi Rotifera walaupun media kulturnya memiliki kandungan ammonia yang tinggi. Hal ini diduga ada kaitannya dengan lingkungan asal Rotifera yang merupakan tempat
pembuangan limbah rumah tangga sehingga Rotifera yang dikultur telah mampu beradaptasi lama pada lingkungan tersebut (Kaligis, 2015). Rotifera banyak ditemukan di lingkungan perairan dengan kandungan bahan organik dengan kondisi yang berubah-rubah, oleh karena itu dapat disebut sebagai organisme dengan kemampuan adaptasi yang tinggi (Rumengan et al., 2007). Kandungan ammonia diperkirakan mengalami peningkatan dimulai pada awal kultur. Meningkatnya kandungan ammonia disebabkan karena kandungan bahan organik dan anorganik dalam media kultur yang berasal dari hasil ekskresi maupun jasad Rotifera yang telah mati. Nilai ammonia pada media kultur Branchionus plicatilis pada awal masa kultur memiliki nilai ammonia yang lebih rendah daripada pada akhir masa kultur.
Menurut Maya (2014), bahwa media kultur tempat hidup Rotifera yang memiliki kandungan nutrisi yang tinggi dan kualitas air yang optimal dapat menyebabkan terjadinya pertambahan populasi kepadatan Rotifera dengan cepat, tetapi populasi kepadatan Rotifera juga akan mengalami penurunan dengan cepat pula apabila kualitas air dan nutrisi tidak lagi dapat mendukung kehidupannya.
Pemberian pakan yang berbeda terhadap laju pertumbuhan Branchionus plicatilis tiap media perlakuan berpengaruh terhadap laju pertumbuhan Rotifera. Nilai terbaik laju pertumbuhan Branchionus plicatilis setelah pemberian pakan diperoleh pada media perlakuan 3 (Nannochloropsis ocullata+tepung ikan) dengan nilai laju pertumbuhan sebesar 1,395 ind/ml/hari.
Ucapan terimakasih
Terimakasih kepada Kementerian Riset Dikti yang telah memberikan bantuan biaya pendidikan melalui beasiswa Peningkatan Prestasi Akademik (PPA), Balai Besar Perikanan Budidaya Air Payau Jepara beserta staf pegawai yang telah memberikan fasilitas tempat penelitian dan membantu penelitian saya, dan Fakultas Kelautan dan Perikanan Universitas Udayana yang telah memberikan fasilitas untuk menempuh pendidikan .
Daftar Pustaka
Astuti, R. P., S. L. Sagala, Gunawan, G. S. Sumiarsa., & P. T. Imanto. (2012). Optimasi dosis dan frekuensi pakan dalam produksi Rotifera (Brachionus rotundiformis). Jurnal Ilmu dan Teknologi Kelautan Tropis. 4(2), 239-246.
Cahyaningsih, S. (2006). Petunjuk teknis produksi pakan alami. Departemen Kelautan dan Perikanan Dirjen Perikanan Budidaya. Balai Budidaya Air Payau Situbondo. Situbondo: Indonesia, pp. 25.
Fogg, G.E. (1975). Algae culture and phytoplankton ecology. (2nd ed). Maddison: University of Wisconsin Press.
Fulks W., & K. L. Main. (1991). Rotifera and microalgae culture systems. In Proceedings of a U.S. Asia workshop. The Oceanic Institute, Honolulu, Hawaii, 28-31
Januari 1991 (pp. 364).
Fukusho, K. (1989). Biology and mass pro-duction of the Rotifer, Branchionus plicatilis (1). International Jounal of Aquatic Fish Techonolgy 1, 232-240.
Hagiwara A., & Yoshinaga T. (2017). Rotifers–Aquaculture, Ecology, Gerontology and Ecotoxicology. (Ed.). Tokyo: Japanese Society of Fisheries Science.
Isnansetyo, dan Kurniastuty. (1995). Teknik Kultur Phytoplankton dan Zooplankton. Pakan Alami Ikan Untuk Pembenihan Organisme Laut. Yogyakarta: Penerbit Kanisius, pp. 14–15.
Jusadi, D. (2003). Budidaya Pakan Alami Air Tawar. Direktorat Pendidikan. Direktorat Jenderal Pendidikan Dasar dan Menengah Departemen Pendidikan Nasional: Jakarta, pp. 12-16.
Kaligis, E. (2015). Kualitas air dan pertumbuhan populasi Rotifera Brachionus rotundiformis strain tumpaan pada pakan berbeda. Jurnal LPPM Bidang Sains dan Teknologi. 2(2), 42-48.
Leaver, M. J., Bautista, J. N., Bjornsson, B. T., Jonsson, E., Krey, G., Tocher, D. R., & Tortstensen, B. E. (2008). Towards Fish Lipid Nutrigenomics; Current State and Prospects for Fin-fish Aquaculture. Reviews in Fish Science. 16(1), 73-94.
Maya, A.W. (2014). Laju Petumbuhan Populasi Branchionus plicatilis O. F. Muller Diperkaya Beberapa Variasi Dosis Scotts’ Emultion Pada Kombinasi Kotoran Yama Broiler, Pupuk Urea, dan TSP. Skripsi. Medan, Indonesia: Departemen Biologi, Universitas Sumatra Utara.
Pangkey, H. (2011). Kebutuhan asam lemak esensial pada ikan laut. Jurnal Perikanan dan Kelautan Tropis. 7(2), 9398.
Priyambodo. (2001). Budidaya Pakan Alami untuk Ikan. Jakarta, Indonesia: PT. Penebar Swadaya, pp. 28.
Roosharoe, I. (2006). Mikologi Dasar dan Terapan. Jakarta, Indonesia: Yayasan Obor Indonesia, pp. 56-64.
Ruka, A, H. (2011). Pengaruh salinitas yang berbeda terhadap pertumbuhan Rotifera Branchionus plicatilis O.F Muller. Jurnal Media Litbang Sulteng. 4(1), 8-11.
Rumengan, I. F. M., Sulung, M. Lantiunga, Z., &
Kekenusa, J. (2007). Morfometri Rotifera Brachionus rotundiformis strain ss asal tambak minanga dan tambak Watuliney Sulawesi Utara yang dikultur pada salinitas berbeda. Jurnal Riset Akuakultur. 2(2), 221-229.
Sargent, J.R., Tocher, D.R., & Bell, J.G., (2002). The lipids, In Halver, J.E., Hardy, R.W. (Eds.), Fish Nutrition. (3rd ed.). San Diego: Academic Press.
Sumartini, E. (2002). Pengaruh Siklus Pencahayaan (Fotoperiodik) Terhadap Produksi Rotifera. Skripsi. Bogor, Indonesia: Institut Pertanian Bogor.
Suastika, M., & Sumiarsa, G. S. (2011). Penggunaan jenis pakan berbeda pada kultur Rotifera (Branchionus
rotundiformis). Dalam Prosiding Pertemuan Inovasi Teknologi Akuakultur. Balai Besar Riset Perikanan Budidaya Laut, Bali, 30 Desember 2011 (pp. 818).
Widianingsih,. Hartati, R., Endrawati, Yudiati, E., & Iriani, V. R. (2011). Pengaruh pengurangan konsentrasi nutrien fosfat dan nitrat terhadap kandungan lipid total Nannochloropsis ocullata. semarang. Jurnal Ilmu Kelautan Universitas Diponegoro. 16(1), 24-29.
Widjaja, F. (2004). Pendayagunaan Rotifera yang diberi pakan alami berbagai jenis mikroalgae. Jurnal Ilmu-Ilmu Perairan dan Perikanan Indonesia. 11(1), 23-27.
Curr.Trends Aq. Sci. II(1): 93-100 (2019)
Discussion and feedback