PENENTUAN NILAI KM DAN VMAKS DARI ENZIM PAPAIN DALAM HIDROLISIS KONSENTRAT PROTEIN AMPAS TAHU
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 10 Nomor 2, Oktober 2022

PENENTUAN NILAI KM DAN VMAKS DARI ENZIM PAPAIN DALAM HIDROLISIS KONSENTRAT PROTEIN AMPAS TAHU
Oka Ratnayani*, Sakinatul Fatimah, Ketut Ratnayani, dan Ni Made Puspawati Program Studi Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Badung-Bali, Indonesia *E-mail: okaratnayani@unud.ac.id
ABSTRAK: Sisa kandungan protein dalam ampas tahu yang masih cukup tinggi perlu dioptimalkan pemanfaatannya dengan cara mengisolasi komponen protein tersebut sehingga diperoleh konsentrat protein ampas tahu dan digunakan sebagi substrat untuk produksi hidrolisat protein. Penelitian ini bertujuan untuk menentukan kemampuan enzim papain dalam menghidrolisis konsentrat protein ampas tahu yaitu dengan menentukan nilai Km (Konstanta Michaelis-Menten) dan Vmaks (Kecepatan Maksimum). Tahap penelitian diawali isolasi protein total sehingga diperoleh konsentrat proteinnya.yang selanjutnya dihidrolisis secara parsial dengan enzim papain sehingga diperoleh produk hidrolisat protein. Proses isolasi protein ampas tahu menggunakan sampel ampas tahu segar dengan metode ekstraksi alkalik dilanjutkan dengan presipitasi isoelektrik mampu menghasilkan serbuk konsentrat protein dengan nilai kadar protein mencapai 50,36% sehingga memenuhi syarat sebagi konsentrat protein. Hasil penentuan nilai Km dan Vmaks enzim papain dalam menghidrolisis substrat konsentrat protein ampas tahu memperoleh nilai Km sebesar 237,0229 mg/mL dan nilai Vmaks sebesar 5,1975 mg/mL/menit. Hal ini menunjukkan bahwa enzim papain mampu menghidrolisis konsentrat protein ampas tahu sehingga menghasilkan produk hidrolisat protein ampas tahu.
Kata kunci: hidrolisis protein; ampas tahu; enzim papain; Km
ABSTRACT: The remaining protein content in tofu dregs is still quite high, so that its utilization can be optimized by isolating the protein component to obtain the protein concentrate that can be used as a substrate for the production of protein hydrolysates. This study aimed to determine the ability of the papain enzyme to hydrolyze the protein concentrate of tofu dregs through determining the values of Km (Michaelis-Menten constant) and Vmax (Maximum Speed). The research steps began with the total protein isolation to obtain the protein concentrate, which was then partially hydrolyzed with papain enzymes to produce protein hydrolysate. The isolation of the tofu dregs protein from fresh tofu dregs samples was done by using an alkaline extraction method followed by isoelectric precipitation resulted in protein concentrate powder with a protein content value of 50.36%, so that it qualified as a protein concentrate. The determination of Km and Vmax values of the papain enzyme in hydrolyzing the protein concentrate substrate of tofu dregs obtained a Km value of 237.0229 mg/mL and a Vmax value of 5.1975 mg/mL/minute. This showed that the papain enzyme was able to hydrolyze the tofu dregs protein concentrate to produce a tofu protein hydrolyzate product.
Keywords: protein hydrolysis; tofu dregs; papain enzyme; Km
Ampas tahu sebagai produk samping industri pengolahan kedelai cukup potensial jika digunakan sebagai bahan baku untuk
produksi hidrolisat protein mengingat kandungan proteinnya yang masih cukup tinggi, ekonomis, ketersediaannya berlimpah dan tentunya akan berdampak positif bagi lingkungan. Hidrolisat protein
dapat diproduksi melalui reaksi hidrolisis protein secara kimiawi maupun enzimatis menggunakan enzim protease. Hidrolisat protein yang dihasilkan secara enzimatis telah banyak dimanfaatkan secara luas di antaranya sebagai suplemen bernutrisi, pangan fungsional, meningkatkan cita rasa dalam makanan, bahan kosmetik, dan fortifikasi ekstrak buah dan minuman ringan [1].
Hidrolisis protein secara enzimatis memiliki kelebihan jika dibandingkan hidrolisis protein dengan asam dan alkali karena produk peptida yang dihasilkan memiliki komposisi dan urutan asam amino yang spesifik sesuai dengan jenis enzim protease yang digunakan [2]. Enzim papain adalah enzim proteolitik yang terdapat pada getah pepaya (Carica papaya L.). Enzim papain memiliki keunggulan yaitu relatif mudah diperoleh di pasaran, mudah diisolasi serta mempunyai stabilitas suhu lebih tinggi dibanding enzim protease lain. Keaktifan enzim papain hanya menurun 20% pada pemanasan 70oC selama 30 menit pada pH 7,0. Enzim papain telah banyak dimanfaatkan dalam produksi hidrolisat produksi termasuk pada kacang kedelai. Anggraini dan Yuanita [3] menggunakan nzim papain untuk menghidrolisis protein kedelai edamame.
Ampas tahu (secara internasional diberi istilah “okara”) merupakan limbah kedelai hasil samping dari pengolahan tahu dan susu kedelai [4]. Selama ini pemanfatan ampas tahu di Indonesia masih terbatas antara lain digunakan sebagai bahan baku pembuatan tempe gembus dan pakan ternak. Meskipun ampas tahu merupakan produk samping dalam produksi tahu namun kandungan gizi ampas tahu masih cukup tinggi. Kandungan gizi ampas tahu cukup bervariasi tergantung pada cara produksi tahu yang dilakukan sebelum dihasilkan ampas tahu, dan terutama ditentukan oleh kadar airnya. Ampas tahu kering mengandung 50% serat, 25% protein, dan 10% lipid.
Kadar protein dalam ampas tahu yang masih cukup tinggi tersebut
berpotensi jika dimanfaatkan sebagai sumber bahan baku untuk pembuatan konsentrat protein, yang pada tahap selanjutnya dapat diolah menjadi hidrolisat protein melalui proses hidrolisis menggunakan enzim papain yang akan dikaji dalam penelitian ini. Beberapa peneliti sebelumnya telah menggali potensi pemanfaatan protein ampas tahu, yaitu Yuslinawati pada [5] telah berhasil menemukan bahwa ekstraksi alkalik pada suhu 50 oC dan pH 10 dalam proses isolasi protein dari ampas tahu mampu menghasilkan konsentrat ampas tahu dengan karakteristik terbaik yaitu rendemen 11,68% dengan kadar protein mencapai 61,14%.
Berdasarkan latar belakang tersebut, maka perlu dilakukan penelitian untuk mengetahui kemampuan enzim papain dalam menghidrolisis konsentrat protein ampas tahu sehingga diperoleh hidrolisat protein. Untuk mencapai tujuan tersebut maka dilakukan serangkaian tahap penelitian yaitu diawali dengan proses isolasi protein total dari ampas tahu segar sehingga diperoleh serbuk konsentrat proteinnya. Konsentrat protein tersebut selanjutnya dihidrolisis dengan enzim papain sehingga diperoleh suatu produk hidrolisat protein. Kemampuan enzim papain dalam menghidrolisis protein ampas tahu dikarakterisasi dengan menentukan nilai Km dan Vmaks dari enzim papain pada substrat spesifik (konsentrat protein ampas tahu).
Alat yang digunakan meliputi peralatan gelas, alat sentrifugasi, waterbath-shaker dan spektrofotometer UV-Vis.
Bahan penelitian yang digunakan adalah ampas tahu dari pabrik tahu daerah Gatot Subroto, Denpasar. Bahan kimia yang digunakan meliputi : HCl, aqua DM, etanol, NaOH, ninhidrin, TCA (Tri Chloroacetid Acid), leusin dan enzim papain.
Sampel Ampas tahu segar dikumpulkan dari sebuah usaha produksi tahu di daerah Gatot Subroto Denpasar Bali dan ditentukan kadar airnya. Sampel ampas tahu basah dimasukkan ke dalam freezer dan tahan dalam penyimpanan sampai 5 hari.
Sampel ampas tahu segar dicampur dengan NaOH 0,7% (dengan rasio 1:5) dan dihomogenisasi menggunakan magnetic stirrer 60oC selama 30 menit. Selanjutnya campuran disaring dengan kain bersih dan filtratnya disentrifugasi pada 6.000 rpm selama 10 menit. Supernatan yang diperoleh merupakan fraksi protein. Selanjutnya dilakukan tahap presipitasi dengan cara pengaturan pH 4,5 dengan penambahan HCl 0,1N. Kemudian disentrifugasi pada 6.000 rpm selama 10 menit, diambil pelletnya dan dikeringkan pada suhu 50oC selama 12 jam.
-
2.4. Penentuan Kadar Asam Amino Bebas dengan Metode Spektrofotometri Ninhidrin [6]
Kadar asam amino bebas dalam sampel hidrolisat protein ditentukan dengan metode spektrofotometri menggunakan reagen ninhidrin pada 570 nm (menggunakan standar asam amino leusin).
Sebanyak 0,6 mL reagen ninhidrin ditambahkan ke dalam 1 mL sampel selanjutnya di homogenkan dengan vortex, setelah itu campuran di panaskan dengan suhu 80-1000C selama 4-7 menit. Campuran kemudian dibaca absorbansinya pada panjang gelombang 570 nm dengan spektrofotometer. Kurva kalibrasi diperoleh dengan cara memplot nilai absorbansi vs konsentrasi asam amino (leusin).
-
2.5. Penentuan Konstanta Michaelis-Menten (Km) Enzim Papain Pada Substrat Konsentrat Protein Ampas Tahu
Sebanyak 1,0 mL larutan enzim papain 0,8% ditambahkan ke dalam
substrat (larutan protein ampas tahu 4%) dengan variasi volume substrat sehingga diperoleh terjadi peningkatan kadar substrat tanpa diiringi dengan peningkatan konsentrasi enzim agar diperoleh kurva Michelis-Menten.
Ke dalam masing-masing tabung ditambahkan aqua DM sampai volume masing-masing tabung menjadi 6 ml. Dilakukan pengaturan pH campuran menjadi pH 7 dengan penambahan NaOH 0,1 N. Proses hidrolisis menggunakan waterbath-shaker dilakukan dengan kecepatan 60 rpm dan suhu 500C selama waktu 3 jam. Setelah inkubasi, reaksi dihentikan dengan pemanasan pada 850C selama 10 menit. Hidrolisat protein diatur pH nya menjadi pH 5 dan disentrifugasi pada 5000 rpm selama 10 menit, kemudian supernatan disimpan dalam botol kaca gelap pada suhu -15oC.
Jumlah produk yang terbentuk diukur dengan menentukan kosentrasi asam amino bebas yang dihasilkan dari masing-masing hidrolisat yang diperoleh dengan metode speksktrofotometri ninhidrin seperti ditampilkan pada metode 2.4. Nilai kecepatan reaksi (Vo) dari masing-masing sampel hidrolisat dihitung dengan membagi konsentrasi produk dengan waktu seperti persamaan berikut:
Ts ]
Kecepatan reaksi awal (Vo)=
waktu inkubasi
Penentuan nilai Km dilakukan dengan membuat kurva Lineweaver-Burk yang merupakan hubungan antara (1/V) sebagai sumbu Y terhadap (l/[S]) sebagai sumbu X.
-
3. HASIL DAN PEMBAHASAN
Sampel ampas tahu yang digunakan dalam penelitian ini adalah sampel ampas tahu segar yang diperoleh dari sebuah industri tahu di wilayah Gatot Subroto, Denpasar. Alasan penggunaan sampel ampas tahu segar adalah berdasarkan hasil penelitian dari Yuslinawati [5] yang telah menemukan bahwa penggunaan ampas tahu segar dalam proses isolasi protein
ampas tahu mampu menghasilkan rendemen lebih tinggi, tahapan prosesnya lebih sederhana dibandingkan dengan penggunaan ampas tahu kering. Selain itu, produk konsentrat protein yang diperoleh dari hasil isolasi protein menggunakan ampas tahu segar memiliki sifat fungsional yang lebih baik daripada jika menggunakan ampas tahu kering.
Setelah dilakukan ekstraksi alkalik menggunakan pelarut NaOH 0,7%, selanjutnya dilakukan tahap presipitasi isoelektrik yang dilakukan melalui perlakuan pengaturan pH terhadap filtrat hasil ekstraksi alkalik menjadi pH 4,5 dengan penambahan HCl 0,1 N. Tujuan dari perlakuan ini adalah untuk mengendapkan semua komponen protein yang tadinya terlarut dalam filtrat hasil ekstraksi alkalik, mengingat pH 4,5 merupakan titik isoelektrik dari molekul protein secara umumnya. Setelah dilakukan sentrifugasi terhadap hasil tahap presipitasi isoelektrik, maka diperoleh pellet berwarna putih yang merupakan konsentrat protein ampas tahu. Hasil perhitungan menunjukkan bahwa rendemen konsentrat protein ampas tahu yang diperoleh menggunakan metode isolasi protein yang telah dilakukan dalam penelitian yaitu mencapai 11,05%. Nilai rendemen ini masih cukup rendah dibandingkan rendemen yang diproleh oleh Ma et al. [7] yang telah mengekstraksi protein dari ampas susu kedelai pada pH 9 dan suhu 80oC selama 30 menit. Isolat protein kering bebas lemak yang diperoleh memiliki kadar protein 83% dan recovery proteinnya mencapai 53% dengan komposisi asam amino yang mirip dengan kacang kedelai sebelum diolah. Namun perlu diingat bahwa kadar protein dari sampel ampas tahu yang digunakan memiliki kadar protein yang sangat bervariasi tergantung pada proses pengolahan kacang kedelai yang dilakukan sampai diperoleh ampas tahu.
Tabel 1. Kadar Protein dan Kadar Air
Konsentrat Protein Ampas Tahu
No Karakteristik Nilai (%)
|
1 |
Kadar Protein |
50,34 |
|
2 |
Kadar Air |
11,52 |
-
3.3. Penentuan Kadar Air dan Kadar Protein dari Konsentrat Protein Ampas Tahu Hasil Isolasi
Untuk mengetahui kelayakan hasil isolasi protein ampas tahu agar dapat digunakan sebagai substrat dalam hidrolisis protein ampas tahu, maka perlu dilakukan karakterisasi terhadap hasil isolasi tersebut dari segi kadar protein dan kadar airnya. Metode yang digunakan untuk penentuan kadar protein adalah metode Ntotal dengan metode Kjeldahl, kadar Ntotal yang diperoleh selanjutnya dikalikan dengan faktor konversi 6,25 untuk memperoleh nilai kadar protein. Hasil karakterisasi dari hasil isolasi protein ampas tahu ditampilkan pada Tabel 1.
Kadar protein dari serbuk hasil isolasi akan menunjukkan keberhasilan proses isolasi apakah benar isolat yang diperoleh memiliki kandungan protein yang cukup tinggi sehingga cukup baik jika digunakan sebagai substrat dalam produksi hidrolisat protein. Berdasarkan Tabel 1, ditunjukkan bahwa kadar protein dari hasil isolasi mencapai 50,34% sehingga memenuhi syarat sebagai konsentrat protein karena memiliki kadar protein di atas 50%. Berdasarkan nilai kadar air serbuk konsentrat ampas tahu pada Tabel 1. yang mencapai 11,52% menunjukkan bahwa serbuk konsentrat protein yang diperoleh sudah memiliki kadar air memenuhi syarat untuk penyimpanan jangka panjang sebagai sebuah simplisia yang akan dijadikan substrat dalam hidrolisis protein.
-
3.4. Penentuan Nilai Km dan Vmaks dari Substrat Konsentrat Protein Ampas Tahu
Nilai Km dan Vmaks merupakan dua parameter kinetika enzim yang
Tabel 2. Data [S] dan Vo dalam pembuatan kurva Lineweaver-Burk.
|
Kode sampel |
[S] (mg/mL) |
V0 (mg/mL.menit) |
1/[S] |
1/V0 |
|
S1 |
17,5 |
0,3488 |
0,0571 |
2,8669 |
|
S2 |
25,0 |
0,494 |
0,0400 |
2,0243 |
|
S3 |
32,5 |
0.7212 |
0,0308 |
1,3866 |
|
S4 |
42,5 |
0,8098 |
0,0235 |
1,2349 |
|
S5 |
50,0 |
0,8541 |
0,0200 |
1,1708 |
|
S6 |
57,5 |
1,0058 |
0,0174 |
0,9942 |
|
S7 |
67,5 |
1,0508 |
0,0148 |
0,9516 |
|
S8 |
75,0 |
1,1189 |
0,0133 |
0,8937 |
|
S9 |
82,5 |
1,5275 |
0,0121 |
0,6547 |
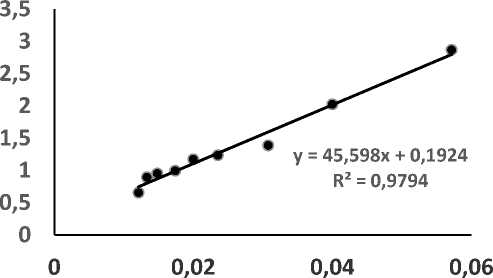
1/[S] mg/ml
Gambar 3.1. Kurva Lineweaver–Burk Untuk Penentuan Nilai Km dan Vmaks.
menunjukkan karakteristik suatu enzim yang bekerja pada substrat tertentu. Kecepatan reaksi hidrolisis oleh enzim papain pada berbagai variasi konsentrasi substrat ditentukan dengan menentukan kecepatan peningkatan konsentrasi produk hasil hidrolisis yaitu berupa kadar gugus α-amina bebas per satuan waktu. Kadar gugus α-amina bebas dianalisis dengan metode spektrofotometri ninhidrin menggunakan standar leusin. Selanjutnya dibuat kurva Lineweaver-Burk, yaitu kurva antara (1/Vo) sebagai sumbu Y terhadap (1/[S]) sebagai sumbu X. Hasil analisis hubungan antara variasi kadar substrat konsentrat ampas tahu ([S]) dengan kecepatan reaksi hidrolisis oleh enzim papain (V0) dapat dilihat pada Tabel 2., sedangkan kurva
Lineweaver-Burk yang menggambarkan hubungan antara 1/[S] dengan 1/V dapat dilihat pada Gambar 1. Nilai Km tidak tergantung pada besarnya konsentrasi enzim, sedangkan Vmaks dipengaruhi oleh besarnya konsentrasi enzim. Km dapat diartikan sebagai ukuran afinitas enzim terhadap substrat. Penentuan Km dan Vmaks ini dilakukan pada suhu inkubasi optimum yaitu suhu 50 oC.
Berdasarkan plot kurva Lineweaver-Burk pada sumbu X (1/[S]) dan sumbu Y (1/Vo) dari kurva pada Gambar 1., maka dapat disimpulkan bahwa nilai Km enzim papain pada substrat konsentrat ampas tahu adalah sebesar 237,0229 mg/mL, dan nilai Vmaks sebesar 5,1975 mg/mL/menit. Hal ini menunjukkan
bahwa nilai Km dan Vmaks enzim papain pada substrat konsentrat ampas tahu yang diperoleh dalam penelitian ini masih jauh lebih besar jika dibandingkan dengan nilai Km dan Vmaks enzim papain pada substrat kasein yang diperoleh oleh Mathias Elsson et al (2019). Hasil penelitian Mathias et al. [8] menunjukkan bahwa kinetika dari enzim papain komersial merk tertentu pada substrat kasein memperoleh nilai Km sebesar 248,68 ppm dan nilai Vmaks sebesar 1,514 ppm kasein/menit. Nilai Km dari enzim yang sama akan berbeda jika bekerja pada jenis substrat yang berbeda. Mengingat Km merupakan konsentrasi substrat yang dibutuhkan untuk mencapai Vo = ½ Vmaks, maka jika nilai Km yang rendah akan membutuhkan sedikit substrat untuk mencapai ½ Vmaks. Tingginya nilai Km enzim papain yang diperoleh dalam penelitian ini dibandingkan pada substrat kasein kemungkinan disebabkan karena kadar protein dalam substrat konsentrat protein ampas tahu yang digunakan masih rendah (50,34%) dibandingkan dengan penelitian Mathias et al, [8] yang menggunakan kasein murni. Hal ini berakibat masih banyaknya komponen non protein di dalam substrat sehingga berpengaruh terhadap afininitas enzim papain terhadap substrat protein ampas tahu menjadi kurang efektif.
Proses isolasi protein ampas tahu menggunakan sampel ampas tahu segar mampu menghasilkan serbuk konsentrat protein ampas tahu yang berwarna putih dengan nilai kadar protein mencapai 50,36% sehingga memenuhi syarat sebagai konsentrat protein untuk digunakan sebagai substrat dalam produksi hidrolisat protein. Nilai Km enzim papain pada substrat konsentrat ampas tahu adalah sebesar 237,0229 mg/mL, dan nilai Vmaks sebesar 5,1975 mg/mL/menit.
Penulis mengucapkan terima kasih kepada LPPM Universitas Udayana atas
sumber pendanaan PUPS serta kepada semua pihak yang telah membantu demi terlaksnanya penelitian dan publikasi ini.
-
[1] Zheng, X.Q., Lim, L.T., Liu, X.L., Wang, X.J., Lin, J. dan Li, D. 2006. Production of Hydrolysate with Antioxidative Activity by Enzymatic Hydrolysis of Extruded Corn Gluten. Applied Microbiology and
Biotechnology, 73: 763-770.
-
[2] Restiani, Ratih. 2016. Hidrolisis Secara Enzimatis Protein Bungkil Biji Nyamplung (Calophyllum
inophyllum) Menggunakan Bromelin. Biota, 1 (3).
-
[3] Anggraini A, dan Yunianta. 2015. Pengaruh Suhu dan Lama Hidrolisis Enzim Papain Terhadap Sifat Kimia, Fisik Dan Organoleptik Sari Edamame. Jurnal Pangan dan Agroindustri, 3 (3) : 1015 – 1025.
-
[4] Li, B., Qiao, M., and Lu,. F., 2012, Food Reviews International,
Composition, Nutrition, and
Utilization of Okara (Soybean Residue), 28:231–252, Taylor & Francis Group, DOI:
10.1080/87559129.2011.595023
-
[5] Yuslinawati, 2006, Skripsi: Isolasi dan Karakterisasi Sifat-Sifat Fungsional Protein Ampas Tahu, Jurusan ITP, FTP, IPB, Bogor.
-
[6] Wang, N.S. 2006. Amino Acid Assay by Ninhidrin Colorimetcric Method. <http://www.eng.umd/nsw/ench485/l ab3a.htm>. Akses tanggal 5 April 2020.
-
[7] Ma, C.-Y.; Liu, W.-S.; Kwok, K.C.; Kwok, F. 1997. Isolation and
Characterization of Proteins from Soymilk Residue. Food Res. Int., 29: 799–805.
-
[8] Mathias, E., Widjanarko, A., and
Sahlan, M., 2019, Michaelis-Menten Parameters Characterization of
Commercial Papain Enzyme “Paya”, Cosci – PBBMI IOP Conf. Series:
Earth and Environmental Science 217012037 IOP Publishing.
DOI:10.1088/1755-1315/217/1/012037
97
Discussion and feedback