KARAKTERISASI DAN UJI KEMAMPUAN AKTIVITAS SENYAWA ANTIOKSIDAN EKSTRAK JAHE MERAH (Zingiber officinale var rubrum) SECARA IN VITRO
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 10 Nomor 2, Oktober 2022
Cafaa tKjmia
KARAKTERISASI DAN UJI KEMAMPUAN AKTIVITAS SENYAWA ANTIOKSIDAN EKSTRAK JAHE MERAH (Zingiber officinale var rubrum) SECARA IN VITRO
Miftakul Sururi, Ni Wayan Bogoriani*, Ida Ayu Raka Astiti Asih Program Studi Kimia, FMIPA, Universitas Udayana, Bukit Jimbaran, Bali-Indonesia *
ABSTRAK: Jahe merah adalah umbi yang mengandung antioksidan berupa terpenoid, polifenol dan minyak atsiri yang sangat berguna untuk menurunkan oksidan dalam tubuh manusia. Tujuan dari penelitian ini yakni menentukan IC50 fraksi dari ekstrak jahe merah, kadar total flavonoid dan fenol yang terdapat pada jahe merah dengan aktifitas antioksidan terkuat, dan mengidentifikasi senyawanya. Metode DPPH digunakan untuk menentukan aktivitas antioksidan dan metode Folin-Ciocalteu untuk menentukan total flavonoid dan fenol serta identifikasi senyawa aktif menggunakan LC MS/MS. Nilai IC50 fraksi air, n-heksan, dan fraksi kloroform secara berutut-turut 52,92 µg/ml, 149,92 µg/ml, dan 108,10 µg/ml. dengan total flavonoid dan fenol fraksi air 34,9045 mg/g QE dan 2,37 mg/g GAE. Hasil identifikasi LCMS/MS menunjukkan fraksi air jahe merah mengandung Senyawa antara lain 6-gingerol, Zerumbone, 6-shogaol dan 10-gingerol yang muncul pada waktu retensi 3.89; 5.90; 8.60 dan 10.11. Disimpulkan bahwa fraksi air jahe merah mempunyai aktivitas antioksidan terkuat dengan kandungan senyawa aktif yang berkontribusi sebagai antioksidan.
Kata kunci: Jahe merah, flavonoid, fenol, DPPH, LC-MS/MS.
ABSTRACT: Red ginger is a spice that contains antioxidant compounds of terpenoids, polyphenols, and essential oils which are very useful for reducing oxidants in the human body. The IC50 determination of fraction from extract red ginger, the total levels of flavonoids and phenols found in red ginger with the strongest antioxidant activity, and to identify the compounds. The antioxidant activity determination using DPPH methods and the total flavonoids and phenols determination using Folin-Ciocalteu methods meanwhile the identification of active compounds using LC-MS / MS. The antioxidant activity test showed that the IC50 values of the water fraction, n-hexane, and chloroform fraction were 52,92 µg/ml, 149,92 µg/ml, and 108,10 µg/ml, respectively. with total flavonoids and phenols, water fraction 34.9045 mg/g QE, and 2.37 mg / g GAE. The results of LCMS / MS identification showed that the red ginger water fraction contained compounds are 6-gingerol, Zerumbone, 6-shogaol, and 10-gingerol which appeared at retention time of 3.89; 5.90; 8.60, and 10.11. Conclusion is red ginger water fraction has the strongest antioxidant activity with active compounds that contribute as antioxidants.
Keywords: Red ginger, flavonoids, phenols, DPPH, LC-MS/MS
Manusia tidak bisa lepas dari radikal bebas. Radikal bebas adalah senyawa yang memiliki elektron yang tidak berpasangan. Senyawa bereaksi dengan sel tubuh karena elektron-elektron yang tidak berpasangan tersebut berikatan dengan molekul sel-sel tubuh. Reaksi ini sering disebut sebagai oksidasi. Stress oksidatif diakibatkan adanya oksidasi berlebihan [13].
Asam nukelat, karbohidrat, protein, lemak dan DNA sel yang teroksidasi secara berlebih menginisiasi penyakit degeneratif seperti kanker, gangguan kognisi, dan koroner [7]. Antioksidan tubuh berupa enzim katalase, peroksidase, glutation, histidine-peptidin sering kali dirasa kurang dikarena akibat lingkungan. Sehingga senyawa antioksidan dari makanan sangat dibutuhkan [13].
Peristiwa oksidasi dapat diperlambat dengan adanya anioksidan. Antioksidan dapat dibedakan menjadi antioksidan enzimatik dan antioksidan non-enzimatik. Enzim superoksida dismutase, dismutase gluatathione peroksidase dan katalase merupakan contoh antioksidan enzimatik. Sedangkan golongan antioksidan non-enzimatik dibedakan antara antioksidan larut air dan antioksidan larut lemak. Antioksidan non-enzimatik berasal dari luar tubuh manusia yang berasal dari bahan alam maupun sintetik. Contoh dari antioksidan non-enziamatik yakni tokoferol, karotenoid, flavonoid, fenolik, quinon, bilirubin, vitamin C, Se dan Zn [16]. Penangkapan dan menstabilkan radikal bebas adalah karakter dari senyawa anioksidan[15]. Salah satu tanaman yang menjadi sumber antioksidan non-enzimatik adalah tanaman Jahe.
Jahe (Zingiber officinale) di Kuba merupakan sumber antioksidan yang memiliki senyawa fenolik seperti shagaol, gingerol, paradol, dan gingerdion [14]. Jahe disebutkan juga mengandung alkaloid, asam
askorbat, terpenoid, beta karoten, dan polifenol seperti flavonoid [2]. Jahe yang ditanam di negara Malaysia memiliki nilai IC50 sebesar 40 µg/mL menggunakan metode DPPH [4].
Jahe merah (Zingiber officinale var rubrum) adalah varian dari jahe yang telah ditanam di Indonesia. Aktivitas dan kegunaan jahe merah belum banyak diketahui masyarakat, Jumlah beberapa kandungan senyawa minyak atsiri jahe merah melebihi dari jumlah minyak atsiri dari jahe varietas lainnya [19].
Bahan-bahan yang digunakan meliputi jahe merah (Zingiber officinale var rubrum) yang berasal dari Desa Batubulan, Kecamatan Sukawati, Kabupaten Gianyar, metanol, etanol 96%, HCl pekat, 1,1-Diphenyl-2-picrylhydrazyl (DPPH), quercetin, asam galat, pereaksi Folin-Ciocalteu, pereaksi Wagner, pereaksi Dragendorff, pereaksi Meyer, kloroform, n-heksan, asam sulfat, anhidrat asetat, dan serbuk magnesium
Pada penelitian ini dipergunakan gelas ukur, Erlenmeyer, plat tetes, pipet tetes, bola hisap, pipet volume, LC-MS/MS, Vacuum Rotary Evaporator, Spektrofotometer UV-Vis
Rimpang jahe merah segar sebanyak 1 kg diparut. Maserasi dilakukan dengan pelarut etanol 96% selama 24 jam dengan pengadukan 6 jam pertama tiap interval 2 jam. Setelah itu dilakukan filtrasi antara filtrat dan residu. Filtrat dikumpulkan sedangkan residu diekstraksi lagi dengan metode yang sama sampai terekstraksi habis. Ekstrak pekat etanol diperoleh dari pemekatan Vacuum Rotary Evaporator.
Sejumlah 500 mg simpel, diberikan 1 mL asam klorida 2 N dan 9 ml, lalu selama 2 menit dipanasi pada penangas air, kemudian disaring dan didinginkan. Pada gelas arloji ditetesi 3 tetes filtrat, selanjutnya ditambahkan 2 tetes Wagner-Bouchard LP.
Reaksi Liebermann Burchard digunakan unuk mengidentifikasi adanya triterpenoid dan steroid. Sampel sebanyak 0,5 g ditambah 2 mL etanol 70% selanjutnya diuapkan pada cawan porselen. Penggunaan 0,5 mL kloroform dilakukan untuk pelarutan residu, setelah itu anhidrat asam asetat sebanyak 0,5 mL ditambahkan. Asam sulfat pekat 2 mL diberikan melalui dinding tabung.
Identifikasi flavonoid melalui penambahan 500 mg sampel dan 2 mL etanol 7% kemudian diaduk, setelah itu diberi serbuk 3 tetes HCl pekat dan magnesium 0,5 g. Terbentuknya warna kuning hingga merah memungkinkan adanya flavonoid.
Identifikasi saponin ditunjukkan ketika 0,5 g sampel dituang ke tabung reaksi, ditambah 10 mL air panas. Setelah dingin, kocok 10 detik. Terbentuknya buih antara 110 cm selama 10 menit. Apabila diberi 1 tetes HCl 2 M, buih tidak hilang.
Eksrak pekat jahe 5 g dimasukkan kedalam corong pisah lalu ditambah dengan air:n-heksana (1:1) hingga total volume 100 mL dan gojog hingga terpisah. Setelah terjadi pemisahan, fraksi n-heksan diambil sedangkan fraksi air akan ditambahkan kloroform sebanyak 50 ml. Kemudian digojog lagi hingga terjadi pemisahan. Tiap fraksi dievaporasi dan ditimbang untuk menentukan rendemen. Kemudian dilakukan uji antioksidan pada tiap fraksi.
Larutan 100 ppm tiap fraksi akstrak jahe disiapkan melalui pelarutan 10 mg ekstrak
tersebut kedalam 100 ml etanol. Dari larutan tersebut, dibuat konsentrasi larutan dengan variasi 0, 10, 25, 50, 100 dan 200 ppm. Pada tiap variasi diberikan larutan 1 ml larutan DPPH 1 mM (394,32 mg/L metanol), sehingga volume total menjadi 4 ml. Sebagai blanko, 1 ml DPPH tersebut ditambahkan etanol hingga volume akhir 4 ml. Inkubasi 30 menit dilakukan pada ruangan gelap dengan suhu 28οC. Selanjutnya pengukuran
absorbansi menggunakan spektrofotometer UV-VIS pada 517 nm. Hambatan (persentase) dihitung dengan rumus:
Abs Blanko - Abs sampel % inℎ =
Abs Blanko
Inhibition Concentration 50% (IC50) diperoleh dari hasil plot antara nilai inhibisi sebesar 50 dengan konsentrasi larutan melalui persamaan garis yang didapat dari hasil analisis diatas[21].
Kadar fenol total ditentukan melalui metode Folin-Ciocalteu dengan cara menyediakan 0, 10, 20, 30, 40, 50, 60, 70, 80, 90 dan 100 ppm larutan standar asam galat. Sedangkan fraksi ekstrak jahe dengan kemampuan antioksidan paling kuat sebanyak 1 g dilarutkan dalam 10 ml metanol 85%. Kemudian campuran tersebut disentrifus dengan kecepatan 4000 rpm. Larutan standard dan supernatant dipipet 4 ml dan ditambahkan 0,4 ml reagen Folin-Ciocalteun lalu didiamkan 6 menit. Setelah itu, ditambahkan 4,2 ml Na2CO3 5% dan didiamkan 30 menit. Pembacaan absorbansi dilakukan pada 760 nm terhadap larutan standard dan larutan supernatant tersebut [20].
Kadar flavonoid total dilakukan dengan cara mengambil sebanyak 0,1 g fraksi ekstrak jahe dengan kemampuan antioksidan paling kuat dilarutkan dengan 5 ml etanol 50 % lalu disentrifus 3000 rpm selama 15 menit. Supernatan yang diperoleh disaring,
sedangkkan filrat diencerkan hingga 5 ml. Sedangkan standar quercetin 0,01 g diencerkan menjadi 100 ml dengan etanol 50 %. Setelah itu, dibuat seri 0, 10, 20, 30, 40, 50 ppm. Tiap 1 ml larutan standar dan campuran filtrate akuades 1:1 ditempatkan pada tabung reaksi dan ditambahkan 1 ml AlCl3 2 %. Kemudian diinkubasi 30 menit dan dibaca nilai absorbansinya pada 415 nm setelah diinkubasi [20].
Fraksi air ekstrak jahe merah diidentifikasi dengan LC-MS/MS menggunakan parameter yang sesuai. Sampel dipreparasi dengan metode Solid Phase Extraction yakni pemisahan fase padat secara kromatografi yang tebuat dari N-vinylpyrrolodine untuk hidrofilik dan divinyilbenzene untuk hidrofobik. Metanol digunakan sebagai frasa gerak yang mengelusi senyawa sedangkan diklorometana untuk elusi senyawa non-polar. Larutan sampel yang telah dilarutkan dengan metanol dimasukkan ke dalam wadah yang sudah berisi fasa diam berupa syringe lalu dielusi dengan metanol kemudian ditampung. Selanjutnya sampel tersebuit dielusi dengan diklorometana dan ditampung. Hasil elusi dimasukkan ke dalam LC-MS/MS untuk dilakukan analisis. Spektrum massa diketahui dengan melakukan pembacaan menggunakan Program MasslynxV4.1 dari hasil kromatogram yang diperoleh.
Ekstraksi dimulai dari proses maserasi jahe merah kedalam etanol 96% selama 24 dengan pengadukan pada 6 jam pertama tiap interval 2 jam. Pada 24 jam pertama, rendaman masih berwarna coklat keruh yang menandakan bahwa ekstraksi masih bias dilakukan karena masih ada senyawa yang belum terekstrak habis. Setelah perendaman lagi 2 kali selama 24 jam, rendaman yang
dihasilkan sudah berwarna bening pada cairan etanol yang menandakan bahwa jahe merah telah terekstar habis dengan cairan etanol 96%. Dari 1085,27 gram jahe merah, menghasilkan sebanyak 190,97 gram ekstrak etanol jahe merah.
-
3.2. Skrining Fitokimia
Tabel 1.
Merah
Skrining Fitokimia
Ekstrak Jahe
Metabolit
Parameter
Uji Ekstrak
Alkaloid
Endapan putih-jingga
+
Flavonoid
Warna kuning-merah
+
Saponin
Terbentuk buih
+
Steroid
Cincin biru kehijauan
-
Triterpenoid
Cincin kecoklatan atau violet +
Endapan putih timbul di pereaksi mayer dan endapan warna coklat numcul di pereaksi bouchardt dimungkinan adanya alkaloid, reaksi penggantian ligan yang menyebabkan hal ini. Pada pereaksi-pereaksi tersebut timbul karena adanya pergantian pasangan elektron bebas antara ion iodo dengan nitrogen pada alkaloid [18]. Alkaloid bersifat semipolar karena terdiri dari sistem siklik nitrogen dengan substituen berupa gugus amida, fenol, amina, dan metoksi. Ion iodium I3- yang terbentuk dari pembentukan endapan ligan antara alkaloid dengan Kalium menghasilkan warna kecoklatan. Govindarajan pada tahun 1982 mengemukakan bahwa 2,4% jahe yang telah dikeringkan terdapat nitrogen. Selain dari protein, nitrogen pada jahe berasal dari alkaloid. Contoh alkaloid yang terdapat pada jahe adalah thiamin, niacin dan riboflavin.
Pengujian golongan flavonoid yang mulanya sampel disiapkan pada tabung dan ditambah FeCl3 dan HCl pekat, warnanya menjadi merah maka positif mengandung flavonoid. Gugus gula yang dimiliki flavonoid menyebabkannya lebih mudah larut dengan pelarut bersifat polar [8], ektraksi flavonoid yang polar dan senyawa aktifnya dapat dilakukan menggunakan etanol 70% [6]. Timbulnya reaksi warna
kuning adalah ciri adanya flavonoid terjadi akibat adanya reaksi reduksi senyawa flavonoid karena penambahan magnesium dan asam klorida[17]. Senyawa flavonoid pada jahe diperkirakan merupakan turunan dari 6-gingerol merupakan senyawa fenol yang memiliki aktifitas antioksidan, anti-jamur dan anti kanker.
Saponin cenderung bersifat polar dalam bentuk glikosida [6]. Timbulnya busa terjadi akibat senyawa saponin yang memiliki gugus polar berkumpul ke luar berbeda dengan non polar yang berkumpul ke dalam saat terjadi pembentukkan misel [17];[18]. Kemungkinan besar pada jahe merah terdapat senyawa golongan saponin. Mengingat bahwa jahe mengandung 7,6% gula pentosa dan bebarapa gula glukosa, fruktosa dan sukrosa [5].
Identifikasi triterpenoid dan steroid yang sering digunakan ialah reaksi Liberman-Bouchard (anhifdrat asetat-H2SO4 pekat). Hasil positif pengujian triterpenoid yakni hijau-biru dan pengujian steriod membentuk cincin biru kehijauan [6]. Senyawa terpen seperti zingiberene, curcumene dan zerumbone sebagian besar merupakan golongan minyak atsiri yang mudah menguap [23].
Setelah didapat ekstak etanol jahe merah, dilakukan fraksinasi dengan cairan air, kloroform dan n-heksan menggunakan corong pisah. Pemisahan ini dilakukan berdasarkan polaritas senyawa terhadap sifat pelarut. Pelarut air memiliki sifat polar, klorofrom semi-polar dan n-heksan non-polar. Pemisahan pertama dilakukan adalah pemisahan antara fraksi air dan fraksa n-heksan. Tahap ini dilakukan untuk memisahkan senyawa dengan sifat polar dan non-polar. Pemisahan ini mengahasilkan 2 lapisan. Bagian atas adalah fraksa n-heksan sedangkan bagian bawah yakni fraksa air dikarenakan massa jenis n-heksan lebih ringan dibandingkan air. Hasil pemisahan menghasilkan fraksi air sebanyak 3,91 gram
dan fraksi n-heksan 1,09 gram setelah dievaporasi. Kemudian Fraksi air yang telah terpisah, ditambahkan kloroform. Tahap ini merupakan tahap pemisahan antara fraksi dengan sifat polar dengan semi-polar Proses penggojogan dilakukan hingga membentuk dua lapisan. Lapisan bawah merupakan lapisan fraksi kloroform. Fraksi air akhir diperoleh adalah 2,67 gram dan fraksi kloroform 1,24 gram.
Uji aktifitas ini bertujuan untuk mengetahui kadar IC50 dari fraksi-fraksi ekstrak jahe merah. Fraksi yang diujikan adalah fraksi air, n-heksan dan fraksi kloform. Fraksi air mewakili senyawa polar, n-heksan sebagai pembawa senyawa non polar, dan kloroform membawa senyawa semi-polar.
Metode yang dilakukan sesuai pada metode penelitian sehingga pada pengukuran pada tiga fraksi diatas didapatkan nilai absorbansi dan inhibisi pada masing-masing fraksi yang dapat ditampilkan pada Tabel 2. Absorbasi yang diukur pada tiap konsentrasi tiap fraksi akan digunakan sebagai acuan perhitungan inhibisi. Inhibisi merupakan perbandingan antara absorbansi larutan DPPH tanpa perlakuan dengan larutan DPPH yang telah diberikan fraksi jahe merah dengan konsentrasi tertentu.
Tabel 2. Hasil pengukuran aktifitas antioksidan fraksi ektrak jahe merah dengan DPPH
|
Konsentrasi (ppm) |
Inhibisi (%) | ||
|
Air |
n-heksan Kloroform | ||
|
0 |
- |
- |
- |
|
10 |
9.45 |
6.54 |
5.80 |
|
25 |
23.62 |
11.20 |
12.55 |
|
50 |
47.24 |
18.96 |
23.82 |
|
100 |
94.48 |
34.49 |
46.35 |
|
200 |
100.00 |
65.55 |
91.41 |
Dari Tabel 2, persamaan linier inhibisi fraksi air diperoleh y = 0,94475 x + 0,0013 dengan r = 0,9978. Persamaan linier fraksi n-heksan adalah y = 0,3106 x + 3,4321 dengan r = 0,9986. Persamaan linier untuk fraksi kloroform adalah y = 0,4506 x + 1,289 dengan r = 0,9989. Interpolasi nilai 50% pada nilai y ke tiap persamaan akan menghasilkan nilai IC50. Nilai IC50 fraksi air, n-heksan dan kloroform secara berturut-turut adalah 52,92 ppm, 149,92 ppm dan 108,10 ppm. Tidak munculnya absorbansi pada nilai 200 ppm fraksi air hal ini disebabkan karena pada fraksi air, inhibisi 100% diperoleh pada konsentrasi 105,84 ppm dengan cara interpolasi nilai 100% ke persamaan garis untuk fraksi air. Semakin rendah nilai IC50, maka semakin kuat pula sifa antioksidan suatu materi. Pada tahun 2004, Molyneux menggolongkan aktifitas antioksidan senyawa ke beberapa golongan. Golongan antioksidan dengan aktifitas sangat kuat dengan IC50 kurang dari 50 ppm, golongan antioksidan kuat dengan 50-100 ppm, golongan antioksidan sedang memiliki nilai 100-150 ppm, sedangkan nilai 150-200 ppm dianggap sebagai antioksidan lemah, sedangkan senyawa yang memiliki nilai lebih dari 200 ppm dianggap sebagai senyawa dengan aktifitas sangat lemah. IC50 pada semua fraksi memiliki nilai yang lebih rendah dari 150 µg/ml, sehingga dapat dikatakan bahwa ekstrak jahe merah memiliki sifat anti oksidan yang kuat. Fraksi air dengan hasil 52,9 µg/ml yang memiliki nilai lebih rendah, hal ini karena air yang membawa senyawa polar lebih banyak dibandingkan dengan fraksi lainnya sebagai pendonor proton untuk menetralisir oksidan, sedangkan kloroform semi-polar dan n-heksan non-polar. Meskipun setiap fraksi menunjukkan nilai inhibisi yang rendah, tidak diperbolehkan penggunaan n-heksan dan kloroform dalam penggunaan terhadap makhluk hidup.
-
3.5. Total Fenol dan Flavonoid
Uji flavonoid menggunakan standar quarsetin sedangkan uji total fenol menggunakan standar asam galat. Metode yang digunakan tertera pada metode penelitian, memperoleh hasil pengukuran absorbansi yang tercantum pada Gambar 1 dan 2.
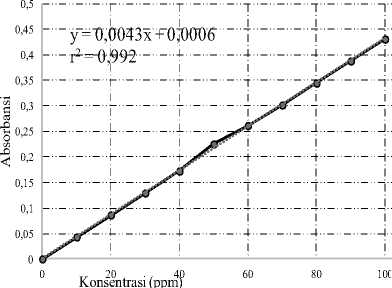
Gambar 1. Kurva kalibrasi Asam Galat
untuk penentuan kadar fenol total
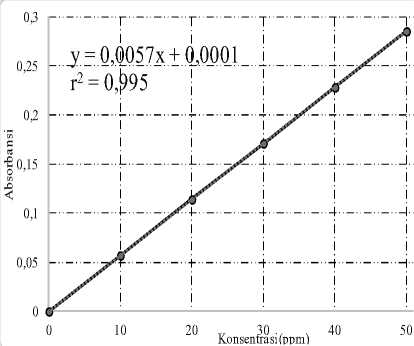
Gambar.2 Kurva kalibrasi quarsetin untuk penentuan kadar flavonoid total.
Extrapolasi antara absorbasi yang diperoleh dengan persamaan garis y = 0,0043 x + 0,0006 menghasilkan nilai rata-rata total fenol 2,3790 mg/g GAE. Galic Acid Equivalent (GAE) adalah satuan yang digunakan untuk pengukuran total fenol karena asam galat merupakan fenol yang dapat membentuk komplek dengan reagen Folin-Ciocalteau yang memberi warna untuk diserap pada Spektrofotometer UV-Vis.
warna yang dihasilkan untuk pembacaan pada Spektrofotometer UV-Vis merupakan senyawa komplek yang merupakan hasil dari reaksi antara fenol dengan reagen Folin-Ciocalteau.
Sebagian besar senyawa fenol pada jahe adalah gingerol, shogaol, zingeron, dan paradol. Senyawa-senyawa tersebut memiliki gugus hidroksi (-OH) pada cincin aromatis yang menandakan bahwa senyawa tersebut merupakan senyawa fenol [12]. Perendaman jahe merah pada air 100oC menyebutkan kadar fenol dari jahe merah adalah 12.5333 mg/g GAE [11]. Total fenol 132,541 mg/g GAE pada jahe merah yang dimaserasi dengan metanol p.a. dan 155.1784 mg/g GAE pada jahe merah yang dimaserasi dengan etanol 96% [3]. Perbedaan disebabkan oleh perbedaan lokasi pengambilan sampel, metode ekstraksi dan pelarut yang digunakan.
Dengan menggunakan persamaan grafik y = 0,0057 x + 0,0001. Dari grafik Gambar 2. dapat dicari nilai total fenol rata-rata yakni 34,9057 mg/g QE. Quarcetin Equivalent (QE) adalah satuan yang digunakan dalam penggunaan pengukuran total flavonoid. Kuarsetin adalah senyawa flavonoid yang sering dilakukan sebagai standar pengukuran total flavonoid. Senyawa flavonoid yang terdapat pada jahe berupa kuersetin, epikatekin, katekin, dan rutin [4]. Nilai total flavonoid disebutkan oleh Betty L 563.103 mg/g QE dengan maserasi metanol p.a. dan 609.655 mg/g QE dengan maserasi etanol 96%. Nilai IC50 tidak terlepas dari total fenol dan flavonoid. Senyawa flavonoid dan fenol memiliki sifat antioksidan yang dengan cara melepaskan H+ pada gugus hidroksi (-OH).
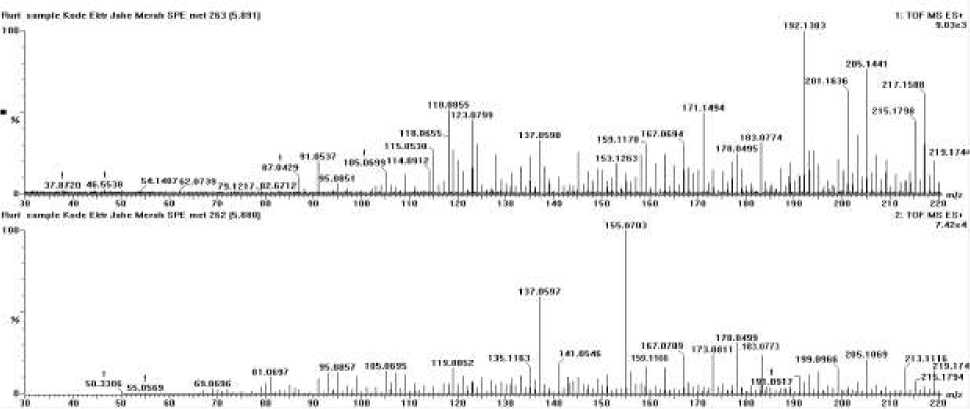
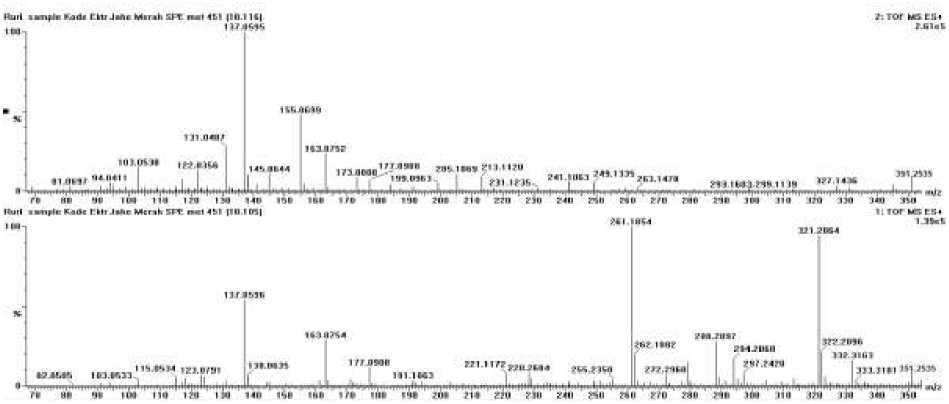
Hasil pembacaan Ekstrak Air Jahe merah menghasilkan kromatogram sesuai grafik pada Gambar 3. Kromatogram tersebut
menampilkan waktu retensi pada menit 3.89; 5.90; 8.60 dan 10.11. Selanjutnya akan diidentifikasi spektrum pada waktu retensi tersebut.
Spektrum (Gambar 4.) pada waktu retensi 3.89 menunjukkan puncak ion prekursor (M+H)+ dengan massa 295,1918 (C17H27O4). Ion produk yang ditampilkan pada massa 177,0908; 163,0750; dan puncak pada 137,0590 m/z. Senyawa pada waktu retensi 3.89 diprediksikan adalah 6-gingerol dengan rumus molekul C17H26O4 yang merupakan turunan fenol [9].
Spektrum (Gambar 5.) pada waktu retensi 5.90 puncak menunjukkan ion prekursor (M+H)+ dengan massa 219,1746 m/z (C15H23O) pada spektrum massa. Ion produk yang ditampilkan pada massa 183,0773 m/z dan 159,1166 m/z. Pada waktu retensi 5.90, diprediksikan merupakan senyawa Zerumbone dengan rumus C15H22O. Zerumbone merupakan senyawa monosiklik terpen dengan aktifitas antioksidan, antiinflamasi dan anti kanker [1].
Spektrum (Gambar 6) pada waktu retensi 8.60 menunjukkan ion prekursor (M+H)+ dengan massa 277,1796 (C17H25O3). Ion produk yang ditampilkan pada massa 155,0700 m/z dan puncak pada 137, 0603 m/z. Diperkirakan senyawa pada waktu 8.60 adalah 6-shogaol (C17H24O3). Senyawa ini merupakan golongan fenol yang bersifat antioksidan.
Spektrum (Gambar 7) pada waktu retensi 10.11 menunjukkan puncak ion prekursor (M+H)+ dengan massa 351,2535 (C21H35O4). Ion produk yang ditampilkan pada massa 177,0908 m/z; 163,07 m/z; dan puncak pada 137, 0596 m/z. Perkiraan senyawa ini adalah 10-gingerol dengan rumus senyawa (C21H35O4). Senyawa ini juga merupakan senyawa fenol dengan kekuatan antioksidan, anti inflamasi dan anti kanker.
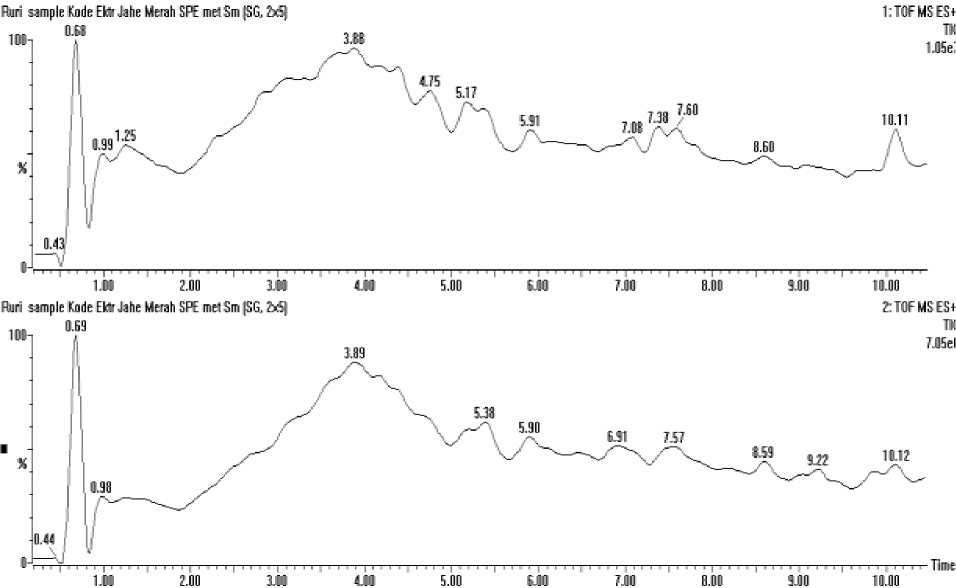
Gambar 3. Kromatogram fraksa air ekstrak jahe merah
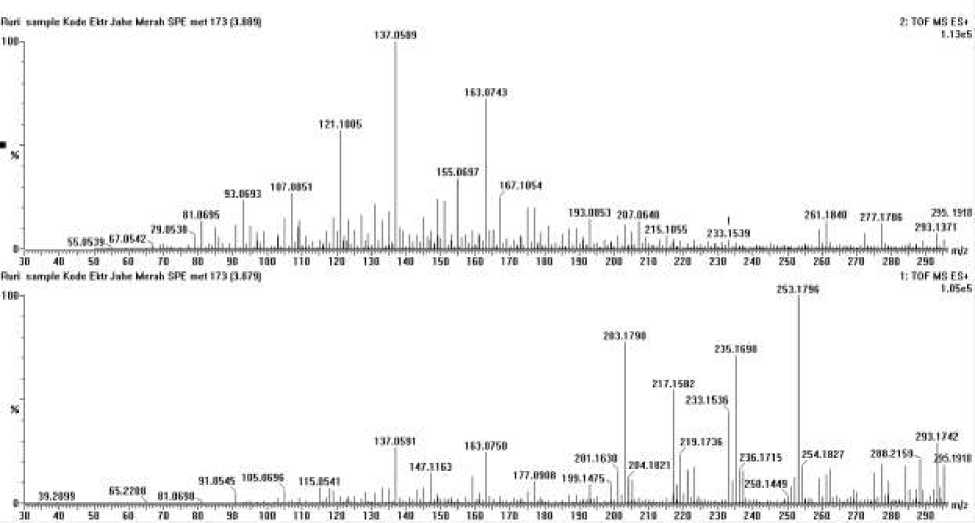
Gambar 4. Spektrum massa waktu retensi 3.89
Gambar 5. Spektrum massa waktu retensi 5.90
Ilwi wamp*c Pndc L» Jt∙c Merwh SPK -e∣ JK p.M-η f IDf MN tN«

Gambar 6. Spektrum massa waktu retensi 8.60
Gambar 7. Spektrum massa waktu retensi 10.11
Ekstrak jahe merah memiliki kemampuan IC50 yang baik. Tiga fraksi ekstrak jahe merah yakni fraksi air, n-heksan, dan fraksi kloroform memiliki nilai IC50 secara berutut-turut 52,92 µg/ml, 149,92 µg/ml, dan 108,10 µg/ml. Kemampuan IC50 tidak terlepas dai senyawa flavonoid dan fenol yang terdapat pada jahe merah. Total flavonoid dan fenol ekstrak jahe merah secara berutut-turut 34,905 mg/gr QE dan 2,3790 mg/gr GAE. Dengan menggunakan metode LC-MS/MS didapati 6-gingerol, Zerumbone, 6-shogaol dan 10-gingerol pada waktu retensi menit ke 3.89; 5.90; 8.60 dan 10.11.
-
[1] Akira. Murakami and H. Ohigashi. 2006, Cancer-preventive antioxidants that attenuate free radical generation by inflammatory cells, Biological
Chemistry, vol. 387, no. 4, pp. 387–392.
-
[2] Aruoma, O.I., Spencer, J.P., Warren, D., Jenner, P., Butler, J., dan Halliwell, B., 1997, Characterization of Food Antioxidants, Illustrated Using
Commercial Garlic and Ginger Preparations, Food Chem,60, 49–156.
-
[3] Betty Lukiati, Sulisetijono,
Nugrahaningsih, Rahmi Masita, 2020, Determination of Total Phenol and Flavonoid Levels and Antioxidant Activity of Methanolic and Ethanolic Extract Zingiber officinale Rosc var. Rubrum Rhizome, Universitas Negeri Malang:Malang, https://doi.org/10.1063/5.0002657
-
[4] Ghasemzadeh, A., Jaafar Z.E.H., dan Rahmat, A., 2010, Antioxidant Activities, Total Phenolics and Flavonoids Content in Two Varieties of Malaysia Young Ginger (Zingiber officinale roscoe), J. Molecules, 15, 4324-4333
-
[5] Govindarajan, V., 1982. Ginger
chemistry technology and quality evaluation: Part-I CRC. Critical Reviews in Food Science and Nutrition. 17,1–96.
-
[6] Harborne, J. B. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan, Terbitan Kedua: Penerbit ITB. Bandug. Hal. 239.
-
[7] Leong L.P., Shui, G. 2002, An Investigation of Antioxidant Capacity of Fruits in Singapore Markets, Food Chemistry 76:69-75
-
[8] Makham, K. R. 1988, Cara Mengidentifikasi Flavonoid: penerbit
ITB. Bandung. Hal.21, 27, 39
-
[9] National Center for Biotechnology Information. 2006,
pubchem.ncbi.nlm.nih.gov diakses 22 Desember 2020
-
[10] Nigam, M. C., Nigam, I. C., and Levi, L., 1964, Essential oils and their constituents. XXII. Detection of new trace components in oil of ginger, Can. J. Chem., 42, 2610
-
[11] Nurul M, P Wahyono1 and D Djunaedi, 2020, Antioxidant Activity and Total Phenolic Content of Three Varieties of Ginger (Zingiber Officinale) in Decoction and Infusion Extraction
Method, J. Phys.: Conf. Ser. 1567
022028
-
[12] Peng, F., Tao, Q., Wu, X., Dou, H., Spencer, S., & Mang, C. 2012, Cytotoxic, Cytoprotective and Antioxidant Effects of Isolated Phenolic Compounds from Fresh Ginger. Elsevier Fitoterapia,
83(3), 568-585.
-
[13] Pietta P-G. 1999, Flavonoids as
Antioxidants, Reviews, J. Nat. Prod., 63,1035-1042
-
[14] Pino Jorge A. 2004, Chemical Composition of The Essential Oil of Zingiber officinale roscoe L from Kuba. J. Essent Oil Res., 16, 186-88
-
[15] Prakash A., 2001, Antioxidants Activity, Medallion Laboratories Analytical Progress, Vol. 19 (2)
-
[16] Reynertson, K.A. 2007, Phytochemical Analysis of Bioactive Constituents from Edible Myrtaceae Fruit, Dissertation, The City University of New York, New York.
-
[17] Robinson, T. 1991, Kandungan Organik Tumbuhan Tingkat Tinggi. Bandung: Penerbit ITB. Pp. 152-196
-
[18] Sangi, M., M.R.J. Runtuwene.,H.E.I. Simbala.,V.M.A. Makang. 2008, Analisis Fitokimia Tumbuhan Obat di Kabupaten Minahasa Utara. Chem. Prog. 1(1):47-53.
-
[19] Setyawan, A dwi., 2002, Keragaman Varietas Jahe (Zingiber officinale rosc.) Berdasarkan Kandungan Kimia Minyak Atsir, J. BioSMART., 4, 48-54
-
[20] Suman Chandra, Shabana Khan, Bharathi Avula, Hemant Lata,1 Min Hye Yang, Mahmoud A. ElSohly, and Ikhlas A. Khan, 2014, Assessment of Total Phenolic and Flavonoid Content, Antioxidant Properties, and Yield of Aeroponically and Conventionally Grown Leafy Vegetables and Fruit Crops: A Comparative Study
-
[21] N.W. Bogoriani, A.A.B. Putra, S.Wahjuni, W.E. Heltyani, N.P.P.M.S Dewi, dan V.Y.K Sadin, 2020, The effect of Andong (Cordyline terminalis) leave, one of the traditional plants in Bali as antioxidant and antibacterial, IOP Conference Series: Earth and Environmental Science,
doi:10.1088/1755-1315/724/1/012018
70
Discussion and feedback