AKTIVITAS ANTIBAKTERI EKSTRAK METANOL KULIT PISANG PECAH SERIBU (Musa x paradisiaca L.) TERHADAP BAKTERI Staphylococcus aureus dan Escherichia coli
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 8 Nomor 2, Oktober 2020
AKTIVITAS ANTIBAKTERI EKSTRAK METANOL KULIT PISANG PECAH SERIBU (Musa x paradisiaca L.) TERHADAP BAKTERI Staphylococcus aureus dan Escherichia coli
Wiwik Susanah Rita, Irvansyah Habibi Resaputra*, I Made Sukadana
*
Program Studi Kimia, Fakultas MIPA, Universitas Udayana, Bukit Jimbaran, Bali, Indonesia.
ABSTRAK: Musa x paradisiaca L. merupakan salah satu jenis pisang yang berpotensi sebagai antibakteri. Tujuan penelitian ini adalah untuk mengetahui aktivitas antibakteri ekstrak metanol kulit buah pisang pecah seribu (Musa x paradisiaca L.) terhadap bakteri Staphylococcus aureus dan Escherichia coli serta menentukan kandungan metabolit sekundernya. Ekstraksi dilakukan dengan cara maserasi menggunakan pelarut metanol 95% pengujian aktivitas antibakteri dilakukan dengan metode sumur difusi, dan kandungan metabolit sekuder dalam ekstrak metanol dilakukan dengan uji fitokimia. Hasil uji fitokimia menunjukkan bahwa ekstrak mengandung metabolit sekunder flavonoid, fenol, alkaloid, dan triterpenoid. Hasil uji antibakteri menunjukkan bahwa Konsentrasi Hambat Minimum (KHM) dan Konsentrasi Bunuh Minimum (KBM) ekstrak metanol terhadap Staphylococcus aureus sebesar 4% dan Escherichia coli sebesar 6% dengan daya hambat masing-masing sebesar 6,83 dan 5,25 mm.
Kata kunci: Antibakteri, Musa × paradisiaca L., Staphylococcus aureus dan Escherichia coli.
ABSTRACT: Musa x paradisiaca L. is one type of banana that has potential as an antibacterial. The purpose of this study was to determine the antibacterial activity of the methanol extract of pecah seribu banana peels (Musa x paradisiaca L.) against Staphylococcus aureus and Escherichia coli and determine the content of secondary metabolites. Extraction was carried out by maceration using 95% methanol. Antibacterial activity assay was perfomed by the diffusion well method and the content of secondary metabolites in the methanol extract was carried out by phytochemical tests. The phytochemical test results show that the extract contains secondary metabolites of flavonoid, phenol, alkaloid, and triterpenoid. The antibacterial assay results revealed that the Minimum Inhibitory Concentration (MIC) and Minimum Bactericidal Concentration (MBC) of methanol extract against Staphylococcus aureus of 4% and Escherichia coli of 6% with inhibition of 6.83 and 5.25 mm, respectively.
Keywords: Antibacterial, Musa × paradisiaca L., Staphylococcus aureus and Escherichia coli.
Indonesia memiliki beranekaragam hayati yang dapat dimanfaatkan sebagai obat tradisional yang salah satunya adalah tanaman pisang. Hampir semua bagian tanaman pisang seperti akar, daun, batang, jantung, daging bahkan kulitnya dapat dimanfaatkan. Akan tetapi masyarakat sekarang belum memanfaatkan dengan optimal bagian-bagian tanaman tersebut seperti kulit pisang yang dibuang setelah dikonsumsi bagian dagingnya.
Kulit pisang memiliki kandungan fenolik dan bahan aktif seperti tanin dan flavonoid [1]. Kandungan tanin lebih banyak terdapat pada kulit buah pisang yang belum matang, karena terjadinya peningkatan etanol hingga 70 kali lipat, proses pematangan pisang menyebabkan turunnya kandungan tanin. Pada daging buah pisang mengandung rata-rata 11,21 % flavonoid dan 24,6 % flavonoid pada kulit pisang [2].
Menurut beberapa penelitian, kulit pisang dapat menghambat pertumbuhan bakteri seperti Escherichia coli dan Staphylococcus aureus. Escherichia coli adalah bakteri Gram negatif yang merupakan flora normal di usus manusia yang dapat menyebabkan infeksi saluran dan diare [3]. Staphylococcus aureus merupakan bakteri yang paling banyak menyerang manusia. Bakteri ini dapat menyebabkan iritasi saluran membran tubuh manusia, permukaan kulit, kelenjar keringat, dan saluran usus [4].
Pratama (2018) melaporkan bahwa ekstrak kulit buah mentah pisang kepok (Musa paradisiaca x balbisiana) mampu menghambat pertumbuhan bakteri S. aureus. Konsentrasi ekstrak kulit buah mentah pisang kepok (Musa paradisiaca x balbisiana) yang paling baik dalam menghambat pertumbuhan bakteri S. aureus adalah pada konsentrasi 100% [5]. Ningsih (2013) melaporkan bahwa ekstrak kental tanaman pisang kepok kuning baik itu akar, bonggol, pelepah daun, jantung, maupun buahnya memiliki potensi sebagai antibakteri S. aureus dan E. coli. Ekstrak
kental bonggol pisang kepok kuning memiliki diameter daerah hambat bakteri tertinggi terhadap S. aureus (20,39 mm) dan terhadap E. coli (18,96 mm) [6]. Salah satu pisang yang terdapat di Indonesia adalah pisang pecah seribu. Pisang tersebut banyak di tanam Masyarakat di kecamatan Tejakula Buleleng Bali. Akan tetapi kajian tentang aktivitas antibakterinya belum pernah dilakukan. Oleh karena itu, penelitian ini dilakukan untuk menguji aktivitas penghambatan terhadap
pertumbuhan bakteri Staphylococcus aureus (S. aureus) dan Escherichia coli (E. coli) dan menentukan metabolit sekunder yang terkandung di dalamnya.
Bahan–bahan yang digunakan dalam penelitian ini adalah kulit pisang pecah seribu dari buleleng, bakteri E. coli, bakteri S. aureus, akuades, metanol, tween 10%, amoxicillin, Nutrient Agar (NA), Nutrient Broth (NB), etanol 70%, KMnO4, FeCl3, serbuk Mg, asam asetat anhidrat, HCl pekat, H2SO4 pekat, HgCl2, KI, I2, dan natrium hidroksida. Alat–alat yang digunakan dalam penelitian ini adalah pisau, blender, wadah maserasi, rotary vacum evaporator merek Buchi R-100, seperangkat alat gelas, kapas, oven, desikator, autoklaf, plastik, neraca analitik, inkubator, cawan petri, kertas saring, aluminium foil, jarum ose, bunsen, pipet mikro, dan tip pipet mikro.
Kulit pisang pecah seribu dicuci bersih kemudian ditiriskan. Kulit yang sudah bersih dipotong kecil-kecil lalu dikeringkan dengan cara diangin-anginkan. Sampel yang sudah kering dihaluskan dengan blender untuk memperbesar luas permukaan. Serbuk sampel sudah siap untuk dimaserasi.
Uji kadar air
Cawan porselen dengan tutupnya ditimbang, kemudian dipanaskan dalam oven pada suhu 105°C selama 60 menit. Cawan porselen yang sudah dipanaskan, kemudian dimasukkan ke dalam desikator, dan setelah dingin ditimbang kembali. Pemanasan dilakukan beberapa kali pengulangan sehingga massanya konstan (perbedaan penimbangan berturut-turut tidak lebih dari 0,0005 g) [7]. Sebanyak 1 g sampel dimasukkan ke dalam cawan porselen yang massanya sudah konstan lalu ditimbang. Sampel dalam cawan porselen kemudian dipanaskan pada suhu 105°C selama 60 menit. Cawan porselen dibiarkan dalam keadaan tertutup dan mendingin dalam desikator hingga suhu kamar, kemudian ditimbang kembali. Pemanasan dilakukan beberapa kali hingga massanya konstan. Rumus penentuan kadar air adalah sebagai berikut:
massa awal - massa setelah dikeringkan
% Kadar Air = X 100
massa awal
Ekstraksi
Sampel kering kulit pisang pecah seribu ditimbang sebanyak 1000 g, dimaserasi dengan metanol selama 24 jam, disaring dengan kertas saring lalu ditampung dalam wadah kaca. Maserasi dilakukan 2 x 24 jam dan 1 x 24 jam pada suhu ruang. Seluruh maserat yang diperoleh dipekatkan dengan rotary vacum evaporator pada suhu 40°C hingga diperoleh ekstrak kental metanol.
Uji Aktivitas Antibakteri a. Sterilisasi alat
Peralatan gelas dimasukkan kedalam autoklave yang ditutup dengan rapat dan nyalakan autoclave dengan temperatur 121 oC dan tekanan antara 15-17,5 psi atau 1 atm selama 1 jam.
Bakteri uji yang tumbuh pada media Nutrient Agar (NA) miring digoreskan dengan jarum ose kemudian dimasukkan ke dalam 50 mL media Nutrient Broth (NB).
Bakteri uji selanjutnya diinkubasi dalam inkubator di suhu 37°C selama 24 jam.
Sebanyak 1,5 g media Nutrient Agar (NA) dilarutkan dalam 100 mL akuades steril. Media dipanaskan sampai mendidih. Pengadukan dilakukan dengan
menggunakan magnetic stirer untuk memastikan media tersuspensi sempurna. Setelah media tersuspensi sempurna, Nutrient Agar (NA) dituangkan ke dalam tabung reaksi sebanyak 10 mL lalu ditutup dengan kapas yang selanjutnya akan disterilisasi dengan autoklaf pada suhu 121 ºC dengan tekanan 1 atm selama 30 menit. Media yang sudah steril tersebut, dituangkan ke dalam cawan petri steril dengan tingkat kedalaman seragam ± 0,5 cm kemudian media didiamkan sampai memadat [8].
Ekstrak kental metanol dan etil asetat kulit pisang pecah seribu ditimbang sebanyak 2 g kemudian dilarutkan dalam 2 mL tween 10% sehingga didapat konsentrasi ekstrak 100%. Larutan stok 100% diencerkan menjadi konsentrasi 75, 50, 40, 30, 20, 15, 10, 8, 6, 4, dan 2% untuk selanjutnya dilakukan uji antibakeri dan ditentukan konsentrasi hambat minimum (KHM) dan Konsentrasi bunuh minimum (KBM). Tween 10% digunakan sebagai kontrol negatif.
Uji aktivitas antibakteri dilakukan dengan metode difusi agar (sumur difusi). Cawan petri yang telah diisi dengan media Nutrient Agar (NA) dan 200 μL suspensi bakteri uji disiapkan. Sumur difusi kemudian dibuat pada media Nutrient Agar (NA) yang telah memadat, dengan cork borer ukuran 0,5 cm yang dipanaskan dan ditekankan di media tersebut sehingga terbentuk sumur difusi. Setiap cawan petri dapat diisi dengan empat sumur difusi. Ekstrak kulit pisang seribu dengan konsentrasi 100, 75, 50, 40, 30, 20, 15, 10,
-
8, 6, 4, 2, dan 0% diambil sebanyak 20 μL dengan mikro pipet lalu dimasukkan ke dalam sumur difusi yang telah berisi kultur E. coli dan S. aureus pada masing-masing cawan petri, berikut pula tween 10% sebagai kontrol negatif dan amoxicillin 0,03% lalu diinkubasi dalam inkubator pada suhu 37°C selama 24 jam. Diameter zona bening yang timbul setelah masa inkubasi diukur dengan penggaris untuk mengetahui diameter zona hambat yang dihasilkan. Konsentrasi sampel terkecil yang dapat menghambat pertumbuhan bakteri (ditandai dengan adanya zona bening) ditentukan sebagai Konsentrasi Hambat Minimum (KHM).
Konsentrasi Bunuh Minimum (KBM) ditentukan dengan menginkubasi kembali hasil uji KHM yang telah dilakukan sebelumnya pada suhu 37°C selama 24 jam. KBM ditentukan pada konsentrasi terkecil dimana pada media tidak terdapat pertumbuhan koloni bakteri.
Uji ini dilakukan dengan mencampurkan 0,1 g ekstrak kulit pisang dengan 10 mL akuades kemudian ditambahkan 2 mL kloroform kemudian ditambahkan 2 mL amonia dan 3-5 tetes H2SO4. Larutan dibagi 2. Sebagian filtrat larutan ditambahkan dengan 4-5 tetes pereaksi Meyer, positif mengandung senyawa alkaloid jika menghasilkan endapan putih [9]. Sebagian lagi filtrat ditambahkan dengan 4-5 tetes pereaksi Wagner menghasilkan endapan coklat muda sampai kuning maka positif mengandung senyawa alkaloid [10].
Uji ini dilakukan dengan mencampurkan 0,1 g ekstrak kulit pisang dengan 10 mL akuades kemudian dipanaskan hingga mendidih selama 5 menit. Larutan dibagi 2. Sebagian filtrat ditambahkan 2 tetes HCl lalu dikocok
hingga berbusa. Hasil uji positif saponin jika busa tidak menghilang setelah 10 menit. Sebagian lagi ditambahkan larutan FeCl3 1%. Hasil uji positif tanin ditandai dengan terbentuknya warna biru tua atau hijau kehitaman [10].
Uji ini dilakukan dengan mencampurkan 0,10 g ekstrak kulit pisang dengan 15 mL akuades kemudian dididihkan selama 2 menit dan disaring. Untuk uji fenol, 5 mL filtrat ditambahkan beberapa tetes FeCl3 5%. Terbentuknya
warna hijau atau biru kehitaman menunjukkan adanya senyawa fenolik. Uji flavonoid dilakukan dengan memasukkan 5 mL filtrat ke dalam tabung reaksi, lalu mencampurkan 0,05 g serbuk Mg, dan 1 mL HCl pekat kemudian tabung dikocok kuat. Hasil uji positif flavonoid ditunjukkan oleh terbentuknya warna merah, kuning, dan jingga [10].
Uji ini dilakukan dengan mencampurkan 1 mL ekstrak kulit pisang dengan 10 tetes asam asetat anhidrat dan 2 tetes H2SO4 pekat (Lieberman-Buchard). Uji positif triterpenoid jika terbentuk warna merah, dan positif steroid jika terbentuk warna hijau atau biru [10].
Tujuan digunakannya sampel berupa serbuk saat proses ekstraksi adalah untuk memperluas permukaan sampel dan memperbesar kontak antara sampel dengan pelarut, sehingga semua komponen senyawa yang terdapat dalam sampel dapat terekstrak secara maksimal. Hasil penentuan kadar air sampel kering kulit pisang pecah seribu sebesar 9,11%.
Tabel 1 Hasil Uji Aktivitas Antibakteri Ekstrak Metanol pada Berbagai Konsentrasi
|
Konsentrasi (%) |
Rata-rata Daya Hambat (mm) ± SD E.coli (A) S. aureus (B) |
|
0 2 4 6 8 10 15 20 30 40 50 75 100 |
3 0,00 ± 0,00 a 0.00 ± 0,00 a 3 0,00 ± 0,00 a 0.00 ± 0,00 a 3 0,00 ± 0,00 a 6.83 ± 0,38 b 3 5,25 ± 0,25 b 8.12 ± 0,28 c 3 6,33 ± 0,14 c 8.92 ± 0,14 d 3 7,17 ± 0,52 cd 9.50 ± 0,25 de 3 7,83 ± 0,38 de 10.00 ± 0,25 e 3 8,58 ± 0,52 e 11.42 ± 0,52 f 3 9,83 ± 0,38 f 12.83 ± 0,87 g 3 11,25 ± 0,52 g 13.92 ± 0,38 h 3 12,92 ± 0,62 h 14.75 ± 0,25 i 3 13,42 ± 0,38 hi 15.33 ± 0,38 i 3 14,12 ± 0,62 i 16.25 ± 0,43 j |
*Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata berdasarkan Duncan’s Multiple Range test (p<0,05).
Tabel 2 Hasil Penentuan KBM Ekstrak Metanol terhadap Bakteri E. coli dan S. aureus
|
Konsentrasi (%) |
Daya hambat (mm) Kategori E.coli (A) S. aureus (B) (A)/(B) |
|
8 6 4 2 0 |
6.33 8.92 S / S 5,25 8.12 S / S 0.00 6.83 S / S 0.00 0.00 - / S 0.00 0.00 (-) |
|
Keterangan: SK = Sangat Kuat S = Sedang |
K = Kuat (-) = Negatif Antibakteri |
Simplisia yang baik adalah simplisia dalam kondisi kering dengan kadar air kurang dari 10%, sehingga dapat dikatakan kadar air sampel kulit buah pisang pecah seribu telah memenuhi standar [11].
Ekstrak kental metanol dipartisi dengan berbagai pelarut untuk memisahkan senyawa yang terkandung di dalamnya berdasarkan tingkat kepolaran. Prinsip dari proses partisi yaitu digunakannya dua pelarut yang tidak saling bercampur untuk melarutkan zat-zat yang ada dalam ekstrak. Ekstrak yang digunakan dalam penelitian ini adalah ekstrak dari kulit pisang pecah seribu. Pada penelitian ini dilakukan dengan menggunakan pelarut non polar (n-heksana), semi polar (etil asetat), dan polar (n-butanol). Hal ini disebabkan karena jika pada pengerjaan awal digunakan pelarut
polar, maka dikhawatirkan ada senyawa nonpolar yang ikut terlarut [12].
Pengujian aktivitas antibakteri dilakukan untuk mengetahui potensi ekstrak metanol kulit buah pisang pecah seribu sebagai antibakteri terhadap Escherichia coli dan Staphylococcus aureus. Metode yang digunakan adalah metode sumur difusi.
Uji dilakukan dengan berbagai konsentrasi seperti 100, 75, 50, 40, 30, 20, 15, 10, 8, 6, 4, 2, dan 0%. Pengujian dengan berbagai konsentrasi bertujuan untuk melihat pengaruh konsentrasi ekstrak terhadap daya hambat pertumbuhan bakteri E. coli dan S. aureus. Di samping itu, uji ini dilakukan untuk mengetahui KHM ekstrak
Tabel 3 Skrining Fitokimia Pisang Pecah Seribu
|
Senyawa |
Ekstrak Metanol Kesimpulan |
|
Uji alkaloid
Uji flavonoid
Uji fenol
Uji triterpene / steroid
merah-ungu/steroid: hujau-biru) Uji saponin (timbul buih) |
Terdapat endapan putih + Terdapat endapan coklat Merah bata + Biru kehitaman + Merah + Tidak Timbul buih - |
metanol. Hasil uji aktivitas antibakteri terhadap ekstrak metanol pada berbagai konsentrasi dapat dilihat pada Tabel 1.
Hasil pengujian aktivitas antibakteri ekstrak metanol terhadap bakteri E. coli dan S. aureus pada Tabel 1 menunjukkan bahwa terdapat perbedaan daya hambat yang diberikan oleh ekstrak metanol terhadap kedua bakteri yang diuji. Ekstrak metanol mampu memberikan daya hambat sampai pada konsentrasi 4% terhadap S. aureus dan 6% terhadap E. coli, sehingga dapat dikatakan bahwa KHM ekstrak metanol terhadap S. aureus sebesar 4% dan terhadap E. coli sebesar 6%.
Pengaruh terbaik ekstrak metanol kulit buah pisang pecah seribu dalam menghambat pertumbuhan bakteri ditunjukkan pada konsentrasi 100%. Hal ini karena semakin tinggi konsentrasi maka semakin tinggi daya hambatnya dan diduga konsentrasi yang tinggi mengandung senyawa aktif yang lebih banyak dibandingkan dengan konsentrasi lain [13].
Hasil uji beda Duncan’s menunjukkan bahwa konsentrasi memberikan pengaruh nyata terhadap diameter zona hambat bakteri S. aureus dan E. coli. Akan tetapi, pada konsentrasi 820% menunjukkan perbedaaan tidak nyata dalam menghambat pertumbuhan E. coli, sedangkan terhadap pertumbuhan S. aureus, perbedaan tidak nyata ditunjukkan pada konsentrasi 8-15%.
Penentuan KBM dilakukan dengan menginkubasi kembali hasil pengujian
KHM sebelumnya selama 24 jam lagi dan kemudian dilakukan pengukuran diameter bunuh yang terjadi. Hasil KBM ekstrak metanol dapat dilihat pada Tabel 2. KBM ekstrak metanol terhadap bakteri E. coli adalah sebesar 6% dan terhadap bakteri S. aureus sebesar 4%. Ekstrak yang memiliki KBM dengan konsentrasi kecil maka semakin baik potensial ekstrak tersebut sebagai antibakteri karena pada konsentrasi kecil ekstrak sudah dapat membunuh bakteri [14].
Skrining fitokimia dilakukan pada ekstrak metanol yang meliputi pengujian senyawa alkaloid, flavonoid, fenol, triterpenoid, steroid, dan saponin. Beberapa penelitian melaporkan bahwa senyawa metabolit sekunder dapat bertindak sebagai senyawa antibakteri secara individu, maupun bersama-sama dengan senyawa lainnya [15]. Hasil skrining fitokimia dapat dilihat pada Tabel 3. Tujuan penambahan HCl untuk meningkatkan kelarutan alkaloid agar membentuk garam yang mudah larut dalam air. Uji alkaloid dilakukan dengan pereaksi Mayer dan Wagner dimana hasil positif untuk pereaksi Mayer diperoleh yaitu endapan putih yang meruakan kompleks kalium-alkaloid dan endapan coklat untuk pereaksi Wagner. Proses pembuatan pereaksi Mayer dengan larutan merkuri (II) klorida ditambah kalium iodide berlebih membentuk kalium tetraiodomerkurat (II) [16]. Reaksi yang terjadi pada uji Mayer disajikan pada
HgCl2 + 2KI -------► HgI2 + 2KC1
HgI2 + 2KI --------► K2[HgI4]
Kalium Ietraiodomerkurat (II)
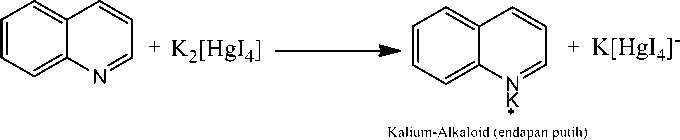
Gambar 1. Reaksi uji Mayer [16]
2
2HCl
Mg
+ MgCl2
Intermediet Resonansi
Gambar 2. Reaksi senyawa Flavonoid dengan logam Mg dan HCl [17]
OH
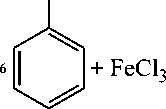
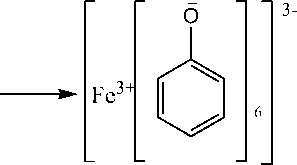
+3Cl- +6H+
Gambar 3. Reaksi senyawa Fenol dengan FeCl3 [18]
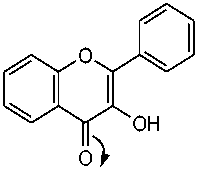
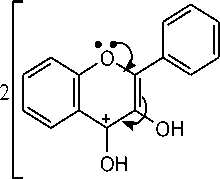
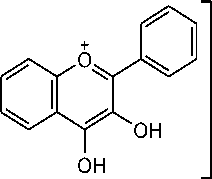
Gambar 1. Tujuan penambahan serbuk Mg dan HCl pada uji flavonoid yaitu untuk mereduksi inti benzopiron yang terdapat dalam struktur flavonoid sehingga terbentuk garam flavilium berwarna merah bata atau jingga. Reakasi senyawa flavonoid dengan logam Mg dan HCl disajikan pada Gambar 2.
Adanya senyawa fenol ditunjukkan dengan terjadinya perubahan warna dari kuning menjadi merah kehitaman. Reaksi pembentukan warna pada senyawa fenol terjadi karena ion hidroksi pada senyawa fenol bereaksi dengan Fe3+ dari pereaksi FeCl3 membentuk kompleks. Reaksi senyawa fenol dengan FeCl3 disajikan pada
Gambar 3. Kandungan total flavonoid dan total fenolik berkorelasi positif dengan aktivitas antibakteri, hal ini dibuktikan dengan penelitian sebelumnya yang menyatakan bahwa pisang pecah seribu memiliki kandungan flavonoid dan fenolik berturut-turut sebesar 2033,53 mg QE/100g dan 250,25 mg GAE/100g dapat menghambat pertumbuhan bakteri S. aureus sebesar 12,27 mm pada konsentrasi 20% dan 13,60 mm pada konsentrasi 50%, sedangkan bakteri E. coli sebesar 11,87 mm pada konsentrasi 20% dan 12,73 mm pada konsentrasi 50% [19].
Adanya kandungan senyawa triterpen ditunjukkan dengan terjadinya perubahan
Ac2O[H+]
--►
-HOAc
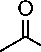
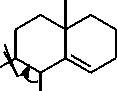
H
[H+]
-HOAc
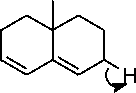
Gambar 4. Reaksi senyawa triterpen dengan pereaksi Lieberman-buchard [20]
warna dari kuning menjadi warna merah. Reaksi uji triterpen dan steroid yaitu pelepasan H2O dan penggabungan karbokation. Senyawa triterpen dan steroid akan mengalami asetilasi gugus hidroksil oleh asam asetat anhidrat. Gugus asetil merupakan gugus pergi yang baik, sehingga terbentuk ikatan rangkap. Selanjutnya terjadi pelepasan gugus hidrogen beserta elektronnya, mengakibatkan ikatan rangkap berpindah. Senyawa triterpenoid mengalami resonansi yang bertindak sebagai elektrofil atau karbokation. Serangan karbokation menyebabkan adisi elektrofilik, diikuti pelepasan hidrogen. Kemudian gugus hidrogen beserta elektronnya dilepas, akibatnya senyawa mengalami perpanjangan konjugasi yang memperlihatkan munculnya warna merah-ungu atau hijau [20]. Reaksi senyawa triterpen dengan pereaksi Lieberman-Buchard disajikan pada Gambar 4.
Ekstrak metanol kulit pisang seribu aktif sebagai antibakteri dengan Konsentrasi Hambat Minimum KHM dan Konsentrasi Bunuh Minimum KBM sebesar 4% terhadap S. aureus dan 6% terhadap E. coli dengan daya hambat sebesar 6,83 dan 5,25 mm. Semakin besar
konsentrasi yang diterapkan, maka daya hambat pertumbuhan semakin besar.
Penulis mengucapkan terima kasih kepada kepala laboratorium dan staff dari laboratorium kimia organik, laboratorium forensik, laboratorium penelitian Program Studi Kimia, FMIPA UNUD.
-
[1] Wardini, L. A. dan Sulandjari, S. 2017. Pengaruh Penambahan Tepung Kulit Pisang Kepok dan Kulit Jeruk Nipis Terhadap Hasil Lulur Tradisional. e-Journal Universitas Negeri Surabaya. 6(1):73-80.
-
[2] Dinastuti, R., Sri P. Y. S., dan Hidayati, D. Y. H. 2015. Uji
Efektifitas Antifungal Ekstrak Kulit Pisang Kepok (Musa acuminata x balbisiana) Mentah Terhadap Pertumbuhan Candida albicans Secara In Vitro. Majalah Kesehatan FKUB. 2(3):173-180.
-
[3] Jawetz, E., Melnick, J. L., dan Adelberg, E. A. 2010. Mikrobiologi Kedokteran. a.b., Mudihardi, E., Kuntaman, Wasito, E.B.,
Mertaniasih, N.M., Harsono, S., dan Alimsardjono, L., Salemba. Penerbit Buku Kesehatan Jakarta.
-
[4] Pelczar, M. J. dan. Chan, E. C. S. 1988. Dasar-Dasar Mikrobiologi. Jilid 2. a.b. Ratna Siri Hadioetomo. UI-Press. Jakarta.
-
[5] Pratama, H. Y., Ernawati, dan
Mahmud, N. R. A. 2018. Uji Antibakteri Ekstrak Kulit Buah Pisang Kepok (Musa paradisiaca x balbisiana) Mentah Terhadap Pertumbuhan Bakteri Staphylococcus aureus. Jurnal prodi pendidikan biologi FKIP. 7(2):147-152.
-
[6] Ningsih, A. P., Nurmiati., dan Agustien A. 2013. Uji Aktivitas Antibakteri Ekstrak Kental Tanaman Pisang Kepok Kuning (Musa
paradisiaca Linn.) terhadap
Staphylococcus aureus dan
Escherichia coli. Jurnal Biologi Universitas Andalas. 2(3): 207-213.
-
[7] SNI 01-2891-1992. 1992. Cara Uji
Makanan dan Minuman. Pusat Standardisasi Indusri. Departemen Perindustrian.
-
[8] Ngajow, M., Abidjulu, J., dan Kamu,
-
V. S. 2013. Pengaruh Antibakteri Ekstrak Kulit Batang Matoa (Pometia pinnata) terhadap Bakteri
Staphylococcus aureus secara In Vitro. Jurnal MIPA UNSRAT. 2(2):128-132.
-
[9] Tiwari, P., Kumar, B., Kaur, M.,
Kaur, G., and Kaur, H. 2011. A Review: Phytochemical Screening
and Extraction. Internationale Pharmaceutica Sciencia. 1(1):98-
106.
-
[10] Departemen Kesehatan Republik
Indonesia (Depkes RI). 1989. Materia Medika Indonesia Jilid V. Direktorat Pengawasan Obat dan Makanan. Jakarta.
-
[11] Depkes RI. 2000. Parameter Standar
Umum Ekstrak Tumbuhan Obat, Jakarta.
-
[12] Verdiana, M., Widiarta, I. W. R., dan
Permana, I. D. G. M. 2018. Pengaruh Jenis Pelarut pada Ekstraksi menggunakan Gelombang Ultrasonik terhadap Aktivitas Antioksidan
Ekstrak Kulit Buah Lemon (Citrus limon (Linn) Burn F.). 7(4):213-222.
-
[13] Rastina., Sudarwanto, M., dan Wientarsih, L. 2015. Aktivitas Antibakteri Ekstrak Etanol Daun Kari (Murraya koenigii) Terhadap Staphylococcus aureus, Escherichia coli, dan Pseudomonas sp. Jurnal Kedokteran Hewan. 9(2):187-188.
-
[14] Permata, P., Kawuri, R., dan Darmadi, A. A. K. 2018. Uji Aktifitas Antibakteri Ekstrak Etanol Kulit Buah Manggis (Gracinia mangostana L.) Terhadap Pertumbuhan Bakteri Escherichia coli. Jurnal Simbiosis. 6(1):7-11.
-
[15] Puspawati, N. M., Yasa, I. G. T. M., dan Suirta, I. W. 2018. Aktivitas Antibakteri Ekstrak Metanol Daun Cendana (Santalum album L.) Terhadap Bakteri Staphylococcus aureus dan Escherichia coli. Cakra Kimia. 6(2):116-122
-
[16] Ergina., Nuryanti S., dan Pursitari I. D. 2014. Uji Kualitatif Senyawa Metabolit Sekunder pada Daun Palado (Agave angustifolia) yang Diekstraksi dengan Pelarut Air dan Etanol. J.Akad.Kim. 3(3):165-172.
-
[17] Septyaningsih, D. 2010. Isolasi dan identifikasi komponen utama ekstrak biji buah merah (Pandanus conoideus lamk). Skripsi. Universitas Sebelas Maret. Surakarta.
-
[18] Arum, Y.P., Supartono., dan Sudarmin 2012. Isolasi dan Uji Daya Antimikroba Ekstrak Daun Kersen (Muntingia calabura), Jurnal MIPA. 35 (2):165-174.
-
[19] Siadi, K., 2012, Ekstrak Bungkil Biji Jarak Pagar (Jatropha curcas) sebagai Biopestisida yang Efektif dengan Penambhaan Larutan NaCl. Jurnal MIPA. 35(1):77-83.
-
[20] Rita, S. W., Swantara I. M. D., Asih, I. A. R. A., dan Puspawati, N. M. 2020. Antibacterial Activity and Antioxidant Capacity of Selected Local Banana Peel (Musa sp.) Methanol Extracts Cultivated In Bali.
International Journal of Agriculture, Environment and Bioresearch. 5(03):242-251.
91

Discussion and feedback