REDUKSI ION KROMIUM HEKSAVALEN MENGGUNAKAN FOTOKATALIS ZEOLIT ALAM TEREMBANKAN TiO2 DAN RADIASI SINAR UV
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 7 Nomor 2, Oktober 2019

REDUKSI ION KROMIUM HEKSAVALEN MENGGUNAKAN FOTOKATALIS ZEOLIT ALAM TEREMBANKAN TiO2 DAN RADIASI SINAR UV
I Made Sutha Negara*, I Nengah Simpen, Ewa Satriawijaya
Program Studi Kimia, Fakultas MIPA Universitas Udayana, Kampus Bukit Jimbaran, Bali-Indonesia *sutha_egar@yahoo.co.id
ABSTRAK: Tujuan penelitian adalah mempelajari kemampuan katalis zeolit alam terembankan TiO2 (zeolit alam/TiO2) untuk reduksi ion kromium heksavalen [Cr(VI)] pada variasi massa pengembanan TiO2 terhadap zeolit alam, variasi waktu penyinaran, dan variasi pH larutan Cr(VI). Selain itu, dipelajari pula keterkaitan antara persentase reduksi Cr(VI) terhadap karakteristik zeolit alam/TiO2 pada kondisi optimumnya. Katalis zeolit alam/TiO2 dianalisis asam-basa permukaan secara titrasi asam-basa, gugus fungsi permukann dengan fourier transform infrared (FTIR), luas permukaan secara sorpsi methylene blue, kristalinitas dan rerata ukuran kristal ditentukan dengan X-ray diffraction (XRD), dan morfologi permukaan dengan scanning electron microscopy (SEM). Jumlah Cr(VI) yang tereduksi dalam proses fotokatalisis dianalisis dengan spektroskopi UV-vis. Hasil penelitian menunjukkan bahwa karakteristik terbaik diperoleh pada katalis zeolit alam/TiO2 (100:9). Kondisi optimum reduksi Cr(VI) oleh zeolit alam/TiO2 (100:9) diperoleh pada waktu penyinaran 60 menit dan pH larutan 1, dengan reduksi sebesar 94,73% lebih efektif dibandingkan TiO2 tunggal (77,09%). Katalis tersebut potensial digunakan untuk reduksi Cr(VI).
Kata kunci: zeolit alam/TiO2, Cr(VI), fotokatalis, reduksi
ABSTRACT: Research to study the ability of TiO2 inserted natural zeolite (natural zeolite/TiO2) for reduction of hexavalent chromium ions [Cr(VI)] on various massa of TiO2 insertion toward natural zeolite, irradiation time, and pH of Cr(VI) solution was done. The other hand, relationship of percentage Cr(VI) reduction to natural zeolite/TiO2 characteritics on its optimum condition could be determinated too. Catalyst of natural zeolite/TiO2 was analyzed surface acidity-basicity by acid-base titration method, surface fuctional groups by FTIR, surface area by sorption of methylene blue, crystallinity and mean crystal size by XRD, and surface morphology by SEM. The amount of Cr(VI) reduction in photocatalytic were analyzed by UV-vis spectroscopic. Result showed that the catalyst of natural zeolite/TiO2 (100:9) had best characteristics. The optimum condition of Cr(VI) reduction were irradiation time of 60 minutes and pH 1, with percentage its reduction of 94.73% more effective than TiO2 catalyst (77.09%), which was potential to Cr(VI) reduction.
Keywords: natural zeolite /TiO2, Cr(VI), photocatalysis, reduction
Kromium dalam perairan, berada dalam bentuk kromium trivalen [Cr(III)] yang bersifat relatif kurang toksik, karena secara biologi diperlukan tubuh 50-200 μg per hari dan kromium heksavalen [Cr(VI)]
yang bersifat sangat toksik. Efek toksik dari Cr(VI) adalah dapat meracuni paru-paru, merusak ginjal, menyebabkan enzim tidak aktif, dan kerusakan kulit serta menyebabkan kanker [1]. Menurut World Health Organization (WHO), konsentrasi maksimum Cr(VI) yang diperbolehkan
dalam air minum adalah 0,05 mg/L [2]. Ion logam ini dapat masuk ke dalam tubuh melalui jalur pernafasan dan/atau pencernaan. Dalam proses pengolahan limbah, ion Cr(VI) penanganannya relatif lebih sulit (sangat selektif) dibandingkan ion Cr(III), termasuk sangat sulit didegradasi secara alami [1, 3]. Saat ini, banyak dikembangkan metode untuk minimalisasi kandungan toksik dalam limbah cair, antara lain metode koagulasi, elektrokimia, oksidasi, adsorpsi, biodegradasi, ozonisasi, dan fotodegradasi [4]. Diantara metode-metode yang ada, kombinasi adsorpsi-fotodegradasi merupakan metode yang cocok digunakan, karena relatif ekonomis, mudah diterapkan, dan aman. Adsorpsi-fotodegradasi merupakan metode jerapan (adsorpsi) oleh adsorben terhadap zat pencemar yaitu Cr(VI) pada tahap awal, selanjutnya terdegradasi (terurai secara oksidasi dan/atau reduksi) setelah diberikan sinar UV (irradiasi). Adsorpsi-fotodegradasi menggunakan katalis semikonduktor merupakan metode yang dapat digunakan untuk pengendalian dan penanggulangan limbah cair zat warna termasuk ion Cr(VI) agar dapat memenuhi baku mutu lingkungan yang diperbolehkan [5].
Metode fotodegradasi memerlukan bahan semikonduktor yaitu TiO2, ZnO, Cr2O3, dan/atau Fe2O3 serta bantuan irradiasi sinar ultra violet (UV). Titanium dioksida (TiO2) adalah katalis semikonduktor yang paling efektif, karena mempunyai energi celah (band gap) relatif besar (3,2 eV) yang cocok digunakan untuk fotokatalis, serta tidak beracun, harganya terjangkau, dan keberadaan di alam mudah diperoleh [6]. Keuntungan utama TiO2 adalah memiliki stabilitas kimia yang tinggi ketika berikatan dengan senyawa asam dan basa, tidak bersifat toksik, biaya relatif lebih murah dan kekuatan oksidasinya yang tinggi, sehingga membuatnya menjadi promotor katalis yang kompetitif untuk banyak aplikasi fotokatalis. Namun, fotokatalis TiO2 umumnya kurang maksimal jika digunakan dalam keadaan
murni, oleh karena mempunyai luas permukaan spesifik yang relatif rendah dan biaya operasional relatif lebih mahal [7]. Oleh karena itu, fotokatalis TiO2 (sebagai promotor) perlu diembankan ke dalam pori-pori suatu adsorben (matrik). Salah satu adsorben yang dapat digunakan sebagai matrik pengembanan adalah zeolit alam. Zeolit alam mempunyai struktur tiga dimensi yang stabil serta mempunyai luas permukaan spesifik dan porositas yang besar, sehingga dapat mengadsorpsi senyawa yang berukuran lebih kecil [8]. Selain itu, zeolit alam juga stabil secara kimia, bersifat ramah lingkungan (ecofriendly), dan mudah diperoleh sehingga harganya menjadi ekonomis [7]. Zeolit alam juga bersifat relatif lebih polar, sehingga diharapkan dapat mengadsorpsi molekul air. Hal ini berguna untuk memperkaya pembentukan radikal hidroksil selama proses fotokatalitik terjadi dalam mendegradasi polutan organik termasuk organo-logam [9]. Dengan menggunakan zeolit alam sebagai matrik katalis, maka dapat dihasilkan adsorben-fotokatalis yang memiliki kapasitas adsorpsi, efisiensi, dan aktivitas fotokatalitik sesuai yang diharapkan. Penelitian Fauzi et al. (2019), telah berhasil mendegradasi rhodamin B menggunakan fotokatalis zeolit alam-TiO2, dengan persentase degradasi tertinggi (97,39%) pada kondisi optimum (pH 4 pada 10 menit interaksi) [10]. Pemanfaatan fotokatalis TiO2 murni dan sinar UV untuk reduksi Cr(VI), telah dipelajari oleh Ma et al. (2012), diperoleh persentase reduksi 38,1% dan optimum pada pH 3 [11]. Ramataobane dan Mphela (2016), telah berhasil juga mereduksi Cr(VI) menggunakan fotokatalis TiO2 murni dengan persentase kurang dari 80% dan optimum pada pH 2 [12]. Persentase reduksi yang diperoleh lebih tinggi dibandingkan hasil penelitian Ma et al. (2017), namun keduanya masih menggunakan TiO2 murni (belum menggunakan matrik sebagai host) sehingga biaya operasional masih relatif lebih mahal [13].
Berdasarkan uraian tersebut, maka dipelajari kemampuan fotokatalis zeolit alam terembankan TiO2 untuk reduksi Cr(VI) pada variasi massa pengembanan TiO2 terhadap zeolit alam, variasi waktu penyinaran, dan variasi pH larutan Cr(VI). Selain itu, dipelajari pula keterkaitan antara persentase adsorpsi-fotodegradasi (reduksi) Cr(VI) terhadap karakteristik zeolit alam/TiO2 pada kondisi optimum.
Aktivasi zeolit alam dengan asam sulfat
Seratus gram zeolit alam lolos ayakan 200 mesh dimasukkan ke dalam 1000 mL akuades sambil diaduk dengan pengaduk magnet selama 3-4 jam. Zeolit alam disaring dan dikeringkan pada suhu 50oC sampai. Kemudian zeolit alam ditambahkan 1000 mL asam sulfat 2 M dan diaduk selama 14-16 jam dengan pengaduk magnet. Zeolit alam kemudian dicuci dengan akuades sebanyak 3 kali dan dikeringkan dalam oven pada suhu 120oC. Zeolit alam yang telah kering dihaluskan dan diayak kembali sampai lolos ayakan 200 mesh [10]. Selanjutnya zeolit alam dianalisis menggunakan FTIR.
Sintesis zeolit alam/TiO2
Zeolit alam dan TiO2 dicampurkan secara reaksi padat-padat dengan rasio zeolit alam/TiO2 100:3; 100:5; 100:7; dan 100:9. Campuran kemudian diaduk sampai homogen dan dikalsinasi dalam tanur pada suhu 3500C selama 12 jam [14]. Zeolit alam/TiO2 yang diperoleh dianalisis keasaman-kebasaan permukaan secara titrasi asam-basa, gugus fungsi dengan FTIR, dan Langmuir surface area secara sorpsi methylene blue, kristalinitas dan rerata ukuran kristal dengan XRD, dan morfologi permukaan dengan SEM. Karakteristik rasio massa terbaik, digunakan dalam penentuan kondisi optimum reduksi Cr(VI) dalam larutan.
Optimasi waktu penyinaran terhadap reduksi Cr(VI) menggunakan fotokatalis zeolit alam/TiO2
Tujuh buah gelas beker 50 mL yang telah dibungkus plastik hitam, masing-masing diisi dengan 25,0 mL larutan ion Cr(VI) konsentrasi 50 ppm. Tujuh gelas beker tersebut ditambahkan masing-masing 0,5 gram zeolit alam/TiO2 hasil karakteristik terbaik. Tujuh buah gelas beker berisi zeolit alam/TiO2 di diamkan selama variasi waktu kontak 5, 10, 15, 30, 45, 60, dan 90 menit. Filtrat yang
mengandung sisa ion logam Cr(VI) dan suspensi dipisahkan dengan sentrifugasi pada kecepatan 3500 rpm selama 10 menit. Konsentrasi ion logam Cr(VI) yang tersisa pada filtrat ditentukan dengan mengukur absorbansi filtrat pada panjang gelombang maksimum ion Cr(VI) menggunakan spektrofotometer UV-vis. Konsentrasi Cr(VI) sisa dihitung dari hasil pengkuran tersebut berdasarkan persamaan linear dari kurva standar sehingga didapatkan nilai konsentrasi sisa ion Cr(VI). Nilai konsentrasi ion Cr(VI) sisa kemudian dimasukkan ke dalam persamaan persentase reduksi yang dirumuskan sebagai berikut.
Persentase reduksi = x 100%
Co
Dimana, Co adalah konsentrasi Cr(VI) dan Ct adalah konsentrasi Cr(VI) dalam
kesetimbangan.
Optimasi pH terhadap reduksi Cr(VI) dengan fotokatalis zeolit alam/TiO2
Enam buah gelas beker 50 mL yang telah dibungkus plastik hitam, masing-masing diisi dengan 25,0 mL larutan ion Cr (VI) 50 ppm dengan variasi pH 1, 2, 3, 4, dan 6 dengan menambahkan HCl 0,5 M atau NaOH 0,5 M ke dalam larutan. Ke dalam masing-masing gelas beker, dimasukkan 0,5 gram fotokatalis zeolit alam/TiO2 dan diaduk sampai homogen
Tabel 1. Kebasaan dan Kebasaan Permukaan Katalis pada Berbagai Rasio
|
Katalis |
Kebasaan permukaan (mmol/g) |
Jumlah situs aktif basa (x1020 atom/g) |
Keasaman permukaan (mmol/g) |
Jumlah situs aktif asam (x1020 atom/g) |
|
Zeolit alam |
1,0485 |
6,3151 |
0,7952 |
4,7895 |
|
Zeolit alam/TiO2 |
1,4113 |
8,4988 |
0,5926 |
3,5686 |
|
(100:3) | ||||
|
Zeolit alam/TiO2 |
1,2495 |
7,5245 |
0,5469 |
3,2934 |
|
(100:5) | ||||
|
Zeolit alam/TiO2 |
1,2201 |
7,3474 |
0,5926 |
3,5686 |
|
(100:7) | ||||
|
Zeolit alam/TiO2 |
1,2054 |
7,2589 |
0,8517 |
5,1289 |
|
(100:9) |
selama waktu penyinaran optimum. Pemisahan dilakukan antara suspensi dan filtrat yang mengandung sisa ion Cr(VI), yang dilakukan dengan sentrifugasi pada kecepatan 3500 rpm selama 10 menit. Konsentrasi ion Cr(VI) yang tersisa dalam filtrat ditentukan dengan cara mengukur absorbansi filtrat pada panjang gelombang maksimum ion logam Cr(VI) menggunakan spektrofotometer UV-vis. Nilai presentase reduksi dihitung dengan cara yang sama dengan prosedur pada optimasi waktu penyinaran. Setelah didapatkan persentase reduksi, kemudian ditentukan pH optimum dengan cara dimasukkan ke dalam kurva hubungan antara persentase reduksi dan variasi pH.
Efektifitas reduksi Cr(VI) pada kondisi
optimum
Enam buah gelas 50 mL yang sudah dibungkus plastik hitam masing-masing diisi dengan 25,0 mL larutan ion logam Cr(VI) 50 ppm. Ke dalam enam buah gelas dimasukkan masing-maisng 0,5 gram zeolit alam/TiO2 dan diaduk sampai homogen. Tiga gelas dimasukkan ke dalam kotak penyinaran dan pembungkus plastik hitam dilepas. Gelas beker disinari sinar UV panjang gelombang 253,47 nm selama waktu penyinaran dan pH kerja optimum. Tiga buah gelas beker sisanya dilakukan perlakuan yang sama, namun tanpa mendapat penyinaran UV. Setelah dilakukan penyinaran dan tanpa penyinaran
selama waktu optimum, dilakukan pemisahan antara suspensi dan filtrat yang mengandung sisa ion logam Cr(VI) menggunakan alat sentrifugasi dengan kecepatan 3500 rpm selama 10 menit. Konsentrasi ion logam Cr(VI) yang tersisa dalam filtrat ditentukan dengan cara mengukur absorbansi filtrat pada panjang gelombang maksimumnya menggunakan spektrofotometri UV-vis. Nilai persentase reduksi dihitung dengan cara yang sama pada prosedur optimasi waktu kontak.
Kebasaan permukaan, keasaman permukaan, dan jumlah situs aktif permukaan
Kebasaan dan jumlah situs aktif basa permukaan zeolit alam/TiO2 mengalami penurunan seiring dengan peningkatan rasio TiO2 yang ditambahkan pada zeolit alam. Sementara, keasaman dan jumlah situs aktif asam permukaan mengalami peningkatan dengan peningkatan rasio TiO2 (Tabel 1). Jumlah situs aktif permukaan tertinggi adalah dihasilkan dari katalis zeolit alam/TiO2 (100:9). Jumlah situs aktif permukaan yang tinggi pada katalis zeolit alam/TiO2 akan mampu meningkatkan jerapan (adsorpsi) di tahap awal terhadap ion Cr(VI). Semakin tinggi kemampuan adsorpsi katalis zeolit alam/TiO2 terhadap Cr(VI) maka akan
dapat meningkatkan peluang reduksi terhadap Cr(VI).
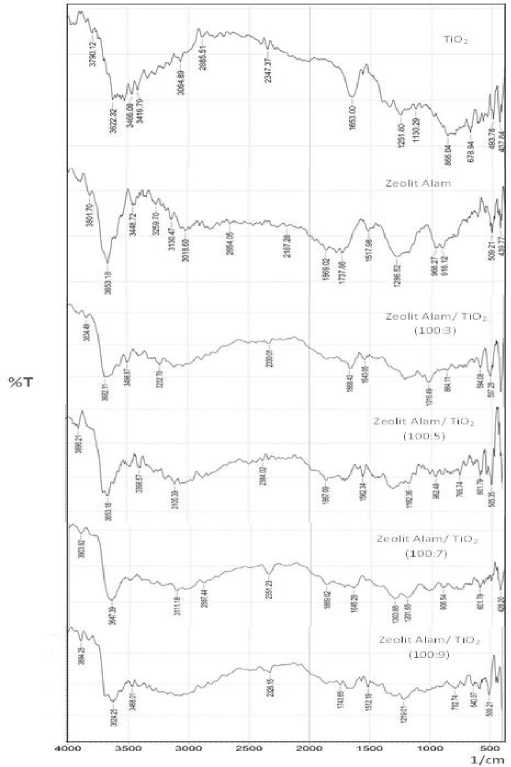
Gambar 1. Hasil spektra FTIR dari katalis pada berbagai rasio zeolit alam dan TiO2
Gugus fungsional permukaan
Gambar 1 menunjukkan bahwa serapan karakteristik O-H muncul pada bilangan gelombang 3624,25 cm-1 yang merupakan O-H regang dan serapan 1737,86 cm-1 merupakan O-H tekuk dari molekul H2O yang terperangkap pada zeolit alam [15]. Serapan bilangan gelombang 2347,37 cm-1 merupakan puncak khas dari TiO2, sementara serapan pada bilangan gelombang 1251,80 cm-1 dan 678,94 cm-1 merupakan regangan asimetris dari O-Si-O dan O-Al-O. Serapan pada bilangan gelombang 690,5 cm-1 sampai 420,5 cm-1 merupakan karakteristik dari ikatan Al-O
dan Si-O [16]. Serapan bilangan gelombang pada 2326,15 cm-1 dan 640,37 cm-1 merupakan puncak khas dari TiO2 yang mengindikasikan bahwa telah adanya TiO2 pada zeolit alam akibat pengembanan. Spektra FTIR pada zeolit alam/TiO2 rasio (100:3), (100:5), (100: 7), dan (100:9), terjadi pergeseran serapan bilangan gelombang pada 3682,11 cm-1, 3653,18 cm-1, 3647,39 cm-1, dan 3624,25 cm-1 yang merupakan ikatan O-H regang akibat terjadi dehidrasi dalam proses kalsinasi [10]. Titanium dioksida (TiO2) pada permukaan zeolit alam, dibuktikan munculnya serapan pada bilangan gelombang 2330,01 cm-1, 594,08 cm-1, 507,28 cm-1 (zeolit alam/TiO2 (100:3), 2384,02 cm-1 dan 601,79 cm-1 (zeolit alam/TiO2 (100:5), 2351,23 cm-1, dan 601,79 cm-1 (zeolit alam/TiO2 (100:7), serta bilangan gelombang 2326,15 cm-1, 640,37 cm-1 pada zeolit alam/TiO2 (100:9) yang merupakan karakteristik dari TiO2 [17].
Luas permukaan
Luas permukaan spesifik katalis ditentukan secara sorpsi methylene blue. Luas permukaan katalis sangat ditentukan oleh jumlah situs aktif yang ada pada permukaan katalis. Luas permukaan katalis zeolit alam/TiO2 (100:9) terbesar (Tabel 2) dibandingkan dengan luas permukaan rasio TiO2 yang lebih kecil. Pertambahan TiO2 yang diembankan pada zeolit alam menyebabkan fluktuasi luas permukaannya. Peningkatan luas permukaan spesifik sejalan dengan peningkatan jumlah situs aktif permukaannya (Tabel 1 dan 2). Dalam pengukuran ini, didasarkan pada model isoterm adsorpsi Langmuir, maka yang memberikan nilai untuk luas permukaan katalis adalah kemampuan katalis tersebut dalam mengadsorpsi methylene blue. Luas permukaan yang tinggi akan dapat memperbesar kemampuan katalis untuk mengadsorpsi Cr(VI) sehingga peluang untuk mereduksi Cr(VI) akan semakin tinggi pula.
Tabel 2. Luas Permukaan Spesifik Katalis
|
pada Berbagai Rasio | |
|
Katalis |
Luas permukaan spesifik (m2/g) |
|
Zeolit alam/TiO2 |
32,4494 |
|
(100:3) | |
|
Zeolit alam/TiO2 |
33,2272 |
|
(100:5) | |
|
Zeolit alam/TiO2 |
34,6334 |
|
(100:7) | |
|
Zeolit alam/TiO2 |
35,1935 |
|
(100:9) | |
Kritalinitas dan ukuran kristal
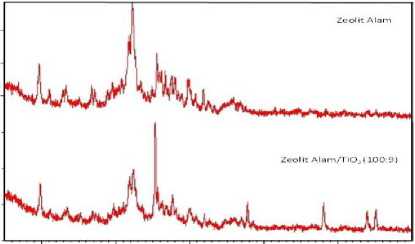
Hasil difraksi sinar-X (Gambar 2) diperoleh bahwa katalis zeolit alam dan zeolit alam/TiO2 tergolong kristalin dan semi kristalin. Persenyawaan TiO2 muncul pada 2θ 25,31o dengan intensitas relatif 100 counts serta muncul pada 2θ 37,79o, 48,00o, dan 53,88o dengan intensitas berturut-turut 23,06; 22,83 dan 16,38 counts. Ini berarti, kristal TiO2 telah masuk ke dalam struktur zeolit alam. Hal ini sejalan dengan penelitian Fadhil (2017), bahwa TiO2 cenderung membentuk kristalin dan semikristalin alami [18].
20 C)
Gambar 2. Difraktogram difraksi sinar-X dari katalis
Tabel 3. Rerata Ukuran Kristal dari Katalis
|
Katalis |
Rerata ukuran kristal |
|
(nm) | |
|
Zeolit alam |
254,5352 |
|
Zeolit alam/TiO2 |
77,3704 |
|
(100:9) |
Ukuran kristal zeolit alam lebih besar dibandingkan dengan zeolit alam/TiO2 (Tabel 3). Ini berarti, pengembanan TiO2 ke dalam struktur zeolit alam menyebabkan perubahan rerata ukuran kristal cenderung nanokristal.
Morfologi permukaan
Morfologi permukaan katalis zeolit alam/TiO2 (100:9) (Gambar 3) menampilkan bentuk partikel yang tidak beraturan (irregular shaped particles) dengan ukuran relatif lebih kecil dibandingkan dengan zeolit alam. Ukuran partikel yang lebih kecil disebabkan akibat masuknya TiO2 ke dalam struktur zeolit, kemungkingan terjadi pemecahan struktur semikristal zeolit alam dan penyusunan ulang strukturnya. Fenomena ini didukung juga dari hasil rerata ukuran kristal (Tabel 4), bahwa ukuran kristal katalis zeolit alam/TiO2 (100:9) lebih kecil (77,3704 nm) dibandingkan zeolit alam (254,5352 nm).

Gambar 3. Morfologi permukaan (a) zeolit alam dan (b) zeolit alam/TiO2 (100:9) pembesaran 9000x
Aktivitas Fotokatalis terhadap Reduksi Cr(VI)
Optimasi waktu penyinaran dan pH larutan
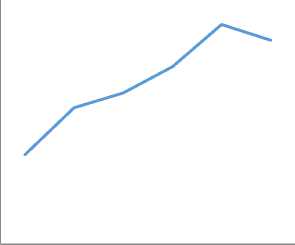
Waktu penyinaran optimum zeolit alam/TiO2 dalam mereduksi Cr(VI) (Gambar 4), menunjukkan bahwa dari menit ke-10 hingga menit ke-60 terjadi kenaikan reduksi Cr(VI). Setelah mencapai menit ke-60, proses reduksi tidak lagi mengalami peningkatan melainkan terjadinya sedikit penurunan persentase reduksi (92,02%) dari menit ke-60 menuju
menit ke-90. Hal ini terjadi karena kemampuan katalis zeolit alam/TiO2 dalam reduksi Cr(VI) telah mencapai titik optimum (kesetimbangan). Oleh karena itu, menit ke-60 dipilih sebagai waktu optimum reduksi Cr(VI) dengan persentase reduksi 92.79%.
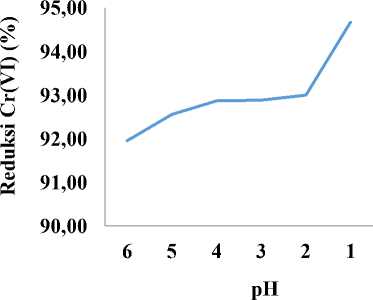
Kromium (VI) lebih mudah tereduksi pada pH yang lebih asam (Gambar 4), tertinggi diperoleh pada pH larutan 1 dengan reduksi 94,67% dan terendah pada pH 6 (91,95%). Kromium (VI) lebih mudah tereduksi pada pH asam daripada basa dapat dijelaskan berdasarkan teori pHpzc (point of zero charge). Nilai pHpzc dapat diartikan sebagai nilai pH permukaan suatu oksida yang tidak bermuatan. Nilai pHpzc untuk TiO2 adalah 6,5 [19]. Permukaan TiO2 akan bermuatan positif pada kondisi asam yang ditandai dengan adanya gugus TiOH2+, sehingga semakin banyak Cr(VI) yang mampu teradsorpsi pada permukaan zeolit alam/TiO2 dan bereaksi dengan radikal bebas [20]. Sementara, permukaan TiO2 akan bermuatan negatif pada kondisi basa akibat terbentuknya gugus TiO-, sehingga Cr(VI) tidak mudah diadsorpsi pada permukaan zeolit alam/TiO2 dan sulit direduksi oleh radikal bebas [21]. Hasil yang sama juga didapatkan oleh Mphela (2016) yang meggunakan TiO2 tunggal, menunjukkan bahwa reduksi Cr(VI) terjadi dalam suasana asam pH 2 dengan persentase reduksi 75,30% [19].
Efektivitas katalis
Reduksi Cr(VI) oleh katalis zeolit alam/TiO2 dengan dan tanpa irradiasi sinar UV diperoleh berturut-turut 94,73% dan 88% (Gambar 5). Sementara, reduksi Cr(VI) oleh katalis TiO2 dengan dan tanpa irradiasi sinar UV berturut-turut 77,09% dan 38,78%. Kemampuan zeolit alam/TiO2 dalam reduksi Cr(VI) disebabkan oleh kemampuan TiO2 yang bersifat semikonduktor dan kontribusi luas permukaan spesifiknya. Pada saat katalis tersebut dikenai irradiasi sinar UV, maka elektron-elektron dalam pita valensi mengalami eksitasi ke pita konduksi yang akan menghasilkan elektron (e-cb) dan mengalami
kekosongan atau hole (h+vb) pada pita valensi, yang bermuatan positif [22]. Selisih persentase reduksi Cr(VI) tersebut oleh katalis zeolit alam/TiO2 tanpa dan dengan irradiasi sinar UV membuktikan bahwa proses reduksi terjadi.
94,00
7 92,00
Cx
90,00
5 88,00
’s 86,00
£ 84,00
82,00
10 15 30 45 60 90
Waktu (menit)
Gambar 4. Optimasi waktu penyinaran dan pH terhadap reduksi Cr(VI)
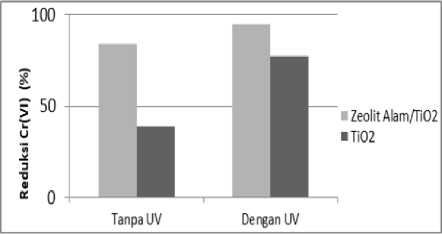
Gambar 5. Katalis zeolit alam/TiO2 dan TiO2 untuk reduksi Cr(VI) tanpa dan dengan irradiasi sinar UV
Karakteristik terbaik katalis diperoleh pada zeolit alam/TiO2 (100:9) yang memiliki jumlah situs aktif terbanyak, luas permukaan spesifik terbesar tergolong dominan kristalin dengan ukuran nanokristal dan bentuk partikel tidak beraturan. Optimasi reduksi Cr(VI) oleh katalis zeolit alam/TiO2 (100:9) diperoleh pada waktu penyinaran 60 menit dan pH larutan 1. Efektivitas reduksi Cr(VI) sebesar 94,73% lebih efektif dibandingkan TiO2 tunggal (77,09%). Oleh karena itu, katalis tersebut potensial digunakan untuk reduksi Cr(VI).
Diucapkan terimakasih kepada LPPM Universitas Udayana melalui Fakultas MIPA atas Penelitian Unggulan Program Studi tahun 2019 serta kepada teman sejawat di Program Studi Kimia Fakultas MIPA Universitas Udayana atas kontribusi pemikirannya.
DAFTAR PUSTAKA
-
[1] Dermatas, D. and Meng, X. 2004. Removal of As, Cr, and Cd by Adsorptive Filtration. Global Nest. The Int. J. 5(1): 73-80.
-
[2] WHO. 2011. Guidelines for Drinking Water Quality. Fourth Edition. World Health Organization.
-
[3] Suksabye, P., Nakajima, A.,
Thiravetyan, P., Baba, Y. and
Nakbanpote, W. 2009. Mecanism of Cr(VI) Adsorption by Coir Pith Studied by ESR and Adsorption Kinetic. J. Hazard. Mater. 161. 11031108.
-
[4] Simpen, IN., Suastuti, N.G.A.M.D.A., Negara, IM.S., and Ratnayani, O. 2018. Adsorption of Cr(VI) Using the Adsorbent of Hydroxyapatite Extracted from Bali Bovine Bone Waste and Coated with Fe-Al Oxides. Res J. Chem. Environ. Sci. 6(5): 2329.
-
[5] Madani, M.E., Harir, M., Zrineh, A., and Azzouzi, M.E., 2015.
Photodegradation of Imazethapyr Herbicide by using Slurry and Supported TiO2: Efficiency
Comparison. Arab. J. Chem. 8. 181185.
-
[6] Abdennouri, M., Baalala, M., Galadi, A. Makhfouk, M.E. Bensitel, M., Nohair, K., Sadiq, M., Boussaoud, A., and Barka, N. 2016. Photocatalytic Degradation of Pesticides by Titanium Dioxide and Titanium Pillared Purified Clays. Arab. J. Chem. 9. 313-318.
-
[7] Fatimah, I., Wang, S., Narsito, Wijaya, K. 2010. Composites of TiO2-
Aluminium Pillared Montmorillonite: Syntesis, Characterization and
Photocatalytic Degradation of Methylene Blue. Apllied Clay Sci. 50. 588-590.
-
[8] Slamet, Ellyana, M., dan Bismo, S. 2008. Modifikasi Zeolit Alam dengan Fotokatalis TiO2 melalui Metode Sol Gel dan Aplikasinya untuk Penyisihan Fenol. Laporan
Penelitian. Departemen Teknik Kimia. FakultasTeknik. Universitas Indonesia.
-
[9] Slamet, Abrianti, R., dan Marliana, E. 2007. Pengolahan Limbah Cr(VI) dan Fenol dengan Fotokatalis Serbuk TiO2 dan Cu/TiO2. Widyanuklida. 11(2): 78-85.
-
[10] Fauzi, W.A., Simpen, IN., dan Sudiarta, IW. 2019. Sintesis dan Karakterisasi Zeolit-TiO2 serta
Pemanfaatannya sebagai Fotokatalis untuk Degradasi Rhodamin B. Jurnal Kimia. 13(1): 82-88.
-
[11] Ma, C.M., Shen, Y.S. and Lin, P.H. 2012. Photoreduction of Cr(VI) Ions in Aqueous Solutions by UV/TiO2 Photocatalytic Processes. Int. J. Photoenergy. 7. 1-7.
-
[12] Ramataobane, K., and Mphela. 2016. Photocatalytic Degradation of Salicylic Acid and Reduction of Cr(VI) using TiO2. Int. J. Res. Chem.
Metallurgi. and Civil Eng. 3. 23491450.
-
[13] Ma, C., Wang, F., Zhang, C., Yu, Z., Wei, J., Yang, Z., Li, Y., Li, Y., Zhu, M., Shen, L., and Zeng, G. 2017. Photocatalytic Decomposition of Congo Red under Light Irradiation using MgZnCr-TiO2 Layered Double Hydroxide. Chemospere. 168. 80-90.
-
[14] Simpen, IN. 2001. Preparasi dan Karakterisasi Lempung
Montmorillonit Teraktivasi Asam Terpilar TiO2. Tesis. Universitas Gajah Mada. Yogyakarta.
-
[15] Agusty, I.P. 2012. Penggunaan Zeolit Terimpregnasi TiO2 untuk
Mendegradasi Zat Warna Congo Red. Skripsi. Departemen Kimia. Fakultas Sains dan Teknologi. Universitas Airlangga. Surabaya.
-
[16] Stuart, B., and Ando, D.J. 1999. Modern Infrared Spectroscopy.
John Wiley & Sons, New York.
-
[17] Utubira, Y., Wijaya, K., Triyono, E. 2006. Preparasi dan Karakterisasi TiO2-Zeolit Serta Pengujiannya pada Degradasi Limbah Industri Tekstil secara Fotokatalitik. Indones. J. Chem. 6(3): 231-237.
-
[18] Fadhil, D.H. 2017. Titanium oxide Nanoparticles: Analysis and
Photodegradation activity for Hexamethylpararosaniline chloride. J. Pharm. Sci. & Res. 9(5): 685-689.
-
[19] Mphela, R K., Msimanga, W., Pete, K Y.,Chiririwa, H., and Ochieng, A., 2016, Photocatalytic Degradation of Salicylic Acid and Reduction of Cr(VI) using TiO2, Int. J. Res. Chem. Metallurgi. and Civil Eng.3.
-
[20] Park, H. and Choi, W. 2005.
Photocatalitic Reactivities of Nation-Coated TiO2 for the Degradation Changed Organic Compounds under UV or Visible Light. J. Phys. Chem. B. 109(23):11667-11674.
-
[21] Okitsu, K., Iwasaki, K., Yobiku, Y., Bandow, H., Nishimura, R., and Maeda, Y. 2005. Sonochemical
Degradation of Azo Dyes in Aqueos Solution: a New Heterogeneous
Kinetics Model Taking into Account the Local Concentration of OH Radicals and Azo Dyes, J. Ultrasonic Sonochem. 12(4): 255-262.
-
[22] He, Z., Sun, C., Yang, S., Ding, Y., He, H., and Wang, Z. 2009. Photocatalitic Degradation of Rhodamine B by Bi2WO6 with Electron Accepting Agent under Microwave Irradiation: Mechanism and Partway. J. Hazard. Mater. 162. 1477-1486.
179
Discussion and feedback