ADSORPSI ZAT WARNA RHODAMIN-B DALAM LARUTAN OLEH ARANG AKTIF BATANG TANAMAN GUMITIR TERAKTIVASI ASAM FOSFAT
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 6 Nomor 1, Mei 2018
ADSORPSI ZAT WARNA RHODAMIN-B DALAM LARUTAN OLEH ARANG AKTIF BATANG TANAMAN GUMITIR TERAKTIVASI ASAM FOSFAT
Emmy Sahara*, Putu Sri Gayatri, Putu Suarya
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali
*Email : emmy_sahara@unud.ac.id
ABSTRAK: Zat warna rhodamin B adalah salah satu zat warna yang terdapat dalam limbah yang berasal dari industri tekstil/pencelupan. Salah satu cara yang dapat dilakukan untuk menangani pencemaran lingkungan perairan oleh adanya zat warna ini adalah adsorpsi dengan arang aktif. Arang aktif yang terbuat dari batang gumitir dan diaktivasi dengan asam fosfat telah dilaporkan dapat menurunkan kadar Cu dan Pb dalam air limbah pencelupan. Penelitian ini bertujuan untuk menentukan kapasitas adsorpsi arang aktif yang dibuat dari batang gumitir teraktivasi asam fosfat (H3PO4) 15% terhadap zat warna rhodamin B. Optimasi kondisi penyerapan dilakukan dengan menentukan waktu setimbang, isotherm adsorpsi dan pengaruh pH dalam mengadsorpsi zat warna rhodamin B. Hasil penelitian menunjukkan bahwa kondisi adsorpsi yang optimum terjadi pada waktu kontak selama 90 menit (jumlah maksimum adsorbat yang teradsorpsi 2,3437 mg/g), pH 3 (jumlah maksimum yang diserap adsorben 2,2778 mg/g) dengan konsentrasi isotherm adsorpsi sebesar 120 mg/L. Kapasitas adsorpsi pada kondisi optimum ini adalah 2,6320 mg/g. Proses adsorpsi arang aktif dari batang gumitir dalam penelitian ini tergolong kemisorpsi dengan energi adsorpsi sebesar 27,7338 kJ/mol (mengapa negatif)dan mengikuti model isotherm adsorpsi tipe Langmuir dengan nilai koefisien linier (R2) 0,8906.
Kata kunci: adsorben, arang aktif, kapasitas adsorpsi, rhodamin B
ABTRACT: Rhodamine B colorant is one of the dyes present in the waste coming from the textile/dyeing industry. One way that can be done to handle the pollution of the aquatic environment by the presence of this dye is adsorption with activated carbon. The phosphoric acid activated carbon made from marigold stem has been reported to be usefull in decreasing Cu and Pb from dyeing wastewater. This study aimed to determine the adsorption capacity of phosphoric acid (15% H3PO4) activated carbon made from marigold stems to rhodamine B dye. The optimization of absorption conditions was done by determining the equilibrium time, adsorption isotherm and the effect of pH in adsorpting Rhodamine B. The results showed that the optimum adsorption conditions occurred at contact time for 90 minutes, in which the maximum adsorbate adsorped was as much as 2.3437 mg/g, pH 3 with an adsorption isotherm concentration of 120 mg/L, in which an amount of 2.2778 mg ansorbate was adsorped by a gram of adsorbent. The adsorption capacity at the optimum conditions was of 2.6320 mg/g. The adsorption process of the activated carbon in this study was classified as chemisorpsi with an adsorption energy of 27.4113 kJ/mol and followed the isotherm adsorption of Langmuir model with the linear coefficient (R2) of 0.8906.
Keywords: adsorbent, activated carbon, adsorption capacity, rhodamine B
Dewasa ini penggunaan pewarna sintetik lebih diminati daripada pewarna alami karena sifat zat warna sintetik lebih murah, mudah digunakan, daya mewarnai kuat, stabil, tahan terhadap lingkungan. Setelah terkena air, zat ini akan sulit terdegradasi dikarenakan zat warna adalah senyawa sintesis yang sifatnya kompleks dan dirancang agar kuat terhadap cahaya, reaksi kimia dan biologi. Hal ini membuat konsentrasi limbah zat warna tinggi susah untuk dihilangkan. Salah satu zat warna yang sering digunakan yaitu zat warna rhodamin B. Masuknya rhodamin B berlebihan ke lingkungan akan mengubah pH perairan sehingga mikrooganisme dan hewan yang berada di lingkungan periran akan terganggu [1]. Dalam tubuh manusia akumulasi zat warna ini akan menimbulkan dampak serius seperti keracunan, kanker hati, iritasi saluran pernafasan, iritasi kulit, serta iritasi saluran pencernaan [2].
Salah satu cara yang dapat dilakukan dalam menangani pencemaran lingkungan perairan adalah adsorpsi dengan arang aktif. Proses aktivasi arang dilakukan untuk membersihkan kotoran yang menempel pada pori sehingga diameter pori arang lebih besar dan penyerapan yang tejadi lebih besar [3]. Arang aktif dapat dibuat dari bahan yang mengandung karbon. Bahan baku yang digunakan untuk pembuatan arang aktif dapat berasal dari limbah antara lain sekam padi, bonggol jagung, ampas penggilingan tebu, sabut kelapa [4]. Arang aktif juga dapat dibuat dari limbah batang gumitir. Arang limbah batang gumitir hasil karbonisasi pada suhu 300 ᴼC selama 90 menit [5], yang selanjutnya diaktivasi asam fosfat 15% [6] mempunyai karakteristik yang memenuhi standar SNI 06-3730-1995 sebagai arang aktif teknis.
Arang aktif limbah bonggol jagung yang teraktivasi asam sulfat (H2SO4) telah
dilaporkan dapat digunakan sebagai adsorben rodamin B. Limbah bonggol jagung dapat digunakan sebagai adsorben karena mengandung selulosa dengan gugus O-H [7]. Arang aktif limbah batang gumitir yang teraktivasi asam fosfat (H3PO4) mengandung karbon dengan gugus fungsi OH, C-H alifatik, P=O dan P-OH [5]. Arang aktif ini mempunyai luas pemukaan, situs aktif dan keasaman permukaan berturut-turut 36,4505m2/g; 37,1292x1020 molekul/gram;
6,1656 ± 0,0235 mmol/gram.Arang hasil
aktivasi ini memiliki kondisi lebih baik apabila dibandingkan dengan arang yang belum diaktivasi dengan luas pemukaan, situs aktif dan keasaman permukaan berturut-turut 28,2206 m2/g; 29,9920x1020
molekul/gram; 4,9804±0,0461 mmol/gram [8]. Dengan demikian, arang aktif batang gumitir berpotensi untuk digunakan sebagai adsorben zat warna rhodamin B, sehingga dapat mengurangi tingkat pencemaran oleh zat warna rhodamin B di lingkungan dan mahluk hidup.
Limbah batang tanaman gumitir dari Perkebunan Bali Gumitir Mayungan Baturiti Tabanan, aquades, asam fosfat (H3PO4), indikator phenolptalin, larutan buffer pH 4,00 ; 7,00 dan 11,00 serta Rhodamin B.
Penyiapan arang aktif dari batang gumitir Pembuatan arang aktif mengacu pada pembuatan arang aktif batang gumitir yang telah dikerjakan sebelumnya [8]. Sampel batang gumitir dicuci dengan air kran, lalu dibilas dengan aquades. Kemudian sampel dipotong kecil dan dijemur hingga kering. Sebanyak 600 gram batang gumitir kering dikarbonisasi dalam tanur pada suhu 300 ᴼC selama 90 menit. Kemudian tanur
didinginkan, arang yang terbentuk diayak dengan pengayak ukuran 200-100 mesh. Arang hasil ayakan selanjutnya diaktivasi asam fosfat 15% dengan dimasukkan ke dalam gelas beker sebanyak 100 gram dan ditambahkan 250 mL asam fosfat (H3PO4) dengan konsentrasi 15%. Campuran didiamkan selama 24 jam kemudian disaring dan dibilas dengan aquades hingga didapatkan pH netral.
Pembuatan kurva kalibrasi Rhodamin B
Sebanyak 1,0; 2,0; 3,0 dan 4,0 mL larutan standar Rhodamin B 1000 mg/L masing-masing dimasukkan kedalam labu ukur 100 mL dan diencerkan sampai tanda batas sehingga diperoleh larutan standar rhodamin B sebesar 10, 20, 30, dan 40 mg/L. Selanjutnya larutan tersebut diukur menggunakan spektrofotometer UV-VIS. Pengukuran diawali penentuan panjang gelombang maksimum Rhodamin dengan mengukur adsorbansi larutan Rhodamin B konsentrasi 20 mg/L. Panjang gelombang maksimum yang didapat akan digunakan untuk mengukur adsorbansi seri larutan standar Rhodamin B yang sudah disiapkan. Absorbansi yang diperoleh diplot dengan konsentrasi sehingga diperoleh kurva kalibrasi dan persamaan garis regresi linier.
Penentuan waktu setimbang
Waktu setimbang penyerapan arang aktif ditentukan dengan cara sebagai berikut: 7 erlenmeyer 250 mL yang diisi 1 g sampel arang aktif batang gumitir dan ditambahkan 25 mL larutan rodamin B 100 mg/L. Campuran diaduk dengan pengaduk magnet selama 30, 60, 90, 120, 150 dan 180 menit. Selanjutnya campuran disaring dan filtratnya diukur dengan spektrofotometri UV-visibel.
Penentuan pH optimum
Ke dalam 3 labu elenmeyer 250 ml masing-masing diisi dengan 1 gram arang yang telah diaktivasi. Masing-masing gelas kemudian ditambahkan 25,0 ml larutan Rhodamin B 100 mg/L dengan variasi pH larutan masing-masing 1, 2, 3, 5, 7, 9 dan 11. Campuran diaduk dengan pengaduk magnet selama waktu setimbang pada suhu kamar kemudian disaring dan filtratnya diukur dengan spektrofotometer UV-VIS. pH optimum adsorben dalam mengadsorpsi rhodamin B diketahui dengan membuat grafik antara banyaknya rhodamin yang teradsorpsi per gram adsorben dengan variasi pH.
Penentuan isoterm dan kapasitas adsorpsi
Kedalam 6 gelas erlemneyer dimasukkan masing-masng 1 gram arang aktif batang gumitir yang diaktivasi, kemudian ditambahkan 25 ml zat warna Rhodamin B sesuai pH optimum dengan konsentrasi rhodamin B yang bervariasi yaitu 20, 40, 60, 80, 100, 120 dan 140 mg/L . Campuran diaduk selama waktu setimbang pada suhu kamar kemudian disaring dan adsorbansi filtratnya diukur dengan spektrofotometer UV-VIS. Isoterm adsorpsi diketahui dengan membuat grafik antara banyaknya Rhodamin B yang teradsorpsi per gram adsorben dengan variasi konsentrasi.
-
3. HASIL DAN PEMBAHASAN
Pembuatan kurva kalibrasi Rhodamin B
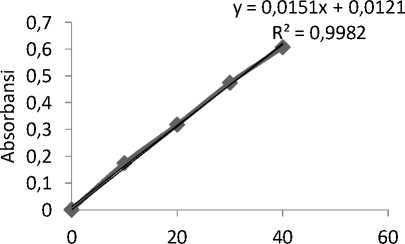
Pembuatan kurva kalibrasi larutan rhodamin B diawali dengan penentuan panjang gelombang maksimum larutan rhodamin B. Panjang gelombang maksimum ditentukan dengan menggunakan larutan rhodamin B 20 mg/L. Hasil pembacaan adsorbansi terhadap larutan rhodamin B 20 mg/L digambarkan pada grafik dengan
adsorbansi sebagai sumbu y dan panjang gelombang sebagai sumbu x, sehingga dapat diketahui panjang gelombang maksimum dari puncak yang terbentuk yaitu 553,6 nm. Panjang gelombang yang telah didapat digunakan untuk pembuatan kurva kalibrasi. Konsentrasi larutan rhodamin B yang digunakan dalam yaitu 0, 10, 20, 30 dan 40 mg/L. Pembuatan kurva kalibrasi dilakukan dengan pengukuran masing-masing larutan Rhodamin B dalam panjang gelombang maksimum (Gambar 1). Berdasar kurva di atas diketahui nilai R² sebesar 0,9982. Nilai ini menunjukan hubungan yang linier antara adsorbansi dan konsentrasi larutan yang diukur. Persamaan regresi linier yang diperoleh adalah y = 0,0151x + 0,0121.
Penentuan waktu setimbang bertujuan untuk mengetahui waktu minimum yang dibutuhkan oleh sejumlah adsorben untuk menjerap adsorbat sampai pada keadaan jenuh. Keadaan jenuh tercapai apabila ketika adsorben direaksikan dengan adsorbat, adsorben tidak mampu lagi menyerap adsorbat [9].
[Rhodamin B], mg/L
Gambar 1. Kurva kalibrasi Rhodamin B
Semakin lama waktu interaksi semakin banyak adsorbat yang teradsorpsi karena semakin banyak kesempatan partikel-partikel adsorben yang bersinggungan dengan
adsorbat sehingga semakin banyak adsorbat yang terikat dalam pori-pori partikel adsorbat [10]. Penambahan waktu interaksi tidak mempengaruhi adsorpsi apabila telah tercapai keadaan jenuh.
2,5000
2,0000 QD
'w 1,5000
£ 1,0000
0,5000
aktivasi
—■ tanpa aktivasi
0,0000
0 100 200 300
Waktu kontak (menit)
Gambar 2. Penentuan waktu kontak optimum
Dari Gambar 2 dapat dilihat adanya peningkatan jumlah adsorbat yang teradsorpsi akibat besarnya interaksi yang terjadi antara adsorben (teraktivasi dan tanpa aktivasi) dengan adsorbat.Tetapi setelah menit ke 90 terjadi penurunan jumlah adsorbat yang teradsorpsi dan konstan pada waktu interaksi selanjutnya yang akibat terjadinya kejenuhan pada situs aktif adsorben yang digunakan sehingga sehingga tidak mampu lagi mengadsorpsi zat warna rhodamin B lagi. Kapasitas adsorpsi terbesar pada waktu interaksi 90 menit untuk adsorben aktivasi dan tidak aktivasi berturut-turut 2,3437 mg/g dan 1,9868 mg/g.
pH merupakan suatu parameter yang berpengaruh pada proses adsorpsi. Penentuan pH optimum terhadap kapasitas adsorpsi bertujuan untuk mengetahui pH larutan zat warna rhodamin B saat proses adsorpsi zat warna tersebut yang maksimum. pH merupakan suatu parameter yang berpengaruh pada proses adsorpsi. Penentuan
pH optimum terhadap kapasitas adsorpsi bertujuan untuk mengetahui pH larutan zat warna rhodamin B saat proses adsorpsi zat warna tersebut yang maksimum. Pemberian perlakuan variasi pH mengubah konsentrasi ion H+ dan ion OH- dalam larutan. Pada pH asam (pH<7) konsentrasi ion H+ lebih besar daripada ion OH-, sebaliknya pada pH basa (pH>7) konsentrasi ion OH- akan lebih besar daripada H+. Variasi pH yang digunakan dalam penelitian ini adalah 1, 2, 3, 5, 7, 9, dan 11 dengan lama interaksi sesuai waktu setimbang. Hubungan kapasitas adsorpsi arang aktif dalam berbagai variasi pH terhadap rhodamin B dapat dilihat pada Gambar 3.
Semakin meningkat pH larutan rhodamin B yang digunakan maka persentase penurunan kapasitas adsorpsi akan semakin mengingkat pula hingga tercapai pH optimum pada pH 3-4 dan mengalami penurunan kapasitas setelah pH 4 [11]. Dari gambar 3 diketahui pada pH 1 sampai 3 terjadi peningkatan jumlah adsorbat yang teradsorpsi, akan tetapi terjadi penurunan pada pH 5, pada pH yang lebih tinggi kapasitas adsorspsi cenderung konstan dan pada pH 11 mengalami penurunan kapasitas adsorpsi.
2,5000
2,0000
M 1,5000
E.
∈ 1,0000
0,5000
0,0000
aktivasi
—■ tanpa aktivasi
0 1 2 3 4 5 6 7 8 9 10
pH
Gambar 3. Hubungan kapasitas adsorpsi dalam berbagai variasi pH
Hal ini karena pada kondisi asam (pH<7) ion Cl- yang ada pada rhodamin B terlepas sehingga bermuatan positif. Sedangkan pada pH basa, pelepasan ion Cl-akan terhambat akibat tertekan oleh ion OH-dalam larutan sehingga interaksi antara adsorben dengan rhodamin menjadi kecil [12].
Oleh karena itu, dapat dilihat bahwa kapasitas maksimum adsorpsi rhodamin B baik oleh arang teraktivasi maupun tanpa aktivasi paling besar pada kondisi pH 3 dengan kapasitas adsorpsi berturut-turut sebesar 2,2778 mg/g dan 2,0066 mg/g.
Perubahan konsentrasi adsorbat dalam proses adsorpsi sesuai dengan mekanismenya dapat dipelajari melalui penentuan isoterm adsorpsi. Isoterm adsorpsi yang biasa digunakan adalah isoterm adsorpsi tipe Langmuir dan Freundlich.Penentuan isoterm adsorpsi dilakukan dengan mengalurkan persamaan isoterm adsorpsi Langmuir dan Freundlich menjadi kurva kesetimbangan garis lurus dimana model kesetimbangan tergantung pada hasil koefisien determinasi (R) yang paling tinggi.Penentuan isoterm adsorpsi bertujuan untuk menentukan banyaknya jumlah ion Rhodamin B yang diadsorpsi oleh adsorben yang diaktivasi maupun tanpa aktivasi.Tipe isoterm adsorpsi dapat digunakan untuk mengetahui mekanisme adsorpsi adsorben terhadap adsorbat.Adsorpsi fase padat cair biasanya mengikuti tipe isoterm adsorpsi Langmuir dan Freundlich, dengan ikatan antara molekul adsorbat dengan permukaan adsorben dapat terjadi secara fisisorpsi dan kemisorpsi.
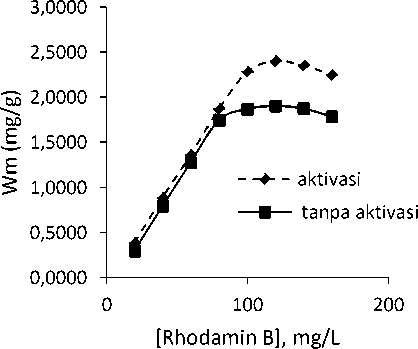
Gambar 4. Kapasitas adsorpsi arang terhadap berbagai rhodamin B
Dari Gambar 4 dapat diketahui bahwa terjadi peningkatan jumlah adsorbat yang teradsorpsi oleh adsorben aktivasi maupun tanpa aktivasi. Peningkatan jumlah yang teradsorpsi meningkat cukup signifikan dari konsentrasi awal 20 – 120 mg/L. Terjadinya peningkatan adsorpsi diakibatkan belum jenuhnya situs aktif pada permukaan adsorben sehingga semakin tinggi konsentasi zat warna rhodamin B maka akan semakin banyak molekul zat warna yang teadsorpsi [13]. Pada konsentrasi >120 mg/L terjadi penurunan yang tidak signifikan. Penurunan jumlah molekul yang teradsorpsi menunjukan permukaan adsorben yang digunakan telah melewati titik jenuh sehingga pori-pori pada permukaan adsorben tidak mampu lagi mengikat molekul-molekul zat warna yang masih tersisa pada larutan. Dari Gambar 4 diketahui bahwa konsentrasi maksimum untuk penyerapan zat warna rhodamin B pada konsentrasi 120 mg/L dengan kapasitas adsorpsi berturut-turut sebesar 2,4007 mg/g dan 1,9031 mg/g baik oleh arang batang gumitir yang diaktivasi maupun yang tidak diaktivasi.
Pembuatan kurva isoterm adsorpsi dilakukan dengan tujuan untuk mendapatkan
persamaan korelasi yang dapat digunakan dalam menentukan kapasitas adsorpsi, konstanta kesetimbangan dan energi adsorpsi.Hasil penentuan persamaan isoterm adsorpsi dilihat seperti Tabel 1.
Tabel 1 menunjukkan bahwa proses adsorpsi arang batang gumitir yang teraktivasi asam fosfat dan tanpa aktivasi cenderung mengikuti pola isoterm adsorpsi Langmuir. Persamaan isoterm adsorpsi Langmuir didasarkan pada terbentuknya lapisan monolayer dari molekul-molekul adsorbat dengan permukaan adsorben yang bersifat homogen.Ini menandakan bahwa pori-pori yang terbentuk pada arang batang gumitir bersifat homogen sehingga pada satu situs aktif permukaan hanya mampu menyerap satu jenis molekul adsorbat. Kompetisi pada situs aktif adsorben akan meningkat seiring dengan semakin meningkatnya konsentrasi adsorbat sehinga jumlah adsorbat yang terserap akan mengalami peningkatan pula [14].
Tabel 1. Nilai Koefisien Determinasi Tipe
Adsorpsi Langmuir dan Freundich
|
Tipe Isoterm Adsorpsi |
Aktivasi |
Tanpa Aktivasi |
|
Langmuir |
y = 181999x + 3,0702 R² = 0,8906 |
y = 209192x + 7,389 R² = 0,7670 |
|
Freundlich |
y = 0,3704x + 1,6648 R² = 0,4002 |
y = 0,4158x + 1,3006 R² = 0,3948 |
Pada isoterm adsorpsi tipe Langmuir, proses adsorpsi terjadi dengan mekanisme pertukaran ion pada permukaan adsorben sehingga ukuran pori adsorben dan molekul adsorbat sangat mempengaruhi. Apabila ukuran pori adsorben lebih besar dari ukuran molekul adsorbat maka proses pertukaran ion lebih mudah terjadi, tetapi apabila ukuran pori adsorben lebih kecil dari ukuran pori maka proses pertukaran ion akan sulit terjadi.
Pada permukaan adsorben terjadi pertukaran ion antara H+ yang ada pada permukaan dengan N+ pada rhodamin B. Berdasar pada kurva isoterm adsorpsi maka diperoleh nilai kapasitas adsorpsi optimum dari zat warna rhodamin B oleh arang batang gumitir yang teraktivasi dan tanpa aktivasi berturut-turut 2,6320 mg/g dan 2,2899 mg/g.
Fenomena ini sejalan dengan penelitian [15] bahwa pola isoterm adsorpsi arang teraktivasi ZnCl2 dalam mengadsorpsi zat warna rhodamin B mengikuti pola isoterm adsorpsi Langmuir. [16] juga mengungkapkan hasil sejalan bahwa adsorpsi zat warna rhodamin pada humin mengikuti pola isoterm adsorpsi Langmuir.
Karbon aktif teraktivasi asam fosfat menunjukkan bahwa terbentuk bilangan gelombang pada rentang 900 - 1200 cm-1 dikarenakan adanya penyerapan oleh OH, CH, C-OH dan CH2 pada unit glikosil dalam karbon aktif. Karbon aktif yang dihasilkan memiliki pola serapan dengan jenis ikatan OH, C=O, dan C-O [11]. Arang aktif batang gumitir teraktivasi asam fosfat memiliki serapan pada 1240,23 dan 1026,13 cm-1 yang terjadi karena penyerapan gugus P=O dan P-OH [14]. Adanya ikatan OH, C-O, P-O menunjukkan bahwa karbon aktif yang dihasilkan cenderung bersifat lebih polar. Dengan demikian karbon aktif yang dihasilkan dapat digunakan sebagai adsorben zat yang cenderung polar seperti untuk penjernihan air, gula, alkohol atau sebagai penyerap zat warna rhodamin B.
Adanya kecenderungan adsorpsi rhodamin B mengikuti pola isoterm adsorpsi model Langmuir juga dapat dilihat dari proses adsorpsi yang dilakukan. Isoterm adsorpsi Langmuir memiliki energi adsorpsi ≥20 kJ/mol karena molekul yang teradsorpsi tertahan pada permukaan oleh gaya valensi yang kuat dalam membentuk ikatan kimia sehingga dibutuhkan energi yang besar untuk
memutuskan ikatan [17]. Energi adsorpsi merupakan energi yang dihasilkan oleh satu mol zat warna (adsorbat) pada suatu adsorben. Energi adsorpsi dapat dijadikan acuan dalam menentukan proses adsorpsi yang terjadi apakah tergolong fisisorpsi atau kemisorpsi. Penentuan energi adsorpsi dengan rumus perubahan energi Gibbs, ∆ G ° = -RT ln K. Hasil penentuan energi adsorpsi, dari adsorben arang batang gumitir yang teraktivasi dan tidak diaktivasi berturut-turut sebesar 27,7338 kJ/mol dan 25,8664 kJ/mol. Energi adsorpsi yang didapat bernilai positif atau perubahan energi Gibbs negatif. Energi adsorpsi rhodamin B dengan arang ini lebih besar dari 20 kJ/mol sehingga berdasarkan besarnya energi maka adsorpsi yang terjadi dapat digolongkan sebagai kemisorpsi. Terjadinya kemisorpsi dikarenakan adanya reaksi pembentukan ikatan kimia antara adsorben dengan adsorbat yang bersifat ireversibel dengan energi yang cukup tinggi sehingga ikatannya sulit untuk diputuskan.
Waktu setimbang adsorpsi rhodamin B oleh arang batang gumitir teraktivasi asam fosfat terjadi pada waktu 90 menit pada pH 3 dengan konsentrasi isoterm adsorpsi adalah 120 mg/L, yang mengikuti pola isoterm adsorpsi Langmuir. Kapasitas adsorpsi arang aktif batang gumitir teraktivasi asam fosfat terhadap zat warna rhodamin B pada kondisi optimum yaitu 2,4007 mg/g
Penulis mengucakan terima kasih kepada dosen pembimbing, staff laboratorium bersama FMIPA, staff Laboratorium Jurusan Kimia dan semua pihak yang membantu hingga terselesainya penelitian ini.
|
DAFTAR PUSTAKA | ||
|
[1] |
Laksono, E.W., 2009, Kajian Penggunaan Adsorben Sebagai Alternatif Pengolahan Limbah Zat Pewarna Tekstil, Universitas Negeri Yogyakarta, Yogyakarta. |
[9] |
|
[2] |
Trestiati, M., 2003, Analisis Rhodamin B pada Makanan dan Minuman Jajanan Anak SD (StudiKasus : Sekolah Dasar di Kecamatan Margaasih Kabupaten Bandung), Thesis, Institut Teknologi Bandung, Bandung. |
10] |
|
[3] |
Manocha, S. M., 2003, Porous Carbon. Sadhana Press, India. |
[11] |
|
[4] |
Sembiring, T. M., dan Sinaga, T. S., 2003, Arang Aktif (Pengenalan dan Proses Pembuatannya), Universitas Sumatera Utara, Medan. | |
|
[5] |
Siaka, I M., Ni P D. Febriyanti, E. Sahara, dan I M. S. Negara, 2016, Pembuatan Dan Karakterisasi Arang Aktif Batang Tanaman Gumitir (Tagetes Erecta Pada Berbagai Suhu Dan Waktu Pirolisis, Cakra Kimia |
[12] |
|
(Indonesian E-Journal of Applied Chemistry) 4(2): 168 – 177 |
[13] | |
|
[6] |
Sahara, E., W. D. Sulihingtyas, dan Mahardika, I.P.A.S.,2017, Pembuatan Dan Karakterisasi Arang Aktif Dari Batang Tanaman Gumitir (Tagetes Erecta) Yang Diaktivasi Dengan H3PO4, Jurnal Kimia, 11 (1): 1 – 9 |
[14] |
|
[7] |
Munawaroh, I., 2012, Pemanfaatan Bonggol Jagung Sebagai Adsorben Rhodamin B Dan Metanil Yellow, Skripsi, Universitas Islam Negeri Sunan Kalijaga Yogyakarta. | |
|
[8] |
Sahara, E., Kartini, N. P. W., Sibarani, J., 2017, Pemanfaatan Arang Aktif Dari Limbah Tanaman Gumitir (Tagetes erecta) Teraktivasi Asam Fosfat (H3PO4) Sebagai Adsorben Ion Pb2+ Dan Cu2+ Dalam |
[15] |
Larutan, Cakra Kimia (Indonesian EJournal of Applied Chemistry), 5 (2): 67 – 74
Castellan, G. W., 1982, Physical Chemistry, Third Edition, General Graphic Servies, New York.
Gultom., Mulyana, E., dan Turmuzi, M., 2014, Aplikasi Karbon Aktif Dari Cangkang Kelapa Sawit Dengan Aktivator H3PO4 Untuk Penyerapan Logam Cd dan Pb, Jurnal Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatra Utara.
Kurniasih, M., A. Riapanitra, dan A. Rohadi, 2014, Adsorpsi Rhodamin B dengan Adsorben Kitosan Serbuk dan Beads Kitosan. Jurnal Sains & Matematika ISSN 2302-7290 Vol. 2 No. 2, Universitas Jenderal Sudirman, Purwokerto.
Nurmasari, R., M. D. Astuti, D. Umaningrum, dan D. A. Khusnaria. 2014. Kajian Adsorpsi Rhodamin B Pada Humin. Jurnal Kimia FMIPA Universitas Negeri Surabaya, Surabaya.
Cool, P., and Vansant, E. F., 1998, Pillared Clays: Preparation, Characterization andApplications, Laboratory of Inorganic Chemistry, University of Antwerp, USA.
Bhattcharyya, KG and Gupta, S.S., 2007, Adsorptive Accumulation of Cd(II), Cu(II), Pb(II) and Ni(II) from Water On Montmorillonite, Influence of Acid Activation. Journal Of Colloidand Interface Science, 310: 411-424.
Bhadusha N., And Ananthabaskaran, T., 2012, Kinetic, Thermodynamic And Equilibrium Studies On Uptake Of Rhodamine B Onto ZnCl2 Activated Low Cost Carbon, E-
Journal Of Chemistry 9(1): 137-144, India.
-
[16] Mohideen, M. Faizal, M. Faiz, H. Salleh, H. Zakaria, and R. V. Raghavan, Drying of Oil Palm Frond via Swirling Fluidization Technique. Proceedings of the World Congress on Engineering, (2011) Vol III.ISSN : 2078-0966.
-
[17] Atmoko, R. D., 2012, Pemanfaatan Karbon Aktif Batu Bara Termodifikasi TiO2 pada Proses
Reduksi Gas Karbon Monoksida (CO) dan Penjernihan Asap Kebakaran, Skripsi, Fakultas Teknik, Universitas Indonesia.
45
Discussion and feedback