PREPARASI TiO2-TERSENSITIFKAN AgCl DENGAN TEKNIK REFLUKS DALAM SUASANA ASAM DAN KARAKTERISASINYA
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 6 Nomor 1, Mei 2018
PREPARASI TiO2-TERSENSITIFKAN AgCl DENGAN TEKNIK REFLUKS DALAM SUASANA ASAM DAN KARAKTERISASINYA
Ratna Novita Sari, Hari Sutrisno*
Jurusan Pendidikan Kimia, FMIPA, Universitas Negeri Yogyakarta, Jl. Colombo No. 1, Kampus Karangmalang Yogyakarta 55281, Indonesia
*E-mail: sutrisnohari@uny.ac.id
ABSTRAK: Titanium dioksida (TiO2)-tersensitifkan variasi prosen berat AgCl (TiO2@AgCl): 0; 1,3; 3,4; 8,3 dan 15,2% dihasilkan dalam suasana asam. Material
TiO2@AgCl dipreparasi dari reaksi emulsi TiO2 (rutile)-teradsorpsikan ion Cl-, AgNO3, dan HNO3 dengan teknik refluks pada temperatur 150oC selama 6 jam. Keberadaan AgCl sebagai sensitiser terbentuk dari reaksi ion Cl- yang terabsorbsi pada permukaan TiO2(rutile) dengan ion Ag+ yang berasal dari larutan AgNO3. Sampel TiO2@AgCl yang berisi variasi % berat AgCl: 0; 1,3; 3,4; 8,3 dan 15,2% diperoleh dari reaksi TiO2 (rutile) teradsorpsi ion Cl- dengan variasi % berat perak (Ag): 0; 1,5; 3; 6 dan 9% yang berasal dari AgNO3. Semua TiO2@AgCl yang dihasilkan dikarakterisasi dengan X-Ray Diffraction (XRD) dan Spektrofotometer UV-Vis Diffuse Reflectance. Dalam semua sampel (TiO2@AgCl) mengandung anatase (minor), AgCl (minor) dan rutile (major), kecuali pada TiO2 tanpa AgCl hanya berisi anatase (minor) dan rutile (major). Energi celah pita (Eg) sampel TiO2@AgCl pada prosen berat AgCl: 1,3; 3,4; 8,3 dan 15,2% secara berturut-turut: 3,24; 3,00; 3,09 dan 2,95 eV, sedangkan pada TiO2 tanpa AgCl sebesar 3,05 eV. Ukuran kristal masing-masing fasa dalam TiO2@AgCl yaitu sekitar 5-9 nm untuk fasa anatase, 9-11 nm untuk fasa rutile dan 37-60 nm untuk fasa AgCl.
Kata Kunci: pensensitif anorganik, teknik refluks, energi celah pita
ABSTRACT: Titanium dioxide (TiO2) sensitized AgCl variations in weight percent (wt%) (TiO2@AgCl): 0; 1.3; 3.4; 8.3 and 15.2% were obtained on the acidic conditions (pH≈2). Materials of TiO2@AgCl were obtained from the reaction of TiO2(rutile) adsorbed Cl- ions, AgNO3, and HNO3 via reflux technique at temperatures of 150oC for 6 hours. The existence of AgCl as sensitiser formed from the reaction of Cl-ions are absorbed on the surface of TiO2 (rutile) with Ag+ ions originating from AgNO3 solution. Samples of TiO2@AgCl that contain variations wt% AgCl: 0; 1.3; 3.4; 8.3 and 15.2% was obtained from the reaction of
TiO2(rutile) adsorbed Cl- ions at variation wt% of silver (Ag): 0; 1.5; 3; 6 and 9% originating from AgNO3. All of TiO2@AgCl were characterized by X-Ray Diffraction (XRD) and UV-Vis Spectrophotometer Diffuse Reflectance. In all samples (TiO2@AgCl) contains anatase (minor), AgCl (minor) and rutile (major), except on TiO2 without AgCl only contain anatase (minor) and rutile (major). Band gap (Eg) of TiO2@AgCl at AgCl variations in wt%: 1.3; 3.4; 8.3 and 15.2% is 3.24; 3.00; 3.09 and 2.95 eV respectively, whereas the band gap of TiO2 without AgCl is 3.05 eV. The size of each crystal phase on TiO2@AgCl is about 5-9 nm for the anatase phase, 9-11 nm for the rutile phase and 37-60 nm for AgCl phase.
Keywords: anorganic sensitizer, technique reflux, band gap
Titanium dioksida (TiO2) atau titania merupakan semikonduktor tipe-n memiliki berbagai keunggulan, antara lain: kestabilan yang tinggi, ketahanan terhadap
korosi, ketersediaan yang melimpah di alam, dan harga relatif murah [1]. Selain itu, TiO2 bersifat non toksik dan memiliki sifat redoks yaitu mampu mengoksidasi polutan organik, mereduksi sejumlah ion logam dalam larutan dan tersedia secara
komersial serta preparasinya yang mudah dilakukan di laboratorium [2]. Adanya keunggulan tersebut, TiO2 diaplikasikan sebagai pewarna dalam industri cat, kertas, dan plastik [3], degradasi senyawa organik [4], penjernih air [5], antibakteri [6], fotokatalis [7], sel surya [8] dan pengembangan hidrofil aktif permukaan atau superfotohidrofil oleh sinar matahari atau ultra violet [9].
TiO2 umumnya ditemukan dalam tiga tipe struktur kristal yaitu rutile (tetragonal), anatase (tetragonal), dan brookite (ortorombik) [8]. Kristal rutile dan anatase cukup stabil dan biasa digunakan sebagai fotokatalis. Secara fotokatalitik, anatase menunjukkan aktivitas yang lebih baik dari segi kereaktifan dibandingkan dengan rutile [10]. Energi celah pita (Eg) dari anatase sebesar 3,2 eV, sedangkan rutile sebesar 3,0 eV [11]. Harga energi celah pita tersebut berhubungan dengan maksimal serapan panjang gelombang yang berkisar dari 365 hingga 413 nm (daerah UV). Hal tersebut menjadi problem yang besar dalam aplikasi spektrum matahari berbasis TiO2, dikarenakan hanya 5% dari sinar matahari dalam daerah UV. Oleh karena itu, berbagai usaha dilakukan untuk memperbaiki respon TiO2 terhadap sinar tampak [12].
Berbagai metode untuk sintesis TiO2 telah banyak dilakukan, antara lain: sol gel, hidrotermal, solvotermal, elektrodeposisi, metal organik, MOCVD (Metal Organic Chemical Vapor Deposition), sonokimia dan pengendapan [13]. Penelitian ini menggunakan metode pengendapan dengan teknik refluks, karena tingkat kemudahan dalam mengontrol temperatur dan tekanan sehingga struktur dan morfologi dapat direkayasa. Teknik refluks dengan temperatur 83oC selama 15 jam menghasilkan titanium dioksida fasa brookite dengan kemurnian tinggi dan campuran fasa rutile dan anatase terbentuk setelah dilakukan refluks selama 5-10 jam pada temperatur 70oC. Selain itu preparasi partikel anatase dan rutile berukuran nano diperoleh dengan metode hidrotermal dari
TiCl4 [14]. Pada penelitian tersebut dilaporkan bahwa keasaman yang tinggi dari konsentrasi TiCl4 mempengaruhi pembentukan rutile, sedangkan pada pH 3,4 - 8,2 dihasilkan anatase.
Pembentukan struktur kristal dalam sintesis TiO2 dipengaruhi oleh beberapa faktor diantaranya temperatur kalsinasi, pH larutan, konsentrasi pendadah, waktu reaksi (lama pengadukan) dan banyaknya air yang digunakan [15]. Faktor-faktor ini juga dapat mempengaruhi ukuran butir, komposisi atau transformasi fasa, dan kristalinitas dari TiO2. Salah satu faktor yang secara signifikan berpengaruh adalah pengaturan pH larutan. Penelitian oleh Wang et al. (2007) menunjukkan bahwa variasi pH larutan menghasilkan fasa TiO2 yang berbeda [15]. Hal ini dikarenakan semakin tinggi pH larutan maka struktur fasa anatase yang terbentuk, sedangkan semakin rendah pH larutan maka fasa yang terbentuk terarah ke fase rutile. Selain itu, Youji et al. (2008) melaporkan bahwa dalam keadaan pH rendah (kondisi asam) permukaan TiO2 akan bermuatan positif sehingga daya tolak antar partikel TiO2 akan semakin besar [16]. Semakin besarrnya daya tolak antar partikel akan mempengaruhi distribusi partikel.
Nanopartikel TiO2 telah disintesis dengan berbagai macam prekursor, antara lain: titanium tetra iso propoksida (TTIP) [17], tetra butil orto titanate (TBOT) [18], titanium tetra klorida (TiCl4) [19], disamping senyawa titanium lainnya. Prekursor TiO2 yang digunakan akan mempengaruhi morfologi nanopartikel TiO2 yang dihasilkan seperti luas spesifik permukaan, tingkat kristalinitas, dan ukuran kristalit produk yang akan sangat berpengaruh terhadap sifat dan kinerja TiO2 dalam aplikasi.
Kinerja TiO2 dapat ditingkatkan dengan cara meningkatkan aktivitas sifat optik agar terjadi pergeseran respon dari absorpsi sinar UV ke cahaya tampak. Ada 2 cara untuk merekayasa TiO2 yaitu rekayasa kimia melalui penambahan pendadah (chemical modification: doping) dan
rekayasa kimia permukaan melalui penambahan sensitiser (surface chemical modification: sensitization) [20]. Zat pensensitif yang digunakan dalam penelitian ini adalah perak klorida yang memiliki konduktivitas yang baik dan stabil secara kimia [21]. Golongan perak halida terkenal sebagai material yang peka terhadap cahaya dan secara luas digunakan sebagai sumber bahan dalam fotografis film. Dalam proses fotografis, perak halida menyerap foton menghasilkan pasangan elektron (e-) dan hole (h+). Salah satu senyawa perak halida yang digunakan yaitu perak klorida. Sangchaya et al. (2012) [22] melaporkan bahwa serbuk TiO2@AgCl yang disintesis dengan metode sol gel menunjukkan efek fotokatalitik yang lebih efisien dibawah UV dan sinar tampak untuk degradasi metil biru (MB) dengan laju reaksi fotokatalitik yang dihasilkan sebesar 0,47 lebih tinggi dibandingkan dengan TiO2 komersial (Degussa P25) sebesar 0,12. Hal tersebut menunjukkan bahwa dengan penambahan perak klorida yang bertindak sebagai sensitiser dapat meningkatkan aplikasi TiO2 sebagai fotokatalis.
Berdasarkan hal di atas, penelitian ini berkaitan dengan rekayasa kimia permukaan melalui penambahan zat pensensitif AgCl pada titanium dioksida. Tujuan penelitian yaitu menghasilkan dan mengkarakterisasi titanium dioksida (TiO2)-tersensitifkan variasi prosen berat AgCl (TiO2@AgCl) dengan menggunakan teknik refluks dalam suasana asam.
-
2. BAHAN DAN METODE
Bahan
Bahan yang digunakan dalam penelitian yaitu titanium tetra klorida (TiCl4, Merck), perak nitrat (AgNO3, Merck), asam nitrat (HNO3, Merck), hidrogen peraoksida (H2O2, Merck), tetrametil amonium hidroksida (NH4OH, Merck), akuades dan minyak parafin.
Metode Preparasi TiO2-tersensitifkan AgCl
Prekursor TiO2 (rutile) teradsorbsi ion Cl- dihasilkan dari reaksi TiCl4 dengan H2O2 dalam atmosfer udara [23]. Sebanyak 5 g prekursor TiO2 (teradsorpsikan ion Cl-) tersebut dimasukkan ke dalam gelas ukur berukuran 250 ml. Selanjutnya, ke dalam gelas ukur tersebut, dimasukkan akuades sebanyak 50 ml dan diaduk selama 1 jam dengan pengaduk magnet (emulsi A). Emulsi A dimasukkan ke dalam labu leher tiga dan ditambahkan tetes demi tetes larutan pekat HNO3 hingga diperoleh pH ≈ 1 (emulsi B). Sejumlah gram AgNO3 dan tetrametil amonium hidroksida sebanyak 1 ml, dilarutkan masing-masing ke dalam lima buah gelas ukur 100 ml yang berisi 30 ml akuades yang disimbolkan sebagai larutan: P0, P1, P2, P3, dan P4. Kelima larutan tersebut dibuat untuk memenuhi variasi % berat Ag yaitu [masa Ag/masa (Ag+TiO2)]x100%) masing-masing sebesar: 0; 1,5; 3,0; 6,0 dan 9,0%. Selanjutnya, larutan P0 ditambahkan ke dalam emulsi B dan ditambahkan akuades hingga volume total emulsi sebanyak 100 ml. Emulsi campuran tersebut dirangkai dalam peralatan refluks (Gambar 1), selanjutnya diaduk dengan pengaduk magnet pada temperatur 150oC selama 6 jam.

Gambar 1. Rangkaian peralatan refluks
Endapan hasil refluks selanjutnya didinginkan, didekantasi, dan dikeringkan dengan oven pada temperatur 110oC. Prosedur di atas dilakukan untuk masing-masing larutan: P1, P2, P3 dan P4. Padatan yang terbentuk secara berturut-turut disimbolkan dengan S-P0, S-P1, S-P2, S-P3 dan S-P4, dikarakterisasi dengan bantuan instrumen difraktometer sinar-X dan spektrofotometer UV-Vis Diffuse Reflectance.
Karakterisasi
Difraksi Sinar-X (XRD)
Difraktogram XRD semua sampel dihasilkan dari difraktometer sinar-X Rigaku MiniFlex 600-Benchtop dengan sumber radiasi dari logam Cu Kα (λ = 1,5406 Å). Instrumen XRD dioperasikan pada tegangan 40 kV dan arus 15 mA. Data XRD diperoleh dari pengukuran 2θ = 20° -80° dengan interval 0,02°.
Analisis kristal secara kualitatif dilakukan dengan cara membandingkan difraktogram sampel dengan difraktogram standar dari data Crystallography Open Database (COD) dan Inter-national Centre for Diffraction Data (ICDD). Fasa kristal secara kuantitatif dihitung menggunakan metode Reference Intensity Ratio (RIR) [24], sedangkan penentuan para-meter kisi dan bidang kristal dari data difraksi sinar-X serbuk dilakukan dengan program U-Fit [25]. Penentuan ukuran kristal (D) dihitung dengan metode Debya-Scherrer [26] melalui persamaan (1).
D= Kλ βCosθ
(1)
dengan, K adalah konstanta Scherrer = 0,9; λ = panjang gelombang sinar-X yang digunakan (λ Kα Cu = 1,5406 Å); β = puncak pada setengah tinggi intensitas (FWHM = Full Width at a Half Maximum); dan θ = sudut difraksi atau sudut Bragg.
Spektrofotometer UV-Vis Diffuse Reflectance
Perhitungan energi celah pita (Eg) semua sampel dihasilkan dari pengukuran dengan alat spektrofotometri UV-Vis Diffuse Reflectance. Metode ini didasarkan pada pengukuran intensitas UV-Vis yang direfleksikan oleh sampel. Reflektansi yang terukur merupakan reflektansi yang dinyatakan dalam persamaan (2) :
R(ℎν) =
R(ℎV) (sampel) R(hv)( standar)
(2)
Nilai ini akan digunakan untuk mengetahui persamaan Kubelka-Munk [27-29] persamaan (3):
F(R(hν)) = (1-2RR((ℎℎνν))) (3)
Persamaan (2) memiliki hubungan dengan parameter α (koefisien absorbansi) dan s (koefisien hamburan reflektansi difusi), sedangkan F(R(hν)) = α/s, sehingga
persamaan (4) dapat ditulis:
2
F(R(hν)) = α = (1-R((ℎν)) (4)
s 2R(ℎν)
Spektrum UV-Vis diffuse reflectance menghasilkan kurva hubungan antara α/s dengan panjang gelombang (λ) atau absorbansi (A) dengan panjang gelombang (λ) [30]. α berkaitan dengan energi foton yang dinyatakan persamaan berikut [31]:
α = A (E - Eg)γ (5)
dengan A merupakan tetapan yang bergantung dengan sifat-sifat material, E merupakan energi foton, Eg adalah energi celah pita dan γ merupakan tetapan yang memiliki nilai berbeda tergantung tipe transisi elektronik. Selanjutnya persamaan menjadi:
F(R(hν)) = α = - (E E9 )γ (6)

Gambar 2. Pola difraksi XRD TiO2-tersensitifkan variasi % berat AgCl: (a). 0% (S-P0), (b). 1,3% (S-P1), (c). 3,4% (S-P2), (d). 8,3% (S-P3) dan (e). 15,2% (S-P4)
untuk transisi langsung (a permitted direct transition), nilai γ = ½, sehingga persamaan menjadi:
F (R(hν)) = g) ∖e-Eg ) (7)
sedangkan transisi tidak langsung (a permitted indirect transition), nilai γ = 2, sehingga persamaan menjadi :
F (R(hν))0∙ 5 = g) 0 ' * (E-Eg ) (8)
Nilai hν ditentukan dengan persamaan (69):
Eg= h ν = λ (9)
dengan, Eg = energi celah pita (eV), h = tetapan Planck (6,624 x 10-34 Js atau 4,1410-15 eV.s), c = kecepatan cahaya di udara (3 x 108 m/s), dan λ adala panjang gelombang (nm), sehingga persamaan menjadi:
F(R(hν)^ = Q0'5 (hν- Eg) (10)
Perhitungan dilakukan pada setiap sampel dengan menggunakan persamaan Kubelka-Munk dimana Eg diperoleh dari grafik hubungan antara hν dengan (F(R(hν))1/2. Energi celah pita (Eg) semikonduktor merupakan besarnya nilai hν pada saat (F(R(hν))1/2 = 0 yang diperoleh dari persamaan linier kurva tersebut .
HASIL DAN PEMBAHASAN
Difraksi Sinar-X
Pola difraksi sinar-X dari padatan TiO2 tersensitifkan berbagai variasi % berat AgCl (TiO2@AgCl) ditampilkan pada Gambar 2. Berdasarkan pola XRD tersebut menunjukkan adanya 3 fasa yang terbentuk yaitu anatase, rutile dan AgCl. Fasa rutile ditandai dengan kehadiran puncak difraksi 2θ = 27,20; 35,74; 40,90 dan 68,24o yang menunjukkan bidang-bidang kristal (hkl)
secara berturut-turut: (110), (101), (111) dan (301) yang sesuai dengan data standar dari kartu PDF No. 01-076-0322. Fasa anatase didukung dengan munculnya puncak-puncak difraksi pada daerah 2θ = 25,23; 53,90; 62,63 dan 70,30o dari bidang kristal (hkl): (101), (105), (204) dan (220) sesuai dengan data standar dari kartu PDF No: 01-083-2243. Selain itu, pada sampel TiO2@AgCl dengan kode: S-P1, S-P2, S-P3, dan S-P4 menunjukkan adanya puncak difraksi pada daerah 2θ =27,85; 32,23; 46,23; 54,81; 57,41 dan 76,76o yang merupakan representasi bidang(bidang (hkl): (111), (200), (220), (311), (222) dan (420) yang sesuai dengan data standar dari kartu PDF No. 01-085-1355. Adanya puncak-puncak difraksi tersebut mengindikasikan adanya AgCl dalam sampel TiO2 hasil sintesis. Berdasarkan hasil penelitian yang telah dilakukan oleh Tian & Zhang (2012) bahwa pada sampel AgCl, Ag@AgCl, AgCl@TiO2 dan AgCl@Ag@TiO2 yang dikarakterisasi dengan XRD menunjukkan adanya puncak difraksi yang identik dengan penilitian ini yaitu 2θ = 27,80; 32,20; 46,20; 54,80; 57,50 dan 76,70o yang mengindikasikan puncak dari AgCl.
Hasil analisis kuantitatif dari data XRD dengan metode Reference Intensity Ratio (RIR) diperoleh data kuantitatif berupa komposisi % berat fasa anatase, rutile, dan AgCl yang ada dalam sampel sebagaimana pada Tabel 1.
Tabel 1. Komposisi fasa rutile, anatase dan
AgCl dalam TiO2@AgCl
|
Kode TiO2@AgC l |
% bera t Ag awal |
Prosentase fasa (%) | ||
|
Rutil e |
Anatas e |
AgC l | ||
|
S-P0 |
0 |
81,0 |
19,0 |
0 |
|
S-P1 |
1,5 |
89,0 |
10,0 |
1,3 |
|
S-P2 |
3,0 |
92,0 |
4,2 |
3,4 |
|
S-P3 |
6,0 |
97,0 |
4,4 |
8,3 |
|
S-P4 |
9,0 |
82,0 |
3,2 |
15,2 |
Berdasarkan analisis kuantitatif tersebut menunjukkan prosentase fasa AgCl semakin meningkat seiring peningkatan % berat Ag yang digunakan pada awal sintesis, sebagaimana terlihat pada Gambar 3. Berdasarkan Gambar 3 tersebut menunjukkan bahwa ion Cl- yang teradsorpsi pada prekursor TiO2 belum semuanya dapat bereaksi dengan ion Ag+ untuk membentuk kristal AgCl. Hal ini ditunjukkan grafik belum menunjukkan garis mendatar, sehingga masih memungkinkan peningkatan prosen kristal AgCl apabila prosen Ag awal sintesis dinaikkan.
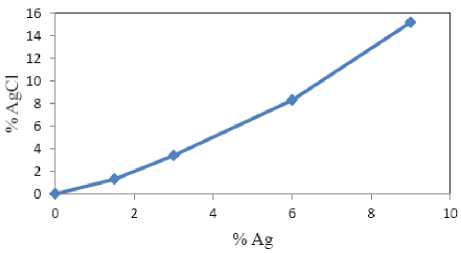
Gambar 3. Hubungan % berat Ag awal sintesis vs % berat AgCl yang dihasilan
Ukuran kristal pada kelima sampel TiO2@AgCl (S-P0, S-P1, S-P2, S-P3, dan S-P4) diperoleh dari data XRD yang dihitung dengan persamaan Debye-Scherrer (persamaan 1). Berdasarkan perhitungan kuantitatif dengan persamaan (1), dengan nilai β yang digunakan adalah nilai puncak-puncak maksimum yang dimiliki oleh fasa anatase pada bidang: (101) dan (200), rutil pada bidang: (110), (101) dan (111), sedangkan AgCl pada bidang: (200) dan 220) didapatkan data ukuran kristal pada Tabel 2.
Hasil perhitungan menunjukkan bahwa sampel TiO2@AgCl berbagai variasi % AgCl mengandung fasa anatase dengan ukuran kristal pada rentang 5-9 nm, rutile 9-11 nm, sedangkan AgCl 37-60 nm. Ukuran kristal yang pada fasa anatase lebih kecil dibandingkan fasa rutile dan AgCl. Struktur anatase memiliki luas permukaan
serbuk yang lebih besar serta ukuran partikel yang lebih kecil dibandingkan dengan struktur rutile [32]. Semua sampel TiO2@AgCl (S-P1, S-P2, S-P3, S-P4, P5) memiliki fasa anatase, rutile dan AgCl yang cenderung menurun seiring dengan penambahan % berat Ag awal sintesis.
Analisis lebih lanjut dari data XRD dilakukan dengan bantuan program U-FIT untuk menentukan nilai parameter kisi fasa-fasa dari masing-masing sampel. Perhitungan nilai parameter kisi dan volume unit sel dengan program U-FIT dilakukan berdasarkan sudut puncak difraksi dan intensitas I/Io.
Tabel 2. Ukuran kristal fasa-fasa dalam
TiO2@AgCl yang berisi
berbagai variasi % berat AgCl
|
Kode TiO2@AgCl |
% berat AgCl |
Ukuran Kristal (nm) | ||
|
Rutile |
Anatase |
AgCl | ||
|
S-P0 |
0 |
9,13 |
5,99 |
- |
|
S-P1 |
1,3 |
9,19 |
9,04 |
60,57 |
|
S-P2 |
3,4 |
11,29 |
8,99 |
49,97 |
|
S-P3 |
8,3 |
10,26 |
7,18 |
37,77 |
|
S-P4 |
15,2 |
10,52 |
7,65 |
41,14 |
Hasil analisis parameter kisi dan volume unit sel pada semua sampel ditampilkan pada Tabel 3. Fasa anatase, rutile dan AgCl yang dihasilkan identik dengan hasil penelitian yang telah dilakukan peneliti terdahulu. Penelitian oleh Weirich et al. (2000), fasa anatase memiliki sistem kristal tetragonal, grup ruang I41/amd, parameter kisi: yaitu a = b = 3,785 Å dan c = 9,514 Å [33]. Menurut Swope et al. (1995), fasa rutile memiliki sistem kristal tetragonal, grup ruang P42/mnm, parameter kisi: a = b = 4,594 Å, c = 2,958 Å [34], sedangkan penelitian Hull and Keen (1999), fasa AgCl memiliki sistem kristal kubik, grup ruang Fm-3m dengan parameter kisi: a = 5,5463 Å [35].
UV-Vis Diffuse Reflectance
Karakterisasi dengan spektrofotometer UV-Vis Diffuse Reflectance dilakukan untuk mengukur absorbansi atau kemampuan material untuk menyerap cahaya dan besarnya energi celah pita TiO2 yang telah tersensitifkan perak klorida. Energi celah pita (Eg) merupakan jarak atau rentang energi pita konduksi dengan energi pita valensi. Nilai energi celah pita sangat penting karena berpengaruh terhadap kinerja semikondutor dalam usaha untuk membentuk elektron dan hole. Selain itu, perbedaaan energi celah pita juga akan berpengaruh terhadap energi foton atau cahaya yang dibutuhkan. Energi celah pita kecil akan membutuhkan energi cahaya yang kecil pula begitu sebaliknya.
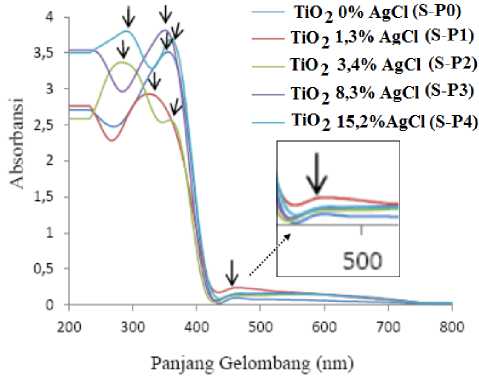
Gambar 4. Spektra UV-Vis TiO2@AgCl
Serbuk hasil sintesis sebelum dianalisis perlu dilakukan preparasi sampel terlebih dahulu pada kaca preparat dengan cara menempelkan serbuk TiO2@AgCl yang telah diemulsikan dengan sedikit etanol. Kaca preparat yang telah terlapisi sampel dikeringkan pada temperatur ruang untuk menguapkan etanol. Sampel TiO2@AgCl akan mengadsorpsi pada panjang gelombang tertentu. Pengukuran dilakukan pada panjang gelombang 200-800 nm. Kisaran panjang gelombang untuk UV adalah 180-380 nm sedangkan untuk Visible adalah 380-780 nm [36]. Karakterisasi UV-Vis diperoleh data absorbansi pada Gambar 4 menunjukkan
bahwa semua sampel TiO2@AgCl mengalami penyerapan energi yang terjadi pada panjang gelombang daerah sinar UV dan sinar tampak. Transisi elektron dalam fasa anatase dan rutile berbeda dikarenakan perbedaan simetri sehingga terdapat perbedaan splitting pada orbital d dari logam Ti.
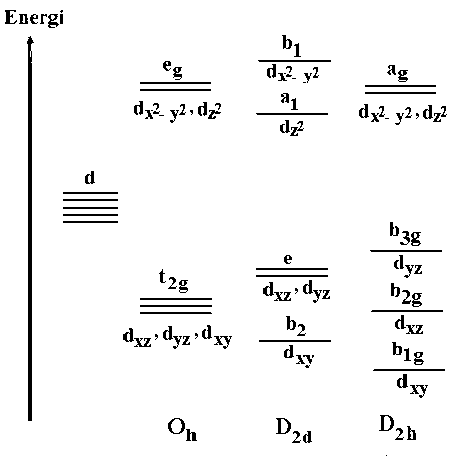
Gambar 5. Splitting orbital 3d dari Ti4+ dalam simetri Oh, D2d (anatase) dan D2h (rutile)
Fasa anatase memiliki sistem kristal tetragonal, grup ruang I41/amd (D41h9) [33] Rutile memiliki sistem kristal tetragonal, grup ruang P42/mnm (D41h4) [34. Masing-masing anatase dan rutile memiliki dua rumus unit sel per per sel Bravais (ZB = 2) yaitu dua atom Ti dan empat atom O dalam sel Bravais. Simetri (site symmetry) dari dua atom Ti dalam anatase mengakomodasi dua atom ekuivalen yaitu D2d, sedangkan dalam rutile yaitu D2h [37]. Orbital 3d dari Ti4+ dalam fasa anatase dan rutile
mengalami splitting dalam keadaan yang berbeda dilustrasikan pada Gambar 5. Orbital d dari Ti mengalami splitting menjadi t2g (dxy, dxz, dyz) dan eg (dz2, dx2-dy2) apabila memiliki simetri oktahedral sempurna (Oh) Fasa anatase memiliki
simetri D2d sehingga orbital 3d dari Ti4+ mengalami splitting menjadi b2 (dxy), e (dxz, 2 22
dyz), a1 (dz2) dan b1 (dx2-dy2). Adanya
splitting tersebut, maka penyerapan energi
dalam fasa anatase untuk 4 transisi elektron yaitu dari orbital: b2 (dxy) atau e (dxz, dyz) ke a1 (dz2), b2 (dxy) atau e (dxz, dyz) ke b1 (dx2-dy2). Fasa rutile memiliki simetri D2h sehingga orbital 3d dari Ti4+ mengalami splitting menjadi b1g (dxy), b2g (dxz), b3g (dyz) dan ag (dx2-dy2, dz2). Dalam fasa rutile terjadi 3 transisi elektron yaitu dari orbital: b1g (dxy) atau b2g (dxz), atau b3g (dyz) ke ag (dx2-dy2, dz2).
Penyerapan energi sampel TiO2@AgCl berbagai variasi % berat AgCl dapat dilihat pada Tabel 4. Dalam Tabel 4 menunjukkan bahwa semua TiO2@AgCl memiliki daerah serapan pada sinar UV: (323 – 360) nm dan sinar tampak: (462 – 559) nm.
Tabel 4. Panjang gelombang maksimum absorbansi TiO2@AgCl
|
Kode Sampel (TiO2@AgCl) |
% berat AgCl |
Panjang gelombang (λ, nm) | |
|
Tampak |
UV | ||
|
S-P0 |
0 |
462 |
355 |
|
S-P1 |
1,3 |
464 |
323 |
|
S-P2 |
3,4 |
553 |
358 |
|
S-P3 |
8,3 |
522 |
350 |
|
S-P4 |
15,2 |
559 |
360 |
Karakterisasi UV-Vis Diffuse Reflectance juga dilakukan untuk menentukan besarrnya energi celah pita dari sampel TiO2@AgCl yang telah disintesis. Perhitungan energi celah pita dapat dilakukan dengan menggunakan persamaan (4) dan (9). Energi celah pita pada semikonduktor adalah (h.c/λ) pada saat (F(R’)hν)1/2 = 0, yang diperoleh dari perpotongan garis lurus yang ditarik memotong sumbu x pada grafik. Data energi celah pita dari sampel TiO2@AgCl dapat dilihat pada Gambar 6.
Penyerapan energi sampel TiO2@AgCl berbagai variasi penambahan perak dapat dilihat pada Tabel 5. Berdasarkan Tabel 5 dapat diketahui bahwa dengan adanya penambahansensitiser AgCl dengan variasi persen mol perak (P2, P3, P4) belum dapat
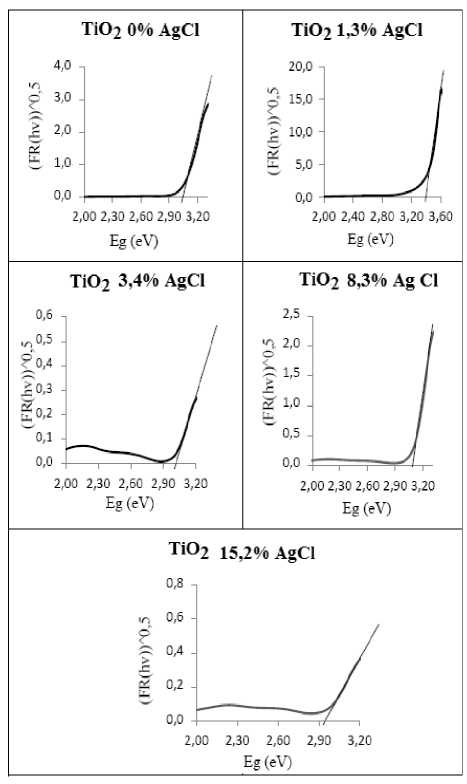
Gambar 6. Grafik fungsi Kubelka–Munk (F(R’) hν)1/2 vs. energi
absorbsi sinar (hν) dari
sampel TiO2@AgCl
Tabel 5. Nilai energi celah pita (Eg) dari sampel TiO2@AgCl
|
Kode Sampel (TiO2@AgCl) |
% berat AgCl |
Energi Celah Pita (eV) |
|
S-P0 |
0 |
3,05 |
|
S-P1 |
1,3 |
3,42 |
|
S-P2 |
3,4 |
3,00 |
|
S-P3 |
8,3 |
3,09 |
|
S-P4 |
15,2 |
2,95 |
menurunkan energi celah pita (Eg) secara maksimal. Akan tetapi, pada sampel
TiO2@AgCl P5 memiliki energi celah pita yang berbeda dari sampel yang lainnya, dimana pada P5 diperoleh energi celah pita yang lebih kecil yaitu 2,95. Energi celah pita tersebut masih pada batas antara sinar UV dengan sinar tampak, sehingga perlu dilakukan penambahan perak yang lebih banyak lagi untuk mengoptimalkan penurunan energi celah pita pada sampel agar terjadi pergeseran respon TiO2 dari sinar UV ke sinar tampak.
Berdasarkan hasil penelitian yang telah dilakukan, maka dapat ditarik kesimpulan Sampel TiO2-tersensitifkan perak klorida (TiO2@AgCl) pada kondisi pH asam dengan variasi penambahan perak 0% (P1); 1,5% (P2); 3% (P3); 6% (P4); dan 9% (P5) menghasilkan struktur kristal rutil (mayor), anatas dan AgCl (minor). Ukuran kristal masing-masing sampel pada fasa anatas antara 5-9 nm, rutil 9-11 nm, dan AgCl 3760 nm. Seiring dengan penambahan variasi persen mol Ag yang semakin banyak meningkatkan komposisi berat AgCl pada masing-masing sampel sebesar 1,3%; 3,4%; 8,3%; 15,2% dengan energi celah pita yang dihasilkan berturut-turut sebesar 3,24; 3,00; 3,09; 2,95 eV, sedangkan pada kontrol
adalah 3,05 eV.
Terima kasih diucapkan kepada Kaprodi Kimia, Ketua Jurusan Pendidikan Kimia dan Kepala Laboratorium FMIPA Terpadu, Universitas Negeri Yogyakarta .
DAFTAR PUSTAKA
-
[1] Radecka, M., Reka, M., Trenczek-Zwac, A. & Zakrzewska, K., 2008. Importance of the band gap energy and flat band potential forapplication of modified TiO2 photonodes in water photocatalysis, Journal of Power Sources, 181: 46-55.
-
[2] Rajh, T., Ostafin, A. E., Micic, O. I., Tiede, D. M., & Thurnauer, M. C.,
1996. Surface modification of small particle TiO2 colloids with cysteine for enhanced photochemical
reduction: An EPR study, Journal Physics Chemistry, 100(11): 4538 -4545.
-
[3] Chen, Y. H., Yi, Y. L., Rong, H. L., & Fu, S. Y., 2009. Photocatalytic
degradation of p-phenylene-diamine with TiO2-coated magnetic PMMA microspheres in an aqueous solution, Journal of Hazardous Materials, 163: 973 - 981.
-
[4] Dastan, D. & Chaure, N. B., 2014.
Influence of surfactants on TiO2 nanoparticles grown by sol-gel technique, International Journal of Materials Mechanics and
Manufacturing, 2: 21 - 24.
-
[5] Smith, W., Shun, M., Ganhua, L.,
Alexis, C., Junhong, C. & Yiping, Z., 2010. The effect of Ag nanoparticle loading on the photocatalytic aactivity of TiO2 nanorod arrays, Chemical Physics Letters, 485:171 - 175.
-
[6] Huang, Z., Maness, P. C., Blake, D. M., Wolfrum, E. J., Smolinski, S., & Jacoby, W. A., 2000. Bactericidal
mode of titanium dioxide photocatalysis, Journal of
Photochemistry and Photobiology A: Chemistry, 130: 163 -170.
-
[7] Venckatesh, R., Kartha, B. & Rajeshwara, S., 2012. Synthesis and characterization of nano TiO2-SiO2:PVA Composite, International Nano Letters, 2: 1 - 5.
-
[8] Chekina, F., Samira B. & Sharifah B. A. H., 2013. Synthesis of Pt doped TiO2 nanoparticles: characterization and application for electro-catalytic oxidation of l-methionine, Sensors and Actuators B, 177: 898 - 903.
-
[9] Wang R., Hashimoto K., Fujishima A., Chikuni M., Kojima E., Kitamura A., Shimohigoshi M. & Watanabe T., 1998. Photogeneration of highly
amphiphilic TiO2 surfaces, Advance Material, 10: 135 - 139.
-
[10] Melemeni, M., Xekoukoulotakis N. P., Mantzavinos, D. & Kalogerakis, N., 2009. Disinfection of municipal wastewater by TiO2 photocatalysis with UV-A, visible and solar irradiation and BDD electrolysis, Global NEST Journal, 11: 357 - 363.
-
[11] Hoffmann, M. R., Martin, S. T., Choi, W. & Bahnemann, W., 1995.
Environmental applications of semiconductor photocatalysis,
Chemical Review, (95): 69 - 96.
-
[12] Anpo, M., & Takeuchi, M., 2003. The design and development of highly reactive titanium oxide photocatalysts operating under visible light irradiation, Journal of Catalysis, 216: 505 - 516.
-
[13] Chen, Y., Yang, S., Wang, K. & Lou, L., 2005. Role of primary active
species and TiO2 surface characteristic in UV-illuminated photo-degradation of acid orange, Journal Photochemistry and Photobiology A: Chemistry, 172: 47 - 54.
-
[14] Cheng, H., Ma, J., Zhao, Z. & Qi, L., 1995. Hydrothermal preparation of uniform nanosize rutile and anatase particles, Chemistry of Material, 7(4): 663 - 671.
-
[15] Wang, P., Wang, D., Li, H., Xie, T., Wang, H. & Du, Z., 2007. A facile solution-phase synthesis of high quality water-soluble anatase TiO2 nanocrystals, Journal Colloid and Interface Science, 314: 337 - 340.
-
[16] Youji, L.I., Mingyuan, M.A., Wang, X. & Wang, X., 2008. Inactivated properties of activated carbon supported TiO2 nanoparticles for
bacteria and kinetic study, Journal of Environmental Sciences, 20: 1527 -1533.
-
[17] Nagamine, S., Sugioka, A., Iwamoto, H. & Konishi, Y., 2008. Formation of
TiO2 hollow microparticles by spraying water droplets into an organic solution of titanium tetraisopro-poxide (TTIP) - effects of TTIP concentration and TTIP-protecting additives, Journal Powder Tecnology, 2: 168 - 175.
-
[18] Yu, J., Wang, G., Cheng, B. & Zhou, M., 2007. Effects of hydrotermal
temperature and time the
photocatalytic activity and
microstructures of bimodal
mesoporous TiO2 powders, Applied Catalysis Environmental, 69:171 -
180.
-
[19] Lee, M. S., Hong, S.S. & Mohseni, M., 2005. Synthesis of photocatalytic nanosized TiO2-Ag particles with solgel method using reduction agentk, Journal of Molecular Catalysis A, 1-2: 135 - 140.
-
[20] Chen, X. & Mao, S. S., 2007.
Titanium dioxide nanomaterials: synthesis, properties, modifica-tions, and applications, Chemical Review, 10: 2891-2959.
-
[21] Yeo, S. Y., Lee, H. J. & Jeong, S. H., 2003. Preparation of nanocomposite fibers for permanent antibacterial effect, Journal of Materials Science, 38: 2143–2147.
-
[22] Sangchaya, W., Sikonga, L. & Kooptarnonda, K., 2012. Comparison of photocatalytic reaction of commercial P25 and synthetic TiO2-AgCl nanoparticles, Procedia Engineering 32: 590 -596.
-
[23] Mu’izayanti, V.A. 2016. Preparasi TiO2-tersensitifkan AgCl pada Kondisi pH Basa dan Aplikasinya sebagai Material Antiburam, Skripsi, FMIPA-UNY.
-
[24] Klug, H. P., & Alexander, L., 1954. X-Ray Diffration Procedures-for Polycrystalline and Amorphous Materials. New York, John Wiley & Sons.
-
[25] Evain, M., 1995. U-Fit v1.3. Nantes: Institute des Materiaux de Nantes. France.
-
[26] Alexander, L. & Klug, H. P. 1950. Determination of crystallite size with the X-ray spectrometer, Journal of Applied Physic, 21: 137-142.
-
[27] Kubelka, 1948. New contribution to the optics of intensely lightscattering materials. part I, Journal of the Optical Society of America, 38(5): 448 – 457.
-
[28] Tandon, S. & Gupta, J., 1970.
Measurement of forbidden energy gap of semiconductors by diffuse reflectance technique, Physica Status Solidi, 38: 363 - 367.
-
[29] Sreen, K., Poulose, C. & Unni, B., 2008. Colored cool colorants based on rare earth metal ions, Solar Energy Mater Solar Cells, 92: 1462 - 1467.
-
[30] Morales, A. E., Sanchez, M. E. & Pal, U., 2007. Use of diffuse reflectance spectroscopy for optical
characterization of un-supported nanostruc-tures, Revista Mexicana de Fisica, 53(5): 18 -22.
-
[31] Ting, C. & Chen, S., 2000. Structural evolution and optical properties of TiO2 thin films prepared by thermal oxidation of sputtered Ti films, Journal of Applied Physics, 88: 4628 -4633.
-
[32] Su, C., Hong, B.Y. & Tseng, C.M. 2004. “Sol–gel preparation and photocatalysis of titanium dioxide”. Catalysis Today 96: 119 - 126.
-
[33] Weirich, T. E., Winterer, M., Seifried, S., Hahn, H. & Fuess, H. 2000. “Rietveld analysis of electron powder diffraction data from nano-crystalline anatase TiO2”. Ultramicroscopy 81(34): 263 - 270.
-
[34] Swope, R. J., Smyth, J. R., & Larson, A. C., 1995. H in Rutile-type
compounds: I. single-crystal neutron
and X-ray diffraction study of H in rutile, American Mineralogist, 80: 448-453.
-
[35] Hull, S. & Keen, D. A., 1999.
Pressure-induced phase transitions in AgCl, AgBr, and AgI, Physical Review B, 59: 750 - 561.
-
[36] Fesenden & Fesenden. 1997. “Kimia Organik Jilid 1”. Jakarta: Erlangga.
-
[37] Tuschel, D., 2015. The correlation
method for the determination of spectroscopically active vibrational modes in crystals, Spectroscopy, 30(12): 17 - 22.
12
Discussion and feedback