IDENTIFIKASI FRAKSI AKTIF BAKTERISIDA PADA RIMPANG LEMPUYANG (Zingiber gramineum Blume)
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 4, Nomor 1, Mei 2016
IDENTIFIKASI FRAKSI AKTIF BAKTERISIDA PADA RIMPANG LEMPUYANG (Zingiber gramineum Blume)
I Made Dira Swantara
Program Studi Magister Kimia Terapan, Program Pascasarjana, Universitas Udayana, Bali-Indonesia
e-mail: m_dira_swantara@yahoo.co.id
ABSTRAK: Telah diisolasi dan diidentifikasi fraksi yang bersifat bakterisida pada rimpang Lempuyang (Zingiber gramineumBlum bark). Isolasi dengan cara partisi menggunakan pelarut n-heksan, kloroform dan etil asetat. Ektrak yang aktif bersifat bakterisida (ekstrak etil asetat) dipisahkan menggunakan kromatografi kolom menggunakan eluen campuran benzene-kloroform (3:2). Uji aktifitas bakterisida isolate ini menggunakan bioindikator Micrococcus luteus dan Eschericia coli juga telah dilakukan. Struktur kimia senyawanya diidentifikasi menggunakan kromatografi gas – spektrometri massa (GC-MS) yang dilengkapi dengan library Wiley 275L. Fraksi yang aktif bersifat bakterisida terhadap E. coli mengandung empat senyawa yaitu ester etil heksadekanoat, ester etil linoleat, ester etil oleat, dan ester etil oktadekanoat. Sedangkan fraksi yang aktif bersifat bakterisida terhadap M. Luteus mengandung empat senyawa yaitu asam heksadekanoat, asam 9,12-oktadekadienoat, asam oktadek-9-enoat, dan ester dioktil heksadioat.
Kata kunci: Identifikasi; bakterisida, lempuyang.
ABSTRACT: Bactericide fraction has been isolated and identified from Zingiber gramineum Blume bark. The isolation was carried out using partition method with n-hexane, chloroform, and ethyl acetate eluents. The active bactericide of the extract (ethyl acetate extract) has been isolated by column chromatograpic method using benzene-chloroform (3:2) eluent system. The activity test of that isolate using Micrococcus luteus and Eschericia coli was also carried out The chemical structure of the compound was identified using gas chromatography-spectroscopy massa (GC-MS) with Wiley 275L library. The active fraction on E. coli contains hexadecanoic acid, ethyl ester; linoleic acid, ethyl ester; oleic acid, ethyl ester; and octadecanoic acid, ethyl ester. The active fraction on M. luteus contains octadecnoic acid; 9,12-octadecadienoic acid; octadec-9-enoic acid; and hexadioic acid, dioctyl ester.
Keywords: Identification, Bactericide, Zingiber gramineum Blume
Tujuan dari penelitian ini adalah untuk mengetahui antivitas bakterisida dari rimpang Lempuyang (Zingiber gramineum Blume bark) serta kandungan senyawa kimia yang bertanggung jawab terhadap aktivitas tersebut. Hal ini dikarenakan sampai saat ini diketahui bahwa penggunaan obat yang berasal dari tumbuhan sudah sejak lama dilakukan oleh masyarakat di Indonesia maupun di mancanegara. Penggunaan obat yang berasal dari tumbuhan disukai karena pada umumnya obat yang berasal dari tumbuhan tersebut tidak menimbulkan efek samping seperti obat-obat sintetik. Namun demikian pada umumnya penggunaan suatu tumbuhan sebagai obat tidak didukung dengan data-data klinis, sehingga kadang-kadang kesembuhan yang ditimbulkan hanya disebabkan oleh faktor psikologis saja, walaupun tidak menutup kemungkinan tumbuhan tersebut benar-benar mempunya
Di Bali, tumbuhan obat tercatat dalam suatu naskah kuno yang disebut usada. Salah satu usada yang sampai saat ini masih dilestarikan dan sering digunakan sebagai pedoman oleh para balian (dukun) untuk pengobatan suatu penyakit adalah usada Taru Premana. Di dalam usada Taru Premana tercatat 168 jenis tumbuhan obat. Salah satu tumbuhan tersebut adalah lempuyang (Zingiber gramineum Blume) yang mempunyai nama daerah (Bali) Gamongan. [2]
Secara tradisional, Lempuyang dapat digunakan sebagai obat demam, reumatik, mencret, batu ginjal (nephorolithiasis), disentri, kejang pada anak-anak, penambah nafsu makan (stomachica), sakit kuning, sakit kulit (obat luar), borok, bisul, salesma, menyegarkan badan, penghilang rasa sakit (analgesik), cacingan, kurang darah (anemia), meningkatkan stamina, influensa, sakit empedu, nyeri perut, radang usus (enteritis), radang lambung (gastritis), sesak napas, dan sembelit. [3-6]
Beberapa penelitian tentang aktivitas bakterisida dari famili zingiberaceae diantaranya minyak atsiri pada lengkuas (Alpinia galanga) yang dapat menghambat pertumbuhan bakteri Bacillus subtilis dan Staphylococcus aureus [7] serta ekstrak n-heksan rimpang kunyit (Curcuma longa L.) pada konsentrasi 50.000 ppm dapat menghambat pertumbuhan bakteri Eschericia coli, Klebsiella pneumoniae, dan Staphylococcus aureus. [8] Dugenci [9] meneliti efek beberapa ekstrak tumbuhan termasuk genus Zingiber terhadap kekebalan pada ikan. Neogi [10] melaporkan hasil penelitian tentang kombinasi efek bioaktif beberapa ekstrak tumbuhan (termasuk genus Zingiber). Efek antibaktri dari ekstrak Zingiber dilaporkan oleh Akoachere [11]. Aktivitas antibakteri ekstrak Zingiber offcinale pada Echerchia coli dan Salmonella typhi juga telah dilaporkan [12]. Karakterisasi kimia dan aktivitas antimikroba dari minyak Zingiber nimmonii dilaporkan oleh Sabulal et al., [13]. Alzoreky dan Nakahara [14] melaporkan hasil penelitiannya tentang aktivitas antibakteri pada beberapa ekstrak tanaman ( termasuk Zingiber officinale yang berasal dari Asia. Efek konbinasi ekstrak Zingiber officinele dengan Clarithromycin dilaporkan oleh Nostro [15].
Dari penelusuran pustaka diketahui bahwa kandungan senyawa kimia dalam lempuyang (Zingiber gramineum Blume) belum ada yang melaporkan. Namun demikian, beberapa tumbuhan yang satu famili dengan lempuyang sudah diketahui kandungan senyawa kimianya. Misalnya lempuyang gajah (Z. zerumbet) mengandung alkaloid, saponin, flavonoid, polifenol, dan minyak atsiri; lempuyang emprit (Zingiber amaricans BL.) mengandung saponin, flavonoid, dan minyak atsiri; temulawak (Curcuma xanthorihiza Roxb) mengandung saponin, flavonoid, dan minyak atsiri; lengkuas (A. galanga) mengandung
flavonoid minyak atsiri, dan polifenol, serta kayu tawa (Costus speciosus Smith) mengandung alkaloid, saponin, flavonoid, dan tanin [16].
Walaupun kandungan senyawa kimia dalam tumbuhan yang satu famili dengan lempuyang (Z. gramineum) sudah diketahui, namun sampai saat ini kandungan senyawa kimia dan aktiitas bakterisidanya belum ada yang melaporkan. Berkaitan dengan penggunaan rimpang lempuyang sebagai obat-obatan, perlu dilakukan penelitian tentang identifikasi fraksi aktif bakterisida pada rimpang lempuyang. Bakteri yang digunakan sebagai bioindikator adalah Micrococcus luteus (mewakili bakteri gram positif) dan Eschericia coli (mewakili bakteri gram negatif). Dengan informasi hasil penelitian ini diharapkan diketahui secara ilmiah senyawa yang bertanggung jawab terhadap aktivitas yang dimiliki oleh tanaman Lempuyang sehingga berkhasiat sebagai obat.
Identifikasi senyawa pada fraksi aktif rimpang lempuyang dilakukan dengan alat Kromatografi gas-spektroskopi massa GCMS-QP2010S SIMADZU; tipe ionisasi: Electron impact; kolom: Hp 5. Kolom kapiler. Panjang 60 m, diameter 0,25 mm; Suhu kolom: Suhu awal 700C selama 1 menit, kemudian dinaikkan 100C/menit sampai suhunya mencapai 2700C dan ditahan selama 5 menit; Gas pembawa: Helium; Tekanan gas: 9,10 pi; detektor: MS Model no. Agilent: 190915-433; Volume injeksi: 1 mikroliter; Suhu injektor: 2700C. Kromatografi lapis tipis (KLT) dilakukan dengan menggunakan pelat aluminium yang dilapisi silika gel (Merck, Kieselgel 60, GF 254, 0,25 mm), sementara penampakan noda dilakukan dengan lampu UV pereaksi semprot 10% H2SO4 dalam etanol. Kromatografi kolom dengan silika gel (Merck, 70-230 mesh).
Sampel rimpang lempuyang (Zingiber gramineum Blume) diambil dari Dusun Raden, Desa Tua, Kecamatan Marga, Kabupaten Tabanan, Bali. Bahan tersebut dideterminasi di Lembaga Ilmu Pengetahuan Indonesia (LIPI) UPT Balai Konservasi Tumbuhan Kebun Raa Eka Karya Bali di Bedugul. Rimpang lempuyang dicuci bersih, diiris, dan dikeringkan dengan cara diangin-anginkan di udara terbuka tanpa terkena sinar matahari langsung. Selanjutnya sampel tersebut dihaluskan sampai tingkat kehalusan 100 mesh, sehingga menghasilkan serbuk.
Sebanyak kurang lebih 500 gram serbuk kering rimpang lempuyang dimaserasi dengan etanol 70 % sebanyak 500 mL. Setiap 24 jam ekstrak tersebut disaring dan diganti pelarutnya. Ekstraksi ini dilakukan berulang sampai ekstrak terakhir tidak mengandung metabolit. Filtrat etanol yang diperoleh kemudian dievaporasi sehingga dihasilkan ekstrak kental etanol. Terhadap ekstrak kental etanol ini selanjutnya dilarutkan ke dalam 200 mL air. Ekstrak air ini dipartisi berturut-turut dengan n-heksana (10 x 50 mL), kloroform (10 x 50 mL), dan etil asetat (10 x 50 mL). Selanjutnya ketiga ekstrak ini diepavorasi sehingga diperoleh ekstrak kental n-heksan (EH) ekstrak kental kloroform (EK) dan ekstrak kental Etil asetat (EE). Selanjutnya dilakukan uji aktivitas bakteriasida (menggunakan bioindikator bakteri Micrococcus luteus dan Eschericia coli) terhadap ketiga ekstrak ini (EH, EK, dan EE).
Ekstrak yang mempunyai sifat bakterisida paling besar selanjutnya dipisahkan dan dimurnikan lebih lanjut. Pemisahan metabolit ini dilakukan
menggunakan kromatografi kolom (silikagel 60) dengan eluen campuran benzen-kloroform (3:2). Sehingga diperoleh beberapa fraksi. Isolat hasil kromatografi kolom ini selanjutnya diuji aktifitas banterisidanya. Isolat yang menunjukkan sifat bakterisida paling besar slanjutnya diidentifikasi senyawa yang terkandung di dalamnya. menggunakan kromatografi gas-spektometri massa.
-
3. HASIL DAN PEMBAHASAN
Dari kurang lebih 500 gram serbuk kering rimpang lempuyang dimaserasi dengan etanol 70 % sebanyak 500 mL menghasilkan ekstrak etanol berwarna coklat kekuningan sebanyak 35,57 gram. Sebanyak 25 gram ekstrak etanol ini dipartisi berturut-turut dengan n-heksan, kloroform dan etil asetat, sehingga menghasilkan ekstrak kental n-heksan (EH) 2,45 gram, ekstrak kental kloroform (EK) 0,80 gram, dan ekstrak kental Etil asetat (EE) 4,21 gram. Berdasarkan hasil uji aktivitas baterisida, ekstrak etil asetat (EE) menunjukkan aktivitas daya hambat lebih besar (dengan diameter hambatan 19,36 mm terhadap M. luteus dan 14,13 mm terhadap E. coli) dibandingkan dengan EH (diameter daya hambat 0,00 mm terhadap M. luteus dan 0,00 mm E. coli) dan EK (diameter daya hambat 6,81 mm terhadap M. luteus dan 3,92 mm E. coli).
Sehubungan dengan hasil uji aktivitas bakterisida semua ekstrak di atas, maka ekstrak etilasetat (EE) dipisahkan lebih lanjut menggunakan kromatografi kolom dan diperoleh lima fraksi (A, B, C, D, dan E). Berdasarkan hasil uji aktivitas bakterisida kelima fraksi ini diperoleh fraksi A paling aktif menghambat pertumbuhan bakteri E. coli dan fraksi E paling aktif menghambat
pertumbuhan bakteri M. luteus. Kedua fraksi ini selanjutnya diidentifikasi senyawanya
Fraksi A yang aktif mengambat pertumbuhan E. coli diperoleh berupa padatan berwarna coklat kekuningan (sebanyak 0,21 gram). Kromatogram gas fraksi A ini yang ditampilkan pada Gambar 1 memperlihatkan adanya empat puncak dengan waktu retensi (tR) dan luas puncak (%) berturut-turut sebagai berikut: puncak 1, tR 16,78 menit (35,16%); puncak 2, tR 18,36 menit (22,27%); puncak 3, tR 18,41 menit (31,15%); dan puncak 4, tR 18,62 menit (11,42%). Berdasarkan data di atas diduga fraksi A mengandung empat senyawa.
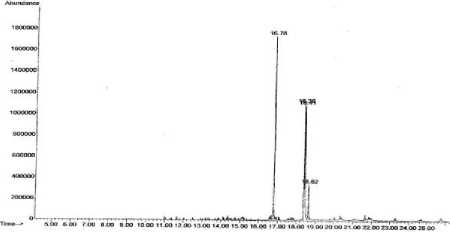
Gambar 1. Kromatogram gas fraksi A
Spektrum massa senyawa pada puncak 1 (A) dan spektrum massa senyawa yang identik yaitu ester etil heksadekanoat (B) [17] yang ditampilkan pada Gambar 2 memperlihatkan adanya ion-ion pada m/z 284 (M+) dan m/z 88 (puncak dasar). Ion molekul (M+) pada m/z 284 mengindikasikan berat molekul 284.
Pola pemenggalan spektrum massa senyawa pada puncak 1 menunjukkan adanya penggalan pada m/z 255 yang merupakan pelepasan gugus etil (M+-C2H5). Selain itu
terlihat juga adanya penggalan pada m/z 241 sampai dengan m/z 101 mengindikasikan pelepasan gugus metilen (M+-14) secara berurutan yang merupakan ciri khas dari senyawa hidrokarbon jenuh [18]. Adanya penggalan pada m/z 101 merupakan sisa dari C5H9O2. Adanya penggalan pada m/z 88 merupakan penataan ulang Mc-Lafferty [18].
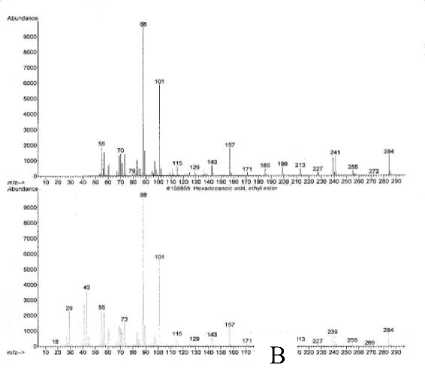
Gambar 2. Spektrum massa senyawa pada puncak 1 (A) dan ester etil heksadekanoat (B)
Berdasarkan pemenggalan seperti
yang terlihat pada Gambar 2 diindikasikan senyawa pada puncak 1 identik dengan ester
etil heksadekanoat (C18H36O2) dengan
struktur seperti Gambar 3 [17].

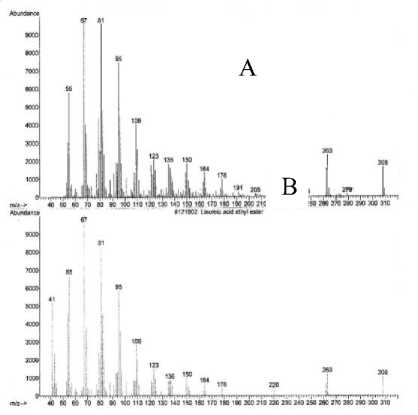
Spektrum massa senyawa pada puncak 2 (A) dan spektrum massa senyawa yang identik yaitu ester etil linoleat (B) [17] ditampilkan pada Gambar 4, memperlihatkan adanya ion-ion pada m/z 308 (M+) dan m/z 67 (puncak dasar). Ion molekul (M+) pada m/z 308 mengindikasikan berat molekul 308.
Pola pemenggalan dari spektrum massa senyawa pada puncak 2 menunjukkan adanya penggalan pada m/z 279 yang merupakan pelepasan gugus etil (M+-C2H5). Penggalan pada m/z 178 sampai dengan m/z 136 mengindikasikan pelepasan gugus metilen (M+-14), yang merupakan ciri khas rantai hidrokarbon [18]. Adanya penggalan pada m/z 263 merupakan penggalan ester etil (C2H5O). Selain itu juga terjadi pemenggalan ester sebanyak 2 kali, yaitu pada m/z 81 dan m/z 67.
Gambar 3. Strukyur molekul ester etil heksadekanoat
3.3.1.2 Identifikasi Senyawa Pada Puncak 2 tR 18,36 menit (22,27%)
Gambar 4. Spektrum massa senyawa pada puncak 2 (A) dan ester etil linoleat (B).
Dengan demikian berdasarkan pola pemenggalan seperti terlihat pada Gambar 4 dapat diindikasikan bahwa senyawa pada puncak 2 identik dengan ester etil linoleat (C20H36O2) yang struktur molekulnya seperti Gambar 5 [17].
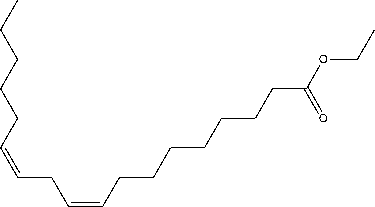
Gambar 5. Struktur molekul ester etil linoleat
Pola pemenggalan spektrum massa senyawa pada puncak 3 menunjukkan adanya penggalan pada m/z 281 yang merupakan pelepasan gugus etil (M+-C2H5). Adanya penggalan pada m/z 264 merupakan pelepasan gugus ester. Penggalan pada m/z 222 sampai dengan m/z 55 mengindikasikan pelepasan gugus metilen (M+-14) yang menjadi ciri khas rantai hidrokarbon [18].
Berdasarkan pola pemenggalan seperti terlihat pada Gambar 6 diindikasikan senyawa pada puncak 3 identik dengan etil oleat (C20H38O2) dengan struktur seperti Gambar 7 [17].
Spektrum massa senyawa pada puncak 3 (A) dan spektrum massa senyawa yang identik yaitu ester etil oleat (B) [17] yang ditampilkan pada Gambar 6, memperlihatkan adanya ion-ion pada m/z 310 (M+) dan m/z 55 (puncak dasar). Ion molekul (M+) pada m/z 310 mengindikasikan berat molekul 310.

Gambar 7. Struktur molekul etil oleat
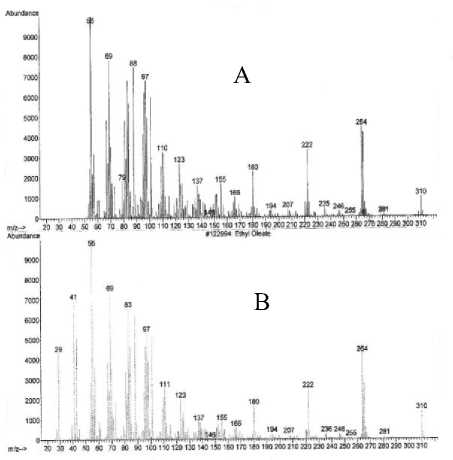
Gambar 6. Spektrum massa senyawa pada puncak 3 (A) dan ester etil oleat (B).
Spektrum massa senyawa pada puncak 4 (A) dan spektrum massa senyawa yang identik yaitu ester etil oktadekanoat (B) [17] yang ditampilkan pada Gambar 8 memperlihatkan adanya ion-ion pada m/z 312 (M+) dan m/z 88 (puncak dasar). Ion molekul (M+) pada m/z 312 mengindikasikan berat molekul 312.
Jika dibandingkan dengan berat molekul senyawa pada puncak 1, berat molekul senyawa pada puncak 4 berselisih 28 satuan massa atom (sma) dan pola pemenggalan senyawa pada puncak 4 mirip dengan pola pemenggalan senyawa pada puncak 1. Dengan demikian senyawa pada puncak 4 diindikasikan suatu asam organik yang berselisih 1 gugus C2H4 dengan senyawa pada puncak 1.
AMrtMlirKe
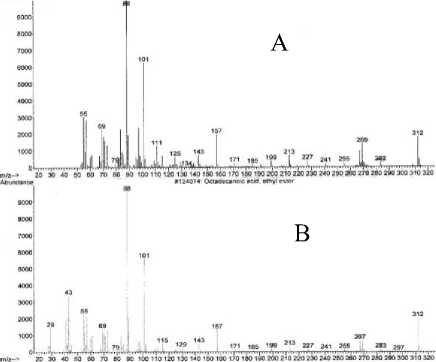
Gambar 8. Spektrum massa senyawa pada puncak 4 (A) dan ester etil
oktadekanoat (B)
Berdasarkan pola pemenggalan
seperti terlihat pada Gambar 8 diindikasikan senyawa pada puncak 4 identik dengan ester etil oktadekanoat (C20H40O2) dengan struktur seperti Gambar 9 [17].
O

Gambar 9. Struktur molekul ester etil oktadekanoat
Fraksi E yang aktif mengambat pertumbuhan bakteri M. luteus diperoleh berupa padatan berwarna kuning seberat 0,27 gram. Kromatogram gas fraksi E yang ditampilkan pada Gambar 10 menunjukkan adanya 4 puncak dengan waktu retensi (tR) dan luas puncak (%) berturut-turut sebagai berikut: puncak 1, tR 16,47 menit (34,73%); puncak 2, tR 18,11 menit (18,87%); puncak 3, tR 18,16 menit (30,61%); dan puncak 4, tR 20,39 menit (15,79%). Berdasarkan data di atas diduga fraksi E mengandung 4 senyawa.
Spektrum massa senyawa pada puncak 1 dan spektrum massa senyawa yang identik yaitu asam dekanoat [17] yang ditampilkan pada Gambar 11 memperlihatkan adanya ion-ion pada m/z 256 (M+) dan m/z 73 (puncak dasar). Ion molekul (M+) pada m/z 256 mengindikasikan berat molekul 256.
Pola pemenggalan spektrum massa senyawa pada puncak 1 menunjukkan adanya penggalan pada m/z 227 yang merupakan pelepasan gugus etil (M+-C2H5). Selain itu terlihat juga adanya penggalan pada m/z 213 sampai dengan m/z 73 mengindikasikan pelepasan gugus metilen (M+-14) secara berurutan yang merupakan ciri khas dari senyawa hidrokarbon jenuh [18]. Adanya penggalan pada m/z 73 merupakan sisa dari C3H5O2. Adanya penggalan pada m/z 60 merupakan penataan ulang Mc-Lafferty [18].
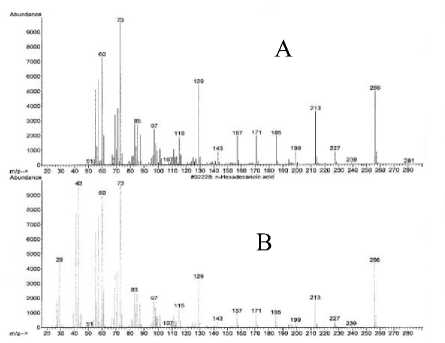
Gambar 11. Spektrum massa senyawa pada puncak 1 (A) dan asam heksadekanoat (B)
Berdasarkan data di atas diindikasikan senyawa pada puncak 1, identik dengan asam heksadekanoat (C16H32O2) dengan struktur seperti Gambar 12.

(C18H32O2) yang struktur molekulnya seperti Gambar 14 [17]
Gambar 12. Struktur molekul asam heksadekanoat
Spektrum massa senyawa pada puncak 2 (A) dan spektrum massa senyawa yang identik yaitu asam 9,12-oktadekadienoat (B) [17] seperti terlihat pada Gambar 13 memperlihatkan adanya ion-ion pada m/z 280 (M+) dan m/z 67 (puncak dasar). Ion molekul (M+) pada m/z 280 mengindikasikan berat molekul 280.
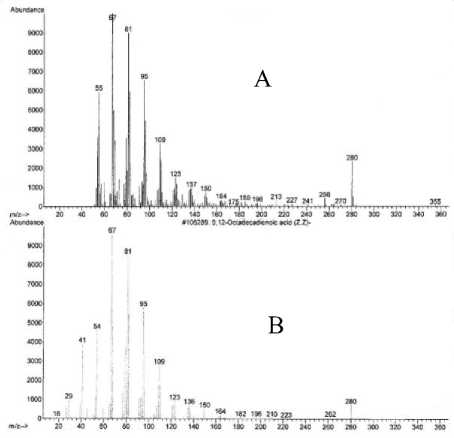
Gambar 13. Spektrum massa senyawa pada puncak 2 (A) dan asam 9,12-oktadekadienoat
(B)
Pola pemenggalan spektrum massa senyawa pada puncak 2 menunjukkan adanya penggalan 14 sma pada m/z 164 sampai dengan m/z 67 mengindikasikan pelepasan gugus metilen (M+-14) [18].
Berdasarkan data di atas dapat diindikasikan bahwa senyawa pada puncak 2 identik dengan asam 9,12-oktadekadienoat
Gambar 14. Struktur molekul asam 9,12-okta dekadienoat
Spektrum massa senyawa pada puncak 3 (A) dan spektrum, msssa senyawa yang identik yaitu asam 9-oktadek-9-enoat (B) [17] seperti yang diperlihatkan pada Gambar 15 memperlihatkan adanya ion-ion pada m/z 282 (M+) dan m/z 55 (puncak dasar). Ion molekul (M+) pada m/z 282 mengindikasikan berat molekul 282.
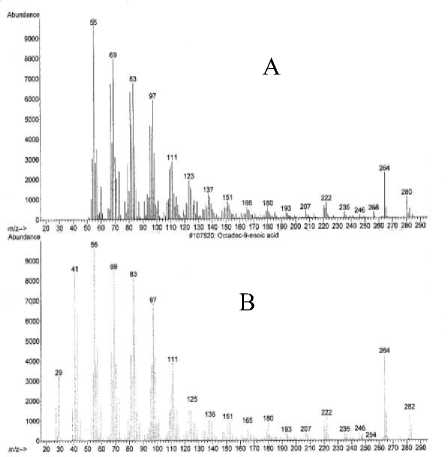
Gambar 15. Spektrum massa senyawa pada puncak 3 (A) dan asam oktadek-9-enoat (B)
Pola pemenggalan spektrum massa senyawa pada puncak 3 menunjukkan adanya
satu kali pelepasan gugus H2O yaitu pada m/z 264 (M+- H2O) mengindikasikan adanya satu gugus hidroksil [18]. Adanya penggalan pada m/z 222 merupakan pelepasan gugus C2H4O2 yang mengalami penataan ulang. Jika dibandingkan dengan berat molekul senyawa pada puncak 2, berat molekul senyawa pada puncak 3 berselisih 2 satuan massa atom (sma). Dengan demikian senyawa pada puncak 3 diindikasikan suatu asam organik yang berselisih 1 ikatan rangkap dengan senyawa pada puncak 2.
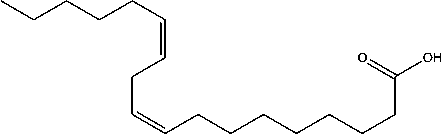
Berdasarkan data di atas dapat diindikasikan bahwa senyawa pada puncak 3 identik dengan asam oktadek-9-enoat (C18H34O2) yang struktur molekulnya seperti Gambar16 [17].
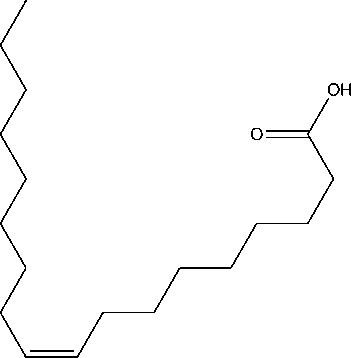
Gambar 16. Struktur molekul asam oktadek-9-enoat
Spektrum massa senyawa pada puncak 4 (A) dan spektrum massa senyawa yang identik yaitu ester dioktil heksadioat (B) [17] yang ditampilkan pada Gambar 17 memperlihatkan adanya ion-ion pada m/z 370 (M+) dan m/z 129 (puncak dasar). Ion
molekul (M+) pada m/z 370 mengindikasikan berat molekul 370.
Pola pemenggalan spektrum massa pada puncak 4 menunjukkan adanya pemenggalan ester sebanyak 2 kali, yaitu pada m/z 241 (M+-C8H17O) dan m/z 112 (M+-C16H34O2). Penggalan pada m/z 129 merupakan penggalan ester oktil. Adanya pemenggalan pada m/z 112 merupakan penggalan molekul yang melepaskan 2 gugus ester oktil (C16H34O2) [18].
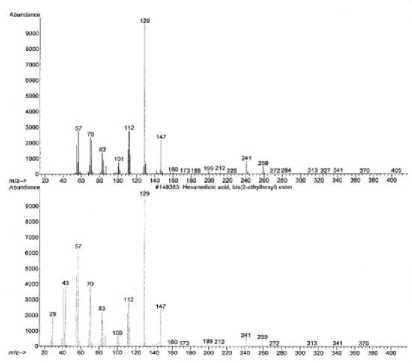
Gambar 17. Spektrum massa senyawa pada puncak 4 (A) dan ester dioktil heksadioat
Dengan demikian berdasarkan pemenggalan seperti terlihat pada Gambar 17 dapat diindikasikan bahwa senyawa pada puncak 4 identik dengan ester dioktil heksadioat (C22H42O4) yang struktur molekulnya dapat dilihat pada Gambar 18.
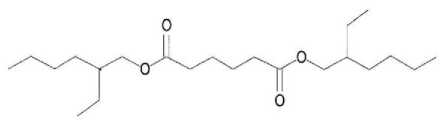
Gambar 18. Struktur molekul ester dioktil heksadioat
Berdasarkan penelitian tentang fraksi yang bersifat bakterisida sebelumnya, fraksi yang aktif bersifat bakterisida selalu mengandung ester dioktil heksadioat sehingga dapat diduga bahwa senyawa yang bersifat
Berdasarkan hasil penelitian ini ekstrak rimpang lempuyang (Zingiber gramineum Blume) bersifat bakterisida. Fraksi yang aktif menghambat pertumbuhan bakteri E. coli teridentifikasi mengandung empat senyawa yaitu: ester etil heksadekanoat, ester etil linoleat, ester etil oleat, dan ester etil oktadekanoat. Sedangkan fraksi yang aktif menghambat pertumbuan bakteri M. luteus juga teridentifikasi mengadung empat senyawa juga yaitu: asam heksadekanoat, asam 9,12-
oktadekadienoat, asam oktadek-9-enoat, dan ester dioktil heksadioat.
UCAPAN TERIMA KASIH
Terimakasih penulis ucapkan kepada semua pihak yang telah membantu penulis, teerutama yang telah membantu selama mengerjakan penelitian ini.
DAFTAR PUSTAKA
-
[1] Wijayakusuma, H. Hidup sehat cara Hembing. PT Alex Media, Komputindo. Jakarta.1995
-
[2] Putra, S. Taru Premana. PT. Upada Sastra. Denpasar. 1991
-
[3] Nala, N. Usada Bali. PT. Upada Sastra. Denpasar.1993
-
[4] Hariana, A. Tumbuhan Obat & Khasiatnya, Penebar Swadaya. Jakarta. 2005
-
[5] Sirait, M. Pemanfaatan Tanaman Obat. Badan Penelitian dan Pengembangan Kesehatan, Departemen Kesehatan. Jakarta. 1989.
antibakteri dalam fraksi E adalah ester dioktil heksadioat.
-
[6] Sukersa, I W. Taru Premana: Suatu Kajian Filologis. Tesis. Universitas Padjadjaran. 1995.
-
[7] Yuharmen, Eryanti, E., dan Nurbalatif, “Uji Aktivitas Antimikroba Minyak Atsiri dan Ekstrak Metanol Lengkuas (Alpinia galanga)”, Skripsi. Universitas Riau. 2002.
-
[8] Hidayati, E., Juli, N., dan Marwani, E., “Isolasi Enterobacteriaceae Patogen dari Makanan Berbumbu dan Tidak Berbumbu Kunyit (Curcuma longa L.) serta Uji Pengaruh Ekstraksi Kunyit (Curcuma longa L.) Terhadap Pertumbuhan Bakteri yang Diisolasi,” Jurnal Matematika dan Sains. 2002.
7(2): 43-52.
-
[9] Dugenci, S.K. Nazli, and Cardan, A. “Some medicinal plants as
immunostimulant for fis,” Journal of Ethnopharmacology. 2003. 88(1): 99106.
-
[10] Neogi, U., Saumya, R., and Irum, B. In vitro combinational effect of bio-active plant extracts on common food borne pathogen. Research Journal of Microbiology. 2007. 22(5): 500-503.
-
[11] Akoachere, J.F., Ndip, R.N., Chenwi, E.B., Ndip, L.M., Njock, T.E., and Anong, D.N.,”Antibacterial effect of Zingiber officinale,” East Africa
Medical Journal. 2002. 79(11). 588
592.
-
[12] Ekwenye, U.N. and Elegalam, N.N., “Antibacterial activity of Ginger (Zingiber offcinale) and Garlic (Allium sativum L.) Extracts on Ezcherchia coli and Salmonella typhi”, International
Journal of Molecular Medicine and Advance Science. 2005.1(4): 411-416.
-
[13] Sabulal, B., Dan, M., Anil, J.J., Kurup, J. R., Padeep, N. S., Valsamma, R. K. and George, V.,”Caryophyllene-rich oil of Zingiber nimmonii from South India: Chemical Characterization and antimicrobial activity”, Phytochemistry. 2006. 67(22): 2469-2473.
-
[14] Alzoreky, N. S. and Nakahara, K 2003. Antibacterial activity of extracts from some edible plants commonly consumed in Asia. International Journal of Food and Microbiology. 2003. 80(3): 223-230.
-
[15] Nostro, A., Cellini, S., Di Bratoloneo, S., Canatelli, M.A., Di Capli, E., Procopio, F., Grande, R., Marzio, L. and
Alonzo, V., “Effects of combining extract (from populis or Zingiber officinale) with Clarithromycin on Helicobacter pylori’’. Phytotheraphy Research, 2006. 20(3): 187-190.
-
[16] Hutapea, J.R. Inventaris Tanaman Obat Indonesia. Badan Penelitian dan
Pengembangan Kesehatan,
Departemen Kesehatan. Jakarta. 2000
-
[17] Wiley 275 L, Database, Enchaned chem station, G170BA version B.01.00, Copyright @ Hewlett-Packard 19891998.
-
[18] Silverstein, R.M., Basler, G.C., and Morril, T.C. 1991, Spectrometric Identification of Organic Compound. John Willey & Sons, Inc. Singapore.
48
Discussion and feedback