AKTIVITAS ANTIOKSIDAN FRAKSI n-BUTANOL EKSTRAK KULIT TERONG BELANDA (Solanum betaceum Cav.) SECARA IN VITRO DAN IDENTIFIKASI SENYAWA GOLONGAN FLAVONOIDNYA
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 4, Nomor 1, Mei 2016

AKTIVITAS ANTIOKSIDAN FRAKSI n-BUTANOL EKSTRAK KULIT TERONG BELANDA (Solanum betaceum Cav.) SECARA IN VITRO DAN IDENTIFIKASI SENYAWA GOLONGAN FLAVONOIDNYA
Ni Putu Widayanti1*, Ni Made Puspawati1,2, I Nyoman Suarsana3, I.A.R. Astiti Asih2, Wiwik Susanah Rita1,2
1Program Studi Magister Kimia Terapan, Universitas Udayana, Denpasar, Bali-Indonesia 2Jurusan Kimia FMIPA, Universitas Udayana, Bukit Jimbaran, Bali-Indonesia 3Fakultas Kedokteran Hewan, Universitas Udayana, Denpasar, Bali-Indonesia
ABSTRAK: Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan secara in vitro dan mengidentifikasi golongan senyawa flavonoid yang terkandung dalam fraksi n-butanol ekstrak kulit terong belanda. Uji aktivitas antioksidan dilakukan dengan metode DPPH. Pemisahan dan pemurnian fraksi aktif n-butanol dilakukan dengan kromatografi kolom menggunakan silika gel yang dielusi dengan n-butanol-etil asetat-asam asetat 10% (2:7:1) dan diidentifikasi dengan spektrofotometer UV-Vis dan FTIR. Fraksi n-butanol memiliki aktivitas antioksidan yang kuat dengan nilai IC50 sebesar 69,89 mg/L. Empat senyawa flavonoid (isolat A, C, H, dan J) berhasil diisolasi dan diidentifikasi sebagai golongan flavon, flavonol dan isoflavon. Senyawa tersebut dipercaya memiliki aktivitas antioksidan.
Kata kunci: Solanum betaceum Cav., aktivitas antioksidan, fraksi n-butanol, flavonoid
ABSTRACT: The present study was conducted to determine in vitro antioxidant activity and ctivity and to identify flavonoid class of compounds present in n-butanol active fraction of Terong Belanda (Solanum betaceum cav.) peel extract. Antioxidant activity test was performed by DPPH (1,1-diphenyl-2-pycrylhidrazyl) method. Separation and purification of n-butanol active fraction were done using silica gel column chromatography eluted with n-butanol-ethyl acetate-acetic acid 10% (2:7:1) and identified by UV-Vis and FTIR spectrophotometer. n-Butanol fraction had strong antioxidant activity with IC50 value by 69.89 mg/L. Four flavonoids (A, C, H, and J isolates) were isolated and identified as flavone, flavonol and isoflavone. This compounds are believed to be responsible for their antioxidant activity.
Keywords: Solanum betaceum Cav., antioxidant activity, n-butanol fraction, flavonoid.
Indonesia yang terletak di kawasan iklim tropis sangat kaya dengan keanekaragaman hayati (biodiversity) berupa tanaman. Beberapa tumbuhan telah dikenal oleh masyarakat sebagai tanaman obat. Namun, keberadaan tanaman obat belum dieksplorasi dan dimanfaatkan secara maksimal. Salah satu tanaman yang
bermanfaat dan perlu dikembangkan sebagai tanaman obat adalah tanaman terong belanda (Solanum betaceum Cav.). Tanaman terong belanda yang juga dikenal dengan sebutan tamarillo tersebar di daerah Bali, Jawa Barat dan Sumatera Utara [1].
Jus terong belanda juga diketahui berpotensi sebagai antioksidan karena mampu menghambat produksi dari reseptor LDL dalam sel hati. Jus buah terong belanda
(Cyphomandra betaceae) dilaporkan mampu menurunkan kadar kolesterol total darah pada tikus putih [2]. Ekstrak etanol biji terong belanda (Solanum betaceum, syn) dilaporkan mampu menghambat reaksi peroksidasi lemak pada plasma darah tikus Wistar [3]. Buah terong belanda sangat kaya nutrisi dan senyawa kimia yang dibutuhkan oleh tubuh diantaranya vitamin (A, B1, B2, B6, C dan E), karoten, karbohidrat, protein, lemak, serat, magnesium, fosfor, kalsium, senyawa fenol dan senyawa flavonoid [4,5].
Berdasarkan uji skrining fitokimia pendahuluan terhadap fraksi n-butanol ekstrak kulit terong belanda diketahui positif mengandung senyawa golongan terpenoid, fenol, flavonoid dan saponin. Senyawa flavonoid merupakan salah satu senyawa metabolit sekunder yang berperan sebagai antioksidan karena terbukti bermanfaat dalam mencegah kerusakan sel akibat stres oksidatif. Aktivitas antioksidan yang dimiliki oleh senyawa flavonoid dapat dimanfaatkan untuk pencegahan penyakit degeneratif. Tujuan penelitian ini adalah untuk mengetahui aktivitas antioksidan secara in vitro dan mengidentifikasi golongan senyawa flavonoid yang terkandung dalam fraksi n-butanol ekstrak kulit terong belanda yang berpotensi sebagai antioksidan.
Bahan-bahan yang digunakan adalah buah terong belanda yang masih segar dan sudah matang, etanol, n-heksan, n-butanol, kloroform, etil asetat, metanol, kristal DPPH (1,1-diphenyl-2-pycrylhidrazyl), kalium bromida, asam klorida pekat, natrium hidroksida, asam asetat, aluminium klorida, asam borat, natrium asetat, akuades, silika gel 60 H dan silika gel GF254, bufer natrium karbonat dan kalium klorida.
Peralatan yang digunakan adalah seperangkat peralatan gelas, toples kaca, neraca analitik, blender, pisau, botol vial, aluminium foil, kertas saring, pipet mikro, centrifuge, pipet kapiler, pipet volume,
seperangkat alat kromatografi kolom dan kromatografi lapis tipis, lampu UV, penguap vakum putar (rotary vacuum evaporator), spektrofotometer UV-Vis dan spektrofotometer FTIR.
Buah terong belanda (Solanum betaceum Cav.) yang diperoleh dari Kintamani, Bangli dibersihkan kemudian dikupas dan diambil bagian kulit buahnya. Sebanyak 1 kg kulit buah terong belanda dipotong kecil-kecil dan dihaluskan dengan blender.
Ekstraksi dilakukan dengan cara maserasi menggunakan pelarut etanol teknis selama ± 24 jam. Selanjutnya filtrat disaring dan ampasnya dimaserasi kembali. Filtrat yang diperoleh kemudian dikumpulkan dan diuapkan dengan rotary vacuum evaporator sampai diperoleh ekstrak pekat etanol. Ekstrak pekat etanol selanjutnya ditambahkan air dan etanol yang telah dilarutkan dengan rasio 7:3. Etanolnya kemudian diuapkan sehingga diperoleh ekstrak airnya.
Ekstrak air selanjutnya dipartisi dalam tiga tahapan sebagai berikut. Pertama, partisi dilakukan dengan menggunakan n-heksan sehingga diperoleh ekstrak air dan ekstrak n-heksan (EH). Tahap kedua, ekstrak air dipartisi kembali dengan menggunakan kloroform sehingga diperoleh ekstrak air dan ekstrak kloroform (EK). Tahap terakhir, ekstrak air dipartisi kembali dengan n-butanol dan diperoleh ekstrak n-butanol (EB). Ekstrak n-butanol selanjutnya dievaporasi sehingga diperoleh ekstrak kental n-butanol. Ekstrak kental n-butanol selanjutnya diuji dengan uji fitokimia.
Penentuan Kandungan Total Flavonoid
Penentuan kandungan total flavonoid pada fraksi n-butanol dilakukan dengan metode spektrofotometri menggunakan reagen aluminium klorida. Sebanyak 2 mL larutan sampel ditambahi dengan 2 mL aluminium klorida 2%. Campuran larutan tersebut selanjutnya divortex selama 20
menit dan diinkubasi selama 24 menit. Selanjutnya serapan diukur pada panjang gelombang 415 nm. Kandungan flavonoid dinyatakan dengan kesetaraan pembanding baku kuersetin [6].
Uji Aktivitas Antioksidan secara In Vitro
Sebanyak 1,0 mL larutan sampel dengan berbagai konsentrasi (10; 25; 50; 75; dan 100 mg/L) ditambahi 1,0 mL DPPH (1,1-diphenyl-2-pycrylhidrazyl) 0,004% dan etanol sebanyak 2,0 mL. Campuran tersebut divortex dan didiamkan selama 30 menit kemudian serapan diukur dengan spektrofotometer UV-Vis pada panjang gelombang 517 nm [7].
Pemisahan dan Pemurnian
Untuk melihat profil kromatografi dari fraksi n-butanol, digunakan cara
kromatografi kolom dan kromatografi lapis tipis. Proses elusi dilakukan dengan cairan pengembang yang memberikan pemisahan terbaik.
-
- Fase diam yang digunakan : Silika gel 60
-
- Fase gerak yang digunakan : n-butanol-
etil asetat-asam asetat 10% (2:7:1)
Masing-masing eluat yang telah ditampung dalam botol sebanyak 3 mL selanjutnya dianalisis dengan kromatografi lapis tipis.
-
- Fase diam : Silika gel GF254
-
- Fase gerak : n-butanol-etil asetat-asam Asetat 10% (2:7:1)
-
- Pendeteksi : Sinar UV 254/366 nm.
Identifikasi Senyawa Flavonoid
Identifikasi senyawa golongan flavonoid dilakukan dengan mengamati warna fluorosensi dari masing-masing eluat di bawah sinar UV. Eluat yang memiliki pola pemisahan noda yang sama digabungkan sehingga diperoleh beberapa fraksi.
Masing-masing fraksi diuapkan dan diuji dengan pereaksi flavonoid berupa test Willstatter, NaOH 10% dan Bate-Smith dan Metcalfe. Fraksi yang positif flavonoid selanjutnya diuji kemurniannya dengan
beberapa campuran fase gerak yang lain dengan cara kromatografi lapis tipis untuk mengetahui fraksi yang relatif murni secara KLT.
Masing-masing isolat yang telah dilarutkan dalam metanol selanjutnya diukur serapannya dengan spektrofotometer UV-Vis panjang gelombang 250-500 nm. Kedudukan gugus hidroksi pada inti flavonoid dapat diketahui dengan menambahkan pereaksi geser berupa natrium hidroksida, aluminium klorida, asam klorida, natrium asetat, dan asam borat. Selain dengan spektrofotometer UV-Vis, identifikasi isolat juga dilakukan dengan spektrofotometer FTIR sebagai uji konfirmasi [8].
Berdasarkan hasil uji fitokimia, fraksi n-butanol positif mengandung senyawa flavonoid. Analisis kuantitatif menunjukkan bahwa kandungan total flavonoid pada fraksi n-butanol sebesar 6,80 ppm. Analisis total kandungan senyawa flavonoid dihitung sebagai ekuivalen kuersetin dalam % (b/b) sebesar 0,68%. Hasil pengukuran tersebut menunjukkan kadar < 1% b/b sehingga senyawa flavonoid golongan kuersetin pada fraksi n-butanol ekstrak kulit terong belanda termasuk ke dalam komponen penyusun minor. Hal ini mengindikasikan bahwa terdapat senyawa golongan flavonoid selain kuersetin pada sampel.
Hasil penentuan aktivitas antioksidan dengan metode DPPH menunjukkan bahwa fraksi n-butanol memiliki nilai IC50 sebesar 69,89 mg/L. Senyawa yang memiliki nilai IC50 yang berkisar antara 50-100 mg/L tergolong senyawa antioksidan yang memiliki aktivitas yang kuat. Dengan demikian, fraksi n-butanol ekstrak kulit terong belanda memiliki aktivitas antioksidan yang kuat [9].
Isolasi terhadap fraksi n-butanol dengan menggunakan fase gerak n-butanol: etil asetat : asam asetat 10% (2:7:1) menghasilkan 10 (sepuluh) kelompok fraksi (FA, FB, FC, FD, FE, FF, FG, FH, FI dan FJ). Kromatogram disajikan pada Gambar 1.
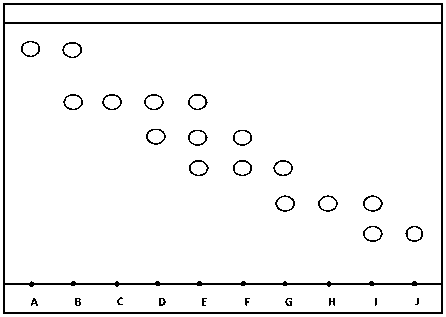
Gambar 1. Kromatogram hasil KLT penggabungan
Hasil KLT penggabungan menunjukkan bercak yang terlihat di bawah lampu UV dengan panjang gelombang 366 nm berfluoresensi hijau dan biru muda yang diduga mengandung senyawa flavonoid golongan flavon dan flavanon yang tidak mengandung 5-OH, misalnya 5-O-glikosida, flavonol yang mengandung 3-OH bebas dan disertai atau tanpa 5-OH bebas dan isoflavon yang tidak mengandung 5-OH bebas [8].
Dari sepuluh fraksi tersebut, hanya empat fraksi yang memiliki noda tunggal dan positif flavonoid yaitu fraksi A, C, H dan J dengan memberikan perubahan warna kuning, oranye dan coklat kemerahan setelah diuji dengan pereaksi flavonoid.
Setelah dilakukan identifikasi dengan mengamati warna fluorosensi masing-masing isolat, selanjutnya dilihat pergeseran batokromik dari empat isolat yang telah murni secara KLT yang disajikan pada Tabel 1 dan Gambar 2.
Karakterisasi isolat FA dengan spektrofotometer UV-Vis dengan pelarut
metanol memberikan serapan maksimum pada panjang gelombang 250,80 nm (pita II), 290,40 nm (bahu) dan 331,00 nm (pita I) sehingga menunjukkan bahwa senyawa tersebut adalah golongan flavon (apigenin) [8]. Penambahan natrium hidroksida menunjukkan pergeseran batokromik sebesar 48,2 nm pada pita I tanpa adanya penurunan intensitasnya, hal ini menunjukkan adanya OH-4’ bebas. Terbentuknya pita baru pada panjang gelombang 264,20 nm menunjukkan adanya OH-7 bebas. Penambahan natrium asetat-asam borat menunjukkan pergeseran batokromik sebesar 21,2 nm pada pita I dan sebesar 8,4 nm pita II yang mengindikasikan adanya ortodihidroksi pada cincin B yaitu OH-4’ dan OH-5’. Penambahan aluminium klorida menunjukkan pergeseran sebesar 25,4 nm pada pita I dan 14,2 nm pada pita II mengarah adanya ortodihidroksi pada cincin A yaitu atom C-6 dan C-7 atau C-7 dan C-8. Penambahan aluminium klorida-asam klorida tidak memberikan pergeseran baik pada pita I maupun pada pita II. Berdasarkan data tersebut di atas, maka senyawa tersebut mengarah pada struktur 6,7,4’,5’ tetrahidroksi flavon atau 7,8,4’,5’ tetrahidroksi flavon.
Serapan yang hampir serupa juga diberikan oleh isolat FC dalam metanol yaitu pada panjang gelombang 250,80 nm (pita II), 289,60 nm (bahu) dan 330,20 nm (pita I) sehingga menunjukkan bahwa senyawa tersebut adalah golongan flavon (apigenin) [8]. Penambahan natrium hidroksida pada isolat Fc memberikan pergeseran batokromik sebesar 50,6 nm pada pita I dan sebesar 9,2 nm pada pita II, hal ini menunjukkan adanya OH-4’ bebas. Penambahan natrium asetat menunjukkan tidak terjadi pergeseran baik pada pita I maupun pita II. Namun, penambahan natrium asetat disertai asam borat menunjukkan terjadinya pergeseran batokromik sebesar 18,6 nm pada pita I dan sebesar 7,6 nm pada pita II yang mengindikasikan adanya gugus ortodihidroksi pada cincin B yaitu pada posisi C nomor 4’ dan 5’. Penambahan
aluminium klorida ternyata hanya memberikan pergeseran batokromik sebesar 6,8 nm pada pita I dan tidak memberikan pergeseran pada pita II. Hal yang serupa juga terjadi pada penambahan pereaksi geser aluminium klorida dan asam klorida yang hanya memberikan pergeseran pada pita II. Dari data spektrum UV tersebut, isolat Fc mengarah pada struktur senyawa 4’,5’ dihidroksi flavon.
Isolat FH memberikan serapan maksimum pada panjang gelombang 331,00 nm (pita I) dan 262,60 nm (pita II) sehingga menunjukkan bahwa senyawa tersebut adalah golongan flavonol (3-OH tersubstitusi) [8]. Pada isolat FH terjadi pergeseran batokromik sebesar 59,2 nm (pita I) dan 3,4 nm (pita II) setelah dilakukan penambahan natrium hidroksida, hal ini menunjukkan adanya OH-4’ bebas. Penambahan natrium asetat memberikan pergeseran batokromik sebesar 0,8 nm pada pita I dan tidak memberikan pergeseran pada pita II serta memiliki kekuatan yang berkurang dengan bertambahnya waktu, hal ini mengindikasikan adanya gugus yang peka terhadap basa yang diduga adalah gugus ortodihidroksi pada posisi C nomor 3 dan 4’. Keberadaan gugus hidroksi pada C nomor 3 semakin memperkuat dugaan senyawa flavonol pada isolat FH. Penambahan natrium asetat dan asam borat memberikan pergeseran batokromik sebesar 21,2 nm pada pita I dan tidak memberikan pergeseran pada pita II yang mengindikasikan adanya gugus ortodihidroksi pada cincin B posisi C nomor 4’ dan 5’. Penambahan aluminium klorida tidak dapat mendeteksi keberadaan gugus hidroksil baik pada cincin A maupun B karena hanya memberikan pergeseran batokromik sebesar 0,8 nm pada pita I dan 9,2 nm pada pita II. Penambahan aluminium klorida dan asam klorida menunjukkan tidak terjadi perubahan pada pita I yang mempunyai nilai serapan yang sama dengan metanol dan memberikan pergeseran batokromik sebesar 6,8 nm pada pita II sehingga mengarah pada dugaan adanya gugus hidroksi pada posisi C nomor 5.
Tabel 1. Data Pergeseran Panjang Gelombang Serapan Maksimum Masing-masing Isolat
|
Isolat/pereaksi |
Pita I (nm) |
Pita II (nm) |
|
Isolat FA | ||
|
Metanol |
331,00 |
250,80 |
|
Metanol + NaOH |
379,20 |
264,20 |
|
Metanol + NaOAc |
330,20 |
251,00 |
|
Metanol + NaOAc + H3BO3 |
352,20 |
259,20 |
|
Metanol + AlCl3 |
356,40 |
265,00 |
|
Metanol + AlCl3 + HCl |
331,00 |
250,80 |
|
Isolat FC | ||
|
Metanol |
330,20 |
250,80 |
|
Metanol + NaOH |
380,80 |
260,00 |
|
Metanol + NaOAc |
329,40 |
250,80 |
|
Metanol + NaOAc + H3BO3 |
348,80 |
258,40 |
|
Metanol + AlCl3 |
337,00 |
250,80 |
|
Metanol + AlCl3 + HCl |
331,00 |
249,80 |
|
Isolat FH | ||
|
Metanol |
331,00 |
262,60 |
|
Metanol + NaOH |
390,20 |
266,00 |
|
Metanol + NaOAc |
331,80 |
262,60 |
|
Metanol + NaOAc + H3BO3 |
352,20 |
262,60 |
|
Metanol + AlCl3 |
331,80 |
271,80 |
|
Metanol + AlCl3 + HCl |
331,00 |
269,40 |
|
Isolat FJ | ||
|
Metanol |
327,60 |
248,20 |
|
Metanol + NaOH |
375,80 |
266,80 |
|
Metanol + NaOAc |
329,40 |
248,20 |
|
Metanol + NaOAc + H3BO3 |
351,20 |
257,40 |
|
Metanol + AlCl3 |
334,40 |
250,80 |
|
Metanol + AlCl3 + HCl |
327,60 |
248,20 |
Dari spektrum UV-Vis tersebut, isolat FH diduga mengandung senyawa 3,5,4’,5’ tetrahidroksi flavonol.
Karakterisasi isolat FJ dalam pelarut metanol memberikan pita serapan berupa pita I yang terletak pada panjang gelombang 327,60 nm, pita II yang terletak pada panjang gelombang 248,20 nm dan bahu yang terletak pada 295,60 nm sehingga menunjukkan bahwa senyawa tersebut adalah golongan isoflavon [8]. Penambahan natrium hidroksida memberikan pergeseran batokromik sebesar 48,2 nm (pita I) dan 18,6 nm (pita II) yang mengindikasikan adanya gugus hidroksi pada posisi C nomor 3’ dan 4’ [10]. Penambahan natrium asetat memberikan pergeseran batokromik sebesar 1,8 nm pada pita I dan tidak memberikan
pergeseran pada pita II. Penambahan natrium asetat dan asam borat menunjukkan pergeseran batokromik sebesar 23,6 nm (pita I) dan 9,2 nm (pita II) yang mengindikasikan keberadaan gugus ortodihidroksi pada cincin A yaitu pada C nomor 6 dan 7 atau 7 dan 8. Penambahan aluminium klorida hanya memberikan pergeseran batokromik sebesar 6,8 nm (pita I) dan 2,6 nm (pita II) dan tidak memberikan pergeseran pada saat penambahan asam klorida. Penambahan pereaksi geser tersebut tidak dapat mendeteksi keberadaan gugus 3’,4’-dihidroksi isoflavon yang kemungkinan disebabkan oleh cincin B yang memiliki sedikit atau tidak adanya konjugasi dengan gugus kromofor utama [10]. Dari spektrum UV-Vis tersebut, isolat FJ diduga mengandung senyawa 6,7,3’,4’ tetrahidroksi isoflavon atau 7,8,3’,4’ tetrahidroksi isoflavon.
Serapan maksimum yang terjadi pada panjang gelombang yang ditunjukkan oleh pita II disebabkan oleh adanya transisi elektronik dari n — π * yang menunjukkan keberadaan gugus kromofor tunggal seperti ikatan C=O [11,13]. Sedangkan serapan maksimum yang terjadi pada panjang gelombang yang ditunjukkan oleh pita I disebabkan oleh adanya eksitasi elektron dari π — π * yang menunjukkan keberadaan gugus kromofor C=C terkonjugasi [12].
Keberadaan senyawa flavonoid pada maing-masing isolat didasarkan pada hasil spektrum UV-Vis dan penambahan pereaksi geser serta didukung oleh data spektrum FTIR. Puncak-puncak spektrum FTIR dari keempat isolat tersebut memberikan petunjuk adanya gugus OH pada 3527,803313,71 cm-1, gugus ester C=O pada 1751,36-1714,72 cm-1 dan gugus C=C aromatik pada 1602,85-1585,00 cm-1 yang merupakan gugus utama penyusun flavonoid [11,13].
Kandungan senyawa flavonoid golongan flavon, flavonol dan isoflavon yang terdapat pada fraksi n-butanol ekstrak kulit terong belanda diduga berkontribusi dalam menangkal radikal bebas sehingga bersifat antioksidan. Krisin merupakan
senyawa turunan flavon yang memiliki aktivitas biologis serta memiliki efek farmakologis diantaranya sifat anti inflamasi, antikanker dan antioksidan. Sedangkan senyawa isoflavon diketahui berpotensi dalam mencegah penuaan dini sel dan penyakit degeneratif [14,15].
(A)
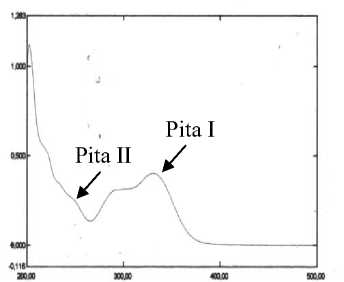
(B)
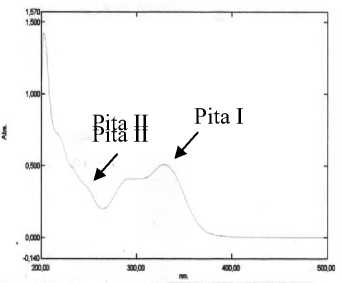
(C)
(D
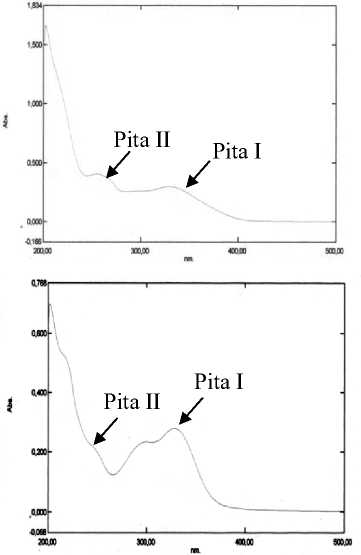
Gambar 2. Spektrum UV-Vis (A) isolat FA, (B) isolat FC, (C) isolat FH dan (D) isolat FJ.
Fraksi n-butanol ekstrak kulit terong belanda memiliki aktivitas antioksidan yang kuat dengan nilai IC50 sebesar 69,89 mg/L. Empat senyawa flavonoid berhasil diisolasi dan diidentifikasi yaitu isolat FA diduga mengandung senyawa 6,7,4’,5’ tetrahidroksi flavon atau senyawa 7,8,4’,5’ tetrahidroksi flavon, isolat FC mengandung senyawa 4’,5’ dihidroksi flavon, isolat FH mengandung senyawa 3,5,4’,5’ tetrahidroksi flavonol dan isolat FJ mengandung senyawa 6,7,3’,4’ tetrahidroksi isoflavon atau senyawa 7,8,3’,4’ tetrahidroksi isoflavon.
Pada kesempatan ini penulis
menyampaikan terima kasih Bakrie Centre Foundation dan pihak lainnya yang telah memberikan dukungan selama penelitian dan penulisan jurnal ini.
-
[1] Kumalaningsih S., Suprayogi.
Tamarillo (Terung Belanda), Tanaman Berkhasiat Penyedia Antioksidan Alami. Trubus Agrisarana, Surabaya, 2006.
-
[2] Syariah W.O., Usmar, Syukur R.
Pengaruh Jus Buah Terong Belanda (Cyphomandra betaceae) terhadap Kadar Kolesterol Total Tikus Putih (Rattus norvegicus) Jantan. J. Farmasi dan Farmakologi, 2011, 15: 95-98.
-
[3] Dewi N.W.O.A.C. Aktivitas
Antioksidan Senyawa Flavonoid Ekstrak Etanol Biji Terong Belanda (Solanum betaceum, syn) dalam Menghambat Reaksi Peroksidasi Lemak pada Plasma Darah Tikus Wistar. Cakra Kimia, 2014, 2: 7-16.
-
[4] Kumalaningsih S. Antioksidan Alami-
Penangkal Radikal Bebas, Sumber, Manfaat, Cara Penyediaan dan Pengolahan. Trubus Agrisarana, Surabaya, 2006.
-
[5] Morton J. Tree Tomato. In: Fruits of Warm Climate. Miami, FL, 1987, p 437-440.
-
[6] Chang C., Yang M., Wen H.C.J. Estimation of Total Flavonoid Content in Propolis by Two Complementary Colorinetric Methods. J. Food Drug Anal. 2002, 10: 178-182.
-
[7] Nurjanah, Abdulla A., Apriand A. Aktivitas Antioksidan dan Komponen Bioaktif pada Keong Ipong-ipong (Fasciolaria salmo). J. Pengolahan Hasil Perikanan Indonesia, 2011,
14(1): 22-29.
-
[8] Markham K.R. Cara Mengidentifikasi Flavonoid. (Terjemahan Kosasih Padmawinata). Penerbit ITB,
Bandung, 1988.
-
[9] Jun M.H.Y., Fong J., Wan X., Yang C.S., Ho C.T. Comparison of Antioxidant Activities of Isoflavones Form Kudzu Root (Puerarua labata O). Journal Food Science Institute of Technologist, 2003, 68: 2117-2122.
-
[10] Mabry T.J., Markham K.R., Thomas M.B. The Systematic Identification of Flavonoid. Springer-Verlag, New York, 1970.
-
[11] Sastrohamidjojo H. Spektroskopi. UGM Press, Yogyakarta, 2001.
-
[12] Fessenden R.J., Fessenden J.S. Kimia Organik, (Terjemahan Aloysius, H.A.). Jil. 1, Ed. 3, Airlangga, Jakarta, 1995.
-
[13] Silverstein, Bassler, Morrill.
Penyidikan Spektrometrik Senyawa Organik. (Terjemahan A.J. Hartomo, Anny Victor Purba). Ed. 4, Erlangga, Jakarta, 1986.
-
[14] Manoharan S., Murugaraj M.P., Nagarethinam B., Ramachandran S., Sekar K., Shamsul A.W.
Chemopreventive Potential of Chrysin in 7,12-dimethylbenz(a)anthracene
Induced Skin Carcinogenesis in Swiss Albino Mice. Int.J.Res.Pharm.Sci. 2012, 3:86-96.
-
[15] Ren M.Q., Kuhn G., Wegner J., Chen J. Isoflavones, Substance with Multi-Biological and Clinical Properties. Eur. J. Nutr. 2001, 40: 135-146
38
Discussion and feedback