PEMANFAATAN BIJI PEPAYA (Carica papaya L) TERAKTIVASI H2SO4 SEBAGAI BIOSORBEN DALAM PENGOLAHAN AMONIA PADA LIMBAH CAIR TAHU
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 11, Nomor 2, Oktober 2023
Cafaa tKjmia
PEMANFAATAN BIJI PEPAYA (Carica papaya L) TERAKTIVASI H2SO4 SEBAGAI BIOSORBEN DALAM PENGOLAHAN AMONIA PADA
LIMBAH CAIR TAHU
Oka Ratnayani*, Kartika Simanjuntak, Ni Made Puspawati Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali *Email : okaratnayani@unud.ac.id
ABSTRAK: Tujuan penelitian ini adalah untuk mengetahui karakteristik biosorben biji pepaya tanpa aktivasi dan teraktivasi H2SO4 10% yang meliputi luas permukaan, keasaman permukaan dan situs aktif, dan juga menentukan efisiensi adsorpsi amonia limbah cair tahu serta daya serap adsorpsinya pada kondisi optimum. Biosorben teraktivasi dibuat dengan cara merendam biji pepaya dalam larutan H2SO4 10% selama 12 jam. Hasil penelitian menunjukkan luas permukaan spesifik biosorben tanpa aktivasi dan teraktivasi asam sulfat masing-masing sebesar 10,9416 m2/g dan 56,3179 m2/g. Keasaman permukaan masing-masing biosorben tanpa aktivasi dan teraktivasi adalah 1,7944 mmol/g dan 3,1880 mmol/g. Situs aktif biosorben tanpa aktivasi dan teraktivasi masing-masing adalah 10,8058 x 1020 molekul/g dan 19,1981 x 1020 molekul/g. Kondisi optimum yang didapatkan untuk mengadsorpsi amonia limbah cair tahu yaitu pada waktu kontak 90 menit dengan berat biosorben sebanyak 0,5 gram. Efisiensi dan daya serap adsorpsi amonia pada kondisi optimum menggunakan biosorben tanpa aktivasi adalah 51,02% dan 0,2951 mg/g, sedangkan menggunakan biosorben teraktivasi masing-masing sebesar 82,63%, dan 0,4779 mg/g. Dari hasil penelitian ini dapat disimpulkan bahwa efisiensi dan daya serap adsorpsi amonia pada kondisi optimum menggunakan biosorben teraktivasi asam sulfat lebih tinggi daripada biosorben tanpa aktivasi.
Kata kunci: Adsorpsi; ammonia; biji papaya; H2SO4 10%
ABSTRACT: The purpose of this study was to characterize the non-activated and activated papaya seed biosorbents, that included the surface area, surface acidity and active sites, as well as to determine the adsorption efficiency and capacity of ammonia (in the form of ammonium ions) of the tofu liquid waste. Activated biosorbents were prepared by soaking papaya seeds in a H2SO4 10% solution for 12 hours. The results showed the specific surface area of the biosorbents without activation and activated with H2SO4 10% was 10.9416 m2/g and 56.3179 m2/g, respectively. The surface acidity of non-activated and activated biosorbents was 1.7944 mmol/g and 3.1880 mmol/g, respectively. The active sites of non-activated and activated biosorbents were 10.8058 x 1020 molecules/g and 19.1981 x 1020 molecules/g, respectively. The optimum conditions required to adsorb the ammonia of the tofu liquid waste were at a contact time of 90 minutes with the biosorbent mass of 0.5 grams. The adsorption efficiency and capacity at the optimum conditions for the non-activated biosorbent were 51.02% and 0.2951 mg/g, respectively, while for activated biosorbents were 0.4779 mg/g and 82.63%, respectively. The adsorption efficiency and capacity activated biosorbents were higher than the non-activated ones.
Keywords: Adsorption; ammonia; papaya seeds; H2SO4 10%
Tahu merupakan makanan bergizi yang mengandung banyak protein dan berbahan dasar kacang kedelai [1]. Industri tahu yang dari waktu ke waktu selalu meningkat dapat menambah pencemaran lingkungan apabila tidak diolah dengan baik [2]. Bahan organik pada limbah cair tersebut diurai oleh bakteri membentuk senyawa seperti amonia (NH3) yang menyebabkan limbah cair tahu berbau menyengat. Konsentrasi amonia dalam air dapat mengakibatkan keracunan bagi semua organisme air [3]. Kadar amonia di atas 35 ppm dapat menyebabkan berbagai masalah kesehatan pada manusia, antara lain kerusakan ginjal dan paru-paru, pertumbuhan lambat dan disfungsi otak, serta jumlah darah rendah [4]. Berbagai metode telah dilakukan guna mengurangi pencemaran yang ditimbulkan dari limbah cair industri tahu misalnya teknik bioremediasi dengan mikroorganisme EM4, hasil menunjukkan bahwa kadar TSS dengan kadar awal 6.300 mg/L berkurang menjadi 150 mg/L pada P2 (20 mL) dengan penurunan 97,61 % dan untuk kadar COD dengan kadar awal 9.600 mg/L berkurang menjadi 106,33 mg/L pada P2 (20 mL) dengan penurunan 98,89% [5]. Arang dan daun bambu juga mampu menurunkan kadar nitrogen total paling rendah dengan penurunan sebesar 38,13% dari sebelum difiltrasi. Namun metode ini memiliki kelemahan, yaitu bahan baku bambu yang masih kurang tersedia, sehingga perlu dilakukan alternatif lain yang lebih efisien [6]. Salah satu metode adsorpsi yang banyak digunakan yaitu dengan menggunakan biosorben (adsorben alami). Biaya operasional yang rendah, ketersediaan yang melimpah dan mudah ditemukan, pemanfaatan limbah, dan kemudahan penerapan. Diantara beberapa biosorben yang didapat dari limbah pertanian, biji pepaya dapat dimanfaatkan dengan biaya
yang murah. Biji pepaya dilaporkan mengandung 24,3 g protein, 25,3 g minyak lemak, 32,5 g total karbohidrat, 17,0 g serat kasar, 8,8 g abu, 0,09% minyak atsiri, glikosida, karisin, dan enzim myrosin per 100 g biji. Keragaman biomolekul ini menunjukkan bahwa beberapa gugus fungsi ada pada strukturnya. Pada penelitian Pavana et al, (2014) analisis FTIR menunjukkan adanya gugus fungsi seperti O-H, C=O dan C–O pada permukaan bubuk biji pepaya yang berpartisipasi dalam interaksi antara biosorben dalam mengikat ion ammonium secara kimia. Kandungan karbohidrat tinggi yang dimiliki biji pepaya mengandung karbon tinggi pula. Semakin tinggi kandungan karbon yang dimiliki maka potensinya semakin baik sebagai biosorben. Penelitian tentang biosorben dari biji pepaya telah banyak dilakukan, pembuatan biji pepaya sebagai biosorben untuk penyerapan kristal violet, dengan ukuran partikel 60 mesh dan menggunakan aktivator H2SO4 98%, dimana diperoleh luas permukaan 1,38 m2/g [7]. Selain itu, adsorpsi larutan Pb (II) menggunakan biosorben biji pepaya menghasilkan ukuran partikel 60 mesh menggunakan asam sulfat 98% sebagai aktivator sehingga diperoleh luas permukaan sebesar 27,5 m2/g [8]. Aktivator digunakan untuk memperluas permukaan adsorben. Pada proses aktivasi, pengotor yang menempel pada permukaan biosorben dapat dihilangkan sehingga menghasilkan pori-pori yang lebih banyak dan dapat memperluas permukaan internal serta meningkatkan daya adsorpsinya. Aktivator berfungsi untuk memaksimalkan daya serap karbon dengan menghilangkan kotoran yang melekat dan menutup pori karbon dengan cara mengoksidasi karbon [9]. Penelitian [10] membuktikan Biosorben biji pepaya yang mengandung aktivator H2SO4 10% mampu
meningkatkan penyerapan zat warna, dengan nilai iodin maksimum 482,22 mg/g pada pemanasan 120 menit dan konsentrasi asam sulfat 10%.
Bahan-bahan kimia yang dimanfaatkan yaitu H2SO4 10%, metilen biru, NaOH 0,1 M, asam oksalat, indikator fenolftalein, HCl 0,1 M, NH4Cl, larutan alkalin sitrat, larutan fenol, natrium nitroprusida, natrium hipoklorit, aquades, dan kertas saring. Sampel limbah cair tahu diperoleh dari produksi tahu di Jl. Taman Pancing, Pemogan, Denpasar Barat. Bahan biosorben berupa limbah biji pepaya lokal yang didapat dari salah satu penjual jus buah di sekitar Bukit Jimbaran. Alat-alat yang digunakan yaitu erlenmeyer, gelas kimia, tabung reaksi, gelas ukur, oven, blender, jerigen, timbangan analitik, desikator, batang pengaduk, aluminium foil, ayakan berukuran 60 mesh, pipet tetes, shaker, magnetic stirer, hot plate dan spektrofotometer UV-Vis Shimadzu UV1800.
Biji pepaya segar yang sudah dicuci dididihkan selama 8 jam. Biji pepaya disaring dan dicuci kembali dengan aquades. Kemudian dikeringkan pada suhu 60°C selama 48 jam dalam oven. Biji pepaya kering dimasukkan ke dalam blender dan diayak dengan ayakan 60 mesh. dan dilakukan pengaktifan dengan merendam biji pepaya dalam H2SO4 10% dengan rasio 1:1 (b/v) dan diovenkan selama 12 jam pada suhu 110°C. Kemudian disaring dan dicuci kembali menggunakan aquades untuk menghilangkan asam. Selanjutnya diovenkan pada suhu 110°C selama 60 menit.
Luas Permukaan Biosorben
Penelitian ini menggunakan metilen biru yang diketahui kemampuan adsorpsinya pada padatan dan kegunaanya sebagai karakterisasi adsorpsi material [11]. Metilen biru dikalibrasi dan diukur pada panjang gelombang optimum. Lalu sebanyak 0,5 g biosorben (biji pepaya yang teraktivasi H2SO4 10 % dan tanpa aktivasi) direndam menggunakan 20 mL metilen biru dan diaduk selama 60 menit, kemudian disaring. Absorbansi filtratnya diukur pada panjang gelombang maksimum. Kemudian ditentukan luas permukaannya.
Penentuan Keasaman Permukaan dan Situs Aktif
Sebanyak tiga erlenmeyer berukuran 100 mL masing-masing diisi 0,5 g sampel, kemudian ditambahkan 25 mL larutan NaOH 0,1 M. Campuran diaduk selama 15 menit dan disaring menggunakan kertas saring, pada blanko perlakuan yang sama dilakukan yang hanya berisi 25 mL larutan NaOH 0,1 M. Dua sampai tiga tetes indikator fenolftalein ditambahkan ke setiap filtrat yang ditunjukkan adanya perubahan warna merah muda. Filtrat dititrasi dengan larutan HCl 0,1 M sampai terjadi perubahan warna yaitu kembali ke warna filtrat awal.
Pembuatan Kurva Standar Untuk Pengujian Amonia
Spektrofotometri UV-Vis dioptimalkan sesuai petunjuk penggunaan alat uji amonia. Sebanyak 25 mL larutan ammonium kerja ditambahkan ke masing-masing erlenmeyer, ditambahkan larutan fenol sebanyak 1 mL dan dihomogenkan, ditambahkan natrium nitroprusida sebanyak 1 mL dan dihomogenkan kembali. Larutan pengoksidasi sebanyak 2,5 mL kemudian ditambahkan dan dihomogenkan. Labu erlenmeyer kemudian ditutup dengan plastik atau film parafin dan didiamkan selama 1
Karakterisasi Adsorben
jam agar terbentuk warna. Lalu dianalisis dengan UV-Vis dan dicatat absorbansinya.
Penentuan Efisiensi dan Daya Serap Adsorpsi Biosorben Pada Waktu Kontak dan Massa Biosorben Optimum
Masing-masing erlenmeyer yang berisi 2 gram bubuk biji pepaya (teraktivasi H2SO4 10 % dan tanpa aktivasi) diisi 50 mL limbah cair tahu dan diaduk dengan shaker dengan kecepatan 150 rpm selama variasi waktu kontak 30, 60, 90 dan 120 menit. Selanjutnya disaring dan sebanyak 25 mL filtrat dipipet dan dimasukkan dalam erlenmeyer 50 mL dan ditambahkan larutan fenol sebanyak 1 mL kemudian dihomogenkan. Natrium nitroprusid sebanyak 1 mL ditambahkan dan dihomogenkan kembali, lalu 2,5 mL larutan pengoksida ditambahkan dan dihomogenkan dan erlenmeyer tersebut ditutup dengan plastik dan untuk pembentukan warna dibiarkan selama 1 jam lalu dianalisis filtratnya dengan UV-Vis untuk mendapatkan waktu optimum. Kemudian masing-masing erlenmeyer yang berisi 0,5; 1; 1,5; dan 2 gram bubuk biji pepaya (teraktivasi H2SO4 10 % dan tanpa aktivasi) diisi 50 mL limbah cair tahu dan diaduk pada waktu optimum menggunakan shaker dengan kecepatan 150 rpm, selanjutnya disaring dan dipipet 25 mL filtrat lalu dimasukkan dalam erlenmeyer 50 mL dan ditambahkan larutan fenol sebanyak 1 mL kemudian dihomogenkan. Natrium nitroprusid sebanyak 1 mL ditambahkan dan dihomogenkan kembali, lalu larutan pengoksida sebanyak 2,5 mL ditambahkan dan dihomogenkan. Erlenmeyer tersebut ditutup dengan plastik dan untuk pembentukan warna dibiarkan selama 1 jam lalu dianalisis filtratnya dengan UV-Vis untuk mendapatkan massa optimumnya. Biji pepaya teraktivasi H2SO4 10 % dan tanpa aktivasi dengan massa optimum dimasukkan kedalam erlenmeyer berbeda dan diisi 50 mL limbah cair tahu dan diaduk dengan
kecepatan 150 rpm menggunakan shaker selama waktu optimum, selanjutnya disaring dan dipipet filtrat sebanyak 25 mL dan dalam erlenmeyer ukuran 50 mL dimasukkan dan ditambahkan larutan fenol sebanyak 1 mL kemudian dihomogenkan. Natrium nitroprusid sebanyak 1 mL ditambahkan dan dihomogenkan kembali, lalu larutan pengoksida sebanyak 2,5 mL ditambahkan dan dihomogenkan. Erlenmeyer tersebut ditutup dengan plastik dan untuk pembentukan warna dibiarkan selama 1 jam lalu dianalisis filtratnya dengan UV-Vis untuk menentukan efisiensi dan daya serap adsorpsi biosorben.
Biosorben Biji Pepaya
Sampel biji pepaya yang digunakan diambil dari salah satu penjual jus buah di Bukit Jimbaran, Badung, Bali. Sampel biji pepaya segar sebanyak 418,05 gram dicuci untuk menghilangkan pengotor dan didihkan selama 8 jam untuk menghilangkan gelatin biji pepaya, kemudan diovenkan selama 48 jam pada suhu 60° untuk menghilangkan air pada sampel. Setelah kering sampel dihaluskan dan diayak dengan ayakan 60 mesh untuk mendapatkan ukuran biosorben yang seragam dan didapatkan berat biosorben kering sebanyak 59,08 gram. Rendemen biosorben biji pepaya yang dihasilkan adalah sebesar 14,13%, dan dari hasil pengujian menunjukkan bahwa kadar air biosorben biji pepaya sebesar 7,5% yang memenuhi persyaratan baku mutu SNI yaitu tidak lebih dari 15%. Biosorben diaktivasi dengan H2SO4 10% selama 12 jam dan dicuci dengan aquades sampai pH netral, serta diovenkan kembali selama 1 jam untuk menghilangkan air pada biosorben. Penentuan kadar air dilakukan untuk mengetahui sifat higroskopis dari biosorben. Kadar air dihitung dengan membandingkan biosorben kering dengan biosorben awal sebelum dipanaskan dan dikalikan dengan
100%. Hasil pengujian menunjukkan kadar air biosorben biji pepaya sebesar 14,13%, dimana memenuhi persyaratan baku mutu SNI yaitu tidak lebih dari 15%. Kadar air pada biosorben sangat dipengaruhi banyaknya uap air yang ada di udara, sifat higroskopis dan lama proses pendinginan dari biosorben. Tingginya kadar air bisa menyebabkan tertutupnya pori biosorben oleh air, sehingga dapat menurunkan daya adsorpsi. Kadar air sebaiknya memiliki nilai yang sangat kecil karena akan mempengaruhi daya serapnya terhadap gas maupun cairan [12].
Keasaman permukaan dan jumlah situs aktif biosorben
Hasil penentuan keasaman permukaan dan jumlah situs aktif biosorben dapat dilihat pada Tabel 1.
Tabel 1. Keasaman Permukaan dan Jumlah
Situs Aktif Biosorben
|
Biosorben |
Keasaman permukaan rata-rata (mmol/g) |
Jumlah situs aktif x 1020 (molekul/g) |
|
K0 |
1,7944 |
10,8058 |
|
KAH |
3,1880 |
19,1981 |
Ket: K0 = biosorben tak teraktivasi
KAH= biosorben teraktivasi H2SO4 10%
Keasaman permukaan dilakukan untuk mengetahui jumlah mmol situs asam yang terikat pada tiap gram biosorben. Meningkatnya situs asam disebutkan mampu memperbesar kemampuan adsorpsi
biosorben, dan permukaan biosorben menjadi lebih bersih dan luas [13]. Penentuan jumlah situs aktif asam dilakukan dengan metode titrasi asam basa. Situs-situs asam yang ada pada biosorben bereaksi dengan basa berlebih yaitu dalam hal ini
NaOH. Sisa OH- yang tidak bereaksi dengan situs asam pada biosorben ditentukan melalui titrasi dengan HCl. Pada Tabel 1 dapat dilihat bahwa biosorben biji pepaya tanpa aktivasi (K0) memiliki keasaman permukaan sebesar 1,7944 ± 0,05 mmol/g dengan situs aktif sebesar 10,8058 x 1020 molekul/g, lebih rendah dibandingkan biosorben yang telah diaktivasi dengan H2SO4 10%. Biosorben teraktivasi H2SO4 10% (KA) memiliki keasaman permukaan yang lebih tinggi yaitu 3,1880 ± 0,02 mmol/g dengan situs aktif sebesar 19,1981 x 1020 molekul/g. Keasaman biji pepaya disebabkan oleh adanya proton yang dapat terdisosiasi atau terlepasnya ionion H+ dari gugus karboksilat (-COOH) dan gugus hidroksi (-OH) yang terdapat pada biosorben biji pepaya. Ion-ion H+ yang terlepas akan bereaksi dengan NaOH dan NaOH yang tersisa direaksikan dengan HCl, reaksi yang terjadi sebagai berikut:
RH + NaOHberlebih → RNa + H2O NaOHsisa + HCl → NaCl + H2O
Dimana R adalah makromolekul dan H adalah proton gugus –COOH dan –OH yang bersifat asam. Peningkatan keasaman permukaan menunjukkan meningkatnya situs aktif pada biosorben yang digunakan untuk proses adsorpsi. Jumlah situs aktif biosorben dari tak teraktivasi dan yang teraktivasi H2SO4 10% mengalami peningkatan sebesar 77.66%. Peningkatan situs aktif disebabkan oleh pembentukan situs-situs aktif setelah diaktivasi dengan asam sulfat [14]. Peningkatan keasaman permukaan terjadi karena H2SO4 mempunyai dua ion H+ untuk ditukarkan sehingga biosorben yang teraktivasi H2SO4 memiliki keasaman permukaan yang lebih besar daripada biji pepaya tanpa aktivasi [15]. Ion H+ dapat menghilangkan logam-logam pengotor dengan menukar ion logam yang terikat pada biosorben. Proses ini meningkatkan jumlah situs aktif pada biosorben yang mengandung ion H+ [16]. Jumlah situs aktif pada biosorben membantu memperkirakan sifat
keasaman biosorbent, jika biosorben bersifat asam, maka lebih banyak situs asam yang ada, sehingga terdapat juga situs asam bronsted dan lewis yang mengikat adsorbat [17].
Penentuan Luas Permukaan Biosorben
Pada penelitian ini digunakan metode adsorpsi metilen biru untuk menganalisis luas permukaaan biosorben. Tabel 2 menunjukkan daya serap biosorben terhadap metilen biru serta luas permukaannya.
Tabel 2 Daya Serap terhadap methylene blue dan Luas Permukaan Biosorben
Biosorben Waktu (menit) Luas
Permukaan Spesifik (S) (m2/g)
K0 60 10,9416
KAH 60 56,3179
Ket: K0 = biosorben tak teraktivasi
KAH= biosorben teraktivasi H2SO4 10%
Luas permukaan merupakan faktor penting dalam proses adsorpsi, besarnya luas permukaan sangat mempengaruhi daya serap adsorpsi suatu biosorben. Penggunaan biji pepaya sangat efektif dalam menghilangkan metilen biru dari larutan berair, keunggulan utama dari biji pepaya ini adalah sifat adsorpsinya yang cepat dan tinggi karena biji pepaya memiliki ukuran pori yang besar. Panjang gelombang maksimum methylene blue yang digunakan di penelitian ini adalah 670 nm. Dapat dilihat pada Tabel 2, adsorpsi biosorben biji pepaya tanpa aktivasi (K0) dan biosorben biji pepaya teraktivasi (KAH) terhadap methylene blue masing-masing sebesar 29,04 mg/g dan 151,60 mg/g pada waktu kontak 60 menit. Banyaknya methylene blue yang terserap berbanding
lurus dengan luas permukaan biosorben tersebut. Luas permukaan suatu biosorben berhubungan dengan kemampuan biosorben dalam menyerap adsorbat yang dinyatakan dalam satuan m2/g. Semakin besar luas permukaan suatu adsorben maka semakin besar daya serap adsorpsinya. Nilai luas permukaan biosorben tanpa aktivasi dan biosorben teraktivasi masing-masing sebesar 10,9416 m2/g dan 56,3179 m2/g pada waktu kontak 60 menit. Luas pemukaan KAH yang lebih besar dibandingkan dengan K0 disebabkan oleh aktivator H2SO4 10% yang dapat melarutkan pengotor yang menutupi pori sehingga pori-pori semakin terbuka. Pengotor yang terdapat pada pori bisa menghambat proses adsorpsi dan luas permukaan biosorben menjadi kecil.
Penentuan Waktu Optimum Adsorpsi
Penentuan waktu optimum untuk KAH dan K0 terhadap amonia limbah cair tahu dilakukan menggunakan variasi waktu kontak 30, 60, 90 dan 120 menit, dengan konsentrasi limbah cair tahu 5,245 mg/L. Pengaruh waktu kontak terhadap daya serap biosorben dapat lihat pada Gambar 1.
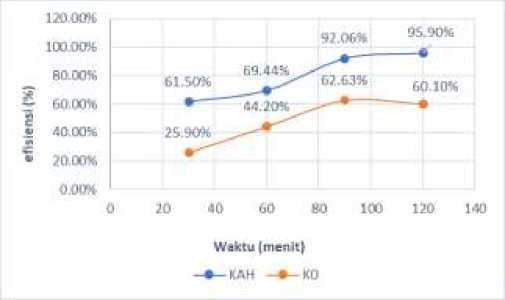
Gambar 1 Kurva Banyaknya Adsorbat yang Teradsorpsi Biosorben Pada Variasi Waktu Kontak
Gambar 1 menunjukkan jumlah ion amonium limbah cair tahu yang teradsorpsi oleh biosorben teraktivasi (KAH) dan
biosorben tak teraktivasi (K0) dalam rentang waktu 30-120 menit. Dari gambar tersebut terlihat bahwa efisiensi adsorpsi pada biosorben KAH semakin meningkat dengan meningkatnya waktu kontak. Hal ini karena waktu kontak dapat mempengaruhi kinerja dan daya serap sehingga akan mempengaruhi efektivitas suatu adsorben, semakin lama waktu kontak, semakin banyak pula adsorbat yang teradsorpsi karena kemampuan adsorbat semakin banyak untuk terikat pada partikel biosorben sehingga tercapai keadaan jenuh. Adsorpsi mengalami peningkatan selama peningkatan waktu kontak dan peningkatan daya serap adsorpsi ini terjadi karena jumlah sisi aktif [18]. Namun dari waktu kontak 90 menit ke 120 menit peningkatan efisiensinya relatif sedikit, yaitu dari 92,06% ke 95,90%. Ini menunjukkan bahwa dari waktu kontak 90 menit ke 120 menit hanya meningkatkan efisiensi sebanyak 3,84%. Dengan demikian waktu 90 menit lebih efisien dibandingkan 120 menit, sehingga waktu kontak optimum yang dipilih adalah 90 menit, namun untuk biosorben K0, efisiensi adsorpsi meningkat dengan bertambahnya waktu hingga 90 menit, namun kemudian terjadi penurunan efisiensi, hingga pada waktu 120 menit efisiensinya 60,10%, lebih rendah daripada efisiensi pada waktu 90 menit (62,63%). Hal ini karena setelah mencapai waktu optimum biosorben mengalami kejenuhan sehingga daya serapnya terhadap ion ammonium menurun. Waktu kontak optimum adalah waktu yang diperlukan biosorben dalam menyerap adsorbat secara optimum, yaitu sampai keadaan jenuh. Tercapainya keadaan jenuh terjadi saat biosorben yang direaksikan dengan adsorbat melewati waktu optimumnya dan adsorbat tidak mampu lagi diserap oleh biosorben [19]. Disaat adsorpsi telah mencapai waktu optimum, efisiensi dan daya serap adsorpsi berkurang. Hal ini dikarenakan proses desorpsi dapat dipicu ketika waktu kontak antara adsorben dan
adsorbat lebih lama dari waktu kontak optimal. Sehingga waktu optimum yang dipilih pada penelitian ini adalah 90 menit.
Penentuan Massa Optimum Adsorpsi
Penentuan massa optimum KAH dan K0 terhadap limbah cair tahu dengan menggunakan variasi massa 0,5; 1,0; 1,5 dan 2,0 gram, dengan konsentrasi limbah cair tahu 5,245 mg/L. pengaruh massa terhadap daya serap biosorben dapat lihat pada Gambar 2.
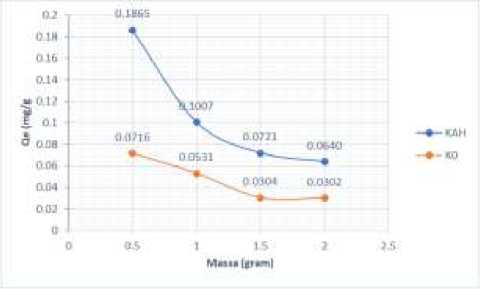
Gambar 2. Kurva Banyaknya Adsorbat yang Teradsorpsi Biosorben Pada Variasi Massa Biosorben
Gambar 2 menunjukkan adanya hubungan antara massa biosorben terhadap daya serap adsorpsi (Qe) pada setiap larutan. Gambar tersebut menunjukkan semakin besar massa biosorben yang diberikan maka semakin kecil daya serap adsorpsi yang diperoleh. Hal ini terjadi karena semakin tinggi massa biosorben maka daya adsorpsi untuk amonium pada limbah cair tahu semakin terbatas akibat dari permukaan biosorben yang saling tumpah tindih dan saling menutupi, sehingga mengakibatkan sejumlah molekul limbah cair tahu tidak ikut teradsorpsi dan tersisa pada larutan. Itu sebabnya semakin besar massa biosorben yang diberikan maka adsorbatnya semakin mudah terdesorpsi. Massa biosorben terbaik pada penelitian ini adalah 0,5 gram, sehingga massa ini yang digunakan untuk menentukan
efisiensi dan daya serap adsorpsi pada kondisi optimum.
Penentuan Efisiensi dan Daya Serap Adsorpsi pada Kondisi Optimum
Limbah cair tahu pada penelitian ini mempunyai kadar amonia sebesar 11,568 mg/L dan pH limbah 3,5. Kandungan amonium pada limbah cair tahu dianalisis menggunakan spektrofotometer UV-Vis pada panjang gelombang maksimum 680 nm. Metode pengujian ini dirancang untuk mengukur kadar amonia dengan metode fenat yaitu terjadinya senyawa kompleks indofenol berwarna biru yang terbentuk pada waktu sekitar 1 jam pada suhu kamar. Prinsip kerja uji kadar amonia ini adalah amonia bereaksi dengan natrium hipoklorit membentuk senyawa kloramin (NH2Cl), yang selanjutnya bereaksi dengan reagen fenolik membentuk senyawa antara monoklorokuinon. Selain itu,
monoklorokuinon bereaksi dengan reagen fenol yang tersisa untuk membentuk senyawa indofenol berwarna biru, yang dapat dideteksi dengan spektrofotometer UV-Vis.Adapun fungsi natrium nitropusida yaitu sebagai katalis pada reaksi pembentukan indofenol biru. Hasil penentuan efisiensi dan daya serap adsorpsi yang dilakukan pada kondisi optimum menunjukkan seberapa besar kemampuan biosorben biji pepaya yang tak teraktivasi dan teraktivasi H2SO4 10% dalam menyerap amonia dalam limbah cair tahu. Adapun kondisi optimum yang didapatkan pada penelitian ini yaitu pada massa biosorben 0,5 gram dan waktu kontak 90 menit. Efisiensi adsorpsi amonia untuk biosorben KAH dan K0 pada kondisi optimum masing-masing adalah 82.63% dan 51,02%, sedangkan daya serap adsorpsinya masing-masing sebesar 0,4779 mg/g dan 0,2951 mg/g dari larutan limbah cair tahu 11,568 mg/L. Dalam penelitian ini penurunan kandungan amonia yang yang lebih baik terjadi pada biosorben teraktivasi asam sulfat 10%. Kandungan amonia pada
limbah cair tahu ditentukan dalam bentuk kandungan ion amoniumnya. Menurut [20] gas amonia dapat dengan mudah terlarut dalam air dan membentuk amonium hidroksida (NH4OH) dan akan terpecah menjadi amoniumfa (NH4+) dan ion hidroksida (OH-) seperti pada persamaan kesetimbangan kimia berikut ini :
NH3 + H2O ≠ NH4OH ≠NH4+ +OH-
Selain itu, pH juga sangat mempengaruhi dalam penentuan kandungan amonia. Ini karena amonia di dalam air berada dalam dua bentuk yaitu berupa ion amonium (NH4+) atau non-ion ammonium (NH3). Pada pH kurang dari 8 amonia berada dalam bentuk ion ammonium (NH4+), sedangkan pada pH 8 atau lebih, terjadi pergeseran kesetimbangan ke kiri sehingga amonia berada dalam bentuk NH3 [3]. Pada penelitian ini, pengukuran dilakukan pada pH 3,5 sehingga amonia berada dalam bentuk ion amonium. Peningkatan daya serap adsorpsi dapat disebabkan oleh beberapa faktor, yaitu proses penambahan aktivator, waktu kontak, dan massa biosorben yang diterapkan. Penentuan daya serap adsorpsi didasarkan pada jumlah zat terlarut yang teradsorpsi pada setiap gram biosorben pada saat jenuh, berdasarkan jumlah zat terlarut yang teradsorpsi pada setiap gram adsorben. Daya serap adsorpsi suatu biosorben didasarkan pada ukuran pori biosorben dan juga dipengaruhi oleh jenis aktivator yang digunakan [10] melakukan penelitian biosorben biji pepaya (Carica papaya L) dengan aktivator H2SO4 untuk adsorpsi zat warna menghasilkan daya serap adsorpsi tertinggi pada waktu adsorpsi 40 menit dan massa biosorbent 1,0 gram yaitu zat warna methyl violet 9,547 mg/g. Perbedaan daya serap adsorpsi yang diperoleh dari penelitian sebelumnya dapat dipengaruhi oleh waktu adsorpsi dan luas permukaan. Semakin lama waktu adsorpsi yang digunakan maka semakin banyak amonium yang terjerap oleh biosorben,
sehingga daya serap adsorpsi juga meningkat, begitu pula sebaliknya. Luas permukaan adsorben juga mempengaruhi kemampuannya untuk menyerap zat. Luas permukaan berbanding lurus dengan daya serap adsorpsi. Daya serap adsorpsi biosorben biji pepaya teraktivasi menghasilkan efisiensi penyerapan yang lebih tinggi dibandingkan dengan adsorpsi oleh adsorben tak teraktivasi. Hal ini terjadi karena biosorben biji pepaya teraktivasi memiliki tekstur yang lebih halus dan ukuran partikel yang lebih kecil sehingga menghasilkan luas permukaan yang lebih besar. Penggunaan biosorben biji pepaya teraktivasi lebih efektif dibandingkan dengan biosorben tak teraktivasi [21].
-
1. Luas permukaan spesifik, keasaman permukaan, dan situs aktif biosorben biji papaya tanpa aktivasi (K0) masing-masing sebesar 10,9416 m2/g, 1,7944
mmol/g dan 10,8058 x 1020, sedangkan untuk biosorben teraktivasi asam sulfat 10% (KAH) masing-masing sebesar 56,3179 m2/g, 3,1880 mmol/g dan
19,1981 x 1020 molekul/g.
-
2. Efisiensi dan daya serap adsorpsi amonia dalam limbah cair tahu pada kondisi optimum waktu kontak 90 menit dan massa biosorben 0,5 gram oleh biosorben biji pepaya tak teraktivasi (K0) adalah berturut-turut sebesar 50,02% dan 0,2951 mg/g, sedangkan oleh biosorben teraktivasi asam sulfat 10% (KAH) berturut-turut sebesar 82,63% dan 0,4779 mg/g.
-
[1] Buchori, L., Sasongko, S. B., Anggoro, D. D., dan Aryanti, N. 2012. Pengambilan Minyak Kedelai Dari
Ampas Tahu Sebagai Bahan Baku
Pembuatan Biodiesel. Jurnal Ilmu Lingkungan. 10(2):49-53
-
[2] Ratnani, R. 2012. Kemampuan
Kombinasi Eceng Gondok dan Lumpur Aktif untuk menurunkan Pencemaran pada Limbah Cair Industri Tahu. Momentum. 8(1):1-5
-
[3] Murti, R. S., Purwanti, C. M. H. 2014. Optimasi Waktu Reaksi Pembentukan Kompleks Indofenol Biru Pada Uji N-Amonia Air Limbah Industri Penyamakan Kulit Dengn Metode Fenat. Majalah Kulit, Karet, dan Plastik. 30(1):29-34
-
[4] Harjanti, W. S., 2016. Analisis Risiko Kesehatan Lingkungan Pajanan Gas Amonia (NH3) Pada Pemulung di TPA Jatibarang, Semarang. Skripsi.
Universitas Diponegoro. Semarang
-
[5] Jasmiati., Anita, S., dan Thamrin. 2010. Bioremediasi Limbah Cair Tahu Menggunakan Efektif Mikroorganisme (EM4). Journal of Environment.
2(4):148-15
[6]Multianingsih., Romansyah. E., Karyanik. Pemanfaatan Limbah Bambu Sebagai Bahan Filtrasi Untuk Mengurangi Kandungan Nitrogen Total Dalam Air Buangan Limbah Tahu. Jurnal AGROTEK. 5(2):87-90
-
[7] Pavana, F. A., Camacho, E. S., Lima, E. C., Dotto, G. L., and Branco, V. T. A. 2014. Formossa Papaya Seed Powder (FPSP): Preparation, Characterization
And Application As On Alternative Adsorben For The Removal Of Crystal Violet From Aqueous Phase. Jurnal of Envioronmental Chemical Engineering. 2(1):230-238
-
[8] Yadav, A., Singh, S. L., Yadav, B., dan Komath, S. S. 2014. Saccharomyces
Cerevisiae Gpi2, An Accessory Subunit of The Enzyme Catalyzing The First Step of Glycosylphosphatidylinositol (GPI) Anchor Biosynthesis, Selectively Complements Some of The Functions of Its Homolog in Candida Albicans. Glycoconjugate Journal. 31(6):497-507
-
[9] Shofa. 2012. Pembuatan Karbon Aktif Berbahan Baku Ampas Tebu Dengan Aktivasi Kalium Hidroksida. Skripsi. Universitas Indonesia. Depok
-
[10] Siswarni, M. Z., Putri, Y. I., dan Rinda, R. 2017. Ekstraksi Kuersetin Dari Kulit Terong Belanda (Solanum Betaceum Cav.). Jurnal Teknik Kimia USU. 6(1):36-42
-
[11] Suhedra, D., dan Gunawan, E.R. 2010. Pembuatan Arang Aktif dari Batang Jagung Menggunakan Aktivator Asam Sulfat dan Penggunaannya Pada Penjerapan Ion Tembaga (II). Makara, Sains. 14(1):22-26
-
[12] Lempang, M., Syafii, W., dan Pari, G. 2011. Struktur dan Komponen Arang Serta Arang Aktif Tempurung Kemiri. Jurnal Penelitian Hasil Hutan. 29(3):278-294
-
[13] Ashadi, K. dan Nur, A. 2013. Adsorpsi Cr(III) Oleh Biosorben Sisitem Kolom Dengan Matriks Pengisi Kombinasi Limbah Aren dan Zeolit Alam Teraktivasi. Skripsi. Universitas Surakarta. Surakarta
-
[14] Sahara, E., Dahliani, N. K., dan Manuaba, I. B. P. 2017. Pembuatan dan Karakterisasi Arang Aktif dari Batang Tanaman Gumitir (Tagetes erecta)
dengan Aktivator NaOH. Jurnal Kimia. 11(2):174-180
Lempung Teraktivasi Asam Sulfat (H2SO4). Jurnal Kimia. 9(2):217-225
-
[16] Sudiarta, I. W. 2009. Biosorpsi Ion Cr (III) Pada Rumput Laut Eucheuma Spinosum Teraktivasi Asam Sulfat. Jurnal Kimia. 3(2): 93-100
-
[17] Mustikawati, S. R., Simpen, I. N., Ratnayani, O. 2018. Adsorpsi Zat Warna Tekstil Remazol Brilliant Blue Oleh Limbah Canang Daun Kelapa. Jurnal Kimia. 12(2):195-200
-
[18] Siringo-ringo, E. P. 2019. Pengaruh Waktu Kontak, pH, Dan Dosis Adsorben Dalam Penurunan Kadar Pb dan Cd Menggunakan Adsorben Dari Kulit Pisang. Skripsi. USU. Medan
-
[19] Castellan, G. W. 1982. Physical
Chemistry. Third Edition. General
Graphic Services. New York
-
[20] Goldman, C.R. and Horne, A.J.1983. Limnology. McGraw-Hill Book Co. New York.464p.
-
[21] Zustriani, A. K. 2019. Pengaruh Aktivasi Adsorben Biji Pepaya Terhadap Adsorpsion Logam Besi (Fe) Dan Tembaga (Cu) Dalam Air Limbah. Integrated Lab Journal. 7(1):29-43
-
[15] Sinta, I. N., Suarya, P., dan Santi, S. R.
2015. Adsorpsi Ion Fosfat Oleh
Discussion and feedback