AVIAN INFLUENZA-H5N1 AND NEWCASTLE DISEASES IN LAYER
on
Buletin Veteriner Udayana Volume 15 No. 6: 1086-1097
pISSN: 2085-2495; eISSN: 2477-2712 Desember 2023
Online pada: http://ojs.unud.ac.id/index.php/buletinvet https://doi.org/10.24843/bulvet.2023.v15.i06.p07
Terakreditasi Nasional Sinta 4, berdasarkan Keputusan Direktur Jenderal Pendidikan Tinggi, Riset, dan Teknologi No. 158/E/KPT/2021
Avian Influenza-H5N1 dan Newcastle Diseases pada Ayam Petelur
(AVIAN INFLUENZA-H5N1 AND NEWCASTLE DISEASES IN LAYER)
Seli Nurmayani1, Gusti Ayu Yuniati Kencana 2*, Anak Agung Ayu Mirah Adi3, I Nengah Kerta Besung4, Nyoman Adi Suratma5
-
1Praktisi Dokter Hewan, Jl. Raya Korleko, Korleko Selatan, Labuhan Haji, Lombok Timur, Nusa Tengara Barat, Indonesia; Email: selinurmayani201@gmail.com
-
2Laboratorium Virologi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia;
-
3Laboratorium Patologi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia;
-
4Laboratorium Bakteriologi dan Mikologi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia;
-
5Laboratorium Parasitologi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia;
*Coressponding author email: yuniati_kencana@unud.ac.id
Abstrak
Penyakit Avian infulenza-H5N1 (AI-H5N1) dan Newcastle diseases (ND) merupakan dua penyakit virus penting pada 1086embali1086 perunggasan karena menyebabkan kerugian ekonomis tinggi. Penyakit AI disebabkan oleh virus Influenza tipe A sedangkan penyakit ND disebabkan oleh Avian paramyxovirus tipe 1. Virus AI dan ND adalah dua 1086embali1086 yang kadang-kadang menginfeksi unggas bersamaan dan sering gejala klinisnya mirip. Tujuan pemeriksaan adalah mengidentifikasi agen penyebab penyakit ayam kasus untuk menentukan diagnosa pasti. Hewan kasus ayam petelur jenis ross brown berumur 5 bulan berasal dari peternakan di Desa Senganan, Kecamatan Penebel, Kabupaten Tabanan, Bali. Populasi ayam sebanyak 6.500 ekor. Gejala klinis ayam diantaranya: gangguan pernapasan, anoreksia, lemas, tidak mampu berdiri dan diare kehijauan. Kematian ayam terjadi 5 hari setelah munculnya gejala klinis. Jumlah ayam sakit mencapai 1000 ekor, ayam mati lebih dari 100 ekor, sehingga morbiditas 15,3%, mortalitas 1,53% dan Case Fatality Rate (CFR) 10%. Perubahan patologi anatomi diantaranya: dilatasi pembuluh darah otak, hemoragi trakea dan paru-paru, edema dan hemoragi otot jantung, pendarahan petekie proventrikulus dan lemak abdominal, hemoragi usus dan ovarium serta ditemukan telur 1086embali pada rongga abdomen. Perubahan histopatologi ditemukan kongesti, hemoragi dan edema pada otak, hemoragi dan nekrosis epitel mukosa trakea, hemoragi multifokal dan kongesti paru-paru, hemoragi, edema dan nekrosis myocardium, erosi dan nekrosis vili usus serta hemoragi dan regresi sel telur pada ovarium. Hasil isolasi virus pada telur ayam berembrio mengakibatkan kematian embrio pada hari ke dua pasca inokulasi ditandai dengan perdarahan dan cairan alantoisnya jernih. Hasil identifikasi virus positif virus Avian influenza -H5N1 dan Newcastle diseases. Diagnosa kasus adalah penyakit virus Avian influenza-H5N1 dan Newcastle diseases. Berdasarkan gejala klinis, data epidemiologi, perubahan patologi dan hasil uji HA/HI, dapat disimpulkan bahwa ayam kasus terinfeksi virus Avian influenza- H5N1 dan Newcastle disease. Disarankan agar peternak melakukan vaksinasi rutin dan menerapkan biosekuriti untuk mencegah penyakit Avian influenza- H5N1 dan Newcastle disease.
Kata kunci: Avian Inflenza H5N1; ayam petelur; kasus lapang; Newcastle disease
Abstract
Avian influenza-H5N1 (AI-H5N1) and Newcastle disease (ND) are two important viral diseases in the poultry industry because they cause high economic losses. AI disease is caused by Influenza virus
type A while ND disease is caused by Avian paramyxovirus type 1. AI and ND viruses are two pathogens that sometimes infect poultry together and often have similar clinical symptoms. The purpose of the examination is to determine the causative agent of the disease in order to determine a definite diagnosis. The 5-month-old Ross Brown laying hen came from a farm in Senganan Village, Penebel District, Tabanan Regency, Bali. The chicken population is 6,500 tails. Clinical symptoms of chickens include: respiratory problems, anorexia, weakness, unable to stand and green diarrhea. Chicken death occurred 5 days after the appearance of clinical symptoms. The number of sick chickens reached 1000, the chickens died more than 100, so the morbidity was 15.3%, the mortality was 1.53% and the Case Fatality Rate (CFR) was 10%. Pathological changes in anatomy include: dilation of cerebral vessels, tracheal and lung hemorrhage, edema and hemorrhage of the heart muscle, proventriculus petechial bleeding and abdominal fat, intestinal and ovarian hemorrhage and ruptured eggs were found in the abdominal cavity. Histopathological changes found congestion, hemorrhage and edema in the brain, hemorrhage and necrosis of the tracheal mucosal epithelium, multifocal hemorrhage and lung congestion, hemorrhage, edema and necrosis of the myocardium, erosion and necrosis of the intestinal villi as well as hemorrhage and regression of the ovum in the ovary. The results of virus isolation in embryonated chicken eggs resulted in the death of the embryo on the second day after inoculation which was characterized by bleeding and clear allantois fluid. The results of positive virus identification for Avian influenza-H5N1 and Newcastle diseases. Based on clinical symptoms, epidemiological data, pathological changes and HA/HI test results, it can be concluded that the case chickens were infected with Avian influenza-H5N1 and Newcastle disease viruses. Breeders are advised to carry out routine vaccinations and apply biosecurity to prevent Avian influenza-H5N1 and Newcastle disease.
Keywords: Avian Influenza-H5N1; laying hens; field case; Newcastle disease
PENDAHULUAN
Penyakit Avian infulenza-H5N1 (AI-H5N1) dan Newcastle diseases (ND) merupakan dua penyakit yang mendapat perhatian penting pada 1087embali1087 perunggasan karena dapat menyebabkan kerugian ekonomis yang tinggi dan infeksi parah pada unggas dengan angka kematian yang tinggi (Capua and Alexander, 2008). Penyakit AI disebabkan oleh virus influenza tipe A yang tergolong dalam family Orthomyxoviridae.
Berdasarkan patogenisitasnya, virus AI dibedakan menjadi highly pathogenic avian influenza (HPAI) dan low pathogenic avian influenza (LPAI). Virus AI yang tergolong HPAI yaitu subtipe H5 dan H7, dapat menyebabkan morbiditas dan mortalitas yang tinggi dan sering menimbulkan wabah pada peternakan ayam, sedangkan virus AI yang tergolong LPAI diketahui menyebabkan morbiditas tinggi (>50%) dan mortalas rendah (<5%) dengan gejala klinis ringan, bahkan unggas yang terinfeksi terkadang tidak menunjukkan gejala klinis. Akan tetapi laju mortalitas pada infeksi LPAI dapat sangat tinggi pada unggas muda jika disertai infeksi patogen
sekunder (Alexander, 2000; Harimoto dan Kawaoka, 2001; Swayne dan PantinJackwood, 2008; Wasito et al., 2014). Influenza pada unggas di Indonesia, pertama kali disolasi dari itik dan burung pelikan pada tahun 1983 (Ronohardjo et al., 1985). Setelah itu tidak ada lagi laporan kejadian AI pada unggas, hingga pada bulan September-Oktober 2003 di Jawa Timur, Jawa Barat dan Jawa Tengah terjadi wabah penyakit pada ayam dengan angka mortalitas mencapai 100%. Wabah ini kemudian menyebar ke Sumatera, Bali dan Kalimantan (Damayanti et al., 2004; Kencana et al., 2012; Kencana et al., 2021).
Penyakit ND disebabkan oleh Avian paramyxovirus tipe 1 (APMV-1), genus Avulavirus, subfamili Paramyxovirinae, famili Paramyxoviridae (Alexander dan Senne, 2008). Virus ND dibagi menjadi tiga patotipe berdasarkan tingkat virulensinya, yaitu tipe velogenik (sangat virulen), mesogenik (virulensi rendah), dan lentogenik (kurang virulen) (Quinn et al., 2002; Pattison et al., 2008). Isolat ND virulen dapat mengakibatkan kematian yang cepat pada unggas, sedangkan ND virulensi rendah pada umunya
menyebabkan penyakit subklinis dengan morbiditas rendah (Kapczynski et al., 2013). Berdasarkan gejala klinisnya dan lesi patologis, penyakit ND dikelompokan menjadi lima patotipe yakni viscerotropic velogenic, menghasilkan infeksi mematikan akut di mana lesi hemoragik menonjol di usus; neurotropic velogenic, menyebabkan kematian tinggi yang diawali tanda-tanda pernapasan dan neurologis; mesogenic, menyebabkan gangguan pernapasan akut dengan tingkat kematian rendah; lentogenic atau respiratorik, menyebabkan gangguan pernapasan ringan atau tidak terlihat dan tipe asymptomatic, tidak menimbulkan gejala klinis (Alexander and Senne, 2008). Penyakit ND di Indonesia dilaporkan pertama kali pada tahun 1926 di pulau Jawa. (Quinn et al., 2002). Pada awal tahun 2011, kasus ND mewabah pada peternakan ayam pedaging secara merata di Sumatra, Jawa, Bali, Kalimantan dan Sulawesi dan mengalami peningkatan jika dibandingkan dengan yang terjadi pada tahun 2009 dan 2010 (Ekaningtias et al., 2017). Di Bali, kejadian penyakit ND bersifat endemik, karena banyak ditemukan pada peternakan ayam buras yang umumnya merupakan peternakan rakyat (Kencana et al., 2012; Pranatha et al., 2018; Yuliantari et al., 2018).
Virus AI dan ND adalah dua patogen unggas yang kadang-kadang menginfeksi unggas secara bersamaan dan sering kali menimbulkan gejala klinis yang sangat mirip (Alexander, 2000; Gelb et al., 2007). Gejala klinis infeksi virus AI biasanya pada saluran pernapasan, gastrointestinal dan susunan syaraf. Hal yang serupa juga terjadi pada penyakit ND yang menyebabkan gangguan yang sangat berat pada system pernapasan, syaraf dan pencernaan (Hewajuli dan Dharmayanti, 2008). Ayam kasus menunjukkan gejala klinis gangguan pernapasan, pencernaan, reproduksi dan gejala syaraf. Kematian terjadi lima hari setelah timbulnya gejala klinis. Ayam dinekropsi untuk mengambil sampel uji. Isolasi dan identifikasi agen
dilakukan untuk mengetahui penyebab penyakitnya didukung dengan pemeriksaan patologi.
METODE PENELITIAN
Anamnesa Hewan Kasus
Hewan kasus adalah ayam petelur jenis ross brown berumur 5 bulan yang berasal dari salah satu peternakan ayam petelur di Desa Senganan, Kecamatan Penebel, Kabupaten Tabanan, Bali. Populasi ayam pada peternakan tersebut sebanyak 6.500 ekor. Gejala klinis gangguan pernapasan, keluar eksudat dari hidung, anoreksia, lemas, tidak mampu berdiri, diare kehijauan yang sudah berlangsung selama 5 hari. Ayam yang sakit kurang lebih mencapai 1000 ekor. Jumlah ayam yang mati dengan gejala klinis sama sekitar 100 ekor lebih. Gejala klinis diawali dengan kurang nafsu makan, penurunan produksi telur, gejala pernapasan ringan sampai berat, feses encer berwarna kehijauan hingga ayam sama sekali tidak mau makan
dan mengalami kematian. Rata-rata kematian terjadi 5 hari sejak timbulnya gejala klinis. Berdasarkan anamnesa dapat dihitung tingkat morbiditas, mortalitas dan Case Fatality Rate (CFR) adalah sebagai berikut:
Morbiditas
Jumlah hewan sakit
=---——--x 100%
Populasi
= — x 100% = 15,3% 6.500 ,
i Jumlah hewan mati
Mortalitas = -------—---x 100%
Populasi
= — x 100% = 1,53% 6.500 ,
CFR = Jumlah hewan matiχ 100%
Jumlah hewan sakit
= —x 100% = 10% 1000
Sampel Organ
Ayam kasus dinekropsi di Laboratorium Patologi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana. Sampel organ diambil untuk pemeriksaan histopatologi dengan ukuran 1x1x1cm pada bagian organ yang mengalami perubahan kemudian dimasukkan ke dalam pot yang berisi Neutral Buffered Formaldehyde (NBF) 10%. Sebagian organ-organ yang
mengalami perubahan juga diambil untuk bahan uji di laboratorium virologi.
Preparat Histopatologi
Pembuatan preparat histopatologi dilakukan di Laboratorium Patologi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana dengan tahap-tahapan sebagai berikut: sampel organ yang sudah difiksasi dengan NBF 10% didehidrasi dengan etanol bertingkat mulai dari 70%; 85%; 95%; dan etanol absolut. Kemudian dilanjutkan tahapan penjernihan
mengunakan larutan xylol. Jaringan yang sudah matang kemudian diinfiltrasi menggunakan paraffin cair dan dilakukan embedding dalam paraffin block. Paraffin block kemudian dipotong dengan ketebalan 5µ menggunakan mikrotom kemudian dikembangkan di atas air dalam waterbath dan diambil dengan glas objek. Preparat dikeringkan pada suhu kamar dan selanjutnya diwarnai menggunakan pewarnaan rutin Hematoksilin dan Eosin (HE). Preparat histopatologi dibaca dengan mikroskop (Olympus BX21, Olympus, Japan).
Isolasi dan Identifikasi Virus
Untuk mendapatkan diagnosa pasti maka dilakukan isolasi dan identifikasi agen penyebab penyakit. Isolasi virus dilakukan pada telur ayam bertunas umur 9 hari, sedangkan identifikasi virus digunakan uji serologi hemaglutinasi (HA/HI). Tahapan uji dilakukan sebagai berikut:
Sebanyak satu gram organ otak, paru-paru, usus, proventrikulus yang mengalami perubahan patologi diambil untuk dibuat 1089embali1089. Organ dipotong kecil-kecil menggunakan gunting kemudian dimasukkan ke dalam tabung eppendorf dan dihancurkan kembali menggunakan stik. Selanjutnya dilakukan penambahan larutan NaCl fisiologis dan disentrifugasi dengan kecepatan 2.500 rpm selama 15 menit. Supernatant diambil dan dimasukkan ke dalam tabung Eppendorf lain, lalu ditambahkan antibiotik penicillin dan streptomycin masing-masing sebanyak
0,1 ml, kemudian divortek dan diinkubasikan pada inkubator dengan suhu 37ºC selama 30 menit.
Inokulum kemudian diinokulasikan pada telur ayam berembrio umur 9 hari menggunakan tuberculin syringe 1 ml melalui ruang alantois dengan dosis 0,2 ml per butir telur. Lubang bekas suntikan pada telur ditutup dengan kuteks. Telur kemudian diinkubasi pada suhu 37ºC selama 3 hari dan dilakukan pengamatan setiap hari. Telur dipanen pada hari ke-3 pasca inokulasi. Cairan alantois diuji Hemaglutinasi (HA) dan Hemaglutinasi Inhibisi (HI).
Uji hemaglutinasi dilakukan untuk mendeteksi keberadaan virus dengan menggunakan teknik microtiter. Uji HA dilakukan dengan menambahkan sebanyak 0,025 mL phosphate buffered saline (PBS) kedalam setiap sumuran plat mikro 1-12 dengan menggunakan pipet mikro. Kemudian ditambahkan sebanyak 0,025 mL antigen virus hasil panen cairan alantois pada sumuran pertama dan kedua. Selanjutnya dilakukan pengenceran berseri berkelipatan dua dimulai dari sumuran ke-2 sampai sumuran ke-11 dengan menggunakan mikropipet kemudian divortek selama 30 detik. Selanjutnya 0,05ml sel darah merah ayam 1% ditambahkan ke dalam semua sumuran kemudian didiamkan pada suhu kamar selama 1 jam dan dilakukan pengamatan hasil setiap 15 menit.
Titer HA yang diperoleh selanjutnya diencerkan menjadi 4unit HA untuk digunakan pada uji HI. Uji HI dilakukan dengan menambahkan PBS sebanyak 0,025 ml pada sumuran plat mikro 1-4, lalu ditambahkan dengan serum AI-H5N1 sebanyak 0,025 ml pada sumuran pertama dan serum ND pada sumuran kedua. Selanjutnya ditambahkan antigen 4unit HA 0,025 ml pada sumuran plat mikro ke-1 sampai ke-3, kemudian dilakukan pengayakan (shaker) selama 30 detik dan diinkubasikan pada suhu ruangan selama 15 menit. Setelah itu dilakukan penambahan suspensi sel darah merah 1%
sebanyak 0,05 ml pada sumuran ke-1 sampai sumuran ke-4 dan diayak selama 30 detik. Plat mikro diinkubasikan kembali pada suhu kamar selama 1 jam yang diamati setiap 15 menit.
HASIL DAN PEMBAHASAN
Hasil
Hasil perhitungan tingkat morbiditas, mortalitas dan Case Fatality Rate (CFR) adalah sebagai berikut: morbiditas ayam kasus adalah sebesar 15,3%, mortalitas sebesar 15,3%, case fatality rate adalah 10%. Hasil penghitungan tingkat morbiditas, mortalitas dan Case Fatality Rate (CFR) yang dimuat pada Tabel 1.
Berdasarkan hasil anamnesa, gejala klinis dan perubahan patologi anatomi, ayam kasus didiagnosa sementara terinfeksi virus Avian Influenza dengan diagnosa banding Newcastle Disease (ND), Cronic Respirasi Disease (CRD) dan Infectious Bronchitis (IB). Organ-organ yang mengalami perubahan diambil untuk diisolasi dan sampel preparat histopatologi.
Hasil pengamatan patologi anatomi ditemukan ada dilatasi pembuluh darah otak, hemoragi pada trakea dan paru-paru, edema dan hemoragi otot jantung, pendarahan petekie pada proventrikulus dan lemak abdominal, hemoragi usus dan ovarium, juga ditemukan adanya sel telur ruptur pada rongga abdomen seperti dimuat pada Gambar 1.
Hasil pengamatan histopatologi ditemukan adanya kongesti, hemoragi dan edema pada otak, hemoragi dan nekrosis epitel mukosa trakea, hemoragi multifokal dan kongesti pada paru-paru, hemoragi, edema dan nekrosis myocardium, erosi dan nekrosis vili usus serta adanya hemoragi dan regresi sel telur pada ovarium. Hasil pengamatan preparat histopatologi dimuat pada Gambar 2.
Hasil isolasi virus tahap pertama terjadi kematian embrio empat hari pasca inokulasi, tetapi hasil uji HA negatif. Pasase dilakukan kembali pada telur ayam berembrio umur 9 hari dengan menggunakan cairan alantois hasil isolasi
pertama. Dari tiga butir telur yang digunakan untuk pasase virus, dua diantaranya menunjukkan kematian embrio hari kedua pasca inokulasi. Hasil panen ditandai dengan perdarahan embrio dan cairan alantois jernih seperti dimuat pada Gambar 3.
Hasil uji HA dari cairan alantois hasil panen menunjukkan terjadinya aglutinasi sel darah merah 1% dengan titer 29unit HA. Titer HA 29unit HA selanjutnya diencerkan menjadi 22unit HA yang digunakan untuk uji HI. Identifikasi virus dengan uji serologi HI dengan dua serum yang berbeda yakni serum AI-H5N1 dan serum ND diperoleh hasil positif seperti dimuat pada Gambar 4 dan 5.
Pembahasan
Swayne dan Pantin-Jackwood (2008) menyatakan bahwa gejala klinis yang ditemukan pada ayam yang terkena penyakit AI dapat berupa perubahan patofisiologis pada saluran pernapasan, pencernaan, reproduksi, dan urinaria. Ayam menunjukkan tanda-tanda infeksi pernapasan ringan hingga berat seperti batuk, bersin, rales, kerincingan, dan lakrimasi berlebihan. Penurunan nafsu makan, muka bengkak, pial dan jengger sianosis, diare dengan feses hijau hinnga gangguan saraf seperti tremor pada kepala dan leher, ketidakmampuan untuk berdiri, tortikolis, opistotonus, dan posisi kepala yang tidak biasa lainnya. Tanda klinis yang ditemukan bervariasi tergntung pada tingkat kerusakan organ dan jaringan tertentu. Tidak semua tanda klinis dapat ditemukan pada satu unggas (Muflihanah et al, 2018; Swayne et al., 2020). Tingkat keganasan dari virus AI juga bervariasi ditentukan oleh waktu, inang yang terinfeksi. Meskipun virus AI yang menginfeksi sama-sama subtipe H5 yang tergolong HPAI, belum tentu menunjukkan keganasan yang sama. Hal tersebut dikarenakan virus AI tergolong virus dengan genom bersegmen, sehinga mudah mengalami mutasi (Ditjennak, 2014).
Infeksi virus ND pada ayam gejala klinisnya mirip dengan infeksi virus AI-
H5N1 yaitu gangguan sistima pernapasan yang berat, gangguan sistima syaraf dan pencernaan (Hewajuli dan Dharmayanti, 2008). Berat ringannya gejala klinis yang ditimbulkan pada penyakit ND dan AI tergantung pada strain virus, spesies inang, umur inang, lingkungan dan status kekebalan ayam saat terinfeksi (Al-Habeeb et al., 2013). Infeksi virus ND dengan virulensi rendah pada umunya menyebabkan penyakit subklinis dengan morbiditas rendah (Kapczynski et al., 2013). Secara umum, gejala klinis penyakit ND pada ayam adalah hilangnya nafsu makan, lesu, penurunan produksi telur, radang trakea dan radang konjungtiva (Ashraf dan Shah, 2014).
Lesi patologi anatomi pada infeksi AI-H5N1 meliputi pendarahan dan kongesti pada otak, radang trakea dan paru-paru, trakea dilapisi mukus atau hemoragik, ovarium pada ayam petelur terlihat hemoragik atau nekrotik, ruptur sel telur (terlihat seperti kuning telur di rongga abdomen), ptekhie pada proventrikulus, tembolok, usus, lemak abdominal dan peritoneum. Pada ayam petelur dan indukan terkadang mengalami gangguan ginjal akut dan pengendapan asam urat visceral (Ditjennak, 2014; Muflihanah et al., 2018; Pranatha et al., 2018).
Perubahan patologi anatomi pada penyakit ND tergantung pada strain virus yang menginfeksi. Infeksi virus velogenik strain Asia menyebabkan perubahan yang patognomonis berupa ptekhie (bintik-bintik perdarahan) pada proventrikulus dan nekrosa pada usus. Perubahan patologi pada saluran pernafasan seperti rhinitis, traheitis, laryngitis, pneumonia dengan ekusudat katarhalis sampai mukopurulent dapat pula ditemui, akan tetapi tidak khas untuk penyakit ND saja. Kelainan susunan syaraf berupa degenerasi dan nekrose otak juga dapat ditemukan. Infeksi virus strain velogenik tipe Amerika menyebabkan perubahan yang serupa dengan infeksi oleh virus strain velogenik tipe Asia, akan tetapi ptekhie pada proventrikulus jarang terjadi dan encephalitis hampir selalu terjadi.
Sedangkan pada infeksi virus strain mesogenik perubahan yang derlihat tidak khas, terbatas pada saluran pernafasan (Ditjennak, 2014).
Perubahan patologi anatomi yang patognomonis pada penyakit ND ditandai dengan ptekhie pada proventikulus, ventrikulus, usus, seka tonsil, trakea, dan paru-paru (Kencana dan Kardena, 2011). Pada kasus AI-H5N1, perdarahan proventrikulus lebih sering terjadi pada saluran bagian depan (perbatasan proventrikulusan dan oesophagus). Hal ini dikarenakan virus AI memiliki sifat tidak tahan asam. Sedangkan pada ND, besar kemungkinan peradangan terjadi pada puncak/bintik-bintik proventrikulus, namun ketika serangan sudah parah maka peradangan bisa menyeluruh pada proventrikulus (Pranatha et al., 2018).
Pendarahan dan regresi sel telur pada ovarium, edema pada jantung, pendarahn difus pada paru-paru serta perivascular cuffing dan gliosis pada otak ditemukan pada histopathologi organ ayam yang terinfeksi AI (Muflihanah et al., 2018). Pneumonia difus, edema kapiler udara, trakeitis heterofilik ke limfositik dan bronkitis merupakan lesi mikroskopis yang ditemukan pada infeksi AI. Nefrosis dan nefritis juga telah dilaporkan (Swayne dan Pantin-Jackwood, 2008). Pada kasus infeksi AI-H5N1 dan ND pada ayam buras ditemukan perubahan histopatologi berupa vasculitis dan edema pada otak, hemoragi pada paru-paru, edema pada miokardium jantung dan juga kongesti pada vena ventralis dan kapiler hati (Pranatha et al., 2018). Lesi yang ditimbulkan oleh virus ND khususnya pada mukosa saluran pernafasan atas unggas menunjukkan adanya hemoragi, edema, dan infiltrasi sel radang berupa leukosit dan makrofag. Pada paru-paru terlihat adanya kongesti, edema parabronki dan hemoragi. Pada hati dapat terjadi nekrosis dan kadang hemoragi serta terdapat hiperplasia dari sel mononuklear fagosit. Perubahan pada ginjal dapat berupa hemoragi dan nekrosis namun lesi tersebut biasanya lebih jarang ditemukan
dibandingkan lesi-lesi pada organ pernafasan dan pencernaan (Alexander dan Senne, 2008).
Kejadian nekrosis pada beberapa sel termasuk sel tubulus ginjal, miosit jantung, dan sel epitel paru-paru pada ayam telah dikaitkan dengan replikasi virus AI yang intens dan adanya nukleoprotein virus AI yang melimpah di nukleus dan sitoplasma (Swayne et al., 2020). Hemoragi, edema dan kongesti dapat disebabkan karena adanya proses inflamasi. Saat terjadi proses inflamasi pembuluh darah mengalami vasodilatasi yang menghasilkan peningkatan volume darah dalam pembuluh. Perdarahan terjadi karena peregangan sel endotel yang menyebabkan jaraknya terlalu lebar sehingga sel darah merah dapat keluar dari pembuluh darah. Kebocoran cairan pembuluh darah juga akan menyebabkan terjadinya edema. Vasodilatasi pembuluh darah juga akan menyebakan perlambatan aliran darah sehingga terjadi kongesti (Baratawidjaja dan Iris, 2012).
Isolasi virus AI dan ND dilakukan melalui ruang alantois dari telur ayam berembrio umur 8-12 hari (Mahardika et al., 2015). Virus AI-H5N1 dapat menyebabkan kematian embrio 24 -96 jam pasca inokulasi. Kematian embrio pasca inokulasi virus AI pada isolasi pertama ditandai dengan cairan alantois jernih sebagai tanda tidak terjadi kontaminasi bakteri tetapi hasil uji HA negatif sehingga perlu dilakukan pasase. Hal ini selaras dengan Swayne et al, 2008 yang menyatakan bahwa jika hasil uji HA negatif, perlu dilakukan pasase untuk memastikan isolat tidak terlewatkan karena rendahnya titer virus dalam sampel akibat infeksi akut. Infeksi virus AI yang virulen seringkali mengakibatkan kematian embrio 2 hari pasca infeksi tanpa ditandai dengan gejala klinis, namun cairan alantoisnya jernih. Titer antigen juga sangat rendah dan cenderung negatif karena virus belum banyak bereplikasi pada sel embrio, Oleh karena itu perlu dilakukan pasase berulang sampai titer virusnya stabil untuk
mendapatkan virus seed vaksin (Kencana et al., 2020).
Virus AI-H5N1 dapat menyebabkan kematian embrio 24 -96 jam pasca inokulasi. Hal ini tergantung pada tingkat patogenitas virus yang menginfeksi. Secara umum HPAI mengakibatkan kematian embrio dalam waktu cukup singkat yakni 24 jam pasca inokulasi, sedangkan subtipe yang LPAI menyebabkan kematian yang beragam antara 48 hingga 96 jam pasca inokulasi pada telur ayam berembrio (Rachmawati et al., 2020). Kemampuan virus ND menginduksi apoptosis sel chicken embrio fibroblast (CEF) juga menjadi kemungkinan penyebab kematian embrio (Ravindra et al., 2008). Kematian embrio juga dapat disebabkan oleh kemampuan virus yang mampu bereplikasi dan menyerang seluruh tipe sel termasuk sel epitel, mengingat sifat dari virus ND virulen adalah pantropik (Alexander, 2001; Kattenbelt et al., 2006; Wakamatsu et al., 2006).
Uji HA menunjukkan hasil positif ditandai dengan aglutinasi sel darah merah pada dasar mikroplat yang terlihat seperti butir-butiran pasir. Hal ini disebabkan karena aktivitas protein virus hemagglutinin yang mengikat sel darah merah unggas 1%. Uji HA juga dilakukan sebagai dasar untuk menentukan titer virus. Titer HA adalah pengenceran tertinggi virus yang masih dapat mengaglutinasi sel darah merah 1% (Mahardika et al., 2015). Titer HA yang diperoleh pada uji kasus ini adalah 29unit HA menandakan virusnya virulen.
Uji Hemaglutinasi (HA) dilakukan untuk mendeteksi keberadaan virus AI dan ND. Hemaglutinasi merupakan proses penggumpalan sel darah merah yang terlihat seperti butir-butir pasir (Nuradji et al., 2008). Virus AI dan ND merupakan virus yang memiliki protein Hemaglutinin (HA) pada amplopnya. Protein HA yang terdapat pada virus AI dan ND berikatan dengan reseptor eritrosit ayam 1% dan menyebabkan terjadinya hemaglutinasi, sehingga aktivitas ini digunakan sebagai
dasar dalam mendeteksi keberadaan virus AI maupun ND (Stevens et al.,2006).
Hasil uji HI positif ditandai dengan terjadinya endapan pada dasar mikroplat mengindikasikan bahwa serum yang digunakan memiliki antibodi homolog dengan antigen yang diuji sehingga sel darah merah 1% bebas untuk mengendap. Prinsip uji HI adalah hambatan aglutinasi sel darah merah akibat terikatnya virus (antigen) dengan antibodi spesifik yang homolog (Erina et al., 2021).
SIMPULAN DAN SARAN
Simpulan
Berdasarkan gejala klinis, data epidemiologi, perubahan patologi dan hasil uji HA/HI, dapat disimpulkan bahwa ayam kasus terinfeksi virus Avian influenza-H5N1 dan Newcastle disease.
Saran
Perlu dilakukan revaksinasi terhadap ayam yang masih sehat dan peningkatan biosekuriti. Program vaksinasi yang teratur dan biosekuriti hendaknya diterapakan pada peternakan ayam guna mencegah penyakit Avian Influenza dan Newcastle disease.
UCAPAN TERIMAKASIH
Penulis mengucapkan terimakasih kepada pemilik peternakan ayam petelur yang telah mengizinkan penulis untuk mengambil kasus. Terimakasih penulis ucapkan kepada segenap Dosen pembimbing Koasistensi Diagnosis Laboratorik (Kodil) dan staf laboratorium atas bimbingannya. Terimakasih pula kepada teman-teman kelompok Kodil atas kerjasamanya.
DAFTAR PUSTAKA
Alexander DJ, Senne DA. 2008 Newcastle Disease, Other Avian Paramyxovirus and Pneumovirus Infection. In Saif YM. Disease of Poultry. 12th Edition.
Blackwell Publishing. Iowa. Pp. 75-92.
Alexander DJ. 2000. Newcastle Disease and Other Avian Paramyxoviruses.
Revue cientifique et technique (International Office of Epizootics) 19: 443-462.
Alexander DJ. 2001. Gordon Memorial Lecture. Newcastle disease. British Poult. Sci. 42(1): 5-22.
Al-Habeeb MA, Mohamed MHA, Sharawi S. 2013. Detection and characterization of Newcastle disease virus in clinical samples using real time RT-PCR and melting curve analysis based on matrix and fusion genes amplification. Vet. World. 6(5): 239- 243.
Ashraf A, Shah MS. 2014. Newcastle Disease: Present status and future challenges for developing countries. Afr. J. Microbiol. Res. 8(5): 411-416.
Baratawidjaja KG and Iris R. 2012. Imunologi Dasar. Edisi Ke-8. Jakarta: Balai Penerbit Fakultas Kedokteran Universitas Indonesia.
Capua I and Alexander DJ. 2008. Ecology, epidemiology and human health implications of avian influenza viruses: why do we need to share genetic data? Zoon.Pub. Health. 55(1): 2-15.
Damayanti R, Dharmayanti NLPI, Indriani R, Wiyono A, Darminto. 2004. Gambaran Klinis dan Patologis pada Ayam yang Terserang Flu Burung Sangat Patogenik (HPAI) di Peternakan di Jawa Timur dan Jawa Barat. J. Ilmu Ternak Vet. 9(2): 128-135.
Ditjennak. 2014. Manual Penyakit Unggas. Direktorat Kesehatan Hewan Direktorat Jenderal Peternakan dan Kesehatan Hewan Kementerian Pertanian.
Ekaningtias M, Wuryastuty H, Wasito. 2017. Pendekatan Diagnosis Avian Influenza Virus dan Newcastle Disease Virus pada Kasus Lapangan Ayam Petelur: Imunopatologis Streptavidin Biotin. J. Sain Vet. 35(1): 118-126.
Erina, Aninaidu H, Zuhrawaty, Etriwati, Hamzah A, Abrar M, Daud AKM. 2021. Deteksi Antibodi terhadap Virus Newcastle Disease pada Burung Trucukan (Pycnonotus goiavier). Acta Vet. Indon. 9(3): 173-178.
Gelb J, Ladman BS, Licata MJ, Shapiro MH, Campion LR. 2007. Evaluating Viral Interference Between Infectious Bronchitis Virus and Newcastle Disease Virus Vaccine Strains Using Quantitative Reverse Transcription-Polymerase Chain Reaction. Avian Dis. 51(4): 924–934.
Harimoto T, Kawaoka Y. 2001. Pandemic Threat Posed by Avian Influenza A viruses. Clin. Microbiol. Rev. 14: 129149.
Hewajuli DA, Dharmayanti NPLI. 2008. Karakteristik dan Identifikasi Virus Avian Influenza. Wartozoa. 18(2): 86100
Kapczynski DR, Afonso CL, Miller PJ. 2013. Immune Responses of Poultry to Newcastle Disease Virus. Develop. Comp. Immunol. 41(3): 447–453.
Kattenbelt JA, Stevens MP, Gould AR. 2006. Sequence variation in the Newcastle disease virus genome. Virus Res. 116: 168-184.
Kencana GAY, Kardena IM, Mahardika IGNK. 2012. Peneguhan diagnosis penyakit newcastle disease lapang pada ayam buras di Bali menggunakan teknik RT-PCR. J. Ked. Hewan. 6(1): 28-31.
Kencana GAY, Suartha IN, Kardena IM, Nurhandayani A. 2020. Isolasi dan Karakterisasi Virus Avian Influenza Subtipe H5N1 Isolat Lapang Asal Bali Untuk Kandidat Vaksin. J. Vet. 21(4): 530-538.
Kencana GAY, Suartha IN, Kardena IM, Agustina KK. 2021. Seroprevalence and Detection of H5N1 Avian Influenza Virus in Local Chickens in Tabanan Regency, Bali, Indonesia. Acata Vet. Indon. 9(3): 223-229.
Kencana GAY, Kardena IM. 2011. Gross pathological observation of acute Newcastle disease in domestic chicken, In: Prosiding Seminar Internasional Perhimpunan Mikrobiologi Indonesia (PERMI) dan International Union of Microbiological Societies (IUMS). Denpasar, 22-24 Juni 2011.
Mahardika IGNK, Astawa INM, Kencana GAY, Suardana IBK, Sari TK. 2015. Teknik Lab Virus. Udayana University Press. Denpasar.
Muflihanah, Andesfha E, Wibawa H, Zenal FC, Hendrawati F, Siswani, Wahyuni, Kartini D, Rahayuningtyas I, Hadi S, Mukartini S, Poermadjaja B, Rasa FST. 2017. Kasus Pertama Low Pathogenic Avian Influenza Subtipe H9N2 pada Peternakan Ayam Petelur di Kabupaten Sidrap, Sulawesi Selatan Indonesia. Diag. Vetr. 16(1): 1-13.
Nuradji H, Parede L, Adjid RMA. 2008. Isolasi dan identifikasi virus avian influenza asal bebek. In Prosiding Seminar Nasional Teknologi
Peternakan dan Veteriner. Bogor, 11-12 November 2008.
Pattison M, McMullin PF, Bradbury JM, Alexander DJ. 2008. Poultry Diseases. 6th Edition. Saunders Elsevier. China. Pp. 298- 301.
Pranatha WD, Irhas R, Arhiono HNP, Widyasanti NWH, Kardena IM. 2018. Laporan Kasus Newcastle Diseases Dan Avian Influenza Pada Ayam Buras. Indon. Med. Vet. 7(5): 498-507
Quinn PJ, Markey BK, Carter ME, Donnelly WJC, Leonard FC. 2002. Veterinary Microbiology and Microbial Disease. Blackwell Science. Iowa. Pp. 283-289
Rachmawati PD, Adikara TS, Plumeriastuti H, Ernawati R, Rahmahani J, Handijatno D, Nugroho CMH. 2020. Analisis Filogenetik Gen Hemaglutinin dan Neuraminidase Avian Influenza H9N2 Asal Ayam Petelur di Jawa Timur. J. Vet. 21(2): 216- 226.
Ravindra PV, Tiwari AK, Sharma B, Rajawat YS, Ratta B, Palia S, Sundaresan NR, Chaturdevi U, Aruna KGB, Chindera K, Saxena M, Subundhi PK, Rai A, Chauhan RS. 2008. Arch. Virol.153(4): 749-754.
Ronohardjo P, Hardjosworo S, Partoatmojo S, Partadireja M. 1985. The Identification and Distribution of
Influenza A Virus in Indonesia. Penyakit Hewan. 17(29): 249-257.
Stevens J, Blixt O, Tumpey TM, Taubenberger JK, Paulson JC, Wilson IA. 2006. Structure and Receptor Specificity of the Hemagglutinin from an H5N1 Influenza Virus. Sci. 312: 404-410.
Swayne DE and Pantin-Jackwood M. 2008. Pathobiology of Avian Influenza Virus Infections in Birds and Mamals. Blackwell Publishing Professional 2121 State Avenue. Ames Iowa 50014. USA. Pp. 87-122.
Swayne DE, Senne DA, Suarez DL. 2008. Avian Influenza. In: A Laboratory Manual for The Isolation, Identification and Characterization of Avian Pathogens. 5th Edition. American
Association of Avian Pathologists. USA. Pp. 128-133
Swayne DE, Suarez DL, Sims LD. 2020. Influenza. In: Diseases of Poultry. 14th Edition. Wiley‐Blackwell. Pp. 210-256.
Wakamatsu N, King DJ, Kapczynski DR, Seal BS, Brown CC. 2006. Experimental Pathogenesis for Chickens, Turkeys and Pigeons of Exotic Newcastle disease Virus from an Outbreak in California During 2002– 2003. Vet. Pathol. 43(6): 925-933.
Wasito R, Wuryastuty H, Tjahyowati G, Irianingsih SH, Tyasasmaya T, Maes RK. 2014. Detection and
Differentiation of Pathogenic H5 and H7 Influenza A Virus Subtypes in Indonesian Poultry by Multiplex Reverse Transcription-Polymerase
Chain Reaction. Biochem. Biotechnol. Res. 2(2): 27-31.
Yuliantari IAM, Kencana GAY, Kardena IM. 2018. Seroprevalensi Penyakit Flu Burung (Avian Influenza) pada Ayam Kampung di Kerta, Payangan, Gianyar, Bali. Indon. Med. Vet. 7(6): 689-698.
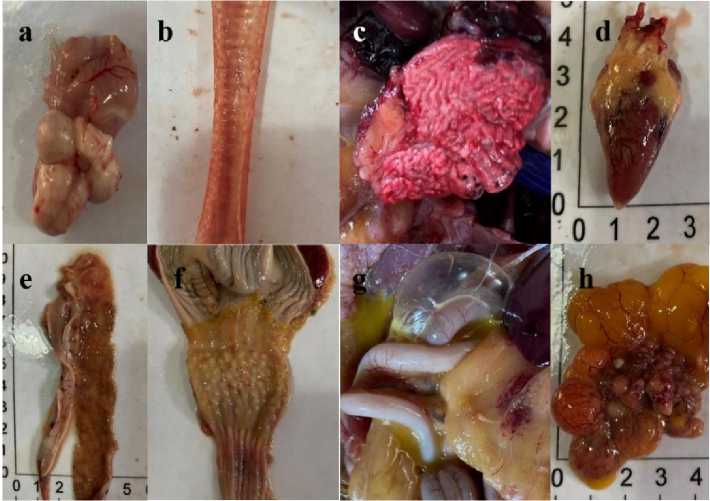
Gambar 1. Perubahan patologi anatomi pada ayam kasus. (Keterangan: (a) dilatasi pembuluh darah otak; (b) hemoragi pada trakea; (c) hemoragi pada paru-paru; (d) edema dan hemoragi pada otot jantung; (e) hemoragi pada usus; (f) pendarahan petekie pada proventrikulus; (g) pendarahan petekie pada lemak abdominal dan ruptur sel telur; (h) hemoragi pada ovarium)
Tabel 1. Hasil penghitungan morbiditas, mortalitas dan CFR.
Parameter Hasil
Morbiditas 15,3%
Mortalitas 1,53%
CRF 10%
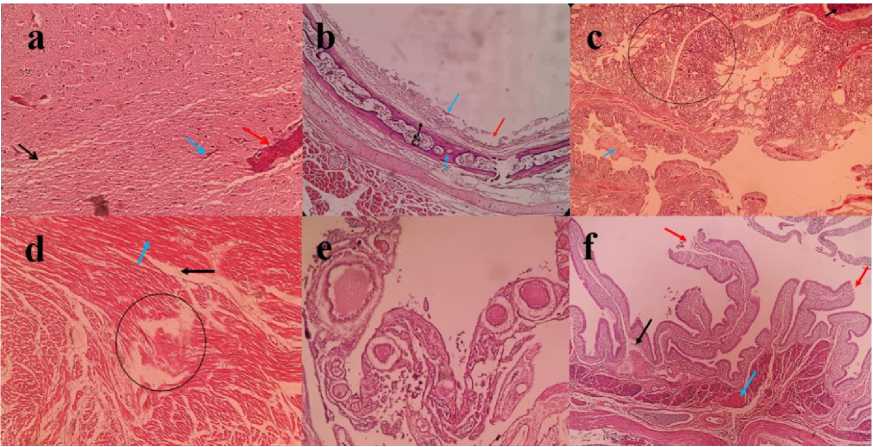
Gambar 2. Perubahan mikroskopik pada organ ayam kasus. (Keterangan: (a) Otak = kongesti
(panah merah), hemoragi (panah biru), edema (panah hitam); (b) Trakea = hemoragi (panah biru), edema (panah hitam), nekrosis sel epitel (panah merah); (c) Paru-paru = kongesti (panah hitam), hemoragi (lingkaran hitam), eksudat pada lumen bronkiolus (panah biru); (d) Jantung = hemoragii (panah biru), edema (panah hitam), nekrosis (lingkaran hitam); (e) Usus = hemoragii (panah biru), nekrosis (panah hitam), erosi vili (panah merah); (f) Ovarium = hemoragi dan regresi sel telur. Pewarnaan H & E, perbesaran 100X

Gambar 3. Hasi panen TAB dua hari pasca inokulasi dalam keadaan steril (Keterangan: Embrio dalam keadaan mati, kerdil, pendarahan pada kepala (panah hitam), dan kerontokan bulu (panah merah)

Gambar 4. Hasil uji HA positif. (Keterangan: (a) kontrol positif, (b) titer antigen (29unit HA), (c) kontrol negatif dan (d) kontrol darah)

Gambar 5. Hasil uji HI positif AI dan ND, (Keterangan: (AI) hasil uji positif AI; (ND) hasil uji positif ND; (KA) kontrol antigen dan (KSD) kontrol sel darah merah)
1097
Discussion and feedback