OOCYTE MORPHOMETRY IN BITCHES FROM VARIOUS AGES AND REPRODUCTIVE MATURITY STATUS
on
Volume 15 No. 4: 508-516
Agustus 2023
DOI: 10.24843/bulvet.2023.v15.i04.p02
Buletin Veteriner Udayana
pISSN: 2085-2495; eISSN: 2477-2712
Online pada: http://ojs.unud.ac.id/index.php/buletinvet
Terakreditasi Nasional Sinta 4, berdasarkan Keputusan Direktur Jenderal Pendidikan Tinggi, Riset, dan Teknologi No. 158/E/KPT/2021
Morfometri Oosit Anjing pada Berbagai Umur dan Status Kedewasaan Kelamin
(OOCYTE MORPHOMETRY IN BITCHES FROM VARIOUS AGES AND REPRODUCTIVE MATURITY STATUS)
Sheren1*, Ni Nyoman Werdi Susari2, I Gusti Ngurah Bagus Trilaksana3
-
1Mahasiswi Sarjana Pendidikan Dokter Hewan, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia, 80234;
-
2Laboratorium Anatomi dan Embriologi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia, 80234;
-
3Laboratorium Reproduksi dan Kemajiran Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia, 80234;
*Email: sherenacademia@gmail.com
Abstrak
Anjing merupakan salah satu hewan yang sudah ribuan tahun menjadi peliharaan manusia. Tujuan dari penelitian ini untuk mengetahui morfometri oosit anjing dari berbagai umur dan status kedewasaan kelamin. Dalam penelitian ini, 22 pasang sampel ovarium dikoleksi dan disimpan dengan Phosphate Buffer Saline (PBS) sebagai media transport. Oosit dikoleksi menggunakan metode slashing, dimana sayatan-sayatan dibuat pada korteks ovarium dan kemudian dibilas dengan NaCl. Cawan petri berisikan NaCl lalu diamati dibawah mikroskop untuk menemukan oosit. Diameter oosit diambil dengan merata-ratakan dua pengukuran secara tegak lurus satu sama lain. Jika oosit terhalang oleh sel kumulus, pengukuran dilakukan secara diagonal. Pengukuran yang diambil adalah diameter oosit (dengan zona pelusida) dan diameter ooplasma. Berdasarkan analisis statistik pada penelitian ini menggunakan uji one-way ANOVA, menunjukan diameter oosit dan ooplasma dari kelompok prepubertas, <1 tahun pospubertas (remaja), 1-4 tahun (dewasa), dan >4 tahun (tua) hampir tidak bisa dibedakan. Oosit dari anjing dewasa memiliki diameter terbesar (oosit = 108,0±27,8µm dan ooplasma = 85,7±19,5µm) dan secara signifikan lebih besar dibandingkan dengan anjing prepubertas (oosit = 102,5±29,4 µm and ooplasma = 84,8±25,4µm). anjing remaja memiliki diameter terkcil (oosit = 94,1±28,9µm and ooplasma = 78,8±25,3µm), diikuti oleh anjing tua (oosit = 98,5±38,7µm and ooplasma 83,01±35,1µm). Penelitian lanjutan mengenai morfometri oosit diperlukan yang lebih berfokus pada ukuran oosit, siklus estrus, dan kualitas oosit.
Kata kunci: Anjing; diameter oosit; morfometri; status kedewasaan kelamin
Abstract
Dog is one of the animals that has been human’s pet for thousands of years. The aim of this study was to find the morphometry of canine oocyte from various age and reproductive maturity status. In this study, 22 pairs of ovarium samples were collected and stored with Phosphate Buffer Saline (PBS) as transport media. Oocytes were collected using the method of slashing, where multiple slashes were made on the cortex of ovaries and then flushed with NaCl. Petri dish containing NaCl were then observed under the microscope to find the oocyte. Oocyte diameter was obtained by averaging two measurements made perpendicular to each other. If oocytes are obscured by cumulus cells, measurement was taken diagonally. Measurements taken were diameter of oocyte (including zona pellucida) and diameter of ooplasma. Based on statistical analysis of this study using one-way ANOVA, showed oocyte and ooplasma diameters from groups of prepubertal, <1 year old post-pubertal (juvenile), 1-4 years old (mature), and >4 years old (old) are almost indistinguishable. Oocytes from mature dogs had the largest diameter (oocyte = 108,0±27,8µm and ooplasma = 85,7±19,5µm) and was sigfinicantly larger than oocytes from prepubertal dogs (oocyte = 102,5±29,4µm and ooplasma = 84,8±25,4µm). Juvenile dogs had the smallest diameter (oocyte = 94,1±28,9µm and ooplasma =
78,8±25, µm), followed by old dogs (oocyte = 98,5±38,7µm and ooplasma 83,01±35,1µm). Further investigations of oocyte morphometry are needed while focusing more on follicle size, estrus cycle, and oocyte quality.
Keywords: Bitch; morphometry; oocyte diameter; reproductive maturity status
PENDAHULUAN
Anjing domestik (Canis lupus familiaris) merupakan salah satu hewan kesayangan yang umum dipelihara. Spesies anjing memiliki keberagaman fenotipe terbesar di dunia (Wang et al., 2015). Anjing mengalami pubertas sekitar umur 524 bulan (Noakes et al., 2018) atau 2-3 bulan sesudah anjing betina mencapai berat badan dewasa (Junaidi, 2021). Siklus estrus dari anjing betina terdiri dari 4 fase; yaitu proestrus, estrus, diestrus/metestrus dan anestrus. Kedewasaan kelamin atau pubertas pada anjing betina ditentukan saat leleran darah proestrus pertama kali keluar atau disebut juga heat (Kustritz, 2009).
Ovarium anjing memiliki ukuran kurang lebih 1,5x0,7x0,5 cm pada anjing dengan berat 12 kg, berlokasi di bagian dorsal dari rongga perut, disebelah kaudal dari ginjal kurang lebih pada tingkat ketiga atau keempat dari vertebrae lumbalis (Junaidi, 2021). Ovarium terdiri dari 2 bagian yaitu; medulla dan korteks, dikelilingi oleh epitel kecambah. Pada medulla terdapat pembuluh limfa, darah dan saraf, sedangkan korteks merupakan tempat pembentukan ovum dan hormon (Schatten dan Constantinescus, 2008). Ovarium dapat mengandung struktur-struktur komponen yang berbeda pada tingkat perkembangannya. Sel-sel folikel akan tumbuh dan berkembang dalam mencapai kematangannya berturut-turut yaitu; folikel primer, sekunder, tertier dan folikel de Graaf. Peristiwa pecahnya folikel de Graaf dan melepaskan ovum dari ovarium disebut ovulasi.
Ovarium mengandung folikel dari berbagai macam fase perkembangan; ini bisa dibedakan berdasarkan ukuran, tipe, jumlah sel granulosa, atau sifat kebergantungan terhadap hormon gonadotropik. Antrum merupakan rongga dalam folikel yang berisikan cairan
folikular yang akan berkembang selama proses maturasi folikel. Berdasarkan keberadaan antrum folikel dapat dibedakan menjadi folikel preantral dan folikel antral. Preantral memiliki 3 fase yaitu; primordial, primer, dan sekunder. Pada anjing domestik, persediaan folikel preantral adalah berjumlah 47.900 (Paulini et al., 2014).
Anjing mengalami ovulasi sebanyak 1 – 2 kali per tahun, dimana oosit yang masih berbentuk germinal vesicle dilepaskan dari ovarium dan menuju ke tuba fallopi untuk meneruskan pendewasaan inti dan sitoplasma dengan bantuan hormone progesteron (Songsasen dan Wildt, 2007). Secara in vivo, maturasi meiosis dimulai 56-72 jam setelah ovulasi (Reynaud et al., 2009) dan berlangsung di oviduk bagian distal (Lee et al,. 2008). Oosit yang melanjutkan meiosis disebut germinal vesicle breakdown (GVBD) dan diteruskan menjadi metaphase I dan metaphase II selama 1 – 4 hari (No et al., 2018). Cumulus Oocyte Complex (COC) didapat dengan cara koleksi oosit dapat dibedakan menjadi 3 kelompok; COC Grade 1 memiliki ooplasma berwarna gelap dan dikelilingi oleh 1 atau lebih lapisan sel cumulus-oophorus, COC Grade 2 memiliki ooplasma yang lebih pucat dibandingkan dengan Grade 1 dan tidak dikelilingi sel cumulus-oophorus secara sempurna, COC Grade 3 berwarna pucat, seringkali berbentuk tidak sempurna dan tanpa sel cumulus-oophorus disekelilingnya (Hewitt dan England, 1998). Zona pelusida (ZP) merupakan lapisan ekstraselular elastis yang mengelilingi oosit dan embrio pre-implantasi, dimana pada saat fertilisasi, sperma menyatu dan menembus lapisan ini (Lunn dan Wright, 2013). Pada anjing, ZPA/ZP2 disintesis oleh oosit, sedangkan ZPC/ZP3 dan ZPB/ZP4 disintesis oleh sel granulosa (Lunn dan Wright, 2013).
METODE PENELITIAN
Objek penelitian
Objek yang akan digunakan pada penelitian ini yaitu ovarium yang diperoleh melalui ovariohysterectomy anjing dari berbagai umur dan status kedewasaan kelamin.
Sampel dan Bahan Penelitian
Sampel menggunakan 22 pasang ovarium anjing lokal yang didapatkan dari ovariohysterectomy. Bahan-bahan yang akan digunakan pada penelitian ini diantaranya adalah NaCl fisiologis (Sodium Chloride 0.9%) dan Phospahte Buffered Saline (PBS). Peralatan yang akan digunakan dalam penelitian ini adalah wadah untuk transportasi sample, mikroskop, cawan petri berbagai ukuran (60x15mm untuk sample oosit), syringe 3ml, jarum 23 G, gloves, pinset, surgical blade/silet, dan gunting bedah.
Pengumpulan Sampel Ovairum
Penelitian ini menggunakan sampel ovarium sebanyak 22 pasang ovarium, yang dibagi menjadi 4 kelompok umur; Kelompok prepubertas, Kelompok remaja: dewasa kelamin <1 tahun, Kelompok dewasa: 1 - 4 tahun, dan Kelompok tua: >4 tahun. Sampel ovarium dimasukan ke dalam wadah plastik yang sudah diisikan Phosphate Buffer Saline (PBS). Selang waktu maksimal dari ovarium didapatkan hingga melakukan koleksi adalah 6 jam.
Persiapan Ovarium
Ovarium diisolasikan dari lemak dan jaringan-jaringan lainnya dengan
menggunakan pinset dan gunting bedah. NaCl fisiologis digunakan untuk menghilangkan darah serta menjaga agar korteks ovarium tetap basah. Pastikan ovarium tetap terendam dalam NaCl jika tidak sedang dilakukan koleksi.
Koleksi Oosit
Koleksi oosit menggunakan metode slashing seperti dijelaskan oleh Saleh pada tahun 2017, yaitu dengan cara menggunakan surgical blade buat sayatan-sayatan pada lokasi folikel yang menonjol
pada korteks ovarium. Jika pada sampel ovarium tidak terdapat folikel yang menonjol, maka sayatan-sayatan dilakukan pada korteks ovarium. Akibat ukuran dari ovarium anjing, tambahan tahap yang berbeda dengan teknik yang dilakukan Saleh pada tahun 2017 adalah melakukan flushing dimana ovarium yang telah dibuat sayatan dicuci dengan NaCl fisiologis sebanyak 2-3 ml menggunakan syringe. Semprotkan NaCl ke arah sayatan-sayatan yang sudah dibuat dan biarkan NaCl jatuh ke cawan petri. Letakan cawan petri yang sudah terisikan NaCl ke bawah mikroskop untuk mencari oosit.
Pengukuran Oosit
Pengukuran diameter setiap oosit dilakukan menggunakan program kamera ImageJ
(https://imagej.nih.gov/ij/download.html) dengan mengambil rata-rata dari 2 pengukuran secara horizontal dan vertikal atau 2 pengukuran secara diagonal tegak lurus jika oosit tertutup oleh sel kumulus. Pengukuran yang diambil adalah diameter oosit (dengan zona pelusida) dan diameter ooplasma. Sebelum pengukuran dengan program ImageJ dilakukan kalibrasi skala dengan bantuan mikrometer objektif.
HASIL DAN PEMBAHASAN
Hasil
Hasil morfologi oosit
Hasil pengamatan di bawah mikroskop pada oosit anjing prepubertas, remaja, dewasa dan tua dapat teramati bahwa oosit grade 1 terdapat ooplasma pada bagian tengah oosit dan sel kumulus yang berbentuk granul. Diantara oosit dan sel cumulus terdapat corona radiata, zona pelusida, membrane vitelin dan rongga perivitelin.
Selain COC grade 1 (Gambar 1), ditemukan juga COC grade 2 dan 3. COC grade 2 memiliki lapisan sel kumulus yang tidak sempurna/komplit, sedangkan COC grade 3 tidak memiliki sel kumulus.
Hasil morfometri oosit
Analisis deskriptif menunjukan bahwa, rata-rata diameter oosit pada kelompok prepubertas dengan 7 ekor anjing sebesar 102,5 µm, diameter ooplasma sebesar 84,8 µm. Pada kelompok remaja sebanyak 5 ekor anjing dan dewasa sebanyak 8 ekor anjing rata-rata diameter oosit sebesar 94,1 µm dan 108,0 µm dan diameter ooplasma sebesar 78,8 µm dan 85,7 µm secara berurutan. Kelompok tua dengan 2 ekor anjing rata-rata diameter oosit pada kelompok tua sebesar 98,5 µm dan diameter ooplasma 83,01 µm.
Berdasarkan analisis statistik pada penelitian ini menggunakan uji one way anova, namun sebelum melakukan analisis one way anova, harus dilakukan uji homogenitas dengan uji Levene. Hasil uji homogenitas data menunjukan data bersifat homogen, dengan nilai P>0,05, sehingga analisis data dilanjutkan dengan uji one way anova. Hasil uji one-way ANOVA menunjukan bahwa, tidak terdapat perbedaan yang signifikan (P>0,05) pada variable diameter oosit dan diameter ooplasma terhadap keempat kelompok umur dan status kedewasaan. Hal ini menunjukan bahwa kelompok anjing dengan status kedewasaan prepubertas, <1 tahun pospubertas, 1-4 tahun dan >4 tahun memiliki diameter oosit yang hampir sama.
Pembahasan
Morfologi oosit anjing
Secara morfologis, oosit anjing berkarakteristik unik, dimana jumlah lipid (fosfolipid dan trigliserida) sangat banyak dan menyebabkan ooplasma tampak padat merata dan gelap (Hu et al., 2020). Hal ini menyebabkan nukleus dari ooplasma oosit anjing yang cenderung gelap sulit diamati dengan Teknik konvensional (Chastant-Maillard et al., 2011). Sel kumulus dari oosit anjing prepubertas memiliki susunan yang longgar dan hal ini menyebabkan penurunan kualitas oosit. Kemampuan oosit untuk melanjutkan meiosis dan mencapai MII mengandalkan komunikasi antar sel kumulus. Oleh karena itu kekompakan sel kumulus dapat
mempengaruhi kualitas oosit (Haenisch-Woehl et al., 2003).
COC Grade 1 memiliki kualitas terbaik dengan kumulus yang kompak dan tidak expanded, terdiri dari paling sedikit 5 lapisan sel kumulus yang utuh, ooplasma jelas (berpigmen gelap), padat dan homogen. COC dengan kualitas buruk memiliki kumulus yang parsial, tidak kompak atau tidak komplit, granulasi ooplasma tidak merata (terdapat bagian yang sangat terang dan bagian yang sangat gelap), oocyte berbentuk tidak berbentuk tidak sempurna, dan terlalu kecil (Zarcula et al., 2020). Penelitian oleh Haenisch-Woehl et al., pada tahun 2003 mendapatkan sedikit oosit pada kelompok anjing remaja, dimana oosit-oosit ini memiliki lapisan sel kumulus yang tidak komplit dan lebih kecil dibandingkan dengan kelompok anjing dewasa. Terdapat beberapa COC grade 2 dan 3 pada setiap kelompok, namun pada penelitian ini hanya oosit grade 1 yang digunakan untuk pengukuran diameter oosit. Berdasarkan pengamatan morfologi oosit anjing pada 4 kelompok, tidak terdapat perbedaan.
Morfometri oosit anjing
Berdasarkan hasil dari rata-rata diameter oosit dan ooplasma pada 4 kelompok yang mencangkupi anjing dari berbagai umur dan status kedewasaan kelamin berjumlah 22 sampel, tidak terdapat perbedaan yang signifikan. Berdasarkan umur, anjing tua menunjukan oosit berukuran lebih besar dibandingkan oosit dari anjing muda, dan anjing yang sudah dewasa kelamin memiliki oosit lebih besar dibandingkan anjing remaja. Hal ini membuktikan bahwa umur mempengaruhi diameter oosit (Lunn and Wright, 2013). Penelitian yang dilakukan oleh Lunn dan Wright (2013) yang memberikan data bahwa rata-rata diameter oosit terbesar pada kelompok tua dan rata-rata diameter oosit terkecil pada kelompok prepubertal, sedangkan
penelitian ini menunjukan hasil yang berbeda dimana rata-rata diameter oosit dari anjing dewasa memiliki diameter terbesar dibandingkan diameter oosit dari
kelompok lainnya. Penelitian ini mendapatkan diameter oosit terkecil pada kelompok remaja. Hal ini bisa terjadi karena banyak faktor yaitu; metode pengelompokan, metode
transportasi/penyimpanan, follikulogenesis, siklus estrus dan kualitas oosit.
kelompok prepubertal pada penelitian Lunn dan Wright (2013) menggunakan anjing berumur kurang dari 6 bulan, sedangkan pada penelitian ini pada kelompok A terdapat beberapa sampel yang didapat dari anjing berumur lebih dari 6 bulan yang belum melewati pubertas. Pada anjing yang belum mengalami pubertas, kualitas oosit rendah dimana ukuran oosit kecil, dan tingkat maturasi rendah (fibrianto et al., 2008). Hal ini disebabkan oleh oosit anjing prepubertas yang kurang maksimal mensintesis protein, tingkat metabolism energi yang tinggi, dan kurangnya komunikasi antar sel kumulus (Haenisch-Woehl et al., 2003).
Folikulogenesis terjadi 2 – 12 minggu setelah lahir dan folikel primordial terlihat pada umur 3 minggu setelah kelahiran (Haenisch-Woehl et al., 2003). Penelitian yang dilakukan oleh Zoppei et al. (2021) menunjukan bahwa folikel multi-oosit dapat ditemukan pada ovarium dari berbagai umur dan siklus estrus. Namun sama seperti Lunn dan Wright (2013), oosit sulit dikoleksi pada ovarium anjing prepubertal dimana pada penelitian ini oosit yang berhasil dikoleksi dari kelompok ini paling sedikit adalah 1 oosit. Folikel pada fase antral (disebut juga folikel de Graaf) dapat ditemukan pada anjing semuda-mudanya berumur 6 bulan dan tepat sebelum proestrus (Songsasen et al., 2009). Oosit anjing dari folikel antral dewasa memiliki diameter yang lebih besar dibandingkan oosit dari folikel preantral, oleh karena itu diasumsikan bahwa semakin besar folikel maka status oosit semakin dewasa (Diagone et al., 2008). Pada ovarium anjing terdapat ~100.000 folikel primordial yang masing-masing memiliki 1 oosit kecil (berdiameter 10 - 26
µm), menjadi 2 kali lipat lebih besar pada folikel primer menjadi berdiameter 16 – 62 µm, dengan rata-rata 31 µm, oosit bertambah besar berukuran 35 – 88 µm dengan rata-rata 60,5 µm pada folikel sekunder (Songsasen dan Nagashima, 2020), dan pada folikel antra/tertier ukuran oosit sekitar ~80 µm pada fase awal antral, hingga ukuran maximum >120 µm saat folikel mencapai ukuran diameter >0.4 mm (Reynaud et al., 2012).
Penelitian terhadap oosit pada berbagai fase siklus estrus biasanya dibagi menjadi 3 kelompok: (1) anestrus, dimana ovarium tidak terdapat folikel dan jaringan luteal tidak menonjol; (2) proestrus/estrus (fase folikular), dimana 1 atau 2 folikel terlihat; (3) diestrus, dimana 1 atau lebih corpora lutea terlihat (Ariu et al., 2016; Otoi et al., 2001). Pada penelitian yang dilakukan oleh Otoi et al. (2001), menemukan bahwa 50.8% oosit dari fase folikular memiliki diameter >120 µm, dan jumlah ini secara signifikan lebih tinggi dibandingkan dengan oosit berdiameter >120 µm pada fase anestrus dan diestrus. Oosit berdiameter <110 µm juga paling sedikit ditemukan di fase yang sama. Rata-rata diameter oosit terkecil didapatkan pada kelompok anestrus. Berdasarkan poin-poin diatas, dapat disimpulkan bahwa penyebab kelompok prepubertal pada penelitian ini berdiameter lebih besar dibandingkan dengan kelompok remaja diakibatkan oleh sampel ovarium anjing prepubertal didominasikan oleh ovarium yang sedang dalam siklus proestrus atau sebelum prepubertas. Sampel dari kelompok remaja didominasikan oleh ovarium yang sedang dalam keadaan diestrus atau anestrus dimana oosit dominan berdiameter kecil. Hal ini masuk akal, mengingat diestrus pada anjing biasanya berlangsung selama 2 bulan tanpa kehamilan (Songsasen dan Nagashima, 2020) dan anestrus selama 2-9 bulan sampai siklus berikutnya dimulai (Greer, 2014). Untuk mengestimasi waktu ovulasi, dapat dilakukan sitologi vaginal. Vaginal swab dilakukan untuk mendapatkan cairan serosanguinos dan
dilakukan pewarnaan Giemsa, dan diamati di bawah mikroskop. Jika sel epitel terdiri dari > 90% sel epitel superfisial maka dianggap sedang dalam masa ovulasi (Hu et al., 2020).
Menurut Pereira et al. (2012), umur mempengaruhi jumlah dan kualitas morfologi oosit, dimana oosit anjing untuk donor memiliki kualitas terbaik pada umur 1-3 tahun. Kumulus sel setelah pubertas mengalami penebalan dan pemadatan sehingga komunikasi antar sel lebih baik dan meningkatkan kemampuan oosit untuk melanjutkan meiosis dan mencapai MII (Haenisch-Woehl et al., 2003). Kualitas oosit menurun seiring bertambahnya usia, pertama terlihat pada anjing usia 4 tahun, dan semakin memburuk pada usia 8 tahun (Greer, 2014). Penelitian oleh Rocha et al. (2006) menunjukan oosit yang dikoleksi dari anjing berumur 9-13 tahun dominasikan oleh oosit kualitas rendah. Hal ini sesuai dengan hasil yang didapatkan pada penelitian ini, dimana kelompok dewasa memiliki diameter terbesar dan mengalami penurunan ukuran pada kelompok tua.
Transportasi ovarium pada penelitian ini menggunakan PBS tanpa memperhatikan suhu media, sehingga sampel beresiko mengalami kerusakan/kematian. Oosit yang masih hidup memiliki diameter yang jauh lebih besar dibandingkan oosit yang sudah mati. Oosit yang yang mati memiliki oolemmae yang rusak sehingga terjadi penyusutan (Lunn dan Wright, 2013). Untuk mengetahui viabilitas oosit, dilakukan pewarnaan dengan propidium iodide (PI). Blastomer dengan membran plasma utuh yang hidup akan berfluoresensi biru (Guaitolini et al., 2012), sedangkan jika membran plasma hancur dan berfluoresensi merah maka oosit dianggap mati (Lee et al., 2006). Penelitian oleh Lee et al. (2006) menunjukan bahwa oosit anjing memiliki sensitivitas tinggi terhadap penyimpanan suhu rendah. Oosit anjing memiliki jumlah lipid yang tinggi sehingga suhu rendah bersifat merusak pada lipid membrane plasma. Viabilitas
oosit pada penelitian ini tidak melalui pengecekan sehingga hasil dapat sangat terpengaruh.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan pengukuran oosit dari 22 pasang ovarium anjing tidak terdapat perbedaan yang nyata (P>0,05) antar umur dan status kedewasaan kelamin. Hasil ini konsisten pada 2 pengukuran yang dilakukan (Oosit dan Ooplasma). Rata-rata oosit terbesar didapatkan pada kelompok dewasa (Oosit: 108,0 µm, Ooplasma: 85,7 µm), sedangkan rata-rata oosit terkecil didapatkan pada kelompok remaja (Oosit: 94,1 µm, ooplasma: 78,8 µm).
Saran
Penelitian lanjutan diperlukan terhadap oosit anjing tetapi lebih memperhatikan ukuran folikel, siklus estrus, dan kualitas oosit. Penelitian serupa dengan perwarnaan khusus dan metode atau media transportasi berbeda juga penting dilakukan agar membantu melengkapi ilmu mengenai oosit anjing dan berkontribusi dalam pemahaman sel oosit terhadapat para ahli yang menekuni ilmu histologi, morfologi, dan reproduksi anjing.
UCAPAN TERIMAKASIH
Terima kasih kepada Laboratium Teknologi Reproduksi dan Genetika Fakultas Kedokteran Hewan, Universitas Udayana karena terlah membina penulis serta memberikan fasilitas yang ada di Laboratium dari awal hingga selesai.
DAFTAR PUSTAKA
Ariu F, Strina A, Murrone O, Falchi L, Bebbere D, Ledda S, Zedda MT, Pau S, Bogliolo L. 2015. Lipid droplet distribution of immature canine oocytes in relation to their size and the reproductive stage. Anim. Sci. J. 87(1): 147–150.
Chastant-Maillard S, Viaris De Lesegno C, Chebrout M, Thoumire S, Meylheuc T, Fontbonne A, Chodkiewicz M, Saint-
Dizier M, Reynaud K. 2011. The canine oocyte: uncommon features of in vivo and in vitro maturation. Reprod. Fertility Develop. 23(3): 391.
Diagone KV, Vicente WRR, Pacheco MR, Mateus O. 2008. Oocyte morphometry in female dogs (canis familiaris, linnaeus, 1758). Anatomia, Histologia, Embryologia. J. Vet. Med. Series C. 37(2): 81–85.
Fibrianto YH, Pangestiningsih TW, Hanna A, Astuti P, Airin CM, Asyhari, Anindito A, Rachmawati N, Kurniawan K, Wibowo PY. 2008. Kuantitas dan kualitas sel telur anjing lokal dari berbagai stadium estrus. Indon. J. Vet. Sci. 26(1): 10-16.
Greer ML. 2014. Canine reproduction and neonatology. 1st Ed. Teton NewMedia. USA.
Guaitolini CRDF, Taffarel MO, Teixeira NS, Sudano MJ, Freitas PMC, Lopes MD, Landin-Alvarenga FDC, de Oliveira CA, Luz MR. 2012. Post-thaw viability of in vivo-produced canine blastocysts cryopreserved by slow freezing. Theriogenology. 78(3): 576–
582.
Haenisch-Woehl A, Kölle S, Neumüller C, Sinowatz F, Braun J. 2003. Morphology of canine cumulus-oocyte complexes in pre-pubertal bitches. Anatomia,
Histologia, Embryologia. 32(6): 373–
377.
Hewitt D, England G. 1998. The effect of oocyte size and bitch age upon oocyte nuclear maturation in
vitro. Theriogenology. 49(5): 957–966.
Hu M, Du Z, Zhou Z, Long H, Ni Q. 2020. Effects of serum and follicular fluid on the in vitro maturation of canine oocytes. Theriogenology. 143: 10–17.
ImageJ.
https://imagej.nih.gov/ij/download.html diakses pada tanggal 20 Mei 2022.
Junaidi A. 2021. Reproduksi dan obstetri pada anjing. Gadjah Mada University Press. IDN.
Kindersley D. 2013. The dog encylopedia. First American Edition. DK Publishing. USA.
Kustritz RM. 2009. Clinical canine and feline reproduction: evidence-based answers (1st Ed.). Wiley-Blackwell. USA.
Lee H, Yin X, Jin Y, Kim N, Cho S, Bae I, Kong I. 2008. Germinal vesicle chromatin configuration and meiotic competence is related to the oocyte source in canine. Anim. Reprod. Sci. 103(3–4): 336–347.
Lee HS, Yin XJ, Kong IK. 2006. Sensitivity of canine oocytes to low temperature. Theriogenology. 66(6-7): 1468–1470.
Lunn MO, Wright SJ. 2013. Distinct subtypes of zona pellucida morphology reflect canine oocyte viability and cumulus-oocyte complex
quality. Theriogenology. 80(5): 498–
506.
No J, Zhao M, Lee S, Ock SA, Nam Y, Hur TY. 2018. Enhanced in vitro
maturation of canine oocytes by
oviduct epithelial cell co-culture.
Theriogenology. 105: 66–74.
Noakes DE, Parkinson TJ, England GCW. 2018. Veterinary reproduction and obstetrics (10th Ed.). Elsevier Health Sciences. DE.
Otoi T, Ooka A, Murakami M, Karja NK, Suzuki T. 2001. Size distribution and meiotic competence of oocytes obtained from bitch ovaries at various stages of the oestrous cycle. Reprod. Fertility Develop. 13(3): 151.
Paulini F, Silva RC, de Paula Rôlo JLJ, Lucci CM. 2014. Ultrastructural changes in oocytes during folliculogenesis in domestic
mammals. J. Ovarian Res. 7(1): 1-12.
Pereira LMC, Bicudo SD, Lopes MD. 2012. Oocyte maturation in bitches. Anim. Reprod. 9(3): 205-209.
Pereira LMC, Bicudo SD, Lopes MD. 2012. Oocyte maturation in bitches. Anim. Reprod. 9(3): 205-209.
Reynaud K, Fontbonne A, Saint-Dizier M, Thoumire S, Marnier C, Tahir M,
Meylheuc T, Chastant-Maillard S. 2012. Folliculogenesis, ovulation and endocrine control of oocytes and embryos in the dog. Reprod. Domest. Anim. 47: 66–69.
Rocha A, Bastos R, Cunha I, Adona P, Santos J. 2006. Quantity and quality of oocytes recovered from donor bitches of different ages. Theriogenology. 66(6–7): 1465–1467.
Rocha A, Bastos R, Cunha I, Adona P, Santos J. 2006. Quantity and quality of ocytes recovered from donor bitches of different ages. Theriogenology. 66(6–
7): 1465–1467.
Saleh W. 2017. Assessment of different methods of bovine oocytes collection, maturation and Invitro fertilization of abattoir specimens. Iraqi J. Vet. Sci. 31(1): 55–65.
Schatten H, Constantinescu GM.
2008. Comparative reproductive
biology. Iowa (USA): Blackwell
Publishing.
Songsasen N, Fickes A, Pukazhenthi BS, Wildt D. 2009. Follicular morphology, oocyte diameter and localisation of fibroblast growth factors in the domestic
dog ovary. Reprod. Domest. Anim. 44: 65–70.
Songsasen N, Wildt D. 2007. Oocyte biology and challenges in developing in vitro maturation systems in the domestic dog. Anim. Reprod.
Sci. 98(1–2): 2–22.
Wang GD, Zhai W, Yang HC, Wang L, Zhong L, Liu YH, Fan RX, Yin TT, Zhu CL, Poyarkov AD, Irwin DM, Hytönen MK, Lohi H, Wu CI, Savolainen P, Zhang YP. 2015. Out of southern east asia: the natural history of domestic dogs across the world. Cell Res. 26(1): 21–33.
Zarcula SM, Godja G, Milovanov C, Tulcan C, Cernescu H, Otava G, Bonca G, Ciobota A, Hutu I, Micru C. 2014. Morphological aspects of cumulusoocyte complexes in different species. Lucrări Ştiinţifice USAMV Iaşi – seria Med. Vet. 57(3/4): 91-97.
Zoppei A, Pinto Neto A, Cattelam J, Martinez A, Trenkel C, Steffens R, Gruchouskei L. 2021. Quantification of multi-oocyte follicles in ovaries of bitches. Arquivo Brasileiro de Med. Vet. Zoot. 73(6): 1269–1277.

Gambar 2. COC grade 2 (A) dan grade 3 (B). Scale bar: 100 µm. Pembesaran: 20x.
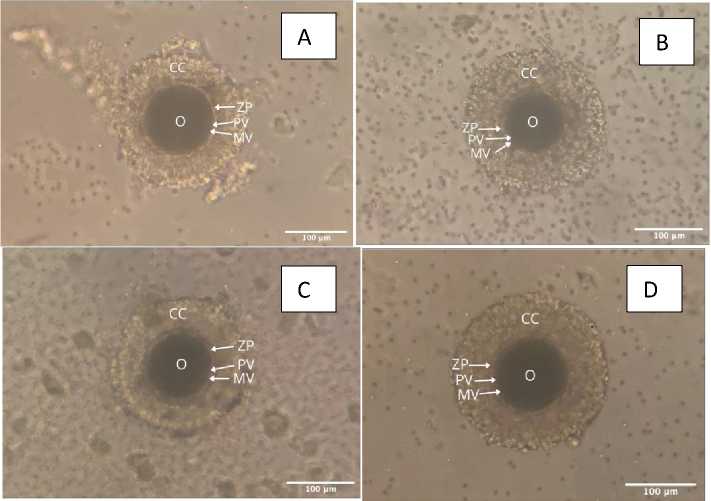
Gambar 1. Morfologi oosit anjing prepubertas (A), anjing remaja (B), anjing dewasa (C), dan anjing tua (D). Keterangan: Sel kumulus (CC), zona pelusida (ZP), rongga perivitelin (PV), membran vitelin (MV), Ooplasma (O), Scale bar: 100 µm. Pembesaran: 20x.
Tabel 1. Analisis deskriptif (rerata ± standar deviasi) diameter ZP, oosit dan ZP-Oosit
Umur dan Status Diameter Diameter
kedewasaan Oosit (µm) Ooplasma (µm)
|
Prepubertas |
102,5 ± 29,4a |
84,8 ± 25,4a |
|
<1 tahun pospubertas (remaja) |
94,1 ± 28,9a |
78,8 ± 25,3a |
|
1-4 tahun (dewasa) |
108,0 ± 27,8a |
85,7 ± 19,5a |
|
>4 tahun (tua) |
98,5 ± 38,7a |
83,01 ± 35,1a |

Gambar 3. Pengukuran pada oosit dan ooplasma. Keterangan: oosit (garis kuning) dan ooplasma (garis biru). Scale bar: 100 µm. Pembesaran: 200.
516
Discussion and feedback