BALI CATTLE OOCYTE MATURATION RATE ON TCM 199 MEDIA WITH THE ADDITION OF HYPOTAURINE
on
Volume 14 No. 5: 524-530
Oktober 2022
DOI: 10.24843/bulvet.2022.v14.i05.p12
Buletin Veteriner Udayana
pISSN: 2085-2495; eISSN: 2477-2712
Online pada: http://ojs.unud.ac.id/index.php/buletinvet
Terakreditasi Nasional Sinta 4, berdasarkan Keputusan Direktur Jenderal Pendidikan Tinggi, Riset, dan Teknologi No. 158/E/KPT/2021
Tingkat Maturasi Oosit Sapi Bali pada Media TCM 199 dengan Penambahan Hipotaurin
(BALI CATTLE OOCYTE MATURATION RATE ON TCM 199 MEDIA WITH THE ADDITION OF HYPOTAURINE)
Ester Novitasari1, Tjok Gde Oka Pemayun2, I Ketut Suatha2, I Gusti Ngurah Bagus Trilaksana2* 1Papua Pet Care, Papua Barat, Indonesia;
2Laboratorium Teknologi Reproduksi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali Indonesia.
*Email: agunglaksana@unud.ac.id
Abstrak
Maturasi oosit merupakan salah satu langkah penting dalam pelaksanaan fertilisasi in vitro untuk pelaksanaan transfer embryo. Oosit hasil koleksi baik secara aspirasi maupun slicing pada umumnya belum mencapai fase MII yang dibutuhkan untuk fertilisasi in vitro sehingga perlu dilakukan maturasi oosit. Tujuan penelitian adalah untuk mengetahui tingkat maturasi oosit sapi bali pada media TCM 199 dengan penambahan hipotaurin. Oosit berasal dari ovarium yang diperoleh dari rumah potong hewan Pesanggaran Denpasar dan dikoleksi dengan metode slicing. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) yang terdiri dari tiga kelompok yaitu kelompok I / kontrol (P0: media maturasi tanpa hipotaurin), kelompok II (P1: media maturasi dengan penambahan hipotaurin dengan konsentrasi 2 mMol dan kelompok III (P2: media maturasi dengan penambahan hipotaurin dengan konsentrasi 4 mMol dengan masing-masing kelompok terdiri dari 27 ulangan. Maturasi oosit dilakukan dengan cara inkubasi selama 24 jam dalam inkubator dengan suhu 38,5 0C dengan tekanan CO2 5 %. Hasil penelitian menunjukkan bahwa tingkat ekspansi sel kumulus hingga tahap cumulus oocyte complexes (COCs) pada kelompok P1 tidak berbeda nyata dibandingkan kelompok P0 (p>0,05), namun kelompok P2 menunjukkan perbedaan yang nyata (p<0,05). Pada tingkat kematangan inti, penambahan hipotaurin tidak menyebabkan perbedaan yang nyata (p>0,05) pada tingkat GVBD, namun pada tingkat MI terdapat perbedaan yang nyata (p<0,05) antara kelompok P0 dengan P1 dan P2, sedangkan pada tingkat MII tidak terdapat perbedaan yang nyata (p>0,05) antara P0 dengan P1 namun berbeda nyata (p<0,05) antara P0 dengan P2. Dari hasil peneltian dapat disimpulkan bahwa penambahan hipotaurin dengan konsentrasi 4 mM pada media maturasi oosit TCM 199 dapat meningkatkan tingkat ekspansi sel kumulus mencapai COCs dan meningkatkan tingkat kematangan inti mencapai fase MII.
Kata kunci: Hipotaurin; maturasi oosit; oosit; sapi bali.
Abstract
Oocyte maturation is an important step in the implementation of in vitro fertilization for embryo transfer. Oocytes collected by aspiration and slicing in general have not yet reached the MII phase needed for in vitro fertilization so oocyte maturation is necessary. The purpose of this study was to determine the maturation level of bali cattle oocytes on TCM 199 medium with the addition of hypotaurine. Oocytes were derived from ovaries obtained from the Pesanggaran Denpasar abattoir and collected using the slicing method. This study used a completely randomized design consisting of 3 groups, namely group I / control (P0: maturation medium without hypotaurine), group II (P1: maturation medium with the addition of 2 mMol hypotaurine), and group III (P2: maturation medium with the addition of 4 mMol hypotaurine). Each group consisted of 27 replications. Oocyte maturation was carried out by 38.5 °C incubation, for 24 hours, with a pressure of CO2 of 5 %. The results showed that the cumulus cells expansion rate up to cumulus-oocyte complexes (COCs) stages in the P1 group were not significantly different than the P0 group (p> 0.05), but the P2 group showed a significant difference (p <0.05). In term of nuclear maturity, the addition of hypotaurine did not cause a significant difference (p> 0.05) at the GVBD level; but the MI level of the P0 was significantly different from that
ofP1 and P2 groups(p <0.05); while at the MII level, there was no significant difference between P0 and P1 (p> 0.05), and that P0 was significantly different to P2 (p <0.05). Collectively, it can be concluded that the addition of 4 mMol hypotaurine to TCM 199 oocyte maturation media increases the rate of expansion of cumulus cells reaching COCs and increase the level of nuclear maturity reaching the MII phase.
Keywords: Bali cattle; hypotaurine; maturation: oocyte
PENDAHULUAN
Teknologi dalam bidang reproduksi telah banyak dikembangkan untuk meningkatkan kualitas maupun kuantitas ternak, salah satunya dengan teknik In Vitro Fertilization (IVF) yang memerlukan oosit matang. In Vitro Maturation (IVM) merupakan salah satu tahapan penting dalam proses IVF, karena keberhasilannya sangat tergantung dari kualitas oosit yang di maturasi (Harissatria, 2012). Tingkat maturasi oosit dinilai berdasarkan dua kriteria yaitu pada tingkat maturasi inti (nuclear maturation) dan maturasi sitoplasma (cytoplasmic maturation) (Nurcahyo dan Ciptono, 2013). Proses maturasi nukleus erat kaitannya dengan aktivitas RNA yaitu ditandai dengan perubahan nukleus dari fase diplotene ke metaphase II (Yulnawati, 2006). Indikator keberhasilan maturasi oosit ditandai dengan adanya ekspansi kumulus oophorus (Ciptadi et al., 2011).
Keberhasilan proses maturasi atau pematangan oosit secara in vitro sangat ditentukan oleh jenis suplemen, kualitas oosit, dan media maturasi yang digunakan (Wattimena, 2011; Daoed et al., 2013), sedangkan menurut Sayuti et al. (2007) menyatakan bahwa diameter folikel sebagai tolak ukur keberhasilan IVM. Kemampuan maturasi oosit secara in vitro lebih rendah daripada in vivo (Adifa et al., 2010), sehingga medium maturasi oosit pada produksi embrio in vitro sering ditambahkan berbagai komponen, antara lain hormon gonadotropin, serum, dan antioksidan.
Dalam proses maturasi oosit akan terjadi metabolisme sel yang menghasilkan oksidan (radikal bebas) yang dapat menyebabkan kematian sel oleh karenanya penambahan antioksidan pada medium maturasi
merupakan hal yang sangat penting (Bintara et al., 2015; Argawal et al., 2005). Secara in vivo, kerusakan seluler akibat paparan radikal bebas dapat dicegah menggunakan endogenous antioksidan yang dimiliki oleh sel, contohnya enzim superoxide dismutase (SOD), catalase (CAT) dan glutathione (GSH) (Gupta et al., 2008). Namun pada proses in vitro, level dari endogenous antioksidan lebih rendah dibandingkan pada in vivo terutama pada saat kultur dari oosit dan embrio. Faktor rendahnya level endogenous antioksidan mengindikasikan perlunya dilakukan penambahan antioksidan pada media maturasi (Wang et al., 2007).
Hipotaurin (2 Amino ethane sulfinic Acid/C2H7NO2S) adalah salah satu antioksidan yang banyak ditemukan pada tuba falopii dan cairan folikel yang berfungsi mempertahankan embrio dari oksidatif stress (OS) (Guerin et al., 2001), melindungi kehidupan spermatozoa, proses kapasitasi dan fertilisasi dari kerusakan akibat peroksidasi (Guerinet et al., 1995), mencegah peroksidasi lemak membran (Tadolini et al., 1995), mencegah terjadinya reaksi H2O2 menjadi H2O + O2‾ oleh enzim superoxide dismutase (Pecci et al., 2000).
Penambahan hipotaurin pada beberapa media kultur telah dilaporkan. Pemayun et al. (2012) melaporkan penambahan hipotaurin dosis 4mM dan 8mM pada media kultur sel vesikula seminalis dan endometrium mampu meningkatkan produksi sel. Pada media perkembangan embrio secara in vitro, hipotaurin dilaporkan berperan melindungi kondisi lingkungan seperti peroksidasi lipid membran, kerusakan atau hambatan pembelahan embrio akibat radikal bebas yang terbentuk selama perkembangan embrio. Namun,
penggunaan hipotaurin sebagai antioksidan pada media maturasi oosit sapi bali belum pernah dilaporkan, maka perlu diteliti untuk mengetahui tingkat maturasi oosit sapi bali.
METODE PENELITIAN
Rancangan Penelitian
Rancangan peneltian yang digunakan dalam peneltian ini adalah Rancangan Acak Lengkap dengan 3 kelompok yaitu kelompok I (P0) tanpa hipotaurin, Kelompok II (P1) penambahan hipotaurin konsentrasi 2 mM dan kelompok III (P2) penambahan hipotaurin 4 mM dengan masing-masing kelompok terdiri dari 27 ulangan. Oosit yang akan dimaturasikan di koleksi dari ovarium yang berasal dari rumah potong hewan Pesanggaran. Penelitian dilakukan di Laboratorium Genetika dan Teknologi Reproduksi Fakultas Kedokteran Hewan Universitas Udayana.
Prosedur Kerja
Koleksi oosit dilakukan dengan teknik slicing (pencacahan) dari ovarium (Wang et al., 2007). Oosit yang terlepas dari ovarium langsung diamati di bawah mikroskop, dan oosit yang digunakan dalam pematangan adalah oosit yang dikelilingi oleh sel-sel kumulus kompak dan mempunyai sitoplasma yang homogen (Harissatria, 2012). Oosit yang diperoleh selanjutnya dipindahkan kedalam cawan petri yang telah berisi PBS untuk pencucian oosit. Oosit hasil koleksi ditempatkan pada cawan petri yang telah berisi media maturasi dan oosit selanjutnya ditambahkan dengan mineral oil sehingga menutupi seluruh permukaan media maturasi, kemudian diinkubasikan pada inkubator CO2 dengan temperatur 38,5oC dengan tekanan CO2 5% selama 24 jam.
Tingkat Maturasi Oosit
Indikator yang digunakan untuk menentukan tingkat maturasi oosit adalah tingkat ekspansi sel kumulus dan tingkat kematangan inti oosit. Pengamatan terhadap tingkat ekspansi sel kumulus dilakukan dengan mengamati tingkat perkembangan
sel kumulus yang mengelilingi oosit dan selanjutnya dilakukan skoring terhadap tingkat perkembangan sel kumulus (Ciptadi, 2011; Miclea et al., 2012). Untuk mengetahui tingkat kematangan inti dilakukan dengan cara terlebih dahulu membersihkan sel kumulus dari oosit dan selanjutnya dilakukan pengamatan terhadap inti oosit. Tingkat kematangan inti yang dapat diamati adalah germinal vesicle (GV), germinal vesicle breakdown (GVBD), metafase I dan metafase II (MII) (Vodkova et al., 2008; Davachi et al., 2014).
Analisis Data
Data yang diperoleh ditabulasikan dan diuji homogenitasnya menggunakan uji Levene dan normalitasnya menggunakan uji Kolmogorov-Smirnov selanjutnya dilakukan analisis statistik dengan menggunakan analisis varian (ANOVA). Bila terdapat perbedaan yang nyata (p<0,05) pengujian dilanjutkan dengan uji berganda Duncan. Penghitungan statistik dilakukan menggunakan program SPSS 25.0 for Windows.
HASIL DAN PEMBAHASAN
Hasil
Tingkat Ekspansi Sel Kumulus
Salah satu indikator kematangan oosit adalah tingkat ekspansi sel sel kumulus yang mengelilingi oosit. Tingkat ekspansi sel kumulus dibagi menjadi 3 yaitu : tingkat 1 (nude), dimana tidak ada lapisan sel kumulus yang mengelilingi oosit, tingkat 2 (partial), terjadi ekspansi sel kumulus yang mengelilingi sebagian dari dinding oosit dan tingkat 3 (ekspanded), terjadi ekspansi sel kumulus yang terdiri dari 5 lapis sel yang mengelilingi seluruh dinding oosit membentuk cumulus oocytes complexes (COCs).
Analisis secara statistik terhadap masing masing tingkat ekspansi sel kumulus menunjukkan bahwa pada ekspansi tingkat 1, tidak terdapat perbedaan yang nyata (P>0,05) antara kelompok kontrol dengan perlakuan 1 dan antara perlakuan 1 dengan perlakuan 2, namun antara kelompok
kontrol dengan perlakuan 2 terdapat perbedaan yang nyata (P<0,05).
Tingkat Kematangan Inti
Indikator tingkat kematangan oosit dapat dilihat dari tingkat kematangan intinya. Oosit matang yang siap di fertilisasi adalah oosit dengan tingkat kematangan inti mencapai fase M II (Tabel 2).
Analisis secara statistik terhadap tingkat kematangan inti setelah inkubasi selama 24 jam menunjukkan bahwa pada tingkat Germinal Vesicle Break Down (GVBD) tidak terdapat perbedaan yang nyata (P>0,05) diantara ketiga perlakuan yang diberikan, pada tingkat Metafase I (M I) tampak perbedaan yang nyata (P<0,05) antara perlakuan kontrol dengan perlakuan 1 dan perlakuan 2 sedangkan antara perlakuan 1 dan perlakuan 2 tidak terdapat perbedaan yang nyata (P>0,05), pada tingkat Metafase II ( MII) tampak tidak ada perbedaan yang nyata (P>0,05) antara perlakuan kontrol dengan perlakuan 1 sedangkan antara perlakuan kontrol dan perlakuan 1 tampak perbedaan yang nyata (P<0,05) dengan perlakuan 2.
Pembahasan
Dalam pelaksanaan produksi embrio secara in vitro melalui fertilisasi in vitro, maturasi oosit merupakan salah satu tahapan penting. Oosit yang akan difertilisasi secara in vitro dapat berasal dari ovarium yang diperoleh dari rumah potong hewan. Koleksi oosit dapat dilakukan secara aspirasi folikel, sayatan (dissection) maupun pencacahan (slicing, slashing) terhadap ovarium (Gabr et al., 2015). Oosit yang berhasil dikoleksi dari ovarium umumnya tidak dapat secara langsung digunakan dalam fertilisasi in vitro karena belum matang atau belum mencapai fase metafase II (M II), oleh karena itu perlu dilakukan pematangan (maturasi) oosit dalam media maturasi dan diinkubasikan pada temperatur 38,5 0C dengan tekanan oksigen 5 %.
Selama proses maturasi oosit pada temperatur dan tekanan oksigen tertentu akan menyebabkan terbentuk ROS (Reactive Oxygen Species) yang bersifat
oksidator dan dapat bereaksi dengan protein, asam nukleat, lemak dan molekul lain yang selanjutnya dapat merubah strukturnya sehingga terjadi kerusakan sel atau jaringan (Donelly et al., 2000; Van Soom et al., 2002). Reactive Oxygen Species dapat menyebabkan disfungsi mitokondria, kerusakan DNA, RNA, dan protein serta menghambat fusi sperma-oosit sampai menyebabkan apoptosis (Gupta et al., 2008). Untuk mengatasi terjadinya
kematian sel akibat adanya ROS selama proses maturasi oosit, pada media maturasi oosit ditambahkan antioksidan.
Dalam penelitian ini, penambahan hipotaurin dengan konsentrasi 4 mMol pada media maturasi oosit menghasilkan peningkatan prosentase oosit, baik persentase pada pada tingkat ekspansi sel cumulus (88,89 %) maupun pada fase MII (70,37 %). Hasil ini tidak jauh berbeda seperti yang dilaporkan oleh Puspitasari, et al., (2017) yang menambahkan a — tocopherol konsentrasi 100 μM pada media maturasi DMEM menyebabkan tingkat ekspansi sel kumulus mencapai 70,83 % dan fase MII mencapai 62,5 %. Bintara dkk. (2015) melaporkan bahwa penambahan β-mercaptoethanol konsentrasi 50 uM pada medium maturasi oosit domba diperoleh hasil 77.78% yang mencapai fase MII. Sejalan dengan fungsi hipotaurin sebagai antioksidan yang berperanan melindungi kondisi lingkungan seperti peroksidasi lipid membran dengan bereaksi terhadap OH* (Barnett and Bavister, 1992). Seperti yang dilaporkan oleh Murray (1993) dan Agrawal et al. (2005) bahwa dalam metabolisme sel diperlukan keseimbangan antara pro-oksidan dengan antioksidan, dan keseimbangan dapat berubah apabila terjadi peningkatan produksi oxygen species yang sangat besar. Perubahan ini bisa terjadi pada metabolisme normal untuk menghasilkan ATP melalui fosforilasi oksidatif dimitokondria dan dalam proses ini akan menghasilkan hasil sampingan berupa reactive oxygen species (ROS) yang
merupakan sekelompok senyawa oksigen yang bersifat reaktif.
Dalam kondisi normal, 85 - 90% oksigen diperlukan oleh mitokondria untuk menghasilkan ATP dan sekitar 1 - 3 % dari jumlah oksigen tersebut akan dirubah menjadi radikal superoksid anion (O*-) yang merupakan salah satu bentuk ROS melalui reaksi univalent (Halliwell and Gutteridge, 1999). Dilaporkan pula bahwa salah satu ROS yaitu OH* merupakan molekul reaktif yang dapat bereaksi dengan protein, asan nukleat, lipid yang selanjutnya akan merubah strukturnya dan akan menyebabkan kerusakan jaringan. Ion OH* juga dilaporkan dapat memodifikasi purin dan pirimidin dan akan menyebabkan kerusakan pada DNA (Donnelly et al., 2000). Hipotaurin juga dilaporkan banyak ditemukan pada cairan tuba falopii dan cairan folikel yang berfungsi
mempertahankan embrio dari oksidatif stress (OS) (Guerin et al., 2001), melindungi kehidupan spermatozoa, proses kapasitasi dan fertilisasi dari kerusakan akibat peroksidasi (Guerin et al., 1995), mencegah peroksidasi lemak membran (Tadolini et al., 1995), mencegah terjadinya reaksi H2O2 menjadi H2O + O2* oleh enzim superoxide dismutase (Pecci et al., 2000).
SIMPULAN DAN SARAN
Simpulan
Dari penelitian ini dapat disimpulkan bahwa penambahan hipotaurin 4 mM pada media maturasi oosit TCM 199 dapat meningkatkan tingkat ekspansi sel kumulus mencapai COCs dan meningkatkan tingkat kematangan inti mencapai fase MII.
Saran
Perlu dilakukan penelitian lebih lanjut terhadap fertilitas oosit hasil maturasi dan kualitas embrio yang dihasilkan melalui proses fertilisasi in vitro.
UCAPAN TERIMAKASIH
Terimakasih Diucapkan kepada Dekan dan Kepala Laboratorium Teknologi Reproduksi Fakultas Kedokteran Hewan
Universitas Udayana, atas fasilitas dan dukungan yang telah diberikan dalam penyelesaian penelitian ini.
DAFTAR PUSTAKA
Adifa NS, Astuti P, Widayanti DT. 2010. Pengaruh penambahan chorionic
gonadotropin pada medium maturasi terhadap kemampuan maturasi,
fertilisasi, dan perkembangan embrio secara in vitro kambing peranakan ettawa. Bul. Peternakan. 34(1): 8-15.
Agarwal A, S Gupta, RK. Sharma. 2005. Role of oxidative stress in femalereproduction. Reprod. Biol. Endocrinol. 3: 28.
Bintara OA, Setiadi MA, Karja NWK. 2015. Tingkat maturasi dan fertilisasi oosit domba yang dimaturasi dalam media dengan imbuhan b-
mercaptoethanol secara in vitro. J. Vet. 16(4): 585-591.
Ciptadi G, Susilawati T, Siswanto B, Karima HN. 2011. Efektifitas penambah hormon gonadotropin pada medium maturasi mSOF terhadap tingkat maturasi oosit. J. Ternak Trop. 12(1): 108-115.
Daoed DM, Ngadiyono N, Widayati DT. 2013. Pengaruh suplementasi fetal calf serum terhadap kemampuan maturasi in vitro oosit sapi. Bul. Peternakan. 37(3): 136-142.
Davachi ND, A Z Shahneh, H Kohram, M Zhandi, S Dashti, H Shamsi, R Moghadam. 2014. In vitro ovine embryo production: the study of seasonal and oocyte recovery method effects. Iran Red. Crescent. Med. J. 16(9): e20749.
Donnelly ET, Mcclure N, Lewis SEM. 2000. Glutathione and hypotaurine in vitro: effects on human sperm motility, DNA integrity and production of reactive oxygen species. Mutagenesis. 15(1): 6168.
Faraq IM, SM Girgis, WKB Khalil, NHA Hasan, AAM Sakr, SM Abd Allah, NI Ali. 2009. Effect of hormones, culture media and oocyte qualition in vitro
maturation of Egyptian sheep oocytes. J. Appl. Biosci. 24: 1520-1534.
Gabr Sh A, AE Abdel-Khalek, IT El-Ratel. 2015. Evaluation of some factors affecting quantity, quality and in vitro maturation of buffalo oocytes. Asian J. Anim. Vet. Adv. 10(1): 1-13.
Guerin P, EL Mouatassim, Y Menezo. 2001. Oxidative stress and protection against reactive oxygen species I the pre-implantasion embrio and its surroundings. Hum. Reprod. 7: 175-189.
Guerin P, J Guillaud, Y Menezo. 1995. Hypotaurin in sopermatozoa and genital secretions and its production by oviduc epithelia cells in vitro. Hum. Reprod. 10(4): 866-872.
Gupta S, Malhotora N, Sharma D, Chandra A, Agarwal A. 2008. Oxidative stress and its role in female infertility and assisted reproduction: clinical
implication. J. Fertil. Steril. 2(4): 147164.
Harissatria. 2012. Persentase kematangan oosit kerbau dengan penambahan sel folikel kerbau dan sapi secara in vitro. J. Ilmiah Tambua. 11(3): 342-348.
Miclea I, N Pacala, A Hettiq, M Zahan, V Miclea. 2012. Alpha-Tacopherol and ascorbic acid combination influence the maturation of sheep oocytes. Anim. Sci. Biotechnol. 45(1).
Nurcahyo H, Ciptono. 2013. Maturasi oosit dan fertilisasi in vitro menggunakan kultur sel granulosa folikel ovarium. Laporan Tahunan Hibah Bersaing. Universitas Negeri Yogyakarta. Yogyakarta.
Pecci L, Fontana M, S Dupre, M Costa, D Cavallini. 2000. Hypotaurine and
superoxide dismutase protection of enzyme against inactivation by
hydrogen peroxide and peroxidation to taurine. Adv. Exp. Med. Biol. 483: 163168.
Pemayun TGO, L Mahaputra, Ismudiono, Soetjipto. 2012. Kadar prostaglandin F2 alfa pada produk biakan sel monolayer
vesikula seminalis dan endometrium sapi bali dengan penambahan hipotaurin. J. Ked. Hewan. 6(1): 11-15.
Puspitasari E, Trilaksana IGNB, Pemayun TGO. 2017. Penambahan α-tocopherol pada media DMEM sebagai media maturasi oosit sapi bali hasil koleksi dari ovarium. Tesis. Magister Kedokteran Hewan Fakultas Kedokteran Hewan Universitas Udayana. Denpasar.
Sayuti A, TN Siregar, M Akmal, Hamdan, Hamdani. 2007. Pengaruh ukuran dan jumlah folikel per ovari terhadap kualitas oosit kambing lokal. J. Ked. Hewan. 1(1): 36-42.
Tadolini B, G Pintus, GG Pinna, F Bennardini, F Franconi. 1995. Effects of taurine and hypotaurine on lipid peroxidation. Biochem. Biophys. Res. Commun. 213: 820-826.
Vadková, R Rajmon, J Petr, P Klabanová, F Jílek. 2008. Effect of genistein and genistin on in vitro maturation of pig oocytes. Czech J. Anim. Sci. 53(1): 1-8.
Van Soom A, Yuan YQ, Peelman IJ, de Matos DG, Dewulf J, Laevens H, de Kruif A. 2002. Prevalence of apoptosis and inner cell allocation in bovine embryos cultured under different oxygen tensions with or without cysteine addition. Theriogenol. 57(5): 1453-1465.
Wang ZG, SD, Yu, ZR, Xu. 2007. Effect of collection methods on recovery efficiency, maturation rate and subsequent embryonic developmental competence of oocytes of oocytes in holstein cow. Asian-Aust. J. Anim. Sci. 20(4): 496-500.
Wattimena J. 2011. Pematangan oosit domba secara in vitro dalam berbagai jenis serum. J. Agrinimal. 1: 22-27.
Yulnawati. 2006. Optimalisasi produksi embrio domba secara in vitro: penggunaan medium cr1aa dan pengaruh status reproduksi ovarium. Tesis. Sekolah Pascasarjana, Institut Pertanian Bogor. Bogor.
Tabel 1. Tingkat ekspansi sel kumulus setelah inkubasi 24 jam
|
Jumlah Kelompok Oosit |
Jumlah (Persentase) 1 2 3 |
|
P0 27 P1 27 P2 27 |
7 (25.92)a 10 (37.03)a 10 (37.03)a 5 (18.52)ab 8 (29.63)ab 14 (51.85)a 1 (3.70)b 2 (7.41)b 24 (88.89)b |
Notasi huruf superskrip yang berbeda pada satu kolom menunjukkan perbedaan yang nyata (P<0,05).
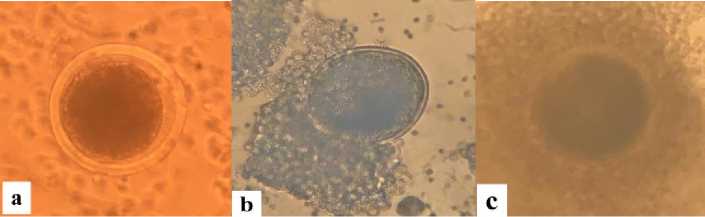
Gambar 1. Tingkat ekspansi sel cumulus : (a) Ekspansi tingkat 1 (Nude), (b) Ekspansi Tingkat 2 (Parsial), (c) Ekspansi Tingkat 3 (COCs).
Tabel 2. Tingkat kematangan inti setelah inkubasi 24 jam
Jumlah (Persentase) Tingkat Maturasi Inti Oosit
Kelompok Jumlah Oosit GV GVBD M I M II
|
P0 |
27 |
- 7 (25.93)a |
13 (48.15)a |
7 (25.93)a | |
|
P1 |
27 |
- |
5 (18.52)a |
12 (44.44)b |
10 (37.04)a |
|
P2 |
27 |
- |
3 (11.11)a |
5 (18.52)b |
19 (70.37)b |
Notasi huruf superskrif yang berbeda pada satu kolom menunjukkan perbedaan yang nyata (P<0,05).
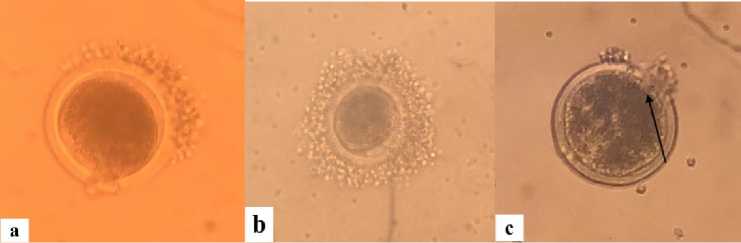
Gambar 2. Berbagai tingkat kematangan inti oosit : (a) GVBD, (b) MI, (c) MII Tanda panah menunjukkan polar body.
530
Discussion and feedback