EXPRESSION OF GROWTH HORMONE RECEPTOR GENE ON BALI CATTLE AND WAGYU CATTLE MUSCLE
on
Buletin Veteriner Udayana Volume 14 No. 2: 69-78
pISSN: 2085-2495; eISSN: 2477-2712 April 2022
Online pada: http://ojs.unud.ac.id/index.php/buletinvet DOI: 10.24843/bulvet.2022.v14.i02.p02
Terakreditasi Nasional Sinta 4, berdasarkan Keputusan Direktur Jenderal Pendidikan Tinggi, Riset, dan Teknologi No. 158/E/KPT/2021
Ekspresi Gen Reseptor Growth Hormon pada Otot Sapi Bali dan Sapi Wagyu
(EXPRESSION OF GROWTH HORMONE RECEPTOR GENE ON BALI CATTLE AND WAGYU CATTLE MUSCLE)
Ni Ketut Suwiti1*, Putu Henrywaesa Sudipa2, Ni Luh Eka Setiasih1 1Laboratorium Histologi Veteriner, Fakultas Kedokteran Hewan Universitas Udayana, Jl. PB Sudirman Denpasar, Bali;
2Laboratorium Bakteriologi dan Mikologi Veteriner, Fakultas Kedokteran Hewan Universitas Udayana, Jl. PB Sudirman Denpasar, Bali.
*Email: nk_suwiti@unud.ac.id
Abstrak
Penelitian ini bertujuan untuk mengetahui berat molekul dan sebaran protein reseptor Growth Hormon (GHR). Sampel yang dipakai adalah otot rib eye sapi bali dan sapi Wagyu. Pemeriksaan berat molekul protein reseptor memakai metode SDS-PAGE, Western Blotting, dan pengecatan Imunohisto kimia. Hasil penelitian menunjukkan, bahwa berat protein reseptor Growth Hormon adalah 76 Kdalton pada kedua jenis sapi tersebut dan rerata nilai IHK-Score untuk otot sapi wagyu adalah 234,5 dan pada sapi Bali adalah 199,6. Dapat disimpulkan, bahwa berat molekul protein reseptor Growth Hormon otot rib eye pada kedua sapi Wagyu dan sapi bali adalah sama dengan sebaran yang tidak sama.
Kata kunci: Reseptor growth hormon; western blotting; imunohisto kimia.
Abstract
This study aims to study the molecular weight and distribution of protein growth hormone receptors (GHR). The sample used was the Balinese beef eye ribs and Wagyu beef muscle. Molecular weight examination using the SDS-PAGE receptor method, Western Blotting, and immunohistochemistry staining. The results showed that the weight of the growth hormone receptor protein was 76 Kdalton in both types of cattle and the average score of IHK for Wagyu beef muscle was 234.5 and in Bali cattle was 199.6. It can be concluded, namely the weight molecule of the growth hormone receptor muscle ribs in both Wagyu and bali cattle with equal distribution.
Keywords: Receptor growth hormone; western blotting; immunohistochemistry
PENDAHULUAN
Seiring dengan pertumbuhan penduduk yang sangat pesat dan disertai dengan kesadaran penduduk yang semakin tinggi tentang pentingnya protein hewani, maka perlu diimbangi dengan penyediaan sumber protein yang memadai. Salah satu bahan pangan asal ternak yang merupakan sumber protein bagi masyarakat adalah daging (Agustina et al., 2017).
Daging merupakan bahan pangan yang penting dalam memenuhi kebutuhan gizi protein daging berupa asam amino esensial yang lengkap dan seimbang (Lawrie, 2003). Sapi bali dinyatakan dapat
menghasilkan daging yang berkualitas prime (56,6%) dengan kadar lemak rendah (2,0%-6,9%), ironisnya daging sapi bali tidak memberikan kontribusi kepada masyarakat dalam hal ini peternak sapi bali (Besung et al., 2019). Bali sebagai pusat pariwisata hanya memberikan keuntungan kepada sebagian masyarakat yang mempunyai keahlian di bidang pariwisata. Sedangkan masyarakat bali yang kebanyakan adalah peternak tidak merasakan dampak dari perkembangan pariwisata tersebut. Karena satu-satunya keahlian yang dimiliki yakni beternak dan hasil produksi ternak (berupa daging) tidak
mampu menembus hotel dan restaurant yang ada di Bali bila dibandingkan daging sapi Wagyu dari Kobe Jepang.
Menurut Lawrie (2003), menyatakan protein dalam daging dapat berkisar antara16-22% protein. Protein merupakan suatu persenyawaan yang khas yang ditemukan di dalam sel dan merupakan komponen terbesar dalam membrane sel. Terdapat tiga jenis otot, yaitu: otot polos merupakan bagian kontraktil seperti pada dinding alat jeroan, otot sekelet (otot rangka) yang melekat pada tubuh, berorigo dan berinsersio pada bungkul tulang dan otot jantung yang merupakan dinding jantung. Otot yang terdapat pada bagian paha adalah otot skelet (otot rangka). Apabila otot skelet dilihat dibawah mikroskop cahaya, tampak serat-serat otot skelet berbentuk silindris dan panjang serta diameter nya sangat beragam (Junqueira dan Carneiro, 1980).
Keempukan dan tekstur daging kemungkinan besar merupakan penentu yang paling penting pada kualitas daging. Faktor yang mempengaruhi kualitas keempukan daging digolongkan menjadi faktor antemortem, seperti genetik, termasuk bangsa, spesies dan fisiologis, umur, manajemen, jenis kelamin dan stress, dan faktor postmortem yang diantaranya meliputi metode chilling, refrigasi, pelayuan dan pembekuan. Selain itu kualitas daging juga dipengaruhi oleh rasio kandungan lemak di antara kelompok daging akan memutuskan serat daging, protein, jenis protein, suhu pengolahan, kadar air dan aktivitas air (Soeparno, 2005).
Teknik pemisahan protein, seperti SDS-PAGE, biasanya digunakan untuk mengukur kemajuan proses pemurnian protein, termasuk untuk mengetahui adanya pola (pita-pita) protein yang ada di dalam daging. Metode ini adalah metode analisis yang memiliki daya pisah tinggi. Molekul elektroforesis SDS-PAGE dapat memisahkan protein-protein yang memilki berat molekul berbeda (Susanto, 2010). Aliran molekul-molekul protein di dalam
protein di dalam gel akan membentuk pola (pita) protein. Protein homogeny akan menghasilkan satu pita, sedangkan sub-unit yang ukurannya berbeda akan menghasilkan banyak pita (Hames dan Rickwood, 2004).
Pemisahan molekul protein oleh SDS -PAGE adalah masih kasar hanya dapat menetukan berat molekulnya saja, untuk mengetahui molekul protein lebih spesifik dapat dilanjutkan dengan metode Western Blotting. Western blotting merupakan teknik untuk mendeteksi protein spesifik pada sampel jaringan yang homogenat ataupun dari suatu ekstraksi berdasarkan kemampuan protein tersebut berikatan dengan antibodi. Teknik ini menggunakan gel elektroforesis untuk memisahkan protein berdasarkan panjang polipeptida atau berdasarkan struktur 3D-nya. Protein tersebut kemudian ditransfer ke sebuah membran, biasanya nitroselulosa atau PVDF, dimana mereka kemudian akan dilacak dengan menggunakan antibodi yang spesifik kepada protein target. Western blot dapat mendeteksi berat molekul protein. Metoda Western blot merupakan proses pemindahan protein dari gel hasil elektroforesis ke membran. Membran ini dapat diperlakukan lebih fleksibel daripada gel sehingga protein yang terblot pada membran dapat dideteksi dengan cara visual maupun fluoresensi. Deteksi ekspresi protein pada organisme dilakukan dengan prinsip imunologi menggunakan antibodi primer dan antibodi sekunder (Tahrin dan Yang, 2012; Ellen, 2012).
METODE PENELITIAN
Karakterisasi Protein dengan SDS-PAGE
Pembuatan gel pemisah (running gel) konsentrasi 10% terdiri dari: 14 ml akrilamid stock 30% ditambah 10 ml aquades; 5 ml larutan 3 M Tris HCL pH 8,9; 0,4 larutan Sodium Dodecyl Sulphate (SDS) 10%; 0,02 ml TEMED; 14,4 ml aquades dan 0,4 ml larutan ammonium persulfat (0,5
g dalam 4,5 ml aquades. Preparasi sampel menggunakan buffer disosiasi (Dissociation Buffer) yang terdiri dari 10 ml SDS 10%; 5 ml gliserin; 5 ml Tris HCL 0,5 M pH 8,8; 0,5 ml bromphenol blue; 0,5 2-Mecaptoethanol; 10 ml aquades. Proses pemisahan protein menggunakan buffer pemisah (running buffer) yang terdiri dari Tris HCL 0,025 M/L; glycine 0,192 M/L dan SDS 0,1% pH 8,8. Pemisahan dilakukan pada kekuatan arus 30 sampai 40 mA selama 4 jam atau jika zat warna contoh telah hampir sampai (jangan sampai melewati) ujung bawah sel pemisah. Setelah elektroforesis selesai, gel difiksasi dengan larutan Tricloroacetic acid (TCA) konsentrasi 12% selama 24 jam. Gel diwarnai dengan larutan 0,25% biru komasi yang dilarutkan dalam 55 methanol dan 7,5% asam cuka dalam 1 liter aquades. Pewarnaan dilakukan dengan merendam gel dengan pewarnaan biru komasi (sambil digoyang-goyang di atas titertek), setelah itu, gel dipucatkan dengan larutan yang terdiri dari campuran methanol, asam cuka dan aquades dengan perbantingan 5:4:1 sambil digoyang-goyangkan sampai terlihat pita protein. Jika sudah terlihat adanya pola (pita-pita) protein, proses pemucatan dihentikan dan untuk keperluan perhitungan Rf pergerakan masing-masing protein dan warna pelacak dapat diukur dan dicatat dengan rumus berikut
Jarak pergerakan pita protein dari tempat awal Jarak pergerakan warna pelacak dari tempat awal
Western Blotting
Basahi noda kering dengan metanol jika blot dibuat dengan PVDF , atau direndam dengan PBS jika blot terbuat dari nitroselulosa. Bilas sampai 4x dengan PBS untuk menyingkirkan metanol, Tempatkan blot untuk blotting yaitu 4,1 % susu skim (dengan pengencer PBS) selama 10 menit (beberapa protein membutuhkan persentase yang lebih tinggi dari susu skim misalnya 5 % dan inkubasi di ruang dingin lebih lama misalnya 30 menit), total 10 ml antibodi primer (Kit antibody eBioscience ; GHR 100µl bs-0654R, Lot YE0604W) diencerkan dengan konsentrasi yang tepat
dengan PBS (susu + 0.2 %) 1 jam, 3x 10 menit setiap PBST, 1:5000 pengenceran sekunder (memilih secondaryeither kambing anti dengan kelinci yang tepat , atau kambing dengan anti tikus) 30 menit, cuci sampai 5x PBST selama 5 - 10 menit. Analisis data dengan membandingkan berat moleklul marker standar
Pewarnaan Imunnohistokimia
Pewarnaan ini memakai metode Avidin Biotin Complex (ABC). Metode ini merupakan modifikasi dari metode imunoperoksidase tidak langsung. Antibodi primer langsung berikatan dengan antigen, selanjutnya antibodi primer berikatan dengan antibodi sekunder yang telah mengalami biotinisasi. Avidin adalah glikoprotein yang mempunyai afinitas ikatan yang tinggi dengan biotin (Dabbs, 2013). Setiap ujung lengan antibodi sekunder telah terkonyugasi dengan biotin yang dapat berikatan dengan molekul avidin. Salah satu molekul avidin mengikat empat molekul biotin (Kim et al., 2003). Waktu pengenceran antibodi sekunder, juga dilakukan pencampuran antara biotin yang diikatkan dengan peroksidase dengan avidin selama 30 menit. Setelah antibodi primer dan sekunder berikatan dimana lengan-lengan antibodi sekunder terikat biotin, selanjutnya campuran kompleks avidin-biotin (ABC) ini diteteskan pada preparat. Biotin pada antibodi sekunder langsung berikatan dengan kompleks tersebut membentuk kompleks ABC melalui avidin (Bancrot dan Gamble, 2008; Kumar et al., 2009).
Analisis Data
Data yang diperoleh berupa deskriptif kualitatif yaitu intensitas organ menyerap zat warna. Sedangkan sebaran protein reseptor hormon pertumbuhan dihitung dengan cara melihat 5 lapang pandang dengan menggunakan pembesaran 10 x 40. Skor IHK dihitung menggunakan rumus modifikasi menurut Lenny et al. (2007). Intensitas pewarnaan IHK, dinilai perlapang pandang:
0 : Negatif (tidak ada terwarnai)
1+ : Lemah
2+ : Sedang
3+ : Kuat
Setiap pewarnaan dihitung jumlah sel dalam persen, dihitung perlapang pandang Menggunakan rumus berikut
IHK H-Score [1 X (% sel 1+) + 2 X (% sel 2+) + 3 X (%sel1+)]
HASIL DAN PEMBAHASAN
Hasil
SDS-PAGE Protein
Untuk pemeriksaan karakterisasi protein memakai metode SDS-PAGE, didapatkan bahwa berdasarkan hasil pengukuran laju pita-pita protein standart marker pada gel eletrophoresis dan mengacu pada berat molekul protein standar marker dengan laju
loading dya (pewarna) adalah 5 cm. Setelah menghitung persamaan regresi untuk menghitung berat molekul protein daging Wagyu dan daging sapi bali yang mengacu pada regresi linier protein standar marker disajikan pada Tabel 2 dan Tabel 3. Visualisasi gel elektroforesis ditampilkan pada Gambar 2 dan 3. Sementara hasil visualisasi Western Blotting ditampilkan pada Gambar 4. Hasil pengamatan preparat histologi dengan memakai pengecatan imunnohistokimia adalah berupa foto mikroskop disajikan pada Gambar 5 dan Gambar 6. Data skoring imunohistokimia otot sapi Wagyu dan sapi bali disajikan pada Tebel 4 dan 5. Diketahui rerata nilai IHK-H Score untuk otot sapi wagyu adalah 234,5 dan pada sapi Bali adalah 199,6.
Chart Title
Linear (Series1)
Rf
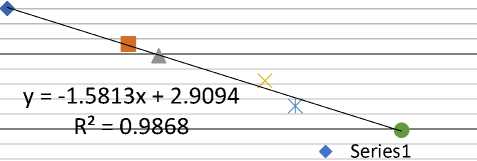
Gambar 1. Kurve regresi log BM marker standar, y adalah log berat molekul, x adalah nilai Rf. Nilai R2 prediksi menunjukan berat molekul yang dihitung mendekati kebenaran karena nilai R2 mendekati satu.
Tabel 1. Berat molekul protein standar marker
|
Pita |
Jarak (cm) |
Rf |
BM (Kdalton) |
Log BM |
|
1 |
1,9 |
0,38 |
200 |
2,30103 |
|
2 |
2,7 |
0,54 |
116,250 |
2,06539 |
|
3 |
2,9 |
0,58 |
97,400 |
1,9886 |
|
4 |
3,6 |
0,72 |
66,200 |
1,8209 |
|
5 |
3,8 |
0,76 |
45 |
1,6532 |
|
6 |
4,5 |
0,9 |
31 |
1,4914 |
Tabel 2. Berat molekul protein daging Wagyu
|
Pita |
Jarak (cm) |
Rf |
BM (Kdalton) |
Log BM |
|
1 |
1,5 |
0,3 |
272,2764 |
2,43501 |
|
2 |
2,3 |
0,46 |
152,0554 |
2,1820 |
|
3 |
3,1 |
0,61 |
76,0529 |
1,8973 |
|
4 |
3,4 |
0,68 |
68,2521 |
1,8341 |
|
5 |
3,8 |
0,76 |
51,0049 |
1,7076 |
|
6 |
4,5 |
0,9 |
30,6358 |
1,4862 |
|
Tabel 3 |
. Berat molekul protein daging Sapi Bali | |||
|
Pita |
Jarak (cm) |
Rf |
BM (Kdalton) |
Log BM |
|
1 |
1,8 |
0,36 |
218,8426 |
2,3401 |
|
2 |
2,7 |
0,54 |
113,6313 |
2,0555 |
|
3 |
2,9 |
0,58 |
98,2304 |
1,9922 |
|
4 |
3,1 |
0,61 |
76,0529 |
1,8973 |
|
5 |
3,8 |
0,76 |
51,0049 |
1,7076 |
|
6 |
4,0 |
0,8 |
44,0920 |
1,6443 |
|
7 |
4,5 |
0,9 |
30,6358 |
1,4862 |
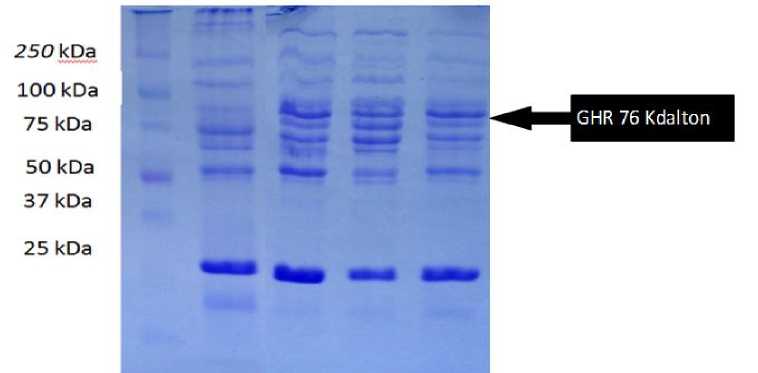
Gambar 2. Visualisasi gel eletroforesis protein otot sapi wagyu
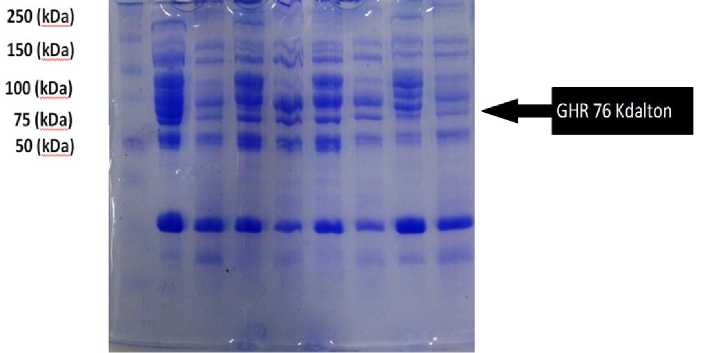
Gambar 3. Visualisasi gel eletroforesis protein otot sapi bali
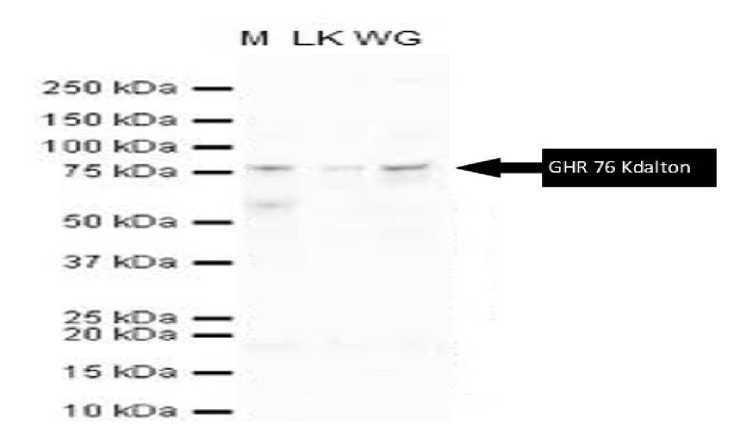
Gambar 4. Visualisasi Western Blotting, WG: Protein daging sapi wagyu, LK: Protein daging sapi lokal; M: Marker (antibodi sekunder GHR_reseptor), analisis reseptor growth hormon setelah dipisahkan dengan membran sellulose setelah diinkubasi dengan antibodi primer (anti reseptor GHR) mempunyai berat molekul 76 Kdalton.
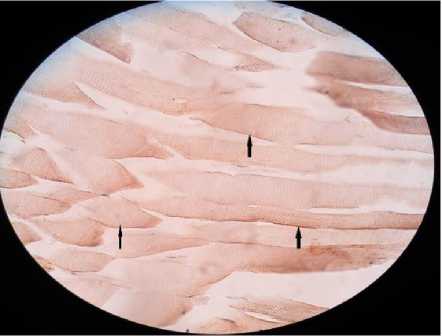
Gambar 5. Jaringan otot sapi bali dengan antibodi primer, tanda panah menunjukkkan protein reseptor GRH.

Gambar 6. Jaringan otot sapi wagyu dengan antibodi primer, tanda panah menunjukkan protein reseptor GRH.
Tabel 4. Data skoring imunohistokimia otot sapi Wagyu
|
No |
Lemah (1+) % |
Sedang (2+) % |
Kuat (3+) % |
Negatif (0+) % |
Total (Jml. sel) |
Skor IHK |
|
1 |
20 (3/15) |
27 (4/15) |
53 (8/15) |
- |
15 |
233 |
|
2 |
8 (1/13) |
38 (5/13) |
54 (8/13) |
- |
13 |
246 |
|
3 |
13 (2/15) |
33 (5/15) |
53 (8/15) |
- |
15 |
238 |
|
4 |
7 (1/15) |
40 (6/15) |
53 (8/15) |
- |
15 |
246 |
|
5 |
22 (4/18) |
33 (6/18) |
45 (8/18) |
- |
18 |
223 |
|
6 |
19 (3/16) |
37 (6/16) |
44 (7/16) |
- |
16 |
225 |
|
7 |
22 (4/18) |
45 (8/18) |
33 (6/18) |
- |
18 |
211 |
|
8 |
12 (2/17) |
23 (4/17) |
65 (11/17) |
- |
17 |
253 |
|
9 |
5 (1/18) |
39 (7/18) |
56 (10/18) |
- |
18 |
251 |
|
10 |
24 (5/21) |
33 (7/21) |
43 (9/21) |
- |
21 |
219 |
Tabel 5. Data skoring imunohistokimia otot sapi Bali
|
No |
Lemah (1+) % |
Sedang (2+) % |
Kuat (3+) % |
Negatif (0+) % |
Total (Jml. sel) |
Skor IHK |
|
1 |
17 (4/24) |
62 (15/24) |
21 (5/24) |
- |
24 |
204 |
|
2 |
28 (7/25) |
62 (15/24) |
24 (6/25) |
- |
25 |
196 |
|
3 |
31 (11/36) |
48 (12/25) |
22 (8/36) |
- |
36 |
191 |
|
4 |
23 (7/30) |
47 (17/36) |
17 (5/30) |
- |
30 |
194 |
|
5 |
32 (10/31) |
60 (18/30) |
20 (6/31) |
- |
31 |
188 |
|
6 |
32 (9/28) |
48 (15/31) |
25 (7/28) |
- |
28 |
193 |
|
7 |
21 (6/28) |
43 (12/28) |
36 (10/28) |
- |
28 |
215 |
|
8 |
15 (4/27) |
55 (15/27) |
30 (8/27) |
- |
27 |
215 |
|
9 |
36 (9/25) |
40 (10/25) |
24 (6/25) |
- |
25 |
188 |
|
10 |
23 (6/26) |
42 (11/26) |
35 (9/26) |
- |
26 |
212 |
Pembahasan
Hasil visualisasi pada kertas cellulose western blotting menunjukan berat molekul adalah 76 Kdalton (Gambar 4). Protein GHR dengan berat molekul 76 KDalton pada jaringan otot menunjukkan bahwa pada otot sapi Wagyu dan sapi Bali mempunyai berat molekul hampir sama. Hal ini menunjukan bahwa dalam genus yang sama walaupun spesies berbeda tetap menujukan berat molekul reseptor GHR sama hanya kemampuan kuantitas ekspresi gen yang berbeda. Ini ditunjukan pada visualisasi elektroforesis dimana bend (pita) pada sapi bali lebih tipis dibandingkan dengan sapi Wagyu, hal ini menjadi dasar untuk mengetahui secara jelas mekanisme growth hormone dalam mengatur pertumbuhan dan metabolisme tubuh. Growth hormone memainkan peran dalam mengatur pertumbuhan dan komposisi tubuh (Zulkharnaim et al., 2010). Hormon pertumbuhan pada sapi (bovine somatotropin) dipengaruhi oleh faktor lingkungan dan faktor genetis. Faktor lingkungan meliputi: pakan, baik hijauan maupun konsentrat, air, iklim dan fasilitas pemeliharaan yang lain. Pengaruh pertumbuhan yang disebabkan faktor lingkungan ini tidak diturunkan kepada anakan. Sedangkan faktor genetis yang dikendalikan oleh gen akan diturunkan kepada keturunannya.
Pertumbuhan dikendalikan oleh beberapa gen, baik yang pengaruhnya besar/utama (major gene) sampai yang
pengaruhnya kecil (minor gene). Salah satu gen yang diduga merupakan gen utama dalam mempengaruhi pertumbuhan adalah gen pengkode hormon pertumbuhan yang mempengaruhi sekresi hormone pertumbuhan. Gen hormon pertumbuhan sapi (bovine growth hormone gene) telah dipetakan terletak pada kromosom 19 dengan lokasi q26-qtr (Purwoko dkk., 2003). Sekuen gen ini terdiri dari 1793 bp yang terbagi dalam lima ekson dan dipisahkan oleh 4 intron. Intron A, B, C dan D berturut-turut terdiri dari 248 bp, 227 bp, 227 bp dan 274bp.
Mekanisme kerja hormone bovine somatotropin merupakan polypeptida bercabang yang mempunyai 416 asam-amino (Hediger, 1990). Hormon ini mempunyai efek terhadap membran sel. Fungsi hormon ini diantaranya sebagai pemicu untuk membentuk dan meningkatkan konsentrasi cAMP sebagai proses terjadinya utusan kedua (second messenger) yang diikuti oleh proses-proses biologis lainnya; meningkatkan asam-amino ke dalam otot, ginjal dan fibroplast dan juga dapat menyebabkan lypolysis pada jaringan lemak yang dibantu oleh hormon lain seperti tiroksin dan glucocorticoid. Mekanisme kerja Somatotropin dalam memperbaiki performans laktasi yaitu dengan perubahan pembagian penyerapan zat makanan, pertambahan lemak dikurangi, mobilisasi lemak ditingkatkan dan penggunaan glukosa oleh jaringan peripheral dan
oksidasi glukosa dan asam-amino dikurangi. Akibatnya glukosa dan asam-amino menjadi tersedia untuk sintesis komponen susu serta cadangan lemak digunakan sebagai sumber energi. Selain itu respons ternak terhadap bST (bovine somatotropin) adalah peningkatan pengeluaran darah dari jantung (cardiac output) dan laju aliran darah ke ambing (mammary blood flow).
Respons-respons ini yang menyebabkan peningkatan pemasukan zat makanan. Growth hormone secara nyata mempunyai efek biologik yang dipengaruhi oleh insulin-like growth factor I (IGF-I) dalam meningkatkan pertumbuhan otot skelet (Jiang dan Ge, 2014) Pemberian faktor pertumbuhan secara in vivo pada ayam pedaging menyebabkan peningkatan kecepatan pertumbuhan dan massa otot sebesar 15 % dan diperlukan pakan 6,5 % lebih sedikit dari pakan normal. Peningkatan pertumbuhan ini mempunyai implikasi dan daya tarik yang besar bagi dunia perunggasan. Tetapi pola ekspresi gen faktor pertumbuhan selama massa pertumbuhan sampai saat ini belum diketahui secara jelas (Purwoko dkk., 2003).
Protein STAT berperan penting dalam regulasi transkripsi gen oleh GH dan sitokin lain yang mengaktifkan Janus Kinase (JAK). Protein STAT yang semula diidentifikasi dalam jalur signaling interferon. Faktor sitoplasmik yang mengandung domain SH-2. Pada fosforilasi tirosil yang sering melalui kaskade berinisiasi JAK kinase, protein STAT sitoplasma membentuk suatu kompleks dengan protein STAT lain melalui interaksi tirosin yang mengalami fosforilasi pada domain SH-2, mengadakan translokasi menuju ke nukleus, berikatan dengan DNA dan selanjutnya mengaktifkan transkripsi pada gen sasaran (Schindler et al., 2007).
Hormon pertumbuhan (somatotropin, somatotropic hormone) sebagaimana hormon protein lainnya sangat berbeda susunan kimianya pada setiap spesies.
Hormon pertumbuhan manusia terdiri dari rantai polipeptida tunggal yang tersusun atas 191 asam amino dengan berat molekul 21-22 kD. (Listrat et al., 2005). Sintesis GH sebagaimana sintesis protein terletak pada gen yang terdapat di kromosom 17. Bagian intron dari DNA akan ditranskripsi menjadi precursor mRNA. Precursor mRNA kemudian mengalami excision dan splicing membentuk mature mRNA. Matur mRNA inilah yang kemudian ditranslasi menjadi preprohormon. Selanjutnya preprohormon diproses menjadi prohormon dan kemudian menjadi GH yang siap untuk disekresi. Sekresi growth hormon dibawah control neural dari hypothalamus melalui sedikitnya dua dan mungkin tiga faktor hypophysiotropic yaitu growth hormone realeasing hormone (GHRH), somatostatin, dan ghrelin. Growth hormone disekresi dalam suatu pola pulsatil, meningkat dan menurun. Mekanisme yang mengatur sekresi growth hormone secara tepat belum sepenuhnya dipahami, namun beberapa faktor yang berkaitan dengan nutrisi dan stress dapat merangsang sekresinya, yaitu (1) kelaparan, terutama pada difisiensi protein berat, (2) hipoglikemia atau juga rendahnya konsentrasi asam lemak dalam darah, (3) latihan atau olah raga (4) ketegangan dan (5) trauma. Growth hormone juga secara khas meningkat pada 2 jam pertama tidur lelap. Seabaliknya pada keadaan dimana terjadi peningkatan. (Li J et al., 2002).
Growth hormone receptor (GHR) adalah anggota famili reseptor membran termasuk reseptor berbagai sitokin (interleukin dan interferon). Penentuan letak seluler reseptor GH sangat penting untuk mengetahui target kerja GH. Pertama kali dideteksi mRNA reseptor GH dengan northing blotting pada limfa, bursa fabricius dan thymus unggas domestik. Analisis dengan polymerase chain reaction (PCR) menunjukkan bahwa sequence mRNA yang mengkode domain intraseluler dan ekstraseluler reseptor GH ada pada semua jaringan dengan homologi tertinggi
pada transkripsi hepatik. Pada tikus GH akan mengikat reseptor pada plasma membran. Kompleks GH- GHR (growth hormone reseptor) adalah bagian dari recycle dimana reseptor selalu disintesis oleh golgi apparatus dan kemudian ditransfer ke plasma membran. Kadar GHR plasma meningkat sesuai dengan pulsatil GH plasma. Reseptor yang disekresi golgi apparatus dengan yang ada dalam plasma membran akan disesuaikan dengan pulsatil GH sehingga dapat disimpulkan bahwa GHR banyak terdapat di golgi apparatus dan kemudian ditransfer ke plasma membran yang selnya peka terhadap GH (Li J et al.. 2002; Schhindler et al., 2007).
Efek GH sangat dipengaruhi oleh terikat tidaknya GH dengan GHR. Mutasi gen GHR (deletions, abnormal splicing, missense mutation) akan menurunkan atau mencegah pengikatan GH ditempat target. Ayam sex linked dwarf (SLD) mengalami ganguan pertumbuhan padahal GH plasma normal dan bahkan berlebih. Ternyata serum ayam SLD mengandung sejumlah besar protein binding yang homolog dengan GHR sehingga GH banyak yang tidak terikat pada reseptor dan akibatnya tidak ada efek pertumbuhan (Marcio et al., 2016). Hasil pewarnaan imunohistokimia sebaran ekspresi gen yang menyandi protein reseptor GHR pada otot skelet sapi bali terlihat lebih sedikit dan tidak merata, hal ini terjadi karena komplek GHR dengan anti GHR yang membawa zat pewarna lebih sedikit dibandingkan sapi Wagyu. Peneliti Vleuric et al. (1996), bahwa distribusi protein reseptor GHR pada setiap lobus organ hati ayam adalah tidak sama.
SIMPULAN DAN SARAN
Simpulan
Dari hasil penelitian dapat disimpulkan berat molekul reseptor GHR pada sapi Wagyu dan sapi bali adalah 76 Kdalton dan skor IHK-H pada sapi Wagyu adalah 234,5 dan pada sapi bali adalah 199,6.
Saran
Perlu dilakukan penelitian lanjutan untuk mengetahui pengaruh Gen Reseptor Growth Hormon terhadap kualitas daging sapi.
UCAPAN TERIMA KASIH
Terima kasih kepada UNUD yang telah menyetujui penelitian ini melalui dana BOPTN UNUD dengan surat perjanjian penugasan No. 104.22 /UN
14.2/PNL.01.03.00 / 2014
DAFTAR PUSTAKA
Agustina KK, Cahya IMRD, Widyantara GM, Swacita IBN, Dharmayudha
AAGO, Rudyanto MD. 2017. Nilai gizi dan kualitas fisik daging sapi bali berdasarkan jenis kelamin dan umur. Buletin Vet. Udayana. 9(2): 156-163.
Banroft JD, Gable M. 2008. Theory and practice of histological techniques: Immunohistochemical. 5th Ed. Merck.
Besung INK, Watiniasih NL, Mahardika GNK, Agustina KK, Suwiti NK. 2019. Mineral levels of bali cattle (bos javanicus) from four different type of land in different rearing areas. Biodiversitas. 20(10): 2931
2936.
Dabbs DJ. 2013. Diagnostic
immunohistochemistry: Theranostic
and genomic app;ication: Techniques of immunohistochemistry: Principles pitfalls, and standarization 4th Ed. United States of Amerirican: Elsevier Saunders. Pp. 1-19.
Susanto E. 2010. Penggunaan SDS-PAGE untuk karakterisasi raksi protein sebagai alternati metoda identikasi pencemaran daging ke dalam bakso. J. Ternak. 1(01): 1-7.
Ellen CJ. 2012. The basic of Western Blotting. The Anatomical Rec. 295: 369-371.
Hames BD, Rickwood. 2004. A Practical Approach: Gel Elektrooresis Protein. Huntington: Robert E. Krieger
Publishing Company.
Hediger R. 1990. Assigment of the growth hormone gen lokus to 19q26qter ini cattle and to 11q25qter in sheep by insitu hybridization. Genome. 8: 171174.
Jiang H, Ge X. 2014. Mechanism of growth hormone stimulation of skeletal muscle growth in cattle. J. Anim. Sci. 12(1): 2129.
Junqueira MD, Carneiro J. 1980. Basic histology. 2nd Ed. editorial Guanabara koogam, SA. Rio de Jeneiro. Brazil. Pp. 265-277.
Kim SH, Shin YK, Lee KM, Lee JS, Yun SM. 2003. An improved protocol of biotinylated tyramine-based
immunohistochemistry minimizing nonspecific bacgrond staining. Journal of histochemistry and cytochemistry. 51 (1): 131
Kumar GL, Wendelboe HG, Bisgaard K, Boenisch T, Fomilo AD, Stead RH. 2009. Education Guide:
Immunohistochemical staining methods 3th edition. California: DACO
corporation. Pp.120
Lawrie RA. 2003. Meat Science 5thed. Oxford Univversity of Nottingham. Pp. 200-305.
Lenny A, Marlinda A, Zanil M, Lisnawati, Saptawati B. 2011. Gambaran ekspresi reseptor estrogen β pada angiofibroma nasofaring belia dengan menggunakan pemeriksaan immunohistokimia. ORLI. 41(1): 8-16.
Li J, Danney MJ, Gilmour RS, Fowden. 2002. Central of growth hormone receptor and y insulin-like growth-1 expresion by cartisel in ovine fetal
skeletal muscle. J. Physiol. 541(2): 582 – 589.
Listrat A, Hocguetle JF, Picard B, Menissier T, Djiane J, Jammes H. 2005. Growth hormone receptor gene expression in the skeletal muscle of normal and double-muscled bovines during foetal development. J. Reprod. Nutr. Dev. 45(4): 393 – 403.
Marcio A, Robert T, Juliana Z, Antonio S, Luis F. 2016. Higth level of GHR nuclear translocation in skeletal muscle of a hyperplastic transgenic zebrafish. J. Mol. Endocrinol. 56(1): 47-54.
Purwoko A, Sutarno, Etikawati N. 2003. Polimorfisme DNA pada lokus-2 gen hormon pertumbuhan sapi madura. Biodiversitas. 4(1): 7-11.
Schindler, Christian, Levy, David E, Dcker, Thomas. 2007. JAK-STAT signaling from interferons to cytokines. J. Biol. Chem. 282(28): 20059-20063.
Soeparno. 2005. Ilmu Dan Teknologi Daging. Gadjah Mada University Press. Yogyakarta.
Tahrin M, Yang PC. 2012. Western Blot: tecnique, theory, and trouble shooting. Am. J. Med. Sci. 4(9): 429 -433.
Vleuric L, Van Veldhoven PP, Decuypera E, Khun ER. 1996. Distribution of GH receptors in chicken liver. Proc. Int. Symposium on Avian Endocrinology. Chateau Lake Louise, Alberta. Pp. 30.
Zulkharnaim, Jakaria, Noor RR. 2010. Identifikasi keragaman genetik gen reseptor hormon pertumbuhan (GHR/Alu I) pada sapi bali. Media Peternakan. 33(2): 81-87.
78
Discussion and feedback