Deteksi Toxoplasma gondii pada Mencit yang Diinfeksi Inokulat Jantung dan Otak Ayam Buras
on
Buletin Veteriner Udayana
ISSN : 2085-2495
Vol. 4 No.2: 63-72
Agustus 2012
Deteksi Toxoplasma gondii pada Mencit yang Diinfeksi Inokulat Jantung dan Otak Ayam Buras
(TOXOPLASMA GONDII DETECTION IN MICE INFECTED WITH HEART AND BRAIN FREE RANGE CHICKEN INOCULANT)
Ida Ayu Pasti Apsari1, Ida Bagus Oka Winaya2, Ida Bagus Ngurah Swacita3 1Bagian Parasitologi, 2Bagian Patologi, 3Bagian Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan – Universitas Udayana, Denpasar-Bali
Email : iapapsari@yahoo.co.id
ABSTRAK
Toxoplasma gondii adalah parasit intraseluler obligat menyebabkan penyakit toksoplasmosis yang sudah tersebar di seluruh dunia. Mencit sangat peka terhadap Toxoplasma gondii, sehingga dipilih sebagai hewan model untuk toksoplasmosis. Mencit sebagai hewan model dilakukan penelitian dengan menginfeksikan inokulat jantung dan otak ayam buras. Tujuan penelitian untuk mendeteksi Toxoplasma gondii pada mencit secara serologis dengan metode ELISA dan secara histopatologis dengan metode mikroskopis dan pengecatan Haematoxylin Eosin preparat histologi. Sejumlah 18 inokulat jantung dan 18 inokulat otak ayam buras berasal dari sembilan kabupaten di Bali, diinokulasi ke 72 ekor mencit. Hasil penelitian diperoleh 9 inokulat jantung positif pada 10 ekor mencit dan 2 inokulat otak positif pada 3 ekor mencit, dengan titer antibodi serum 512 – 1024 EU. Deteksi secara histopatologis pada organ hati, jantung, otak, ginjal dan paru terjadi degenerasi, peradangan dan perdarahan interstitialis. Tidak ditemukan sista pada semua organ mencit yang diperiksa.
Kata kunci : Toxoplasma gondii, mencit, inokulat jantung, inokulat otak, ayam buras.
ABSTRACT
Toxoplasma gondii is anobligate intracellular parasite that causes toxoplasmosis disease, has spread all over the world. Mice are very sensitive toToxoplasma gondii, so chosen as animal model for toxoplasmosis. Mice as an animal model studies with heart and brain of free-range chicken inoculant infected in its. Purpose of this study serologically and histopathologically detected Toxoplasma gondii in mice by ELISA method and microscopic method by histology smear with Haematoxylin Eosin staining. A total of 18 heart inoculant and 18 brain inoculant of free-range chicken originate from nine districts in Bali, was inoculated into 72 mice. The results, obtained 9 positive heart inoculant at 10 mice and 2 positive brain inoculant at 3 mice, with serum antibody titers 512-1024 EU. Histopathological detection in the liver, heart, brain, kidneys and lung soccurred degeneration, interstitial inflammation and bleeding. No cyst was found in all examined organs of mice.
Key word : Toxoplasma gondii, mice, heart inoculant, brain inoculant, free-range chicken
PENDAHULUAN
Toxoplasma gondii adalah parasit obligat intraseluler yang merupakan parasit paling unik diantara famili Apicomplexa, karena parasit ini dapat masuk dan memperbanyak diri di dalam sel dari semua hewan berdarah panas termasuk unggas (Soulsby, 1982; Levine, 1995; Dubey et al., 2005; Dubey et al.,2006). Toxoplasma gondii menyebabkan penyakit toksoplasmosis yang sudah tersebar di seluruh dunia (Tenter et al.,2000). Kasus toksoplasmosis pada hewan dan manusia, baik di dunia maupun di Indonesia sangat tinggi. Kasus pada manusia berkisar 40-85%, sedangkan pada hewan berkisar antara 580% (Subekti et al., 2005). Tingginya kasus toksoplasmosis pada hewan dan manusia, maka deteksi T. gondii pada hewan maupun manusia merupakan hal yang sangat penting dilakukan.
Penelitian sebelumnya dengan metode Inhibitor haemagglutination (IHA) digunakan untuk mendeteksi antibodi T. gondii pada ayam kampung di Jakarta dengan hasil 52,5% (Priyana, 2000). Mufasirin et al. (2002) mendeteksi antigen T. gondii dengan metode Elisa Dot Blot terdeteksi 100% telur ayam kampung mengandung antigen T. gondii. Suwanti et al.(2006) di Surabaya dengan metode digesti mendeteksi 30% jantung dan otak ayam mengandung sista T. gondii. Mencit sebagai hewan model untuk infeksi T. Gondii diinokulasi melalui intra peritonial. Inokulat yang diinokulasikan ke mencit dapat berupa stadium takizoit atau stadium bradizoit (Janitschke, 1999). Mencit dipilih sebagai hewan model di laboratorium, karena mencit demikian peka terhadap T. gondii (Nguyen et al.,1996; Jensen et al.,1998; Dubey et al.,1999; Shojaee et al.,2007a; Shojaee et al.,2007b; Peterico et al., 2009). Kasus di lapangan bahwa tikus lebih tinggi tingkat infeksi
toksoplasmosis dibanding mencit (Kuticic et al., 2005).
Pada hospes perantara ada 2 fase perkembangan aseksual. Fase pertama adalah perkembangan takizoit (endozoit) yang berkembang secara cepat di dalam berbagai tipe sel. Fase kedua, takizoit berkembang yang hasilnya sista jaringan. Sista di dalamnya mengandung bradizoit (sitozoit) yang berkembang secara lambat dengan cara endodyogeni (Dubey and Beattle, 1988; Dubey et al.,1998). Sista jaringan, mempunyai afinitas yang tinggi untuk jaringan neural dan muskular. Sista jaringan yang termakan oleh hospes definitif, bradizoitnya berubah ke fase aseksual dengan berkembang biak secara endodyogeni diikuti pengulangan secara endopoligoni didalam sel epithel usus halus. Stadium akhir dari multiplikasi aseksual ini mengawali fase seksual dari siklus hidup. Oosista sebagai hasil fase seksual dari siklus hidup berada didalam sel epithel usus hospes definitif (Levine, 1995; Dubey et al.,1998; Tenter et al., 2000). Takizoit bebas dapat ditemukan pada media cairan seperti darah, cairan cerebrospinal, sedangkan yang intraseluler ditemukan dalam sel berinti seperti fibroblast, epithel, endotel, monosit dan macrofage (Carruthers et al.,2000; Indra, 2003). Takizoit diperoleh dengan menginokulasikan jumlah sedikit takizoit ke cavum peritonial mencit untuk memperoleh sejumlah besar takizoit (Feyer et al.,1989; Dubey et al.,1997; Sarjono et al., 2004). Isolasi takizoit dapat dilakukan dari darah (Hitt and Felice, 1992). Secara experimen ternyata takizoit dapat diisolasi dari telur ayam mentah (Jacobs and Melton, 1966 cited Tenter et al.,2000). Dari beberapa laporan penelitian menunjukkan bahwa babi merupakan sumber utama penularan pada manusia (Dubey, 1996)). Selanjutnya tidak menutup kemungkinan bahwa unggas khususnya ayam menjadi sumber penularan bagi manusia. Sudah terbukti
persentase daging ayam yang mengandung bentuk sista sebesar 30% (Suwanti et al., 2006) akan berperan bisa sebagai sumber infeksi pada manusia. Penelitian serologis toksoplasmosis pada 34 ekor tikus dari pasar di Wirobrajan ditemukan 1 ekor (1,2%) positif dan pada 26 ekor tikus rumahan ditemukan 3 ekor (3,6%) positif T. gondii secara serologis, sedangkan tikus dari sungai tidak ada ditemukan T. Gondii (Agustin dan Noor, 2009). Tujuan penelitian ini untuk mendeteksi T. gondii secara serologis dan histopatologis pada mencit yang diinfeksi inokulat jantung dan otak ayam buras.
METODE PENELITIAN
Materi berupa 90 ekor mencit Balb/c dibagi 9 kelompok dengan masing-masing kelompok 10 ekor, 18 inokulat jantung dan 18 inokulat otak ayam buras, Protein rekombinan GRA-1 T. gondii (koleksi dari Prof.W.T.Artama UGM), conjugate antimouse IgG alkaline phosphatase (Sigma), buffer, substrat dan bahan digesti pepsin HCl, pengecatan Haematoxylin Eosin dan bahan untuk pembuatan preparat histologi. Alat-alat berupa Elisa reader, mikroskup dan alatpembuatan preparat histologi dengan pengecatan H&E.
Pembuatan inokulat
Inokulat jantung dan otak dibuat berdasar metode digesti pepsin HCl (Dubey, 1998) dari jantung dan otak ayam buras berasal dari 9 kabupaten di Bali. Inokulat jantung (18 inokulat) dan otak (18 inokulat) ayam buras berasal dari 9 kabupaten, masing-masing sebanyak 1 ml diinokulasikan secara intra peritonial ke 2 ekor (inokulat jantung) dan 2 ekor (inokulat otak) mencit. Sebagai kontrol dari masing-masing kelompok kabupaten dipergunakan 2 ekor mencit yang diinokulasi dengan PBS. Pengamatan dilakukan selama 4 minggu.
Deteksi serologis
Serum mencit dikumpulkan berasal dari mencit sebelum diinokulasi (serum preinokulasi), 2 minggu setelah inokulasi (serum 2 minggu I) dan 4 minggu setelah inokulasi (serum 2 minggu II), diperiksa dengan metode ELISA (Crowther, 2001). Pengumpulan serum dilakukan dengan cara mengambil darah dari vena orbitalis.
Deteksi Patologis
Selama 4 minggu perlakuan, mencit diamati gejala klinis yang muncul atau kematian yang terjadi. Setelah 4 minggu, mencit dikurbankan dengan cara ether euthanasia. Organ jantung, hati, paru dan otak mencit diambil dan disimpan pada larutan NBF untuk pengamatan secara histopatologis. Deteksi secara histopatologis dilakukan dengan membuat preparat histologi melalui pengecatan H&E. Hasil deteksi positif T. gondii pada masing-masing organ dengan ditemukannya bentuk sista pada organ tersebut.
HASIL DAN PEMBAHASAN
Hasil pemeriksaan ELISA menggunakan protein GRA-1 T. gondii pada serum mencit diperoleh nilai cut off 0,519. Analisis nilai cut off dari titer antibodi mencit, diperoleh titer yang positif adalah diatas nilai 256 EU (Elisa Unit). Berdasar analisis dari hasil seperti tersaji pada Tabel 1, terdeteksi 18 ekor mencit positif dengan titer antibodi T. gondii 512 – 1024 EU. Pengamatan selama 4 minggu mencit yang diinfeksi inokulat jantung dan otak ayam buras terdeteksi secara serologis 20 % (18 positif dari 90 mencit). Kasus lapangan di Croatia ternyata tikus lebih peka T. gondii dibanding mencit (Kuticic et al., 2005). Hasil penelitian serologis pada tikus di Yogyakarta terdeteksi 1,2 % tikus pasar
dan 3,6% tikus rumah terdeteksi T. gondii (Agustin dan Noor, 2009), ternyata hasilnya jauh lebih kecil dari hasil penelitian ini. Hal ini mengindikasikan bahwa, untuk penelitian laboratoium mencit sebagai hewan coba sangat peka
terhadap toksoplasmosis. Sesuai pernyataan Nguyen et al.(1996) dan Shojaee et al. (2007b), bahwa mencit sebagai hewan model untuk toksoplasmosis, berhasil dideteksi T. gondii dari darah, urine, otak dan serum.
Tabel 1. Hasil Pemeriksaan ELISA Serum Mencit
|
Asal Inokulat Ayam |
Titer Serum Preinokulasi (Elisa Unit) |
Titer Serum 2 minggu I (Elisa Unit) |
Titer Serum 2 minggu II (Elisa Unit) | ||
|
Badung : 01 |
32 |
Control 1 : |
32 |
Control 1 : |
128 |
|
02 |
32 |
Control 2 : |
32 |
Control 2 : |
128 |
|
03 |
128 |
DJ,I.1 |
: 256 |
DJ.I.1 |
: 256 |
|
04 |
128 |
DJ.I.2 |
: 256 |
DJ.I.2 |
: 512 |
|
05 |
128 |
DJ.II.1 |
: 256 |
DJ.II.1 |
: 1024 |
|
06 |
128 |
DJ.II.2 |
: 128 |
DJ.II.2 |
: 64 |
|
07 |
128 |
DO.I.1 |
: 256 |
DO.I.1 |
: 256 |
|
08 |
128 |
DO.I.2 |
: 1024 |
DO.I.2 |
: 256 |
|
09 |
64 |
DO.II.1 |
: 1024 |
DO.II.1 |
: 512 |
|
10 |
64 |
DO.II.2 |
: 1024 |
DO.II.2 |
: 128 |
|
Denpasar 01 |
64 |
Control 1 : |
128 |
Control 1 : |
256 |
|
02 |
64 |
Control 2 : |
256 |
Control 2 : |
- |
|
03 |
64 |
DJ.I.1 |
: 256 |
DJ.I.1 |
: 1024 |
|
04 |
32 |
DJ.I.2 |
: 256 |
DJ.I.2 |
: 1024 |
|
05 |
32 |
DJ.II.1 |
: 128 |
DJ.II.1 |
: 128 |
|
06 |
32 |
DJ.II.2 |
: 128 |
DJ.II.2 |
: 64 |
|
07 |
64 |
DO.I.1 |
: 256 |
DO.I.1 |
: 256 |
|
08 |
32 |
DO.I.2 |
: 128 |
DO.I.2 |
: 128 |
|
09 |
16 |
DO.II.1 |
: 128 |
DO.I.1 |
: 128 |
|
10 |
16 |
DO.II.2 |
: 64 |
DO.II.2 |
: 64 |
|
Tabanan 01 |
16 |
Control 1 |
: 256 |
Control 1 |
: 256 |
|
02 |
64 |
Control 2 |
: 128 |
Control 2 |
: 256 |
|
03 |
32 |
DJ.I.1 |
: 512 |
DJ.I.1 |
: 32 |
|
04 |
16 |
DJ.I.2 |
: 512 |
DJ.I.2 |
: 256 |
|
05 |
16 |
DJ.II.1 |
: 128 |
DJ.II.1 |
: 256 |
|
06 |
32 |
DJ.II.2 |
: - |
DJ.II.2 |
: 64 |
|
07 |
16 |
DO.I.1 |
: 256 |
DO.I.1 |
: 256 |
|
08 |
- |
DO.I.2 |
: 128 |
DO.I.2 |
: 1024 |
|
09 |
- |
DO.II.1 |
: 256 |
DO.II.1 |
: 1024 |
|
10 |
- |
DO.II.2 |
: 256 |
DO.II.2 |
: - |
|
Karangasem 01 |
16 |
Control 1 |
: 64 |
Control 1 |
: 64 |
|
02 |
32 |
Control 2 |
: 64 |
Control 2 |
: 32 |
|
03 |
64 |
DJ.I.1 |
: 64 |
DJ.I,1 |
: 256 |
|
04 |
64 |
DJ.I.2 |
: 64 |
DJ.I.2 |
: 256 |
|
05 |
16 |
DJ.II.1 |
: 512 |
DJ.II.1 |
: 64 |
|
06 |
16 |
DJ.II.2 |
: 64 |
DJ.II.2 |
: - |
|
07 |
64 |
DO.I.1 |
: 64 |
DO.I.1 |
: 128 |
|
08 |
32 |
DO.I.2 |
: 64 |
DO.I.2 |
: 128 |
|
09 |
64 |
DO.II.1 |
: 64 |
DO.II.1 |
: 1024 |
|
10 |
32 |
DO.II.2 |
: 64 |
DO.II.2 |
: 256 |
|
Bangli 01 |
16 |
Control 1 |
: 64 |
Control 1 : |
1024 |
|
02 |
16 |
Control 2 |
:- |
Control 2 : |
- |
|
03 |
16 |
DJ.I.1 |
:- |
DJ.I.1 |
: - |
|
04 |
16 |
DJ.I.2 : |
1024 |
DJ.I.2 : |
1024 |
|
05 |
32 |
DJ.II.1 : |
1024 |
DJ.II.1 : |
1024 |
|
06 |
32 |
DJ.II.2 : |
- |
DJ.II.2 : |
- |
|
07 |
16 |
DO.I.1 : |
1024 |
DO.I.1 : |
64 |
|
08 |
16 |
DO.I.2 : |
- |
DO.I.2 : |
- |
|
09 |
32 |
DO.II.1 : |
- |
DO.II.1 : |
- |
|
10 |
16 |
DO.II.2 : |
64 |
DO.II.2 : |
- |
|
Buleleng 01 |
0 |
Control 1 |
: 1024 |
Control 1 : |
1024 |
|
02 |
16 |
Control 2 |
: 1024 |
Control 2 : |
- |
|
03 |
16 |
DJ.I.1 |
: 1024 |
DJ.I.1 |
: 128 |
|
04 |
16 |
DJ.I.2 |
:- |
DJ.I.2 |
: 512 |
|
05 |
32 |
DJ.II.1 |
:- |
DJ.II.1 |
: 1024 |
|
06 |
0 |
DJ.II.2 |
: 1024 |
DJ.II.2 |
: - |
|
07 |
16 |
DO.I.1 |
:- |
DO.I.1 |
: - |
|
08 |
32 |
DO.I.2 |
: 1024 |
DO.I.2 |
: - |
|
09 |
16 |
DO.II.1 |
: 512 |
DO.II.1 |
: 16 |
|
10 |
0 |
DO.II.2 |
:- |
DO.II.2 |
: - |
|
Gianyar 01 |
16 |
Control 1 : |
256 |
Control 1 : |
512 |
|
02 |
16 |
Control 2 : |
- |
Control 2 : |
- |
|
03 |
16 |
DJ.I.1 |
: 1024 |
DJ.I.1 |
: - |
|
04 |
32 |
DJ.I.2 |
: - |
DJ.I.2 |
: - |
|
05 |
32 |
DJ.II.1 |
:- |
DJ.II.1 |
: 256 |
|
06 |
0 |
DJ.II.2 |
:- |
DJ.II.2 |
: 128 |
|
07 |
32 |
DO.I.1 |
: 128 |
DO.I.1 |
: - |
|
08 |
32 |
DO.I.2 |
:- |
DO.I.2 |
: - |
|
09 |
0 |
DO.II.1 |
: 1024 |
DO.II.1 |
: 1024 |
|
10 |
0 |
DO.II.2 |
:- |
DO.II.2 |
: - |
|
Klungkung 01 |
16 |
Control 1 |
: 64 |
Control 1 |
: 64 |
|
02 |
32 |
Control 2 |
:- |
Control 2 : |
- |
|
03 |
32 |
DJ.I.1 |
: 256 |
DJ.I.1 |
: - |
|
04 |
0 |
DJ.I.2 |
:- |
DJ.I.2 |
: 1024 |
|
05 |
0 |
DJ.II.1 |
: 128 |
DJ.II.1 |
: 1024 |
|
06 |
16 |
DJ.II.2 |
: 128 |
DJ.II.2 |
: 128 |
|
07 |
16 |
DO.I.1 |
: 1024 |
DO.I.1 |
: 256 |
|
08 |
16 |
DO.I.2 |
: 1024 |
DO.I.2 |
: - |
|
09 |
0 |
DO.II.1 |
: 256 |
DO.II.1 |
: 32 |
|
10 |
0 |
DO.II.2 |
:- |
DO.II.2 |
: 32 |
|
Jembrana 01 |
16 |
Control 1 |
: 32 |
Control 1 : |
256 |
|
02 |
16 |
Control 2 |
: 32 |
Control 2 : |
64 |
|
03 |
0 |
DJ.I.1 |
: 64 |
DJ.I.1 : |
256 |
|
04 |
0 |
DJ.I.2 |
: 32 |
DJ.I.2 : |
256 |
|
05 |
16 |
DJ.II.1 |
:- |
DJ.II.1 : |
- |
|
06 |
32 |
DJ.II.2 |
: 64 |
DJ.II.2 : |
256 |
|
07 |
16 |
DO.I.1 |
:- |
DO.I.1 : |
- |
|
08 |
16 |
DO.I.2 |
:- |
DO.I.2 : |
- |
|
09 |
0 |
DO.II.1 |
: 512 |
DO.II.1 : |
- |
|
10 |
0 |
DO.II.2 |
: 32 |
DO.II.2 : |
- |
Keterangan: DJ.I.1 : hasil digesti jantung ayam buras pooling I diinokulasi pada mencit 1
DJ.I.2 : hasil digesti jantung ayam buras pooling I diinokulasi pada mencit 2
DJ.II.1 : hasil digesti jantung ayam buras pooling II diinokulasi pada mencit 1
DJ.II.2 : hasil digesti jantung ayam buras pooling I diinokulasi pada mencit 2
DO.I.1 : hasil digesti otak ayam buras pooling I diinokulasi pada mencit 1
DO.I.2 : hasil digesti otak ayam buras pooling I diinokulasi pada mencit 2
DO.II.1 : hasil digesti otak ayam buras poling II diinokulasi pada mencit 1
DO.II.2 : hasil digesti otak ayam buras pooling II diinokulasi pada mencit 2
Dari Tabel 1, terlihat ada peningkatan titer serum dari 2 minggu I sampai 2 minggu II untuk titer yang positif yaitu : DJ.I.2 , DJ.II.1 (Badung); DJ.I.1, DJ.I.2 (Denpasar); DO.I.2, DO.II.1 (Tabanan); DO.II.1 (Karangasem); DJ.I.2, DJ.II.1 (Bangli); DJ.I.2, DJ.II.1 (Buleleng); DO.II.1 (Gianyar); DJ.I.2, DJ.II.1 (Klungkung). Berdasarkan hasil tersebut inokulat jantung dan otak dari ayam buras yang diinokulasi ke mencit terdeteksi positif T. gondii pada serum setelah 4 minggu pengamatan. Hal ini sebagai indikasi bahwa inokulat jantung dan otak yang diinokulasi, positif mengandung sista T. gondii. Hasil ini sesuai dengan hasil penelitian Suwanti et al. (2006) yang menemukan 30 % jantung dan otak ayam buras mengandung sista T. gondii. Demikian pula hasil penelitian Apsari et al.(2011) dengan metode digesti pepsin HCl berhasil menemukan 50 % inokulat jantung dan otak ayam buras mengandung sista T. gondii.
Berdasar hasil pemeriksaan ELISA menggunakan protein GRA-1 T. gondii pada serum mencit diperoleh nilai cut off 0,519. Analisis nilai cut off dari titer antibodi mencit, diperoleh titer yang positif adalah diatas nilai 256 EU (Elisa Unit). Berdasar analisis dari hasil seperti tersaji pada Tabel 1, terdeteksi 18 ekor mencit positif dengan titer antibodi T. gondii 512 – 1024 EU. Pengamatan selama 4 minggu mencit yang diinfeksi inokulat jantung dan otak ayam buras terdeteksi secara serologis 20 % (18 positif dari 90 mencit). Kasus lapangan di Croatia ternyata tikus lebih peka T. gondii dibanding mencit (Kuticic et al., 2005). Hasil penelitian serologis pada tikus di Yogyakarta terdeteksi 1,2 % tikus pasar dan 3,6% tikus rumah terdeteksi T. gondii (Agustin dan Noor, 2009), memberikan hasil yang jauh lebih kecil dari hasil penelitian ini. Hal ini mengindikasikan bahwa, untuk penelitian laboratoium mencit sebagai hewan coba sangat peka
terhadap toksoplasmosis. Sesuai pernyataan Nguyen et al.(1996) dan Shojaee et al. (2007b), bahwa mencit sebagai hewan model untuk toksoplasmosis, berhasil dideteksi T. gondii dari darah, urine, otak dan serum.
Adanya peningkatan titer serum (Tabel.1) dari 2 minggu I sampai 2 minggu II untuk titer yang positif yaitu : DJ.I.2 , DJ.II.1 (Badung); DJ.I.1, DJ.I.2 (Denpasar); DO.I.2, DO.II.1 (Tabanan); DO.II.1 (Karangasem); DJ.I.2, DJ.II.1 (Bangli); DJ.I.2, DJ.II.1 (Buleleng); DO.II.1 (Gianyar); DJ.I.2, DJ.II.1 (Klungkung). Berdasarkan hasil tersebut inokulat jantung dan otak dari ayam buras yang diinokulasi ke mencit terdeteksi positif T. gondii pada serum setelah 4 minggu pengamatan. Hal ini sebagai indikasi bahwa inokulat jantung dan otak yang diinokulasi, positif mengandung sista T. gondii. Hasil ini sesuai dengan hasil penelitian Suwanti et al. (2006) yang menemukan 30 % jantung dan otak ayam buras mengandung sista T. gondii. Demikian pula hasil penelitian Apsari et al.(2011) dengan metode digesti pepsin HCl berhasil menemukan 50 % inokulat jantung dan otak ayam buras mengandung sista T. gondii. Pada penelitian ini diinokulasikan sejumlah 18 inokulat jantung ke 36 ekor mencit dengan hasil terdeteksi 9 inokulat (50%) pada 10 ekor (33 %) mencit seropositif T. gondii. Sedangkan pada 18 inokulat otak ke 36 ekor mencit, terdeteksi 2 inokulat (11 %) pada 3 ekor (8,2 %) mencit seropositif T. gondii. Hasil ini bahwa 50% kandungan sista pada jantung ayam buras berhasil berkembang 33% pada mencit menimbulkan peningkatan antibodi, yang mana lebih besar dari 11% kandungan sista pada otak yang hanya mampu berkembang pada mencit 8,2% menimbulkan peningkatan antibodi. Hasil penelitian Hooshyar et al. (2009) menemukan pertumbuhan dan perkembangan sista pada organ mencit
dimulai 2 bulan setelah inokulasi dan menetap tidak berkembang lagi setelah 4 bulan. Berdasarkan hasil pemeriksaan histopatologi pada organ (hati, ginjal, paru, otak dan jantung) mencit terlihat peradangan ringan dan perdarahan, tetapi tidak terlihat ada bentukan sista T. gondii.
Inokulat jantung dan otak ayam buras yang diinokulasi ke mencit dalam waktu 4 minggu belum berhasil menginfeksi organ-organ tersebut yang menyebabkan bentuk sista T. gondii belum terlihat berkembang dalam organ.
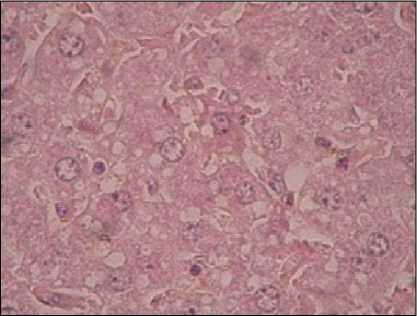
Gambar 1. Degenerasi Hepatitis
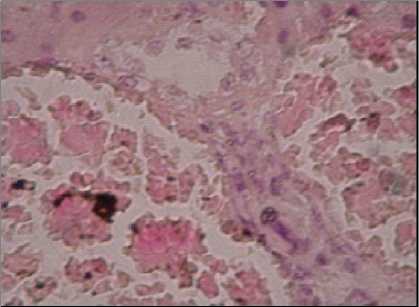
Gambar 3. Glomerulitis hemoragis
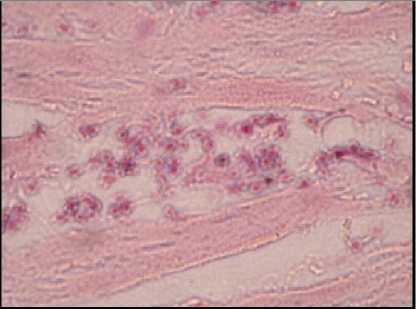
Gambar 2. Myocarditis eosinofilik
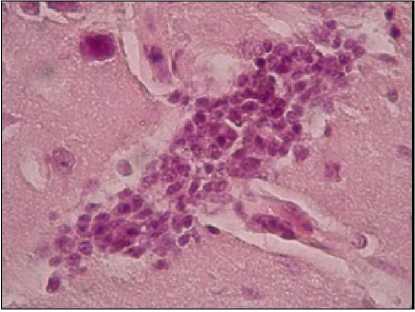
Gambar 4. Encephalitis
Hasil penelitian sebelumnya pada mencit yang diinfeksi secara experimental menemukan Perubahan secara histopatologis pada hati, paru, ginjal, otak dan limpa terjadi kongesti ringan sampai berat serta terjadi necrosis focal (Gunes, 1992; Sukthana et al., 2003). Kedua peneliti sebelumnya menemukan bentukan sista pada hati, ginjal dan limpa, tetapi pada penelitian ini tidak menemukan bentukan sista pada jaringan. Hal ini kemungkinan karena waktu pegamatan pada penelitian ini yang masih belum cukup untuk sista bertumbuh di jaringan atau kemungkinan inokulat jantung dan otak ayam buras yang
diinokulasikan ke mencit tidak cukup mengandung bradizoit yang mampu untuk tumbuh menjadi sista di jaringan mencit. Disebutkan bahwa perbedaan strain T.gondii akan menyebabkan efek yang berbeda pula pada hospes intermediernya. Perbedaan ini karena virulensi yang berbeda dari T. gondii, yaitu Toxoplasma yang virulent (RH strain) menyebabkan akut toksoplasmosis, sedangkan yang avirulent menyebabkan kronis toksoplasmosis (Miller et al., 1999). Berdasarkan hasil yang
diperoleh pada penelitian ini, dalam waktu 4 minggu pengamatan belum terlihat Perkembangan Toxoplasma pada
jaringan organ mencit. Kemungkinan dalam hal ini infeksi yang terjadi berkembang secara kronis untuk menimbulkan efek pada mencit. Hasil ini mengindikasikan kemungkinan strain Toxoplasma pada ayam buras tergolong yang avirulent, sehingga efeknya pada mencit terjadi secara kronis. Artinya perlu waktu pengamatan yang lebih panjang untuk bisa menemukan sista dalam jaringan.
SIMPULAN DAN SARAN
Simpulan
Terdeteksi 50% (9 dari 18) inokulat jantung pada 33 % (10 dari 36) mencit dan 11% (2 dari 18) inokulat otak pada 8,2% (3 dari 36) mencit terdeteksi seropositif T. gondii dengan titer antibodi 512 – 1024 EU. Deteksi secara
histopatologis pada organ hati, jantung, paru, otak dan ginjal mencit selama 4 minggu pengamatan terjadi peradangan, degenerasi dan perdarahan interstitial. Tidak ditemukan bentukan sista di jaringan pada semua organ mencit.
Saran
eteksi toksoplasmosis, untuk menemukan bentuk sista pada organ mencit disarankan pengamatan dilakukan lebih dari 8 minggu.
UCAPAN TERIMAKASIH
Kepada DP2M DIKTI terimakasih atas bantuan dana penelitian melalui Hibah Penelitian Fundamental dan kepada semua pihak yang ikut terlibat dalam penelitian ini, terimakasih atas bantuan tenaga serta dukungannya.
DAFTAR PUSTAKA
Agustin, NN. dan Noor, Z. 2009. Perbedaan Prevalensi
Toksoplasmosis pada Tikus
dengan Uji Serologis Metode ELISA di Kecamatan Wirobrajan dan sekitarnya. Mutiara Medika 9(1) : 1 – 5.
Apsari, IAP.; Artama, WT.; Sumartono; Damriyasa, IM.; Oka, IBM.; Swacita, IBN. 2011. Isolasi Toxoplasma gondii Pad Ayam Buras. Bull.Vet.Udayana 3(2): 6370.
Carruthers, V.B.; Sherman, G.D. and Sibley, L.D. 2000.The Toxoplasma adhesive protein MIC2 is proteolytically processed at multiple sites by two parasite derived proteases. J.Biol.Chem. 275 : 14346-14353.
Crowther, J.R. 2001. The ELISA Guidebooks. Humana Press Inc. New Jersey.
Dubey, J.P.; Shen, S.K.; Kwok,
O.C.H.and Frenkel, J.K. 1999.Infection and Immunity with the strain of Toxoplasma gondii in Rats and Mice. J.Parasitol. 85(4) : 657-662.
Dubey, JP; Su, C; Oliviera, J; Morales, JA; Bolanos, RV; Sundar, N; Kwok, OCH and Shen, SK. 2006. Biologic and Characterization of Toxoplasma gondii isolates in free-ranging chickens from Costa Rica, Central America. Vet Parasitol 139: 29-36.
Feyer, R; Gamble, HR; Lichtenfels, JR and Bier, JW .1992. Food borne and water bone Parasites. In Compendium of Methods for microbiological examination of food (ed Speck, ML). Washington DC. USA Am.Pub.Health Ass. : 789-809.
Gunes, HA.1992. The significance of histopathological diagnosis of toxoplasmosis (Experimental acute acquired toxoplasmosis in mice). Turk J Med Res.10(6) : 314-318.
Hitt, J.A. and Filice, G.A. 1992. Detection of Toxoplasma gondii parasitemia by gene amplification, cell culture and mouse inoculation. J.of Clin.Microbiol. 30(12) : 3181-3184.
Hooshyar, H.; Rostamkhani, P.; Arbabi, M. 2009. Study on growth of Toxoplasma gondii tissue cyst in laboratory mouse. Jundishapur J of Mcrobiol. 2(4) : 140-143.
Indra, C. 2003. Epidemiologi Toxoplasma gondii. USU Digital Library. : 113.
Janitschke, K. 1999. Animal Models of Toxoplasma Infection.Handbook of Animal Models of Infection. Academic Press : 811-820.
Jensen, I.; Heegaard, P.M.H. and Lind, P. 1998. A Study of virulence parameter for Toxoplasma gondii infection in mice. Parasitol Res. 84 : 382 – 387.
Johnson, A.M.; Robert, H. and Tenter, A.M. 1992. Evaluation of recombinant antigen ELISA for the diagnosis of acute toxoplasmosis and comparison with traditional Antigen ELISAs. J. of Med. Microbiol. 37: 404-409.
Kuticic, V.; Wikerhauser, T.; Gracner, D. 2005. A Survey of rats and mice for latent toxoplasmosis in Croatia : a case report. Vet.Med.- Czech. 50(11): 513-514.
Levine, N.D. 1994. Buku Pelajaran Parasitologi Veteriner. Edisi
Indonesia. Gadjah Mada
University Press. : 1-531.
Miller CMD, Smith NC, Johnson AM. Cytokines, nitricoxide, heat shock proteins and virulence. Parasitol Today 1999; 15: 418-22.
Mufasirin; Suprihati, E dan Suwanti, L.T.
2003. Studi Toksoplasmosis pada Telu Ayam yang dijual sebagai
campuran jamu di kota Surabaya dan Kabupaten Sidoarjo
menggunakan uji Dot Blot. Jurnal Penelitian Medika Eksakta. 4(2): 113-119.
Nguyen, T.D.; De Kesel, M.; Bigaignon, G.; Hoet, P.; Pazzaglia, G.; Lammens, M. And Delmee, M. 1996. Detection of Toxoplasma gondii Tachyzoites and Bradyzoites in Blood, Urine and Brain of Infected Mice. Clinical and Diagnostic Laboratory Immunology 3(6) : 635 – 639.
Peterico, S.B.; Langoni, H.; Da Sila, A.V. and Da Silva, R.C. 2009. Evaluation of Toxoplasma gondii placental transmission in BALB/c mice model. Exp.Parasitol. 123 : 168 – 172.
Priyana, A.2000. Antibodi Anti Toxoplasma pada Ayam Kampung (Gallus domesticus) di Jakarta. Majalah Kedokteran Indonesia. 50(11): 504-507.
Shojaee, S.; Rezaei, S. and Keshavarz. 2007a. Detection of Toxoplasma gondii from sera and urine of experimentally infected mice by PCR. Pak J Biol Sci. 10(1): 193195.
Shojaee, S.; Keshavarz, H. Rezaian, M. And Mohebali, M. 2007b. Detection of Toxoplasma gondii antigens in sera from experimentally infected mice. Pak J Med Sci. 23(1) : 100 – 102.
Soulsby, E.J.L. 1982. Protozoa. In Helminth, Arthropods and Protozoa of domesticated animals. 7th Ed. Bailliere Tindall London : 507-759.
Sukthana, Y.; Waree, P.; Pongponratn, E.; Chaisri, U. and Riganti, M. 2003. Pathologic study of acute toxoplasmosis in experimental animals. Southeast Asian J Trop Med Public Health. 34 (1) : 16 – 21.
Suwanti, LT.; Suprihati, E.; Mufasirin. 2006. Prevalensi Toxoplasmosis pada Ayam di beberapa Pasar di kota Surabaya. Media Kedokteran Hewan. 22(1): 32-35.
Subekti, D.T.; Artama, W.T. dan Iskandar, T. 2005. Perkembangan kasus dan Teknologi diagnosis Toksoplasmosis. Lokakarya
Nasional Penyakit Zoonosis.
Bogor.
Tenter, A.M.; Vietmeyer, C. and Johnson, A.M. 1992. Development of ELISAs based on Recombinant antigen for the detection of Toxoplasma gondii-spesific in sheep and Cats . Vet Parasitol 43:187-194.
Tenter, A.M.; Seineke, P.; Simon, K. ; Heckerozh, A.R.; Damriyasa, I.M.; Bauer, C. and Zahner, H. 1999. Aktuelle Studien zur Epidemiologie von Toxoplasma infectionen. Proc.German
Vet.Med. Soc.1999: 247-264.
72
Discussion and feedback