Madu Meningkatkan Kualitas Semen Kalkun Selama Penyimpanan (HONEY IMPROVE THE QUALITY OF SEMEN TURKEY DURING STORAGE)
on
Buletin Veteriner Udayana
p-ISSN: 2085-2495; e-ISSN: 2477-2712
Volume 7 No. 2: 164-171
Agustus 2015
Madu Meningkatkan Kualitas Semen Kalkun Selama Penyimpanan
(HONEY IMPROVE THE QUALITY OF SEMEN TURKEY DURING STORAGE)
Ni Made Dwi Permata Sari1, Wayan Bebas2, I Gusti Ngurah Bagus Trilaksana2
1Mahasiswa Fakultas Kedokteran Hewan Universitas Udayana 2Laboratorium Reproduksi Veteriner Universitas Udayana Jl. PB. Sudirman Denpasar-Bali
Email: pgegz@yahoo.com
ABSTRAK
Penelitian ini bertujuan untuk mengetahui penambahan berbagai konsentrasi madu terhadap motilitas dan daya hidup spermatozoa kalkun yang diencerkan dengan fosfat kuning telur yang disimpan pada suhu 50C selama 72 jam. Penelitian menggunakan Rancangan Acak Lengkap pola factorial, empat kelompok perlakuan masing masing : tanpa penambahan madu (kontrol), penambahan 3% madu, 4% madu, dan 5% madu. Sebanyak tujuh faktor lama penyimpanan masing masing : penyimpanan selama 0 jam, 12 jam, 24 jam, 36 jam, 48 jam, 60 jam dan 72 jam. Setiap perlakuan dilakukan pengulangan sebanyak enam kali. Kualitas semen yang diamati berupa pemeriksaan motilitas progresif dan pemeriksaan daya hidup spermatozoa. Data yang diperoleh dilakukan pengujian dengan General Linear Model (Multivariate). Hasil penelitian menunjukkan bahwa penambahan madu 3% memberikan perbedaan yang nyata terhadap motilitas progresif dan daya hidup spermatozoa selama proses penyimpanan. Dapat disimpulkan bahwa penambahan madu 3% merupakan dosis terbaik untuk mempertahankan motilitas dan daya hidup spermatozoa kalkunselama penyimpanan pada suhu 5°C.
Kata kunci: madu, motilitas spermatozoa, daya hidup spermatozoa, semen kalkun
ABSTRACT
This study aims were to determine the addition of various concentrations of honeyon the motility and viability of spermatozoa turkeywere diluted with phosphate yolk stored at 5oC for 72 hours. This study used a completely randomized design factorial pattern. Four treatment groups, respectively: without the addition of honey (control), the addition of 3% honey, honey 4%, and 5% honey. A total of seven factors of each storage time: storage for 0 h, 12 h, 24 h, 36 h, 48 h, 60 h and 72 h. Each treatment be repeated six times. Semen quality was observed in the form of examination of progressive motility and viability of spermatozoa examination. The data obtained was examined by the General Linear Model (Multivariate). The results showed that the addition of honey gives significant differences on the progressive motility and viability of spermatozoa during storage. It can be concluded that the addition of 3% honey was the best dose to maintain motility and viability of spermatozoa turkeys during storage at 5°C temperature.
Keywords: honey, motility, viability, turkey’s semen
PENDAHULUAN Meleagris yang mulai menjadi perhatian
masyarakat untuk dibudidayakan.
Kalkun merupakan salah satu jenis Masyarakat Indonesia belum terbiasa
unggas dari ordo Galliformes, genus mengkonsumsi daging kalkun dan baru
menjadikan kalkun sebagai binatang hias sehingga harga kalkun masih terbilang mahal. Namun sesungguhnya, mengkonsumsi daging kalkun jauh lebih baik daripada mengkonsumsi daging ayam potong, kambing dan sapi, karena daging kalkun memiliki kolesterolyang lebih rendah dan tinggi protein. Pemeliharaan kalkun pada umumnya dikembangkan melalui sistem perkawinan alami, dan sering mengalami kesulitan dikarenakan perbedaan bobot badan yang mencolok sehingga mengalami kesulitan dalam proses perkawinan alami. Kondisi ini berdampak terhadap rendahnya daya fertilitas telur. Untuk menanggulangi masalah tersebut dapat dilakukan dengan menggunakan teknologi inseminasi buatan. Dengan teknologi ini dapat mempercepat proses seleksi dan penyebaran bibit unggul dalam upaya memperbaiki mutu genetik kalkun.
Dalam upaya penerapan teknologi inseminasi buatan, maka kualitas semen harus tetap dapat dipertahankan dalam kurun waktu tertentu sehingga perlu upaya pengenceran dan penyimpanan pada suhu dingin. Salah satu pengencer yang umum digunakan adalah fosfat kuning telur (Vishwanath dan Shannon, 2000). Pengencer harus dapat menyediakan nutrisi bagi kebutuhan spermatozoa selama penyimpanan, harus memungkinkan sperma dapat bergerak secara progresif, tidak bersifat racun bagi sperma, melindungi spermatozoa terhadap cold shock, sebagai buffer atau penyangga untuk mencegah perubahan pH, mempertahankan tekanan osmotik dan keseimbangan elektrolit serta mengandung antibiotik yang dapat mengurangi pertumbuhan bakteri (Odu dan Egbo, 2012). Khasiat kuning telur terletak pada kemampuannya mempertahankan dan melindungi integritas selubung lipoprotein sel spermatozoa (Toelihere, 1993; Rehman et al., 2013).
Membran plasma spermatozoa kaya akan asam lemak tak jenuh sehingga rentan terhadap kerusakan peroksidasi dan pengaruh cold shock (Maxwell dan Watson, 1996). Untuk menanggulangi hal tersebut maka perlu dilakukan penambahan bahan-bahan seperti antioksidan dan anti coldshock ke dalam pengencer (Feradis, 2006).
Madu adalah salah satu bahan yang berfungsi sebagai antioksidan karena mengandung vitamin C, vitamin E, komponen fenolik, flavonoid, asam askorbat, enzim glukosa oksidase dan enzim katalase. Kandungan glukosa dan fruktosa dalam madu disamping berfungsi sebagai sumber energi juga dapat berperan sebagai anti coldshock atau sebagai krioprotektan ekstra seluler (Hidayaturrahmah, 2007). Madu juga mengandung sejenis lisosim yang memiliki daya anti bakteri (Winarno, 1981).
Berbagai penelitian telah dilakukan untuk mengetahui pengaruh penambahan madu pada pengencer berbagai spesies hewan seperti untuk mengencerkan semen kambing Peranakan Etawah, sapi Frisian Holstein (Taurin, 1977), ikan Komet (Boedi et al., 2010), ikan Patin (Arsetyo et al., 2012). Namun sampai saat ini pengaruh penambahan madu untuk mengencerkan semen unggas belum pernah dilakukan. Penelitian ini bertujuan untuk mengetahui pengaruh penambahan berbagai konsentrasi madu pada pengencer fosfat kuning telur dan lama penyimpanan semen terhadap motilitas dan daya hidup spermatozoa kalkun yang disimpan pada suhu 50C.
METODE PENELITIAN
Materi Penelitian
Hewan coba yang digunakan adalah satu ekor kalkun jantan berumur 1-1,5 tahun dengan berat badan 6-7 kg yang diberi pakan komersil 400 gram/hari (Charoen Pokphand Indonesia) dan
pemberian air minum secara secukupnya.
Bahan yang digunakan dalam penelitian ini adalah semen segar kalkun, madu (madu asli Nusa Tenggara Timur), aquadestilata, pewarna eosin-negrosin sitrat, phosphat buffer saline granul (Sigma), telur ayam kampung, antibiotik kanamycin, alkohol 70 %.
Alat yang digunakan dalam penelitian ini adalah haemocytometer Neubouer(Asistent Germany), mikroskop (Olympus CX21F31 Tokyo Japan), refrigerator, kertas aluminium foil, kompor listrik, object glass, cover glass, pipet pasteur, tabung reaksi, beker glass, cawan petri, api bunsen, tisu, gunting, gelas ukur dan spuite tuberculin.
Metode Penelitian
Kalkun diadaptasikan dengan lingkungan selama satu minggu. Penampungan semen dilakukan dengan metode pemijatan. Semen yang tertampung dilakukan pemeriksaan secara makroskopis dan mikroskopis. Semen yang berkualitas baik dilakukan pengenceran dengan pengencer fosfat kuning telur (kuning telur sebanyak 10%). Pengenceran semen dilakukan dengan konsentrasi spermatozoa sebanyak 150 x 106 ml-1. Konsentrasi madu 3%, 4%, dan 5% dibuat dengan menambahkan masing-masing 3 ml, 4 ml, dan 5 ml madu kedalam 97 ml, 96 ml, dan 95 ml pengencer fosfat kuning telur.
Rancangan penelitian yang digunakan dalam penelitian adalah Rancangan Acak Lengkap dengan empat kelompok perlakuan dan tujuh faktor lama penyimpanan. Empat kelompok perlakuan masing masing: tanpa penambahan madu (kontrol), penambahan madu masing-masing 3%, 4%, 5%, dan tujuh faktor lama penyimpanan masing masing : 0 jam , 12 jam, 24 jam, 36 jam, 48 jam, 60 jam, dan 72 jam penyimpanan. Semen yang telah diencerkan disimpan pada suhu 5oC
Pengamatan dilakukan terhadap
motilitas progresif spermatozoa dan daya hidup spermatozoa. Pemeriksaan
motilitas progresif spermatozoa
dilakukan dengan mengambil 0,05 ml semen yang telah diencerkan diletakkan pada object glass kemudian ditutup dengan cover glass, diperiksa di bawah mikroskop dengan pembesaran 400x untuk menghitung jumlah spermatozoa yang bergerak progresif dalam jumlah persentase. Penghitungan dilakukan sebanyak tiga lapang pandang lalu hasilnya dirata-ratakan. Daya hidup spermatozoa dihitung dengan melakukan pewarnaan Eosin Negrosin Sitrat. Satu tetes sperma yang telah diencerkan (0,05 ml) diletakkan pada object glass kemudian ditambah dengan dua tetes pewarna Eosin Negrosin Sitrat kemudian dihomogenkan, dibuat preparat ulas kemudian dikeringkan dengan cara dianginkan. Pengamatan menggunakan mikroskop perbesaran 400x. Spermatozoa yang mati akan menyerap zat warna merah, spermatozoa yang hidup akan tetap berwarna transparan (Toelihere, 1993).
Analisa Data
Data yang diperoleh ditabulasikan dan dianalisis menggunakan analysis of variance (ANOVA), Jika terdapat perbedaan yang nyata dilanjutkan dengan uji Duncan.
HASIL DAN PEMBAHASAN
Hasil pemeriksaan makroskopis dan mikroskopis semen kalkun diantaranya adalah didapatkan volume sebanyak 1,2 ml, berwarna putih kekuningan, berbau khas semen unggas, kental, motilitas progresif sebesar 85%, konsentrasi sebesar 1,2 x 109ml-1, dan abnormalitas 6%. Semen di atas mempunyai kualitas yang baik dan layak diproses untuk diencerkan sesuai dengan rancangan penelitian.
Hasil penelitian persentase motilitas
progresif spermatozoa dengan penambahan berbagai konsentrasi madu pada pengencer fosfat kuning telur yang
disimpan pada suhu 50C dapat dilihat pada (Tabel 1).
Tabel 1. Rata-rata (x ± SD) persentase motilitas spermatozoa dengan penambahan berbagai konsentrasi madu dan lama penyimpanan
|
Waktu pengamatan (Jam) |
Motilitas spermatozoa (%) | |||
|
Kontrol |
Madu 3% |
Madu 4% |
Madu 5% | |
|
0 |
85,00±0,00 |
85,00±0,00 |
85,00±0,00 |
85,00±0,00 |
|
12 |
80,000±00a |
82,00±0,00g |
79,67±1,36m |
78,00±0,00s |
|
24 |
72,00±0,00b |
76,67±0,51h |
65,67±5,88n |
60,83±0,40t |
|
36 |
64,00±0,00c |
66,00±1,54i |
61,00±2,44o |
53,33±1,96u |
|
48 |
56,00±0,00d |
51,33±2,06j |
51,83±4,49p |
37,50±3,01v |
|
60 |
46,67±1,03e |
46,67±2,42k |
25,00±0,00q |
18,67±1,03w |
|
72 |
34,00±4,38f |
44,00±1,78l |
22,00±0,00r |
12,83±2,22x |
Keterangan: Huruf berbeda pada baris dan kolom menunjukkan berbeda nyata (P<0,05)
Sebelum dilakukan analisis, data diuji homogenitas dengan menggunakan Levene’s Test dan uji normalitas dengan menggunakan Kolmogorov Smirnov Test. Hasil pengujian menunjukkan data homogeny dan berdistribusi normal. Data dianalisis dengan analysis of variance (ANOVA) dan pengujian statistik dilakukan dengan menggunakan uji General Linear Model (Multivariate).
Hasil pengujian statistik menunjukkan bahwa penambahan berbagai konsentrasi madu pada pengencer fosfat kuning telur berpengaruh nyata (P<0,05) terhadap motilitas progresif. Hasil uji Duncan juga menunjukkan bahwa masing-masing perlakuan memberikan pengaruh yang nyata (P<0,05) terhadap motilitas spermatozoa. Lama waktu penyimpanan juga berpengaruh nyata (P<0,05) terhadap penurunan motilitas progresif spermatozoa.
Grafik persentase motilitas progresif spermatozoa dengan penambahan berbagai konsentrasi madu dan lama penyimpanan dapat dilihat pada Gambar 1 dan daya hidup spermatozoa akibat penambahan berbagai konsentrasi madu dan lama waktu penyimpanan dapat dilihat pada (Tabel 2).
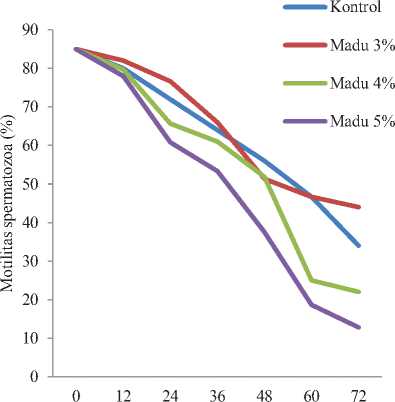
Waktu pengamatan (jam)
Gambar 1.Persentase motilitas progresif spermatozoa dengan penambahan berbagai konsentrasi madu dan lama penyimpanan.
Hasil pengujian statistik menunjukkan bahwa penambahan madu pada pengencer fosfat kuning telur berpengaruh nyata (P<0,05) terhadap daya hidup spermatozoa kalkun. Lama waktu penyimpanan juga memberikan pengaruh nyata (P<0,05) terhadap penurunan spermatozoa yang hidup.
Tabel 2. Rata-rata (x±sd) persentase daya hidup spermatozoa kalkun dengan penambahan berbagai konsentrasi madu dan lama waktu penyimpanan.
|
Waktu pengamatan (Jam) |
Daya hidup spermatozoa (%) | |||
|
Kontrol |
Madu 3% |
Madu 4% |
Madu 5% | |
|
0 |
90,00±0,00 |
90,00±0,00 |
90,00±0,00 |
90,00±0,00 |
|
12 |
83,67±0,81a |
86,00±0,00g |
79,33±1,03a |
74,17±0,98m |
|
24 |
71,33±1,03b |
80,33±0,51h |
72,62±2,06b |
63,00±n.09n |
|
36 |
66,67±0,51c |
75,00±0,00i |
68,00±0,00c |
60,00±0,00o |
|
48 |
58,50±1,97d |
67,67±2,06j |
57,67±1,63d |
52,67±2,06p |
|
60 |
52,67±6,08e |
58,33±1,63k |
48,17±2,85e |
41,00±4,64q |
|
72 |
38,67±4,54f |
40,33±4,80l |
38,83±5,41f |
15,88±4,91r |
Keterangan: Huruf berbeda pada baris dan kolom menunjukkan berbeda nyata (P<0,05).
Grafik persentase daya hidup spermatozoa kalkun dengan penambahan berbagai konsentrasi madu, dan lama waktu penyimpanan dapat dilihat pada Gambar 2.
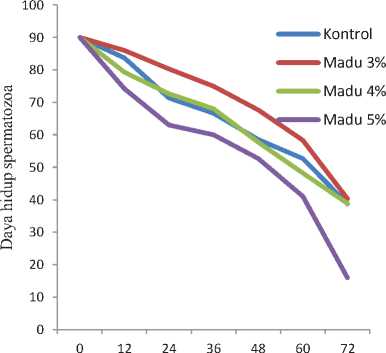
Waktu pengamatan (jam)
Gambar 2. Persentase daya hidup spermatozoa dengan penambahan berbagai konsentrasi madu dan lama waktu penyimpanan.
Hasil penelitian menunjukkan bahwa penambahan madu pada pengencer fosfat kuning telur secara nyata (P<0,05) mampu mempertahankan motilitas dan daya hidup spermatozoa kalkun sampai 72 jam lama penyimpanan pada suhu 5°C dengan batas ukur kelayakan motilitas sampai 40% dan daya hidup di bawah 45%. Fenomena ini didukung oleh
beberapa penelitian yang menyebutkan bahwa penambahan madu mampu mempertahankan motilitas dan daya hidup spermatozoa ikan patin hingga 48 jam (Arsetyo, 2012). Semen yang diencerkan dengan penambahan madu 2%, madu 4%, madu 6% berpengaruh nyata terhadap kualitas spermatozoa kambing peranakan etawah, namun level madu 4% yang terbaik dalam mempertahankan motilitas dan daya hidup. Kemudian pengaruh penambahan madu sebagai campuran bahan pengencer semen terhadap daya hidup spermatozoa kuda juga memberikan hasil yang sangat baik dengan penggunaan 3-5% madu yang dikemukakan Taurin (1977), yang dikutip oleh Reswari (1994). Hal ini disebabkan karena madu mengandung banyak nutrisi yang berfungsi sebagai antioksidan dan anti cold shock. Nutrisi yang disumbangkan oleh madu terutama glukosa dan fruktosa dapat dipakai sebagai sumber energi untuk kelangsungan hidup dan motilitas spermatozoa, dan juga madu mengandung mineral yaitu magnesium sebagai kofaktor dalam proses glikolisis. Apabila persediaan energi habis maka kontraksi fibril-fibril spermatozoa akan terhenti dan spermatozoa tidak bergerak. Untuk melangsungkan pergerakan kembali, perlu melalui respirasi sel spermatozoa yang menghasilkan ATP
(Wijaya, 1996; Hidayaturrahmah, 2007; Kubovicova et al., 2010).
Penambahan madu dosis 3% memberi pengaruh baik terhadap motilitas dan daya hidup spermatozoa kalkun. Penambahan madu 3% pada pengencer fosfat kuning telur merupakan dosis optimum dan terbaik dalam mempertahankan motilitas dan daya hidup spermatozoa kalkun yang disimpan pada suhu 5°C. Hal ini disebabkan penggunan dosis madu 3% tidak memberikan pengaruh yang buruk terhadap motilitas dan daya hidup spermatozoa kalkun dan pada dosis tersebut kandungan antioksidan dan anti cold shock pada madu dapat bekerja secara optimal memberikan perlindungan terhadap spermatozoa, dengan cara mencegah atau memutus reaksi rantai peroksidasi lipida pada membran plasma sel sehingga mampu mencegah atau mengurangi kerusakan yang terjadi pada membran plasma sel spermatozoa selama proses penyimpanan (Mayes, 1995; Aurich et al., 1997; Ilori et al., 2012).
Penambahan madu 4 % malah terjadi penurunan motilitas dan daya hidup spermatozoa sedangkan penambahan madu 5% mengalami penurunan yang lebih tinggi terhadap motilitas dan daya hidup spermatozoa kalkun disebabkan oleh kandungan glukosa dan fruktosa dalam madu sebagai krioprotektan ekstraseluler dan penambahan senyawa antioksidan dalam jumlah banyak akan semakin meningkatkan tekanan osmotik larutan pengencer dan kurang dapat diadaptasi dengan baik oleh spermatozoa (Beconi et al., 1993).
Pengaruh waktu penyimpanan menunjukkan penurunan motilitas dan daya hidup spermatozoa. Hal ini membuktikan semakin lama penyimpanan maka spermatozoa yang mati semakin banyak akibat perubahan kondisi larutan pengencer dan menurunnya zat-zat makanan sebagai sumber energy (Solihati et al., 2006).
Kemampuan hidup spermatozoa dalam larutan pengencer semen dipengaruhi oleh beberapa faktor seperti, banyak sedikitnya zat-zat makanan yang tersedia dalam bahan pengencer, terjaganya keseimbangan elektrolit dan tekanan osmotik dalam penyimpanan (Winarno, 1981; Toelihere, 1993; Tabatabei et al., 2009).
SIMPULAN DAN SARAN
Simpulan
Dari hasil penelitian dapat disimpulkan bahwa, penambahan madu pada pengencer fosfat kuning telur mampu mempertahankan motilitas dan daya hidup spermatozoa kalkun yang disimpan pada suhu 5°C, dosis penambahan madu 3% merupakan dosis optimum dan terbaik dalam mempertahankan motilitas dan daya hidup spermatozoa dan lama penyimpanan berpengaruh terhadap penurunan motilitas dan daya hidup spermatozoa kalkun.
Saran
Perlu dilakukan penelitian lebih lanjut terhadap fertilitas telur kalkun yang diinseminasikan dengan semen yang diencerkan dengan penambahan madu.
UCAPAN TERIMAKASIH
Terimakasih disampaikan kepada bapak Dekan Fakultas Kedokteran Hewan Universitas Udayana dan Kepala Laboratorium Reproduksi Veteriner yang telah memfasilitasi penelitian serta teman-teman yang mendukung sehingga penelitian ini bisa selesai.
DAFTAR PUSTAKA
Arsetyo Rahardhianto, Nurlita
Abdulgani, Ninis Trisyani. 2012.
Pengaruh konsentrasi larutan madu dalam nacl fisiologis terhadap
viabilitas dan motilitas spermatozoa ikan patin (pangasius pangasius) selama masa penyimpanan. J Sains dan Seni, 1(1): 58-63.
Aurich JE, Schonherr U, Hoppe, Aurich C. 1997. Effect of antioxidants on motility and membrane integrity of chilled-stored stallion semen. Theriogenology, 48(2): 185-192.
Barus E. 2001. Pengaruh lama penyimpanan dan media pengencer kuning telur dengan madu terhadap kualitas sperma kambing peranakan etawah (PE). Repository, Fakultas Pertanian. Sumatra Utara.
Beconi MT, Francia CR, Mora NG, Affrachino MA. 1993. Effect of natural antioxidants on frozen bovine semen preservation. Theriogenology, 40: 841-852.
Boedi SRA, Mubarak S, Rini SP. 2010. Penambahan ekstender madu dalam proses penyimpanan sperma beku terhadap motilitas dan viabilitas spermatozoa ikan komet (carassius auratus auratus). J Ilmiah Perikanan dan Kelautan, 2(2): 185-191.
Feradis. 2006. Peranan antioksidan dalam pembekuan semen. J Peternakan, 6(2): 63-70.
Hidayaturrahmah. 2007. Waktu motilitas dan viabilitas spermatozoa ikan mas (cyprinus carpio l) pada beberapa konsentrasi fruktosa. J Bioscientiae: 9-18.
Ilori BM, Isidahomen CE, Akano K.2012. Effect of ambient temperature on reproductive and physiological traits of nigerian indigenous chickens. J Anim Prod Adv, 2(11): 477-489
Kubovicova E, Riha L, Makarevich AV, Apolen D, Pivko J. 2010. Effect of different semen extenders and additives to insemination doses on ewe´s pregnancy rat. Slovak J Anim
Sci, 43(3): 118-122
Maxwell WMC, PF Watson. 1996. Recent progress in the preservation of ram semen. Anim Reprod Sci, 42: 55-65.
Mayes PA. 1995. Struktur dan Fungsi Vitamin yang Larut dalam Lemak. In: Biokimia Harper. Editor: D. H. Ronardy dan J. Oswari. Penerbit Buku Kedokteran, EGC. Jakarta. Pp. 681-691.
Odu NN, Egbo NN. 2012. Assessment of the Effect of Different Preservatives on the Keeping Quality of Soymilk Stored at Different Temperatures. Nature and Science, 10(09): 1-9
Rehman FU, Zhao C, Shah MA, Qureshi MS, Wang X. 2013. Semen
Extenders and Artificial
Insemination in Ruminants .
Veterinaria.1 (1): 1-8
Reswari R. 1994. Pengaruh beberapa
bahan pengencer terhadap kualitas semen domba ekor gemuk. Repository, Fakultas Peternakan. Institut Pertanian Bogor.
Solihati N, Idi R, Setiawan R, Asmara IY, Sujana BI. 2006. Pengaruh lama penyimpanan semen cair ayam buras pada suhu 50C terhadap periode fertil dan fertilitas sperma. J Ilmu Ternak, 6(1): 7–11.
Sutoyo A. 2000. Peranan Bahan pengencer terhadap penyimpanan spermatozoa sampai penetasan pada ikan mas (cyprinus carpio l.). Repository, Universitas Airlangga. Surabaya.
Tabataei S, Batavani RA, Talebi AR. 2009. Comparison of semen quality in indigenous and ross broiler breeder rosters. J of An and Vet adv, 8(1): 90-93
Taurin, MB. 1977. Daya penyimpanan semen baku dalam bentuk pellet dari
sapi-sapi Frisian Holstein dan Peranakan Ongole. Repository, Fakultas Peternakan. Institut Pertanian Bogor
Toelihere MR. 1993. Inseminasi Buatan pada Ternak. Angkasa. Bandung.
Vishwanath RP, Shannon. 2000. Storage of bovine semen in liquid and frozen
state. Anim Reprod Sci, 62: 23-53.
Wijaya A. 1996. Radikal bebas dan parameter status antioksidan. Forum Diagnosticum. Prodia Diagnostics Education Servicas. Bandung.
Winarno FG. 1981. Madu, Teknologi, Khasiat dan Analisa. Penerbit Ghalia. Jakarta
171
Discussion and feedback