Pola Kepekaan E. coli Yang Diisolasi Dari Feses Burung Kicau Penderita Diare Terhadap Antibiotik Sulfametoksazol, Ampisilin, Dan Oksitetrasiklin (SENSITIVITY PATTERN OF E. coli ISOLATED FROM BIRD CHIRPING WITH DIARRHEA FECES AGAINST ANTIBIOTICS)
on
Buletin Veteriner Udayana
p-ISSN: 2085-2495; e-ISSN: 2477-2712
Volume 7 No. 2: 157-163
Agustus 2015
Pola Kepekaan Escherichia coli Yang Diisolasi Dari Feses Burung Kicau Penderita Diare Terhadap Antibiotik Sulfametoksazol, Ampisilin, Dan Oksitetrasiklin
(SENSITIVITY PATTERN OF Escherichia coli ISOLATED FROM BIRD CHIRPING WITH DIARRHEA FECES AGAINST ANTIBIOTICS SULFAMETHOXAZOLE, AMPICILLIN, AND OXYTETRACYCLINE)
I Kadek Juli Handriana1, Gusti Ketut Suarjana2, Ketut Tono PG2 1Mahasiswa Fakultas Kedokteran Hewan Universitas Udayana 2Lab Mikrobiologi Veteriner Universitas Udayana
Jl. PB. Sudirman Denpasar-Bali
Email: juli.handriana@gmail.com
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pola kepekaan kuman Escherichia coli yang diisolasi dari feses burung kicau penderita diare terhadap antibiotik sulfametoksazol, ampisilin, dan oksitetrasiklin di pasar burung Satria dan Sanglah. Hasil penelitian menunjukkan bahwa dari ke 30 isolat feses burung yang diperiksa, Sulfametoksazol sensitif 3,3%, intermediet 13,3%, dan resisten 83,3%. Pada oksitetrasiklin 3,3% sensitif, 40% intermediet, dan 56,7% resisten, sedangkan untuk ampisilin 13,3% sensitif, 23,3% intermediet, dan 63,3% resisten.
Kata kunci : burung kicau, E. coli, sulfametoksazol, ampisilin, oksitetrasiklin.
ABSTRACT
This study aims were to determine the sensitivity pattern of Escherichia coli bacteria isolated from the feces of birds chirping with diarrhea against antibiotic sulfamethoxazole, ampicillin, and oksitetrasiklin in Satria and Sanglah bird market.The results showed that all 30 isolates from bird faeces were examined, sulfamethoxazole sensitive 3.3%, intermediate 13.3%, and resistant 83.3%. In oxytetracycline 3.3% sensitive, 40% intermediate, and 56.7% resistant . While sensitive to ampicillin 13.3%, 23.3% intermediate, and 63.3% resistant .
Keywords: birds chirping, E. coli, sulfametoksazol, ampicillin, oxytetracycline.
PENDAHULUAN
Indonesia dihuni oleh ribuan jenis burung, salah satu jenis burung yang banyak dipelihara dan digemari masyarakat adalah jenis burung kicau. Burung kicau adalah burung dari golongan Passeri yang hidup bertengger (Passeriformes). Selain karena suaranya yang merdu, warna bulu burung kicau juga sangat beragam dan bervariasi. Hal tersebut membuat banyak pecinta burung berlomba-lomba memelihara burung kicau untuk diperlombakan. Burung kicau
perlu diperhatikan kesehatannya. Maka dari itu dalam pemeliharaannya banyak diberikan multivitamin dan terapi antibiotik.
Masalah yang paling banyak dialami oleh para peternak dan kebanyakan pecinta burung ialah burung yang terkena diare yang disebabkan oleh bakteri, misalnya Salmonella sp, coliform, maupun bakteri lain dari family Enterobacteriaciae. Burung yang terkena diare banyak merugikan peternak dan kalangan pecinta burung seperti: nafsu makan berkurang, berat badan menurun,
burung menjadi malas berkicau, biaya ekonomi meningkat untuk pengobatan, bahkan yang paling buruk yaitu kematian. Secara ekonomi, infeksi bakteri pada unggas sangat merugikan peternak (Wooley et al., 2000; Knobl et al., 2006).
Pemeriksaan bakteri pada feses difokuskan pada pemeriksaan terhadap adanya bakteri coliform patogen seperti Escherichia coli (E. coli). Bakteri E. coli termasuk kelompok bakteri yang digunakan sebagai indikator adanya kontaminasi feses (Haribi dan Yusron, 2010). Bakteri E. coli merupakan penyebab penyakit kolibasilosis. E. coli sebagai penyebab kolibasilosis merupakan bakteri Gram negatif, yang secara normal ada dalam saluran pencernaan. Kuman ini akan dapat berubah menjadi patogen jika lingkungannya mendukung (Besung, 2010).
Kebanyakan E. coli hidup di lingkungan kandang unggas melalui kontaminasi feses. Permulaan kejadian patogen dari E. coli mungkin terjadi di hatchery dari infeksi atau telur yang terkontaminasi, tetapi infeksi sistemik biasanya membutuhkan lingkungan predisposisi atau sebab-sebab infeksi lainnya (Aiello, 1998). Infeksi kolibasilosis biasanya terjadi baik melalui peroral atau inhalasi, air, muntahan, dengan masa inkubasi 3-5 hari. Gejala khas yang ditimbulkan adalah diare. Oleh karena banyaknya kasus diare yang ditemukan oleh para pecinta burung membuat mereka mencoba memberikan antibiotik.
Pemberian antibiotik yang dilakukan sering tidak sesuai dengan dosis anjuran dan tidak meminta rekomendasi dari dokter hewan. Pemakaian antibakteri untuk menangani kolibasilosis mempunyai kelemahan yaitu timbulnya resistensi (Samuilov et al., 2007). Terjadinya resistensi kuman terhadap antibiotik, karena kuman sering terpapar oleh antibiotik yang nantinya akan
menyebabkan kuman akan mempunyai kemampuan untuk mencegah pengaruh antibiotik. Adanya resistensi terhadap antibakteri merupakan persoalan utama dalam menangani kolibasilosis (Burch, 2005). Pemberian antibiotik juga menyebabkan adanya residu antibiotik pada organ (Tajick dan Shohreh, 2006; Knobl et al., 2006). Oleh karena pemberian antibiotik yang kurang tepat atau dosis yang tidak sesuai dapat mengakibatkan bakteri menjadi resisten. Pemilihan antibiotika yang tepat sangat diperlukan guna memperoleh keberhasilan dalam pengobatan (Samuilov et al., 2007; Kazemnia et al., 2014). Agar memperoleh pengobatan yang tepat maka perlu dilakukan uji kepekaan bakteri terhadap antibiotik. Oleh karena itu penelitian penting dilakukan untuk mendapat informasi pola kepekaan bakteri E. coli terhadap antibiotik sulfametoksazol, ampisilin, dan oksitetrasiklin.
METODE PENELITIAN
Materi Penelitian
Sampel yang digunakan dalam penelitian ini adalah feses segar yang didapat dengan cara hapusan rektal yang berasal dari burung kicau yang menderita diare. Jumlah sampel yang diambil berjumlah 30 sampel. Lokasi pengambilan sampel dilakukan di Pasar Burung Satria dan Sanglah.
Metode Penelitian
Segala peralatan yang digunakan dalam penelitian ini dalam keadaan steril. Sterilisasi alat yang tahan terhadap panas dilakukan dengan cara memasukan alat ke dalam autoclave pada temperature 121°C dengan tekanan 15 psi selama 15 menit. Ossa dan needle di sterilisasi dengan membakar pada api bunsen. Sedangkan untuk alat yang tidak tahan panas dilakukan desinfeksi dengan alkohol 70%.
Isolasi dan identifikasi E. coli
Spesimen yang berupa hapusan rektal dari burung kicau yang menderita diare diusapkan pada sisi media eosin methylene blue agar (EMBA). Kemudian dengan ossa steril diusapkan dengan menggunakan metode garis ke seluruh bagian EMBA hingga merata. Setelah itu diinkubasikan pada suhu 37°C selama semalam. Koloni yang tumbuh berwarna hijau metalik dengan bagian pusat koloni berwarna gelap dicurigai sebagai E. coli.
Prosedur uji kepekaan dengan difusi cakram menurut metode Kirby-Bauer
Pada uji ini dipergunakan kertas cakram yang mengandung suatu obat dengan konsentrasi tertentu yang diletakan pada lempeng agar yang telah ditanami kuman. Prosedur uji kepekaan dengan difusi cakram menurut metode Kirby-Bauer (Koneman et al., 1983) sebagai berikut: satu sampai dua koloni kuman E. coli murni dari isolat burung kicau yang menderita diare yang telah ditanam pada media EMBA diinokulasi ke dalam 2 ml perbenihan cair bouillon. Selanjutnya diaduk secara merata sekitar 5-10 menit kemudian perbenihan tersebut diinkubasi pada suhu 37°C selama 1-2 jam hingga terlihat kekeruhan.Setelah inkubasi kekeruhan yang tampak disesuaikan dengan standar kekeruhan MacFarland 0,5 yang setara dengan kandungan kuman 1x108 CFU/ml (Coloni Forming Unit). Suspensi kuman diusapkan secara merata dengan kapas bertangkai steril pada seluruh permukaan media mouller hinton agar (MHA), kemudian dibiarkan selama 15-30 menit agar inokulum tersebut meresap pada media MHA. Kertas cakram (paper disk) yang mengandung antibiotik ditempel dengan pinset steril pada permukaan media tersebut, jarak antara paper disk dengan paper disk lain 2 cm dan 2 cm dari tepi plate. Perbenihan tersebut kemudian diinkubasikan ke dalam inkubator dengan suhu 37°C selama 18-
24 jam. Hasil dan ukuran diameter zone hambat pertumbuhan kuman (killing zone) dari masing-masing paper disk diukur dengan menggunakan jangka sorong. Besarnya diameter daya hambat antibiotik sulfametoksazol, ampisilin, dan oksitetrasiklin yang telah diukur lalu dicocokkan dengan tabel penentuan sensitivitas antibiotik standar Kirby-Bauer.
Tabel 1. Standar diameter daya hambat (mm) antibiotik.
|
Antibiotik |
Zona Diameter (mm) | |||
|
Disk |
R |
I |
S | |
|
Ss |
30 μg |
< 12 |
13-16 |
> 17 |
|
Amp |
10 μg |
< 11 |
12-13 |
> 14 |
|
Ok |
30 μg |
< 14 |
15-18 |
> 19 |
Sumber :Konemanet al, (1983) Keterangan:
Ss: Sulfametoksazole
Amp: Ampicilin
Ok: Oksitetrasiklin
R: Resisten; I: Intermediet; S: Sensitif
Analisis Data
Variabel yang diamati adalah diameter zona hambat (mm). Data yang diperoleh dianalisis secara deskriptif dengan cara menghitung persentase resistensi, intermediet, dan sensitif dari 30 isolat terhadap ketiga antibiotik yang digunakan. Diameter zona hambat yang diperoleh kemudian dicocokkan pada standar zona hambat Kirby-Bauer untuk melihat pola kepekaan kuman terhadap masing-masing antibiotik sulfametok-sazol, ampisilin, dan oksitetrasiklin apakah resisten, intermediate, atau sensitif.
HASIL DAN PEMBAHASAN
Hasil yang didapatkan dari pemeriksaan 30 feses burung kicau penderita diare dari pasar burung Sanglah dan Satria diketahui penyebabnya adalah
bakteri E. coli. E. coli yang tumbuh mempunyai ciri khas pada EMBA yaitu berwarna hijau metalik dengan pusat koloni berwarna hitam seperti pada gambar 1.
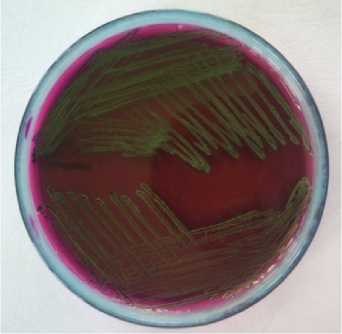
Gambar 1. Koloni E. coli pada media eosin methylen blue agar
Hasil Uji Kepekaan E. coli
Bakteri E. coli yang didapat dari isolasi feses burung kicau penderita diare diuji kepekaannya. Pengujian dilakukan dengan menggunakan antibiotik sulfametoksazol, ampisilin, dan oksitetrasiklin. Hasil yang diperoleh dapat dilihat dari Tabel2.
Hasil Tabel 2 menunjukkan bahwa kuman E. coli penyebab diare pada burung kicau di pasar burung Satria dan Sanglah sebanyak 25 isolat (83,3%) resisten terhadap antibiotik sulfametoksazol, 19 isolat (63,3%) resisten terhadap antibiotik ampisilin, 17 isolat (56,7%) resisten terhadap antibiotik oksitetrasiklin. Empat isolat (13,3%) intermediet terhadap antibiotik sulfametoksazol, tujuh isolat (23,3%) intermediet terhadap antibiotik ampisilin, 12 isolat (40%) intermediet terhadap antibiotik oksitetrasiklin. Empat isolat (13,3%) sensitif terhadap antibiotik ampisilin, dan masing masing satu isolat (3,3%) sensitif terhadap antibiotik sulfametoksazol dan oksitetrasiklin.
Hasil penelitian menunjukkan kuman E. coli sudah multiresisten terhadap
berbagai antibiotika, dalam hal ini terhadap antibiotik sulfametoksazol, ampisilin dan oksitetrasiklin.
Tabel 2. Hasil uji kepekaan escherichia coli penyebab diare pada burung kicau terhadap antibiotik sulfametoksazol, ampisilin, dan oksitetrasiklin
|
No |
Jenis Antibiotik | ||
|
Sulfame-toksazol |
Ampisilin |
Oksitetra-siklin | |
|
1 |
7 mm (R) |
10 mm (R) |
7 mm (R) |
|
2 |
18 mm (S) |
16 mm (S) |
19 mm (S) |
|
3 |
6 mm (R) |
12 mm (I) |
17 mm (I) |
|
4 |
8 mm (R) |
10 mm (R) |
9 mm (R) |
|
5 |
7 mm (R) |
7 mm (R) |
7 mm (R) |
|
6 |
7 mm (R) |
8 mm (R) |
6 mm (R) |
|
7 |
16 mm (I) |
18 mm (S) |
14 mm (R) |
|
8 |
14 mm (I) |
15 mm (S) |
14 mm (R) |
|
9 |
9 mm (R) |
7 mm (R) |
8 mm (R) |
|
10 |
7 mm (R) |
7 mm (R) |
7 mm (R) |
|
11 |
6 mm (R) |
6 mm (R) |
16 mm (I) |
|
12 |
6 mm (R) |
14 mm (S) |
15 mm (I) |
|
13 |
13 mm (I) |
13 mm (I) |
15 mm (I) |
|
14 |
8 mm (R) |
12 mm (I) |
12 mm (R) |
|
15 |
8 mm (R) |
13 mm (I) |
14 mm (R) |
|
16 |
6 mm (R) |
12 mm (I) |
17 mm (I) |
|
17 |
6 mm (R) |
11 mm (R) |
16 mm (I) |
|
18 |
6 mm (R) |
9 mm (R) |
17 mm (I) |
|
19 |
6 mm (R) |
12 mm (I) |
17 mm (I) |
|
20 |
6 mm (R) |
6 mm (R) |
6 mm (R) |
|
21 |
6 mm (R) |
6 mm (R) |
17 mm (I) |
|
22 |
6 mm (R) |
6 mm (R) |
7 mm (R) |
|
23 |
6 mm (R) |
8 mm (R) |
6 mm (R) |
|
24 |
6 mm (R) |
7 mm (R) |
7 mm (R) |
|
25 |
8 mm (R) |
12 mm (I) |
17 mm (I) |
|
26 |
6 mm (R) |
8 mm (R) |
15 mm (I) |
|
27 |
6 mm (R) |
7 mm (R) |
15 mm (I) |
|
28 |
9 mm (R) |
10 mm (R) |
14 mm (R) |
|
29 |
6 mm (R) |
6 mm (R) |
6 mm (R) |
|
30 |
15 mm (I) |
6 mm (R) |
6 mm (R) |
|
R : 25=83,3% |
R:19=63,3% |
R:17=56,7% | |
|
I : 4 = 13,3% |
I :7=23,3% |
I :12=40% | |
|
S : 1 = 3,3% |
S:4=13,3% |
S:1=3,3% | |
Keterangan:
R= Resisten; I= Intermediate; S= Sensitif
Antibiotika yang bisa dipakai secara bebas, ketidaktahuan tentang tata cara pemakaiannya, dan pemberian obat secara sembarangan, menimbulkan generasi kuman yang menjadi kebal (resisten) terhadap antibiotika. Pemakaian antibiotik yang monoton dan tanpa prosedur yang benar dapat meningkatkan resistensi kuman terhadap antibiotik (Speer et al., 1992; Bogaard et al., 2001).
Berdasarkan kejadiannya resistensi dapat dibagi menjadi tiga jenis yaitu: pertama resistensi alamiah, dimana resistensi alamiah merupakan sifat dari antibiotika tersebut yang memang kurang atau tidak aktif terhadap kuman. Kedua resistensi kromosomal, yaitu resistensi kuman terhadap antibiotika yang mempunyai sebab genetik kromosomal misalnya terjadi karena mutasi spontan pada lokus DNA yang mengontrol susceptibility terhadap obat tertentu. Ketiga yaitu resistensi ekstra kromosom, dimana terjadi pemindahan faktor resistensi (faktor R atau plasmid resistensi) dari sel bakteri ke sel bakteri lainnya melalui konjugasi yaitu diantara dua bakteri terbentuk pillus kelamin yang merupakan suatu saluran protein yang digunakan untuk mengangkut faktor R kemudian dibawa ke sel bakteri lain (Gillings, et al., 2008; Svara dan Rankin, 2011; Blair et al., 2015).
Faktor R adalah satu golongan plasmid yang membawa gen-gen untuk resistensi terhadap satu atau lebih antibiotika dan logam berat. Gen dalam plasmid yang menyebabkan resisten obat seringkali memproduksi enzim-enzim yang dapat merusak daya kerja obat (Lanckriet et al., 2010).
• Kuman E. coli sebagai penyebab diare pada burung kicau menunjukkan bahwa 83,3% resisten terhadap antibiotik sulfametoksazol dan 63,3% resisten terhadap antibiotik ampisilin. Penelitian yang sama juga didapatkan oleh Krisnaningsih et al. (2005) yaitu 80% kuman E. coli resisten terhadap antibiotik
ampisilin. Sedangkan E. coli sebagai penyebab diare pada burung kicau menunjukkan bahwa 56,7% resisten dan 40% intermidate terhadap antibiotik oksitetrasiklin. Hal ini berarti penggunaan antibiotik oksitetrasiklin sebaiknya dihindari oleh para peternak maupun pecinta burung, mengingat resistensinya diatas angka 50% walaupun angka intermedietnya mencapai 40% seperti penelitian yang dilakukan oleh Akond et al. (2009), menyebutkan 52% kuman E. coli resisten terhadap antibiotik tetrasiklin. Pemberian obat tetra-chlor yang mengandung tetrasiklin sebaiknya mulai dikontrol dan diperhatikan dengan serius agar resistensi terhadap oksitetrasiklin tidak semakin meningkat (Shaikh et al., 2015).
SIMPULAN DAN SARAN
Simpulan
Kuman E. coli sebagai penyebab diare pada burung kicau menunjukkan 83,3% resisten, 13,3% intermediet, dan 3,3% sensitif terhadap antibiotik sulfametoksazol. Terhadap antibiotik ampisilin 63,3% resisten, (23,3%) intermediet, dan 13,3% sensitif, dan terhadap antibiotik oksitetrasiklin menunjukkan 56,7% resisten, 40% intermediet, dan 3,3% sensitif terhadap
Saran
Untuk mengobati diare pada burung kicau disarankan tidak menggunakan antibiotik tetra-chlor. Perlu dilakukan penelitian lebih lanjut tentang antibiotik jenis lain untuk diuji pola kepekaannya. Pengujian pola kepekaan kuman hendaknya dilakukan secara periodik atau berkala.
UCAPAN TERIMAKASIH
Terimakasih di sampaikan kepada Dekan Fakultas Kedokteran Hewan Universitas Udayana dan Kepala
Laboratorium Mikrobiologi Veteriner yang telah memfasilitasi penelitian ini serta pihak-pihak yang telah membantu dalam proses penelitian dan penulisan artikel ini.
DAFTAR PUSTAKA
Aiello SE, Mays A. 1998. The Merck Veterinary Manual, 8th Ed. New Jersey: White House Station. Pp: 2162-2167.
Akond MA, Alam S, Hassan SMR, Shirin M. 2009. Antibiotic resistance of Escherichia coli isolated from poultry and poultry environment of Bangladesh. J Food Safety, 11: 1923.
Besung INK. 2010. Kejadian kolibasilosis pada anak babi. Majalah Ilmiah Peternakan. 13(1): 1-12.
Bogaard AE van den, London N, Driessen C, Stobberingh EE. 2001. Antibiotic resistance of faecal Escherichia coli in poultry, poultry farmers and poultry slaughterers. J of Antimicrobl Chemother, 47: 763– 771
Burch D. 2005. Problems of antibiotic resistance in pigs in the UK. Farm Anim Practice, 27: 37-43.
Gillings M, Boucher Y, Labbate M, Holmes A, Krishnan S, Holley M, Stokes HW. 2008. The Evolution of class 1 integrons and the rise of antibiotic resistance. J Bacteriol. 190(14): 5095–5100.
Haribi R, Yusron K. 2010. Pemeriksaan Escherichia coli pada air bak wudhu 10 masjid di Kecamatan Tlogosari Semarang. J Kesehatan, 3(1): 21-26.
Blair JMA, Webber MA, Baylay AJ, Ogbolu DO, Piddock LJV. 2015. Molecular mechanisms of antibiotic resistance. Nature Reviews Microbiology. 13: 42–51
Kazemnia A, Ahmadi M, Dilmaghan M. 2014. Antibiotic Resistance Pattern of Different Escherichia coli Phylogenetic Groups Isolated from Human Urinary Tract Infection and Avian Colibacillosis. Iranian Biomed J 18 (4): 219-224
Knobl T, Gomes TA, Vieira MA, Bottino JA, Ferreira AJ. 2006. Occurrence of adhesion encoding operons in Escherichia coli isolated from breeders with salpingitis and chicks with omphalitis. Braz J Microbiol, 37: 140-143.
Koneman EW. 1983. Color atlas and textbook of diagnostic microbiology, 5th Ed. Philadelphia, Lippincott.
Krisnaningsih FMM, Asmara W, Wibowo MH. 2005. Uji sensitifitas isolat Escherichia coli patogen pada ayam terhadap beberapa jenis antibiotik. J Sain Vet, 1(1): 13-18.
Lanckriet A, Timbermont L, De Gussem M, Marien M, Vancraeynest D, Haesebrouck F, Ducatelle R, Van Immersee F. 2010. The effect of commonly used anticoccidials and antibiotics in a subclinical necrotic enteritis model. Avian Pathology, 39(1): 63-68
Shaikh S, Fatima J, Shakil S, Rizvi SMD, Kamal MA. 2015. Antibiotic resistance and extended spectrum beta-lactamases: Types, Epidemiology and treatment. Saudi J of Biological Sci. 22(1): 90-101
Samuilov VD, Bulakhov AV, Kiselevsky DB, Kuznetsova YuE, Molchanova DV, Sinitsyn SV, Shestak A A. 2007. Tolerance to antimicrobial agents and persistence of Escherichia coli and cyanobacteria. Biological Faculty, Lomonosov Moscow State University, Moscow, Rusia; Pp: 1-2.
Speer BS, Shoemaker NB, Salyers AA.
1992. Bacterial resistance to tetracycline: mechanisms, transfer, and clinical significance. Clin Microbiol Rev. 1992 Oct; 5(4): 387– 399.
Svara F, Rankin DJ. 2011. The evolution of plasmid-carried antibiotic resistance. BMC
Evolutionary Biology. 11:130
DOI: 10.1186/1471-2148-11-130
Tajick MA, Shohreh B. 2006. Detection of Antibiotics Residue in Chicken Meat Using TLC. Inter J of Poultry Sci 5(7): 611-612.
Wooley RE, Gibbs PS, Brown TP, Maurer JJ. (2000). Chicken embryo lethality assay for determining the virulence of avian Escherichia coli isolates. Avian Dis, 44: 318-324.
163
Discussion and feedback