PENGARUH LAMA PENYINARAN UV-C PADA BIJI CABAI RAWIT(CAPSICUM FRUSTESCENT L) TERHADAP LAJU PERTUMBUHAN TANAMAN, KADAR KLOROFIL-A DAN KERAPATAN STOMATA DAUN SERTA KADAR KAPSAISIN BUAH CABAI RAWIT
on
Pengaruh Lama Penyinaran UV-C pada biji cabai Rawit (Capsicum Frustescent L.) terhadap laju pertumbuhan
(R.A. Restia Pranagari, dkk.)
PENGARUH LAMA PENYINARAN UV-C PADA BIJI CABAI RAWIT(CAPSICUM FRUSTESCENT L) TERHADAP LAJU PERTUMBUHAN TANAMAN, KADAR KLOROFIL-A DAN KERAPATAN STOMATA DAUN SERTA KADAR
KAPSAISIN BUAH CABAI RAWIT
R.A Restia Pranagari1, Ni Nyoman Rupiasih2, Hery Suyanto3
-
1,2,3Jurusan Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Kampus Bukit Jimbaran, Badung, Bali Indonesia 80361. *
Email : rupiasih@unud.ac.id
Abstrak
Lama penyinaran sinar UV-C mempunyai pengaruh terhadap tinggi tanaman, laju pertumbuhan tanaman sampai fase generatif, kadar klorofil-a, kerapatan stomata dan kadar kapsaisin buah cabai. Perlakuan sampel pada biji/benih dengan radiasi ultraviolet C (UV-C) masing-masing selama 5 menit, 15 menit, 25 menit, 30 menit, 35 menit, 50 menit, 1 jam, 2 jam, 6 jam, 8 jam, 24 jam dan 48 jam. Hasil penelitian menunjukkan bahwa efek penyinaran ultraviolet-C pada biji berpengaruh negatif pada fase vegetatif yaitu terhambatnya perkecambahan. Sedangkan pada fase generatif, tanaman yang mendapat paling sedikit dosis penyinaran UV terhambat pertumbuhannya. Penyinaran ultraviolet pada biji sangat berpengaruh negatif pada kadar klorofil-a. Kadar klorofil-a yang paling sedikit pada sampel perlakuan 5 menit ( S1). Kerapatan stomata tanaman Biji cabai rawit yang diberi perlakuan penyinaran UV C memiliki kerapatan stomata yang lebih besar dibandingkan tanaman yang tidak diberi perlakuan. Kadar kapsaisin yang paling banyak terdapat pada biji cabai dengan lama penyinaran sinar UV-C 2 jam (S8) yaitu rata-rata sebesar 755,17 mg/L tiap buah cabai.
Kata kunci : UV-C, Laju pertumbuhan, klorofil-a, kerapatan stomata, kadar kapsaisin
Abstract
While irradiation of UV-C light has an effect on plant height, plant growth until the generative phase, chlorophyll-a content, stomatal density and concentration capsaicin chilies. Sample treatment on seeds / seedlings to ultraviolet C radiation (UV-C) respectively for 5 minutes, 15 minutes, 25 minutes, 30 minutes, 35 minutes, 50 minutes, 1 hour, 2 hours, 6 hours, 8 hours, 24 hours and 48 hours. The results showed that the effect of ultraviolet-C irradiation on seed negative effect on the inhibition of germination of the vegetative phase. While the generative phase, the plant that gets the least amount of UV radiation dose stunted. Ultraviolet radiation on seed very negative effect on the levels of chlorophyll-a. Chlorophyll-a levels were at least 5 minutes in sample treatment (S1). Stomatal density of cayenne pepper plant seeds treated with UV-C irradiation had a greater stomatal density than the untreated plants. Capsaicin levels which are most numerous in the old bean chili with UV-C irradiation 2 hours (S8) is an average of 755.17 mg / L each of chilies.
Keywords: UV-C. Growth rate, chlorophyll-a, stomata density, capsaicin content
Tumbuhan menangkap cahaya yang merupakan sumber energi fotosintesis menggunakan pigmen yang disebut klorofil. 40
Pigmen inilah yang memberi warna hijau pada tumbuhan. Klorofil terdapat di dalam organel yang disebut kloroplas. Meskipun seluruh bagian tubuh tumbuhan berwarna hijau, namun sebagian besar energi dihasilkan di daun. Di
dalam daun terdapat lapisan sel yang disebut mesofil yang mengandung setengah juta kloroplas setiap milimeter perseginya. Cahaya akan melewati lapisan epidermis, menuju mesofil, tempat terjadinya sebagian besar proses fotosintesis. Ultraviolet dapat menyebabkan gangguan fungsi kloroplas dan rusaknya membran DNA dan berbagai struktur sel tanaman (Utami, 2008).
Berdasarkan panjang gelombangnya, radiasi ultraviolet ( UV) dibagi menjadi 3 yaitu UV-A , UV-B, UV-C. UV-A mempunyai panjang gelombang 380-315 nm, UV-B mempunyai panjang gelombang 315-280 nm dan UV-C mempunyai panjang gelombang 280-100 nm (Thies adolf, 2008). Dengan peningkatan radiasi ultraviolet pada permukaan bumi, karena terjadinya penipisan ozon oleh polutan atmosfer diperkirakan turut menyebabkan peningkatan kanker kulit (Robbin dan Cotran, 2008).
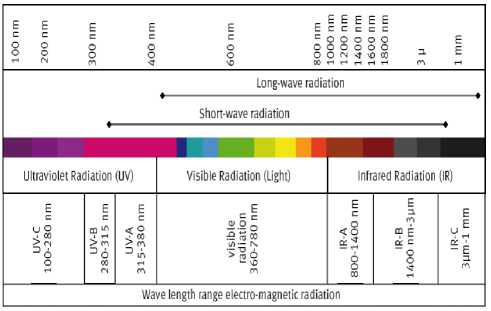
Gambar 2.1 Spektrum gelombang sinar UV (Adolf Thies GMBH & CO KG, 2008).
Absorbsi cahaya UV-Vis mengakibatkan transisi elektron, yaitu perpindahan elektron-elektron dari orbital keadaan dasar yang berenergi rendah ke orbital keadaan tereksitasi berenergi lebih tinggi. Energi yang terserap kemudian terbuang sebagai cahaya atau tersalurkan dalam reaksi kimia. Absorbsi cahaya tampak dan radiasi ultraviolet meningkatkan energi elektron sebuah molekul, artinya energi yang disumbangkan oleh foton-foton memungkinkan elektron-elektron itu mengatasi banyaknya inti dan keluar ke orbital baru yang lebih tinggi energinya. Semua molekul dapat menyerap radiasi dalam daerah UV karena mereka mengandung elektron, yang dapat dieksitasi ke tingkat energi yang lebih tinggi. Absorbsi untuk transisi elektron seharusnya tampak pada panjang gelombang diskrit sebagai suatu spektrum garis atau puncak tajam. Spektrum UV terdiri dari pita absorbsi, lebar pada daerah panjang gelombang yang lebar. Ini disebabkan terbaginya keadaan dasar dan keadaan eksitasi sebuah molekul dalam subtingkat-subtingkat rotasi dan vibrasi. Transisi elektron dapat terjadi dari subtingkat keadaan dasar ke keadaan eksitasi (Benny rio, 2011).
Tanaman cabai rawit merupakan salah satu jenis tanaman budidaya atau holtikultura yang tergolong dari famili terung-terungan. Tanaman cabai rawit termasuk tanaman yang berumur
pendek yang tumbuh sebagai perdu atau semak dengan tinggi tanaman dapat mencapai 1,5 m (Cahyono, 2007).
Secara umum tanaman cabai mengalami 2 fase kehidupan yaitu fase vegetatif dan fase generatif. Fase vegeratif adalah masa kehidupan tanaman cabai dari umur 0 sampai 40 hari (setelah tanam) dan fase generatif dari umur 40 sampai 50 hari. Pada fase vegetatif, energi pertumbuhan cenderung mengarah pada perkembangan batang dan perakaran. Pada fase generatif, energi pertumbuhan digunakan untuk pembungaan, pembuahan, perkembangan buah, dan pematangan buah (Wahyudi dan M. Topan, 2001).
Teknik spektroskopi adalah suatu teknik analisis físika-kimia untuk mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik. Interaksi ini mengakibatkan terjadinya: emisi, scattering (hamburan) dan absorpsi (serapan. Dalam penelitian ini digunakan spektrometer UV-Vis untuk mengukur besarnya absorpsi klorofil-a dari daun tanaman cabai .
Kromatografi Lapis Tipis atau disingkat KLT merupakan salah satu kromatografi planar di samping kromatografi kertas. Pada Kromatografi Lapis Tipis fase geraknya atau pelarut pengembang akan bergerak naik sepanjang fase diam karena adanya gaya kapilaritas pada sis-
tem ascending. Pemilihan fase gerak baik untuk TLC ataupun HPLC didasarkan pada keterpisahan senyawa-senyawa dalam analit yang didasarkan pada nilai Rf. Suatu campuran zat dapat dipisahkan dengan teknik KLT berdasarkan perbedaan afinitas masing-masing komponen pada fase gerak dan fase diamnya. Komponen yang telah terpisah, besar serapannya dapat diukur dengan spektrodensitometer. Kadar dari sampel dapat ditentukan dengan perbandingan antara serapan sampel dan bakunya atau standarnya (Widjaja dan Laksmini, 2010).
Penelitian dilaksanakan di empat tempat yaitu penyinaran biji cabai dilaksanakan di Laboratorium Gelombang dan Optik Jurusan Físika FMIPA, UNUD. Proses penumbuhan dan analisa stomata daun dilaksanakan di Jurusan Biologi FMIPA, proses pengukuran kadar klorofil-a dilaksanakan di Laboratorium Analitik Universitas Udayana dan pengukuran kadar kapsaisin dilaksanakan di Laboratorium Forensik Badung, Bali.
Perlakuan sampel berupa biji/benih yang disinari dengan radiasi ultraviolet C (UV-C) masing-masing selama 5 menit, 15 menit, 25 menit, 30 menit, 35 menit, 50 menit, 1 jam, 2 jam, 6 jam, 8 jam, 24 jam dan 48 jam. Suhu masing-masing sampel selama penyinaran adalah konstan yaitu 30 ºC (sama dengan suhu ruang).
Pengukuran tinggi tanaman dilakukan dengan cara mengukur tinggi masing-masing tanaman mulai dari permukaan media tanam menjadi sampai ujung tanaman. Pengukuran dilakukan menggunakan penggaris yang panjangnya 30 cm dengan skala terkecil adalah 0,1 cm.
Laju pertumbuhan tanaman ditentukan berdasarkan pola bentuk regresi dari tinggi tanaman rata-rata pada masing-masing fase tanaman yaitu vegetatif dan generatif untuk masing-masing sampel. Jika regresinya berbentuk linier atau y = ax + b, maka laju pertumbuhannya adalah a (cm/hari). Jika regresi berbentuk polinomial y = -ax2 + bx +c, maka diperoleh -a adalah nilai perlambatan pertumbuhan tanaman.
Penentuan kerapatan stomata daun cabai rawit dilakukan dengan menggunakan metode utuh yaitu dengan membuat sayatan paradermal pada daun yang diwarnai dengan Safranin 1% (Damayanti, 2007 yang dikutip dari Sass, 1951):
-
1. Daun difiksasi dalam alkohol 70 %,
kemudian dicuci dengan aquades.
-
2. Selanjutnya rendam daun tersebut dalam larutan 20% HNO3 selama 3-4 jam, agar lapisan epidermis dapat dengan mudah dilepaskan dari jaringan mesofil. Lapisan
epidermis bawah daun dapat diperoleh dengan menyayat permukaan bawah daun menggunakan bantuan pinset atau silet. Selanjutnya sayatan tersebut disebut sebagai lapisan epidermis.
-
3. Rendam lapisan epidermis dengan Safranin 1% selama 5 menit.
-
4. Lapisan epidermis yang telah diwarnai
diletakkan pada gelas objek dengan ditetesi
gliserin dan ditutup dengan gelas penutup.
Preparat diamati di bawah mikroskop
dengan perbesaran 400x.
Jumlah stomata
Kerapa tan Stomata = n
luasbidang pandang
(1)
-
■ Ambil beberapa helai daun, kemudian ditimbang sebanyak 0,5 g lalu dicuci dengan air suling.
-
■ Daun yang sudah dicuci kemudian digerus dengan mortir dan pestelnya.
-
■ Hasil gerusan daun tersebut diberi acetone 80% sebanyak 10 ml kemudian masukkan ke dalam mesin spinner dengan kecepatan 3500 rpm selama 5 menit. Hal ini bertujuan untuk memisahkan klorofil dengan sampah/ampas hasil ekstraksi.
-
■ Ukur nilai penyerapan(absorbansi) dengan spektrofotometer UV-Vis pada panjang gelombang 647 nm dan 664 nm. Konsentrasi klorofil-a dihitung dengan metode Jeffery dan Humphrey sebagai berikut: Chl a (mg/L) = 11,93 E664 – 1,93 E647.
Dalam penelitian ini buah cabai hasil panen dari masing-masing sampel dikeringkan selama 3 hari pada suhu 60 0 C, kemudian cabai dihaluskan dengan mortir dan pestelnya, sehingga diperoleh serbuk cabai yang siap diekstraksi. Untuk ekstraksi senyawa kapsaisin dilakukan dengan cara:
-
1. Timbang berat serbuk cabai sebanyak 3 g dan larutkan dalam 10 ml etanol. Campuran atau larutan ekstrak dikocok dengan menggunakan vortex selama 5 menit dengan kecepatan 8000 rpm. Larutan ekstrak didiamkan selama 3 jam.
-
2. Proses ekstraksi dilakukan 3 kali lalu campur ekstrak pertama, kedua, ketiga (± 30 ml) kemudian buang sisa endapan tersebut.
-
3. Ekstrak disaring dengan menggunakan kertas Whatmann No 41, lalu ekstrak hasil saringan diuapkan sampai berbentuk gel. Setelah itu, ekstrak dilarutkan kembali dalam 10 ml methanol dan disaring kembali dengan kertas Whatmann no.41 untuk menghilangkan ampas yang masih terlarut.
-
4. Proses 1-3 dilakukan untuk mengekstraksi kapsaisin dari tiap-tiap sampel: S0, S1, S2, S3, S4, S5, S6, S7, S8, S9, S10, S11, S12.
-
5. Masing-masing sampel kapsaisin sebanyak 5 ml ditotol ( spot plate) 5 μl pada plat silica gel 254. Plat silika gel 254 berukuran 10 cm x 10 cm mempunyai 9 track. Setiap satu track ditotol satu sampel, kira-kira 1 cm dari tepi bawah plat. Sampel-sampel yang sudah
ditotol pada plat tersebut dielusi di dalam chamber 41, yang sudah diisi dengan toluene dan etil masing-masing 6 ml dan 4 ml. Proses elusi dilakukan selama + 15 menit. Kemudian plat sampel diangkat dan didiamkan ± 30 menit (pada posisi horizontal). Plat sampel siap di scan dengan alat spektrodensitometer.
-
IV. HASIL DAN PEMBAHASAN
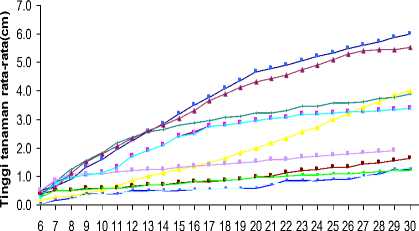
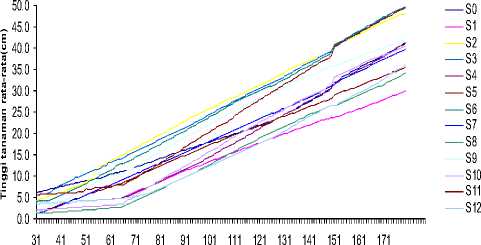
Grafik tinggi tanaman sebagai fungsi waktu dari hari ke 6 sampai 30 (fase vegetatif) terlihat pada Gambar 4.1.1 dan dari hari ke 30 sampai 180 untuk (fase generatif) seperti pada Gambar 4.1.2.
Hari ke-
S1
S2
S3
S4
S5
S6
S7
S8
S9
S10
S11
S12
Gambar 4.1.1 Grafik tinggi tanaman rata-rata sebagai fungsi waktu pada hari ke 6 sampai 30 (fase vegetatif)
Hari ke-
Gambar 4.1.2 Grafik tinggi tanaman rata-rata sebagai fungsi waktu pada fase generatif pada hari ke 31 sampai 180.
Gambar 4.1.1 menunjukkan bahwa secara umum tinggi tanaman rata-rata kontrol lebih tinggi dibanding tanaman yang mendapat perlakuan dan sampel dengan tinggi tanaman rata-rata paling rendah adalah S9.
Gambar 4.1.2 secara umum menunjukkan bahwa tinggi tanaman rata-rata dengan penyinaran UV lebih tinggi dibandingkan tanaman yang tidak mendapatkan perlakuan penyinaran UV (S0).
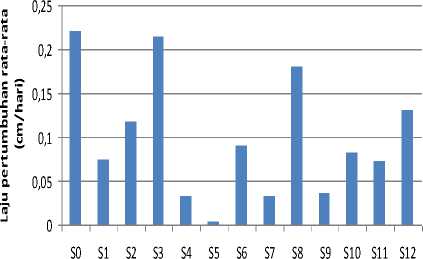
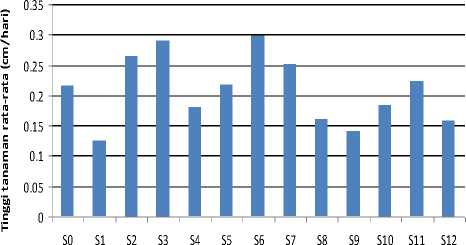
Dari grafik tinggi tanaman rata-rata sebagai fungsi waktu pada Gambar 4.1.1 dan 4.1.2 dapat dihitung laju pertumbuhan untuk masing-masing sampel dengan melakukan regresi polinomial y = at2 +bt + c dan regresi linier y = dt + e , pada masing-masing fase tanaman pada tiap sampel dengan a dan d masing-masing adalah percepatan dan laju pertumbuhan tanaman, y adalah tinggi tanaman rata-rata dan t adalah hari pengamatan. Di bawah ini adalah grafik laju pertumbuhan rata-rata fase vegetatif dan generatif seperti Gambar 4.2 dan 4.3.
sampel
Gambar 4.2 Grafik laju pertumbuhan tanaman rata-rata pada fase vegetatif (6-30 hari).
sampel
Gambar 4.3 Grafik rata-rata laju pertumbuh-an tanaman rata-rata pada fase generatif (31-180 hari).
Untuk grafik stomata daun ditunjukkan pada gambar di bawah ini.
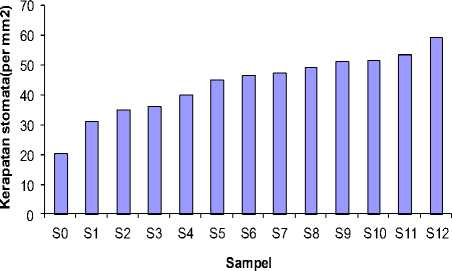
Gambar 4.4 Nilai kerapatan stomata untuk masing-masing sampel.
Dari Gambar 4.6 terlihat bahwa kerapatan stomata daun dari tanaman dengan perlakuan penyinaran UV-C pada bijinya adalah lebih besar dibandingkan Kontrol (tanpa penyinaran UV-C pada bijinya).
Grafik kadar klorofil-a ditunjukkan pada Gambar 4.5, menunjukkan kadar klorofil-a pada S1, S2, S5, S6,S7, dan S9 lebih kecil dari Sampel Kontrol (S0).
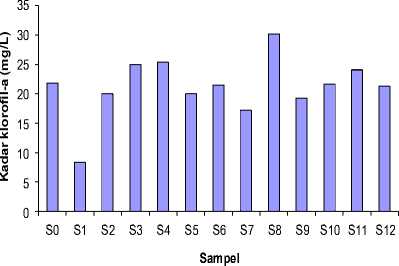
Gambar 4.5 Gambar kadar klorofil-a untuk masing-masing sampel
Dari penelitian yang dilakukan didapat konsentrasi kapsaisin sebagaimana diberikan pada Gambar 4.6, memperlihatkan bahwa konsentrasi kapsaisin S2, S3, S4, S5, S6, S9, S10, S11, dan S12 lebih kecil dari S0.
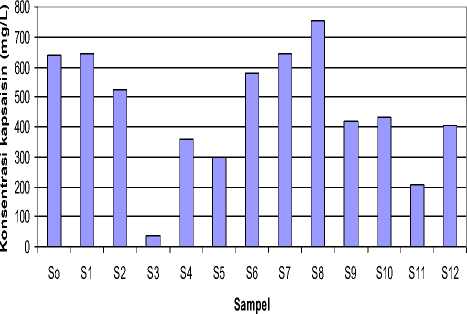
Gambar 4.6 Grafik konsentrasi kapsaisin buah cabai rawit pada masing-masing sampel.
V. KESIMPULAN
Berdasarkan hasil penelitian yang diperoleh dan pembahasan, dapat disimpulkan bahwa dari hasil yang diperoleh bahwa hasil terbaik adalah perlakuan penyinaran UV-C selama 2 jam (S8) yang menghasilkan total kapsaisin tiap buah sebesar 755,17 mg/L.
Daftar Pustaka
Bambang Cahyono, Ir. 2007. Cabai rawit-Teknik Budidaya dan analisis Usaha tani. Penerbit: Kanisius 2007
Damayanti, 2007 Analisis jumlah kromosom dan anatomi stomata pada beberapa plasma nutfah pisang ( MUSA SP.) volume 4 nomer 2.
Rio Benny, 2011. Spektroskopi inframerah (FTIR) dan sinar tampak (UV VIS).Universitas Andalas. Padang
Robin dan Cotrans, 2008. Dasar patologis penyakit edisi 7. Penerbit: buku kedokteran
Thies adolf, 2008. Radiation the world of weather data.Geneva
Tri Utami, 2008. Pengaruh radiasi UV-C dan periode penyiraman terhadap kandungan flavanoid daun sambung nyawa ( Gynura procumbens L) makalah seminar departemen agronomi dan holtikultura Faklutas pertanian Institute pertanian bogor.
Wahyudi, Ir dan Topan M, 2011. Panen cabai di pekarangan Rumah. Penerbit: Agromedia pustaka.
Widjaja, I.N.K dan N.P. L. Laksmini, 2010. petunjuk praktikum kimia analisis. Bukit Jimbaran: Jurusan Farmasi, F.MIPA UNUD
46
Discussion and feedback