Pengaruh waktu induksi dan ZPT terhadap pertumbuhan kalus kotiledon kacang panjang (Vigna unguiculata subsp. sesquipedalis)
on
JURNAL BIOLOGI UDAYANA
P-ISSN: 1410-5292 E-ISSN: 2599-2856
Volume 27 | Nomor 2 | Desember 2023
DOI: https://doi.org/10.24843/JBIOUNUD.2023.v27.i02.p07
Pengaruh waktu induksi dan ZPT terhadap pertumbuhan kalus kotiledon kacang panjang (Vigna unguiculata subsp. sesquipedalis)
The effect of induction time and PGR on callus growth of yard-long bean (Vigna unguiculata subsp. sesquipedalis) cotyledon
Paramita Cahyaningrum Kuswandi*, Selma Nafilatul Husna
Department of Biology Education, Faculty of Mathematics and Science, Universitas Negeri Yogyakarta.
Jl. Colombo No.1, Karangmalang, Sleman, Yogyakarta 55281
*Email: paramita@uny.ac.id
Diterima 5 Mei 2023
INTISARI
Disetujui
18 Desember 2023
Tanaman kacang panjang adalah komoditas pertanian yang sangat berpotensi untuk dikembangkan karena mudah dibudidayakan dan pangsa pasar cukup tinggi, namun masih ada permasalahan dalam memenuhi kebutuhan benih dan masih rentan terhadap hama dan penyakit. Oleh karena itu perlu dilakukan upaya peningkatan produksi dan induksi variasi kacang panjang. Salah satu metode yang dapat digunakan adalah kultur jaringan untuk induksi variasi somaklonal dan/atau pembentukan tanaman transgenik. Penelitian ini bertujuan untuk mengetahui pengaruh variasi waktu inisiasi kalus dan pengaruh pemberian ZPT terhadap pertumbuhan kalus eksplan kotiledon kacang panjang. Sterilisasi biji dilakukan dengan menggunakan detergen, natrium hipoklorit 10%, alkohol 70% dan akuades steril. Hasil penelitian menunjukkan bahwa variasi waktu inisiasi kalus pada media MS dengan penambahan ZPT 2,4-D serta penggunaan beberapa variasi ZPT pada subkultur mampu menginisiasi kalus dan mempengaruhi ukuran kalus, warna kalus, serta persentase browning eksplan kotiledon kacang panjang. Waktu inisiasi kalus 4 minggu dengan kombinasi konsentrasi BAP 2 ppm dan IAA 0,1 ppm menghasilkan ukuran kalus paling besar dan warna kalus putih kecoklatan. Penambahan ZPT saat subkultur memiliki persentase browning yang lebih kecil dari perlakuan tanpa ZPT.
Kata kunci: Vigna unguiculata subsp. sesquipedalis, kotiledon, ZPT, in vitro
ABSTRACT
Yard-Long bean plants are an agricultural commodity that has great potential to be developed because they are easy to cultivate, their market share is also quite high but there are still problems in meeting the need for sufficient seeds and they are still susceptible to pests and disease. Therefore, efforts need to be made to increase production and induce variations. One method that can be used is tissue culture for the induction of somaclonal variations and/or the formation of transgenic plants. This study aims to determine the effect of variations in callus initiation time and the effect of Plant Growth Regulators (PGR) administration on the growth of long bean cotyledon explant callus. Seed sterilization was carried out using detergent, 10% sodium hypochlorite, 70% alcohol and sterile distilled water. The results of the research showed that variations in callus initiation time on MS media with the addition of 2,4-D PGR and the use of several variations of PGR in subcultures were able to initiate callus and influence callus size, callus color, and the percentage of browning of Yard-long bean cotyledon explants. Callus initiation time of 4 weeks with a combination of 2 ppm BAP concentration with 0.1 ppm IAA produced the largest callus size and brownish white callus color. The addition of PGR during subculture had a smaller browning percentage than the treatment without PGR.
Keywords: Vigna unguiculata subsp. sesquipedalis, cotyledon, PGR, in vitro
PENDAHULUAN
Tanaman kacang panjang (Vigna unguiculata subsp. sesquipedalis) adalah komoditas pertanian yang sangat berpotensi untuk dikembangkan karena selain mudah dibudidayakan, pangsa pasarnya juga cukup tinggi meski terdapat fluktuasi produktivitas dari tahun ke tahun (Badan Pusat Statistik Indonesia 2020). Budidaya kacang panjang menggunakan metode tradisional memiliki beberapa kekurangan diantaranya banyaknya serangan hama dan penyakit tanaman, kondisi cuaca dan lingkungan yang tidak mendukung, serta kendala lapangan seperti terbatasnya lahan pertanian. Adanya benih yang dapat menjadi pembawa virus pada kacang panjang juga menjadi salah satu kendali dalam budidaya dan pengembangan varietas tahan penyakit (Susetio & Hidayat, 2014). Salah satu upaya untuk mengatasi permasalahan tersebut adalah dengan menggunakan metode budidaya in vitro (teknik kultur jaringan). Hasil kultur jaringan tumbuhan dapat berupa perbanyakan bibit atau memunculkan variasi baru yang produktivitasnya lebih tinggi dan tahan terhadap penyakit.
Penentuan metode regenerasi menjadi faktor penting dalam penanaman secara in vitro. Organogenesis secara tidak langsung (indirect organogenesis) merupakan organogenesis yang berkembang dari kalus menjadi organ seperti tunas dan akar. Kalus dapat dihasilkan dari berbagai sumber eksplan seperti tunas muda, ujung akar, daun, kotiledon, buah, dan bagian dari bunga. Setelah kalus terbentuk, kalus dirangsang untuk menghasilkan tunas dengan melakukan subkultur ke media dengan kandungan zat pengatur tumbuh (ZPT) yang berbeda (Hesami & Daneshvar, 2016; Hesami & Daneshvar, 2018). Jumlah pemindahan (sub kultur) dan durasi selama kalus berada pada satu jenis media menentukan seberapa besar kemungkinan terjadi variasi pada tanaman hasil kultur jaringan. Variasi ZPT juga menentukan regenerasi yang tepat dari eksplan ke kalus kemudian ke tahap organogenesis.
Penggunaan ZPT jenis 2,4-D untuk induksi kalus sudah banyak digunakan di berbagai spesies tumbuhan. Pada tumbuhan legum, 2,4-D diketahui dapat menginduksi kalus dari eksplan hipokotil dan kotiledon (Budisantoso & Prayoga, 2014) atau dari biji (Ariani et al., 2016). Durasi waktu induksi kalus dapat menentukan ukuran kalus dengan meningkatnya pembelahan sel selama di media induksi. Proliferasi sel pada kalus juga bisa menjadi salah satu faktor untuk meningkatkan peluang terjadinya variasi dari hasil kultur jaringan. Penggunaan ZPT lain seperti BAP dan IAA pada penanaman in vitro sering digunakan pada tahap induksi tunas dan/atau akar (Royani et al., 2015)
Tujuan dalam penelitian ini adalah menentukan durasi waktu induksi kalus dan variasi ZPT pada media sub kultur yang optimal untuk menghasilkan kalus dengan cepat dan kualitas baik yang dapat digunakan sebagai tahap awal perakitan tanaman transgenik atau induksi variasi somaklonal.
MATERI DAN METODE
Tempat dan waktu penelitian
Penelitian dilakukan di Laboratorium Kultur Jaringan, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Negeri Yogyakarta, dari bulan Juni -September 2022.
Bahan dan alat
Alat yang digunakan antara lain botol media (botol kaca), aluminium foil, autoklaf, erlenmeyer, gelas ukur, pengaduk magnetik dengan pemanas (Hotplate stirrer), timbangan analitik, pH meter, pinset, lampu Bunsen, skalpel, cawan petri, kertas saring, kertas payung, kertas label, plastik wrap, oven, rak kultur,
karet gelang, sarung tangan lateks, dan almari LAF (Laminar Air Flow). Bahan yang digunakan dalam penelitian ini antara lain biji kacang panjang, deterjen, akuades steril, larutan natrium hipoklorit (Bayclin®) 10%, alkohol 70% dan 96%, sukrosa, agar-agar, media MS (Murashige Skoog), Zat Pengatur Tumbuh (ZPT) 2,4-D (2,4-dichlorophenoxyacetic acid), BAP (Benzyl amino purin), dan IAA (Indole acetic acid).
Metode
Bahan tanam in vitro (eksplan) adalah kotiledon kacang panjang yang diperoleh dari hasil perkecambahan in vitro. Perkecambahan benih kacang panjang yang sudah disterilisasi ditanam pada media ½ MS. Sterilisasi biji-biji kacang panjang dilakukan dengan larutan deterjen dicampur selama 5 menit. Biji-biji kacang panjang dikeluarkan dan dibilas dengan air mengalir sampai bersih. Tahap sterilisasi kemudian dilanjutkan di dalam almari LAF (Laminar Air Flow) secara aseptik. Sterilisasi dilakukan dengan larutan dengan 10% natrium hipoklorit selama 10 menit, kemudian dibilas menggunakan akuades steril sebanyak 3 kali. Setelah itu sterilisasi dengan alkohol 70% selama 1 menit dan dibilas menggunakan akuades steril sebanyak 1 kali. Biji-biji kacang panjang yang sudah steril ditanam di media ½ MS. Setelah satu minggu dan biji sudah berkecambah, kotiledon dipotong dan dipindah ke media induksi kalus. Durasi waktu induksi kalus adalah selama 2 atau 4 minggu pada media dengan 2 ppm 2,4-D. Kemudian eksplan dipindah ke media sub kultur yaitu media MS dengan variasi BAP dan IAA (Tabel 1) dan dilakukan pengamatan selama 8 minggu.
Pembuatan Media ½ MS tanpa ZPT (media perkecambahan secara in vitro)
Akuades steril dimasukkan ke dalam erlenmeyer sebanyak 300 ml dan diletakkan diatas hotplate dan magnetic stirrer. Bubuk media MS (CV AgriBio) yang mengandung makronutrien, iron, mikronutrien, dan vitamin, dimasukkan sebanyak 1,1075 g, kemudian diaduk menggunakan magnetic stirer hingga larut. Sukrosa dimasukkan sebanyak 15 g dan diaduk hingga larut, kemudian diukur pH hingga derajat keasaman antara 5-6. Akuades steril ditambahkan lagi sebanyak 200 mL. Bubuk agar (Swallow Globe) dimasukkan sebanyak 3,5 g, kemudian larutan diaduk dan dipanaskan hingga mendidih. Setelah mendidih, media dituangkan ke dalam botol-botol steril sebanyak ±20 ml per botol. Botol yang telah diisi larutan media disterilkan menggunakan autoklaf dengan suhu 1210 C selama 15 menit. Media yang sudah dingin disimpan selama 3 hari sebelum siap digunakan.
Pembuatan media MS dengan ZPT
Akuades steril dimasukkan ke dalam erlenmeyer sebanyak 300 ml dan diletakkan diatas hotplate dan magnetic stirrer. Bubuk media MS dimasukkan sebanyak 2,215 g, kemudian diaduk hingga larut. Sukrosa dimasukkan sebanyak 15 g dan diaduk hingga larut. Masing-masing larutan media diberi perlakuan ZPT: 2ppm 2,4 D, 2 ppm BAP, dan 2 ppm BAP + 0,1 ppm IAA. Diukur pH media hingga derajat keasaman sesuai, yaitu antara pH 5-6. Akuades steril ditambahkan sebanyak 200 ml. Bubuk agar dimasukkan sebanyak 3,5 g, kemudian larutan diaduk dan dipanaskan hingga mendidih. Setelah mendidih, dituangkan ke dalam botol steril sebanyak ± 20 mL. Botol steril yang telah diisi larutan media disterilkan menggunakan autoklaf dengan suhu 121°C selama 15 menit. Media yang sudah dingin dan disimpan selama 3 hari sebelum siap digunakan.
Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimen dengan menggunakan Rancangan Acak Lengkap (RAL). Variabel bebas terdiri dari: 2 perlakuan media induksi (MS dan MS + 2 ppm 2,4-D), 2 perlakuan lama induksi ( 2 dan 4 minggu) dan 3 perlakuan media sub kultur ( MS, MS + 2ppm BAP dan MS + BAP 2 ppm + IAA 0,1 ppm) (Tabel 1). Untuk setiap perlakuan terdapat 5 ulangan. Pengambilan data dilakukan dengan metode observasi dan menggunakan skoring. Data diambil 2 minggu setelah subkultur, yaitu pada minggu ke-2, minggu ke-4, minggu ke-6, dan minggu ke-8. Variabel terikat adalah skor ukuran kalus, warna kalus, dan jumlah browning yang diambil dengan menggunakan skoring berdasarkan penelitian Dewi et al. (2012). Skor untuk pengamatan disajikan pada Gambar 1 (skor ukuran kalus), Gambar 2 (skor warna kalus) dan Gambar 3 (skor persentase eksplan browning).

(a)

(b)

Tabel 1. Kode perlakuan dengan tiap macam media dan durasi induksi kalus
|
No. |
Kode perlakuan |
Media induksi kalus |
Durasi di media induksi (minggu) |
Media sub kultur |
|
1 |
A1B1 |
Media MS + 2,4-D 2 ppm |
4 |
MS + BAP 2 ppm. |
|
2 |
A1B2 |
Media MS + 2,4-D 2 ppm |
4 |
MS + BAP 2 ppm + IAA 0,1 ppm. |
|
3 |
A1C1 |
Media MS + 2,4-D 2 ppm |
4 |
MS |
|
4 |
A2B1 |
Media MS + 2,4-D 2 ppm |
2 |
MS + BAP 2 ppm. |
|
5 |
A2B2 |
Media MS + 2,4-D 2 ppm |
2 |
MS + BAP 2 ppm + IAA 0,1 ppm. |
|
6 |
A2C1 |
Media MS + 2,4-D 2 ppm |
2 |
MS |
|
7 |
C1C1 |
Media MS |
4 |
MS |
|
8 |
C1B1 |
Media MS |
4 |
MS + BAP 2 ppm |
|
9 |
C1B2 |
Media MS |
4 |
MS + BAP 2 ppm + IAA 0,1 ppm. |
|
10 |
C2C1 |
Media MS |
2 |
MS |
|
11 |
C2B1 |
Media MS |
2 |
MS + BAP 2 ppm |
|
12 |
C2B2 |
Media MS |
2 |
MS + BAP 2 ppm + IAA 0,1 ppm |
Gambar 1. Skoring persentase ukuran kalus pada kotiledon (a) skor 0 = Kalus tidak tumbuh; (b) skor1 = > 0 - 25% kalus menutupi eksplan; (c) skor 2 = > 25 - 50% kalus menutupi eksplan; (d) skor 3 = > 50 - 75% kalus menutupi eksplan; dan (e) skor 4 = > 75 - 100% kalus menutupi eksplan. Garis skala = 1 cm.

(a) (b) (c) (d)
Gambar 2. Skoring warna kalus pada kotiledon (a) skor 1 = Coklat; (b) skor 2 = Putih kecokelatan/coklat kekuningan; (c) Skor 3 = Putih/bening kehijauan; dan (d) Skor 4 = Hijau. Garis skala = 1 cm.
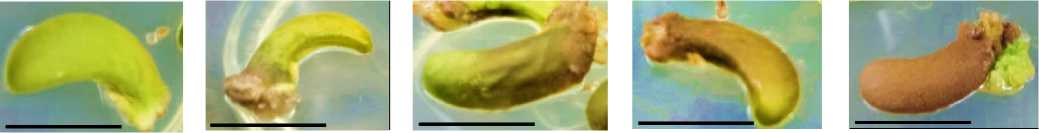
(a) (b) (c) (d) (e)
Gambar 3. Skoring persentase browning pada eksplan kotiledon (a) Skor 0 = Eksplan tidak mengalami browning; (b) Skor 1 = > 0 - 25% bagian eksplan; (c) Skor 2 = > 25 - 50% bagian eksplan; (d) Skor 3 = > 50 - 75% bagian eksplan; and (e) Skor 4 = > 75 - 100% bagian eksplan. Garis skala = 1 cm.
Analisis data
Data yang diamati adalah skor ukuran kalus, warna kalus, jumlah browning. Data kuantitatif yang diperoleh dianalisis menggunakan analisis non parametrik menggunakan uji Kruskal Wallis kemudian analisis uji lanjut dengan uji Dunn.
HASIL
Berdasarkan hasil pengamatan, pengaruh variasi waktu induksi kalus dan variasi pemberian ZPT mampu menginduksi kalus dan mempengaruhi ukuran kalus, warna kalus, serta persentase browning eksplan kotiledon kacang panjang. Hasil penelitian menunjukkan bahwa semua eksplan tumbuh kalus pada perlakuan dengan penambahan ZPT, sedangkan pada kontrol semua eksplan tidak tumbuh kalus.
Ukuran kalus
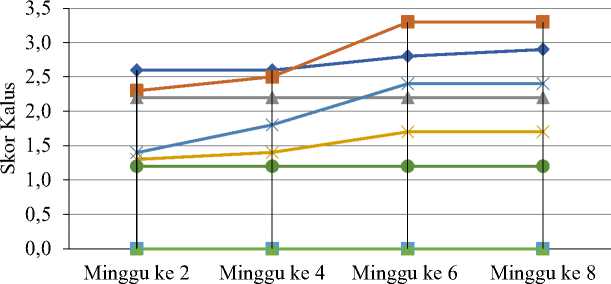
Skor ukuran kalus pada semua perlakuan mengalami peningkatan (Gambar 4), dimana perlakuan A1B2 memiliki skor tertinggi pada minggu ke delapan, diikuti dengan perlakuan A1B1 dan A2B2. Kode perlakuan B1 adalah dengan media subkultur yang mengandung 2 ppm BAP dan kode B2 adalah kode media subkultur dengan BAP 2 ppm + IAA 0,1 ppm.
Waktu pengamatan
A1B1
-÷-A1B2
A1C1
A2B1
-*- A2B2
A2C1
C1C1
^^^^^^^^^^^^^C1B1
^^^^^^^^^^^^^C1B2
C2C1
-■-C2B1
C2B2
Gambar 4. Perubahan skor ukuran kalus eksplan kotiledon kacang panjang pada minggu ke- 2, 4, 6 dan 8 setelah sub kultur.
Perubahan ukuran kalus pada perlakuan A1B2 sebagai perlakuan dengan skor kalus terbesar pada minggu ke delapan ditunjukkan pada Gambar 5. Durasi waktu induksi yang lebih lama (4 minggu), yaitu perlakuan dengan kode A1, juga menghasilkan skor kalus yang lebih tinggi setelah dipindah ke media sub kultur dengan ZPT, dibandingkan dengan durasi induksi kalus hanya 2 minggu (kode A2). Pemindahan kalus dari media induksi baik selama 4 atau 2 minggu
yang dipindah ke media MS tanpa ZPT tidak menghasilkan peningkatan skor kalus (perlakuan A1C1 dan A2C2). Pada perlakuan kontrol (tanpa ZPT baik di media induksi maupun media subkultur) tidak mampu menghasilkan kalus dari eksplan kotiledon kacang panjang (perlakuan C1C1, C2C1, C2B1, C2B2, C2C1).

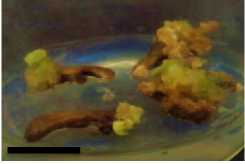
Minggu ke-2

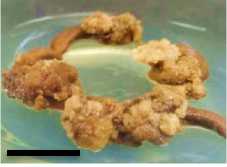
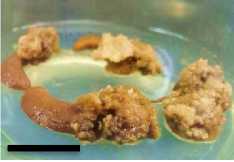
Minggu ke-4



Minggu ke-6
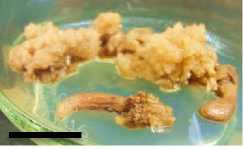

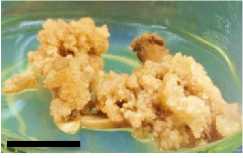
Minggu ke-8
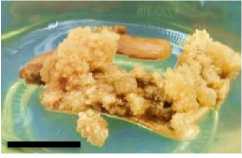
Gambar 5. Perubahan ukuran kalus pada tiga ulangan (3 botol kultur) perlakuan A1B2 pada minggu ke 2, 4, 6 dan 8 setelah subkultur (garis skala = 1 cm).
Analisis data dilakukan dengan menggunakan uji non parametrik uji Kruskal Wallis karena data tidak terdistribusi normal dan tidak homogen. Analisis skor ukuran kalus menunjukkan nilai kurang dari 0,05 sehingga dapat disimpulkan bahwa terdapat pengaruh perlakuan terhadap ukuran kalus. Setelah itu dilakukan uji lanjut menggunakan uji Dunn untuk melihat perbedaan antar perlakuan terhadap ukuran kalus secara signifikan. Berdasarkan hasil uji Dunn (Tabel 2), terlihat bahwa perlakuan A1B2 memiliki rata-rata skor ukuran kalus tertinggi, yaitu 3,3 yang berarti > 50 - 75% kalus menutupi eksplan. Antara perlakuan 2 dan 4 minggu waktu induksi kalus tidak menghasilkan beda nyata rerata skor ukuran kalus pada perlakuan dengan ZPT di media subkultur. Tetapi berbeda nyata dengan semua perlakuan media induksi tanpa ZPT (kontrol).
Perlakuan A1C1 menghasilkan rerata skor ukuran kalus yang tidak berbeda nyata dengan perlakuan A1B1 dan A1B2. Hal ini dapat disebabkan oleh
pengaruh media induksi awal dengan 2ppm 2,4-D sudah mampu menghasilkan kalus dengan skor lebih dari 2 (25 - 50% kalus menutupi eksplan). Perlakuan A2C1 (Media induksi dengan 2,4-D selama 2 minggu dan media sub kultur tanpa ZPT) menghasilkan skor ukuran kalus yang rendah (rerata skor 1,2) dan berbeda nyata dengan perlakuan media induksi lain yang mengandung 2,4-D.
Tabel 2. Rerata hasil uji Dunn ukuran kalus pada eksplan kotiledon kacang panjang pada minggu ke 8 setelah sub kultur.
|
No |
Kombinasi Perlakuan |
Rerata Skor Ukuran Kalus (MST) ± SD |
|
1 |
A1B1 |
2,9 ± 0,2950 a |
|
2 |
A1B2 |
3,3 ± 0,4087 a |
|
3 |
A1C1 |
2,2 ± 0,2092 a |
|
4 |
A2B1 |
1,7 ± 0,2302 ab |
|
5 |
A2B2 |
2,4 ± 0,4604 a |
|
6 |
A2C1 |
1,2 ± 0,1768 bc |
|
7 |
C1C1 |
0 ± 0,0000 c |
|
8 |
C1B1 |
0 ± 0,0000 c |
|
9 |
C1B2 |
0 ± 0,0000 c |
|
10 |
C2C1 |
0 ± 0,0000 c |
|
11 |
C2B1 |
0 ± 0,0000 c |
|
12 |
C2B2 |
0 ± 0,0000 c |
Keterangan: Angka rerata yang disertai notasi yang berbeda menunjukkan perbedaan yang nyata pada derajat signifikansi 0,05 berdasarkan uji Dunn. Pada perlakuan kontrol (C1 dan C2), kalus tidak tumbuh dari eksplan.
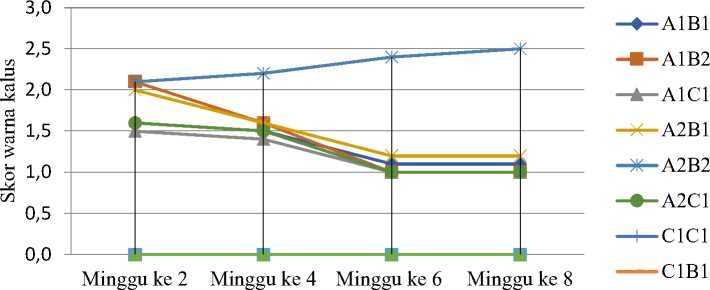
Berdasarkan pengamatan yang telah dilakukan, diperoleh hasil data warna kalus yang diambil pada minggu ke 2, minggu ke 4, minggu ke 6, dan minggu ke 8 saat subkultur. Hasil data diperoleh berdasarkan pemberian skor pada warna kalus, dimana semakin hijau warna kalus maka semakin besar nilai skor: (a) Skor 1 = Coklat, (b) Skor 2 = Putih kecokelatan/coklat kekuningan, (c) Skor 3 = Putih/bening kehijauan, dan (d) Skor 4 = Hijau (Gambar 2). Semua perlakuan dengan penambahan ZPT menghasilkan kalus yang mengalami perubahan warna hingga kuning dan coklat kecuali perlakuan A2B2 yang menghasilkan kalus berwarna putih kehijauan (Gambar 6). Semua perlakuan terus mengalami penurunan skor kecuali perlakuan A2B2 yang mengalami kenaikan. Perubahan warna kalus menunjukkan terjadinya perubahan pertumbuhan dan perkembangan sel, yaitu berwarna putih (sel dengan pertumbuhan baik dan mengandung butir pati yang tinggi), hijau (sel menunjukkan potensi kemampuan fotosintesis) dan coklat (terjadi kematian sel yang dapat disebabkan oleh oksidasi senyawa fenol) (Leupin et al., 2000 cit. Ulva et al., 2019).
Uji statistik dilakukan pada minggu ke-8 setelah sub kultur. Hasil analisis menunjukkan bahwa variasi perlakuan memberikan beda nyata terhadap warna kalus. Uji lanjut Dunn (Tabel 3) menunjukkan bahwa perlakuan A2B2 memiliki rata-rata skor warna kalus tertinggi, yaitu 2,5 yang berarti kalus berwarna putih kehijauan dan berbeda nyata dengan perlakuan kontrol (induksi kalus pada media tanpa ZPT). Warna kalus pada perlakuan A1 (media induksi 4 minggu) tidak berbeda nyata dengan warna kalus pada media A2 (media induksi 2 minggu) dan variasi media sub kultur tidak memberikan beda nyata terhadap warna kalus. Nilai rerata skor warna kalus antara 1-3 menunjukkan bahwa kalus dari kotiledon kacang panjang cenderung mempunyai warna kecoklatan.
^^^^^^*C1B2
Waktu pengamatan
Gambar 6. Grafik warna kalus pada eksplan kotiledon kacang panjang pada minggu ke 2, 4, 6 dan 8 setelah sub kultur.
Tabel 3. Rerata hasil uji Dunn warna kalus pada eksplan kotiledon kacang panjang pada minggu ke 8 setelah sub kultur.
|
No. |
Kombinasi Perlakuan |
Rerata Skor Warna Kalus (MST) ± SD |
|
1 |
A1B1 |
1,1 ± 0,2236 a |
|
2 |
A1B2 |
1 ± 0,0000 a |
|
3 |
A1C1 |
1 ± 0,0000 a |
|
4 |
A2B1 |
1,2 ± 0,2302 a |
|
5 |
A2B2 |
2,5 ± 1,0281 a |
|
6 |
A2C1 |
1 ± 0,0000 a |
|
7 |
C1C1 |
Kalus tidak ada |
|
8 |
C1B1 |
Kalus tidak ada |
|
9 |
C1B2 |
Kalus tidak ada |
|
10 |
C2C1 |
Kalus tidak ada |
|
11 |
C2B1 |
Kalus tidak ada |
|
12 |
C2B2 |
Kalus tidak ada |
Keterangan: Angka rerata yang disertai notasi yang berbeda menunjukkan perbedaan yang nyata pada derajat signifikansi 0,05 berdasarkan uji Dunn.
Penelitian ini menunjukkan bahwa eksplan dan kalus kotiledon kacang panjang mengalami browning (pencoklatan) selama pertumbuhan in vitro. Nilai skor diberikan untuk menunjukkan persentase bagian eksplan yang mengalami browning (Gambar 3). Semua eksplan mengalami browning dan beberapa perlakuan mengalami peningkatan skor browning setelah dilakukan sub kultur (Gambar 7). Eksplan dengan inisiasi kalus menggunakan 2 ppm 2,4-D mengalami sedikit atau tidak mengalami peningkatan browning setelah subkultur, sedangkan eksplan pada perlakuan kontrol sudah mengalami browning sejak awal minggu pengamatan. Eksplan yang ditanam pada media sub kultur tanpa tambahan ZPT mengalami browning lebih banyak dibandingkan eksplan pada media lain.
Uji statistik dilakukan pada minggu ke 8 setelah pemindahan ke media sub kultur. Uji Kruskal Wallis terhadap skor browning menunjukkan adanya beda nyata antar perlakuan. Hasil uji Dunn (Tabel 4) menunjukkan bahwa semua eksplan pada perlakuan mengalami browning, dengan perlakuan yang
ditambahkan ZPT pada saat subkultur persentasenya sedikit lebih kecil dari perlakuan tanpa ZPT dan perlakuan kontrol. Hasil ini menunjukkan bahwa tingkat browning pada perlakuan kontrol dengan waktu inisiasi kalus selama 4 minggu maupun 2 minggu lebih tinggi daripada perlakuan dengan penambahan ZPT, dimana skor browning-nya 4. Selain itu, dapat diketahui bahwa terdapat perbedaan signifikan antar perlakuan A1B1, A1B2, A2B1, dan A2B2 dengan perlakuan A1C1, A2C1, C1C1, C1B1, C1B2, C2C1, C2B1, dan C2B2 yang ditandai dengan huruf notasi yang berbeda.
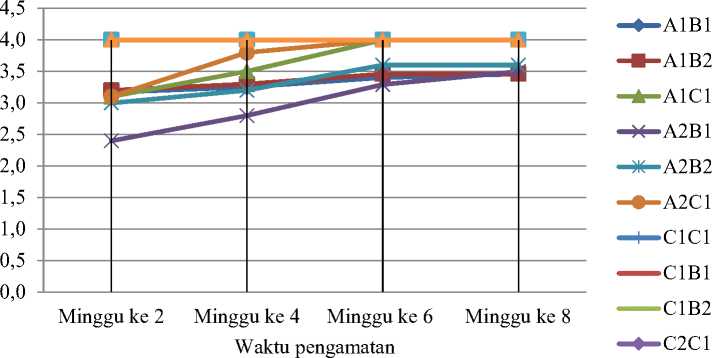
Gambar 7. Grafik skor tingkat browning pada eksplan kotiledon kacang panjang pada minggu ke 2, 4, 6 dan 8 setelah subkultur
Tabel 4. Rerata hasil uji Dunn browning pada eksplan kotiledon kacang panjang pada minggu ke 8 setelah sub kultur.
|
No |
Kombinasi Perlakuan |
Rerata Skor Eksplan mengalami Browning (MST) ± SD |
|
1 |
A1B1 |
3,5 ± 0,6877 a |
|
2 |
A1B2 |
3,5 ± 0,4087 a |
|
3 |
A1C1 |
4 ± 0,0000 b |
|
4 |
A2B1 |
3,5 ± 0,5000 a |
|
5 |
A2B2 |
3,6 ± 0,3899 a |
|
6 |
A2C1 |
4 ± 0,0000 b |
|
7 |
C1C1 |
4 ± 0,0000 b |
|
8 |
C1B1 |
4 ± 0,0000 b |
|
9 |
C1B2 |
4 ± 0,0000 b |
|
10 |
C2C1 |
4 ± 0,0000 b |
|
11 |
C2B1 |
4 ± 0,0000 b |
|
12 |
C2B2 |
4 ± 0,0000 b |
Keterangan: Angka rerata yang disertai notasi yang berbeda menunjukkan perbedaan yang nyata pada derajat signifikansi 0,05 berdasarkan uji Dunn.
PEMBAHASAN
Pada penelitian ini, kalus diinduksi pada media induksi kalus dengan penambahan 2 ppm 2,4-D pada media MS.) Pemberian 2,4-D dapat memicu pembelahan dan pembesaran sel akibat penyerapan air, nutrisi dan zat pengatur tumbuh dari media Dwipayana et al. (2016). Penambahan auksin sangat efektif dalam menginduksi pembentukan kalus, namun peranan sitokinin juga sering
dibutuhkan untuk proliferasi sel sehingga kombinasi auksin dengan sitokinin sangat baik untuk memacu pertumbuhan kalus. Pemberian konsentrasi ZPT yang tepat juga sangat penting karena eksplan mengandung hormon secara alami (hormon endogen) (Indah & Ermavitalini, 2013). Pada perlakuan A1C1 dan A2C1 (perlakuan kontrol dengan subkultur pada media tanpa pemberian ZPT), eksplan tidak mengalami pertumbuhan kalus. Hal ini dapat disebabkan oleh kandungan hormon endogen kalus kotiledon kacang panjang yang tidak mampu memicu pertumbuhan kalus secara in vitro sehingga penambahan ZPT pada media kultur diperlukan untuk induksi kalus dari eksplan kacang panjang.
Kalus pada eksplan kotiledon kacang panjang muncul dari bagian pinggir yang terkena sayatan. Hal ini disebabkan oleh pertumbuhan kalus yang diawali dengan terjadinya penebalan eksplan pada bagian yang dipotong dan tumbuh di daerah yang mengalami pelukaan. Penebalan tersebut adalah hasil interaksi antara eksplan dengan media tumbuh, zat pengatur tumbuh, dan lingkungan tumbuh sehingga eksplan bertambah besar. Selain pengaruh hormon atau ZPT, tumbuhnya kalus juga merupakan respons dari pelukaan eksplan (Yelnititis, 2012; Rasud & Bustaman, 2020). Pembentukan kalus diawali dengan membesarnya sel-sel epidermis bagian atas pada ujung eksplan, kemudian sel-sel tersebut membelah. Ketika tanaman dilukai, selnya mengalami kerusakan dan terjadi autolisis (pemecahan), kemudian sel yang rusak tersebut menghasilkan senyawa yang merangsang pembelahan sel di lapisan berikutnya, terutama sel-sel yang berada di sekitar daerah yang terluka sehingga terbentuk gumpalan sel-sel yang terdiferensiasi (Astutik, 2007).
Perlakuan A1B2 (penambahan BAP 2 ppm + IAA 0,1 ppm pada media subkultur) menghasilkan rerata skor ukuran kalus tertinggi yaitu 3,3 yang berarti > 50 - 75% kalus menutupi eksplan. Hasil ini menunjukkan bahwa waktu inisiasi kalus 4 minggu dengan penambahan 2 ppm 2,4-D dan kombinasi konsentrasi BAP 2 ppm dengan IAA 0,1 ppm saat subkultur menghasilkan ukuran kalus paling besar dibandingkan perlakuan lain. Semakin lama waktu inisasi kalus pada media 2,4-D, maka semakin banyak pula waktu kalus berdiferensiasi sehingga ukurannya akan lebih besar. Pengaruh 2,4-D terhadap induksi kalus pada berbagai eksplan sudah sering ditemukan pada berbagai spesies tanaman. Auksin 2,4-Dichlorophenoxyacetic acid (2,4-D) adalah herbisida sintetik pertama dan mempunyai pengaruh seperti auksin alami dalam dosis yang tinggi yang dapat menyebabkan pertumbuhan abnormal dengan salah satu mekanisme melalui perubahan plastisitas dinding sel (Song, 2014).
Penambahan BAP dan IAA dalam rasio 2:0,1 ternyata mampu memperbesar ukuran kalus dan tidak memicu pertumbuhan tunas. Pada eksplan tertentu, konsentrasi sitokinin dan auksin yang tepat diperlukan untuk memicu pertumbuhan kalus pada eksplan (Rosdiana, 2010). Penggunaan sitokinin dalam media kultur untuk induksi kalus juga ditemukan di tanaman legum lain seperti koro benguk (Ariani et al., 2016) dan kedelai (Muresan et al., 2021).
Sebagian besar kalus pada penelitian ini mengalami perubahan warna dari putih sampai menjadi warna kuning kecoklatan. Kalus yang berwarna putih dapat mengindikasikan jaringan embrionik yang belum mengandung kloroplas, tetapi memiliki kandungan butir pati yang tinggi dan merupakan massa sel yang sedang aktif membelah (Ariati, 2012). Perubahan warna kalus dapat disebabkan oleh berbagai faktor termasuk media atau ZPT yang digunakan dan pencahayaan di ruang kultur (Ariani et al., 2016).
Warna kuning kecoklatan pada kalus dapat disebabkan sebagai respon terhadap luka atau pemotongan kotiledon. Di dalam teknik kultur jaringan, peristiwa browning (warna berubah menjadi coklat) sesungguhnya merupakan
peristiwa alami dan merupakan proses perubahan/respon adaptif bagian tanaman akibat adanya pengaruh fisik seperti pemotongan dan pengupasan, yang merupakan tanda terjadinya kemunduran fisiologis eksplan (Rohmah, 2007). Respon tanaman tersebut dilakukan dengan meningkatkan aktivitas metabolik sehingga dihasilkan senyawa metabolit sekunder yaitu fenol (Pierik, 1987).
Tanaman kacang-kacangan diketahui mengandung senyawa fenolik yang bermanfaat bagi manusia. Senyawa fenol berperan dalam menentukan warna dan rasa serta mempunyai kemampuan mengikat radikal sehingga tanaman kacang-kacangan dapat dikategorikan dalam bahan pangan yang penting bagi kesehatan manusia (Diniyah & Lee, 2020). Kandungan fenol tersebut menjadi salah satu faktor dalam keberhasilan kultur jaringan kacang-kacangan. Senyawa fenol yang muncul pada kalus dapat bersifat toksik bagi sel apabila konsentrasinya berlebihan, yang dapat membuat pertumbuhan menjadi terhambat. Eksplan masih dapat mentoleransi produksi senyawa fenol yang terbatas pada eksplan maupun kalus, sehingga eksplan masih dapat tumbuh. Tetapi, jika senyawa fenol sudah menyebabkan pencoklatan pada media tanam, hal ini dapat menghambat pertumbuhan eksplan dan dapat mengakibatkan gangguan perkembangan eksplan dan bahkan kematian jaringan (Kumar et al., 2015).
Perubahan warna kalus juga dapat disebabkan oleh bertambahnya umur kalus. Kalus yang mengalami penuaan akan menjadi kuning hingga coklat sampai akhir pengamatan (Guntoro, 2013). Kalus yang berwarna coklat merupakan kalus yang mengalami proses penuaan (senescence) sel, sehingga waktu inisiasi kalus yang terlalu lama dapat menyebabkan terjadinya penuaan pada warna kalus (Dwi, 2012; Lizawati 2012). Browning pada perlakuan kontrol dalam penelitian ini dapat menjadi penyebab tidak tumbuhnya kalus pada eksplan. Browning jaringan berhubungan dengan akumulasi polifenol oksidase dan penurunan putresin, spermidin, dan spermin yang menghambat pertumbuhan kalus, diferensiasi tunas dan perakaran (Tang & Newton, 2004). Zat pengatur tumbuh dan elisitor di dalam media juga bisa mempengaruhi tingkat browning (Baskaran et al.,2014).
Dalam pengembangan penelitian kultur jaringan pada tanaman kacang panjang, dapat dilakukan perbaikan metode induksi kalus dengan menekan persentase eksplan yang mengalami browning. Browning yang dapat terjadi pada kultur jaringan dapat dihindari melalui beberapa cara, antara lain menghilangkan produksi senyawa fenol, modifikasi potensial redoks, penghambatan aktivasi enzim fenol oksidase, penurunan aktivitas fenolase, dan ketersediaan substrat. Penanggulangan perubahan ini dalam praktik sering kali dilakukan saat sebelum perlakuan terhadap eksplan, antara lain dengan cara merendam eksplan pada media dasar yang dapat menyerap senyawa fenol, seperti arang aktif yang dapat menyerap senyawa fenolik yang teroksidasi dari jaringan eksplan sehingga browning pada media dapat dicegah (Hutami, 2008). Metode lain adalah dengan penggunaan antioksidan seperti asam askorbat atau PVP, sub kultur yang berulang dan penggunaan kondisi gelap (Amente & Chimdessa, 2021).
SIMPULAN
Waktu inisiasi kalus selama 2 minggu atau 4 minggu pada media MS dengan 2ppm 2,4-D mampu menginduksi kalus dari kotiledon kacang panjang. Setelah pemindahan pada media sub kultur, perlakuan dengan 2 ppm BAP + 0,1 ppm IAA (A1B2) mampu menghasilkan kalus pada minggu kedelapan dengan ukuran lebih besar (rerata skor kalus 3,3) yang berbeda signifikan (P<0.05) dengan perlakuan kontrol (tanpa ZPT pada media inisiasi dan subkultur) dan dengan perlakuan induksi 2 minggu serta subkultur pada media MS saja (A2C1).
Perlakuan kontrol (tanpa ZPT baik pada media inisiasi maupun subkultur) tidak mampu menginduksi kalus pada kotiledon kacang panjang. Warna kalus pada perlakuan A1B2 mempunyai rerata skor 1 (warna kecoklatan) yang berbeda nyata dengan warna perlakuan A2B2 dengan rerata skor 2,5 (warna putih/kuning). Skor warna perlakuan A2B2 tidak berbeda secara signifikan dengan perlakuan lain dengan media yang mengandung ZPT pada tahap inisiasi maupun subkultur. Semua eksplan mengalami browning tetapi perlakuan tanpa penambahan ZPT baik pada media inisiasi maupun subkultur menyebabkan tingkat browning dengan skor yang lebih tinggi pada eksplan kotiledon kacang panjang. Perlakuan A1B2 (media inisiasi 4 minggu dan media subkultur 2 ppm BAP + 0,1 ppm IAA) mampu menghasilkan ukuran kalus terbesar dengan warna putih/kuning yang menunjukkan potensi untuk dimanfaatkan dalam induksi variasi maupun inisiasi tanaman transgenik.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada Departemen Pendidikan Biologi, FMIPA Universitas Negeri Yogyakarta atas terlaksananya penelitian ini dan kepada teknisi yang telah membantu kelancaran penelitian ini.
KEPUSTAKAAN
Amante, Chimdessa. 2021. Control of browning in plant tissue culture: A review. Journal of Scientific Agriculture. 5: 67-71 doi: 10.25081/jsa.2021.v5.7266
Ariani R, Anggraito Y U, Rahayu E.S. 2016. Respon Pembentukan Kalus Koro Benguk (Mucuna Pruriens L.) Pada Berbagai Konsentrasi 2,4-D Dan BAP. Jurnal MIPA 39 (1) : 20-28
Ariati SN. 2012. Induksi Kalus Tanaman Kakao (Theobroma cacao L.) pada Media MS dengan Penambahan 2,4-D, BAP dan Air Kelapa. Jurnal Natural Sciences, 1(1): 74-84.
Astutik S. (2007). Pengaruh Varietas Kedelai (Glycine max) terhadap Pertmbuhan Kalus dan Kandungan Senyawa Isoflavon (Daidzein dan Genisten). Skripsi tidak diterbitkan. Malang. Jurusan Biologi Fakultas Sains dan IPA Universitas Islam Malang
Badan Pusat Statistik. 2020. Luas Panen dan Produksi Kacang Panjang 2018-2020.
https://jateng.bps.go.id/indicator/55/743/1/luas-panen-dan-produksi-kacang-panjang.html
Baskaran P, Moy M, Van Staden J. 2014. In vitro plant regeneration, phenolic compound production and pharmacological activities of Coleonema pulchellum. South African Journal of Botany. 90 : 74-79. https://doi.org/10.1016/j.sajb.2013.10.005
Budisantoso I, Prayoga L. 2012. Pengaruh 2,4-D Terhadap Hipokotil Dan Kotiledon Kedelai Varietas Slamet Yang Ditumbuhkan Secara In Vitro. Jurnal Biologi Udayana. 16 (2)
Dewi IS. Nindita A. Purwoko BS, Efendi D. 2012. Induksi Tunas Pada Kotiledon dan Hipokotil Tanaman Jarak Pagar melalui Organogenesis Tak Langsung. Jurnal Agrobiogen 8(3): 8996.
Diniyah N, S Lee. 2020. Komposisi Senyawa Fenol Dan Potensi Antioksidan Dari Kacangkacangan: Review. Jurnal Agroteknologi. 14 (01)
Dwi NM, Waenati, Muslimin, Suwastika. (2012). Pengaruh Penambahan Air Kelapa dan Berbagai Konsentrasi Hormon 2,4-D pada Medium MS dalam Menginduksi Kalus Tanaman Anggur Hijau (Vitis vinifera L.) Jurnal Natural Science. 1(1): 53-62.
Dwipayana GAJ, Yuswanti H, Mayun IA. (2016). Induksi Kalus Stroberi (Fragaria spp.) Melalui Aplikasi Asam 2,4-Diklorofenoksiasetat Secara In Vitro. EJurnal Agroekoteknologi Tropika. 5(3): 310-321.
Guntoro RR. (2013). Respon Eksplan Sambiloto (Andrographis paniculata Ness) Terhadap Pembentukan dan Pertumbuhan Kalus pada Media MS dengan Penambahan ZPT 2,4-D yang dikombinasikan dengan Air Kelapa. Tidak Diterbitkan. UIN Malang
Hesami M, Daneshvar M. 2016. Regeneration from Callus which is Produced from Cotyledon of Antirrhinum majus. 4: 20-24. 10.1007/ijlbpr_56e24b27b7a3f.
Hesami M, Daneshvar MH. 2018. In Vitro Adventitious Shoot Regeneration through Direct and Indirect Organogenesis from Seedling-derived Hypocotyl Segments of Ficus religiosa L.: An Important Medicinal Plant, HortScience horts, 53(1): 55-61. https://doi.org/10.21273/ HORTSCI12637-17
Hutami S. (2008). Masalah Pencoklatan pada Kultur Jaringan. Jurnal Agro Biogen. 4(2):83-88.
Indah PN, Ermavitalini D. (2013). Induksi Kalus Daun Nyamplung (Calophyllum inophyllum Linn.) pada Beberapa Kombinasi Konsentrasi 6-Benzylaminopurine (BAP) dan 2,4-Dichlorophenoxyacetic Acid (2,4-D). Jurnal Sains dan Seni. 2(1): 1-6.
Kumar, GP, Subiramani S, Govindarajan S, Sadasivam V, Manickam V, Mogilicherla K, Thiruppathi SK, Narayanasamy J. 2015. Evaluation of different carbon sources for high frequency callus culture with reduced phenolic secretion in cotton (Gossypium hirsutum L.) cv. SVPR-2. Biotechnology Reports .7:72-80. ISSN 2215-017X
https://doi.org/10.1016/j.btre.2015.05.005.
Lizawati. 2012. Induksi Kalus Embriogenik Dari Eksplan Tunas apikal Tanaman Jarak Pagar (Jatropha curcas L.) Dengan Penggunaan 2,4-D dan TDZ. ISSN: 2302-6472. 1(2)
Mureșan L, Clapa D, Rusu T, Wang TTY, Park JB. 2021. Soybean Callus-A Potential Source of Tocopherols. Plants (Basel) 10(12):2571. doi: 10.3390∕plants10122571. PMID: 34961042; PMCID: PMC8703269.
Pierik RLM. (1987). In Vitro Culture of Higher Plant. Netherland: Martinus Nijhoff Publiser.
Rasud Y , Bustaman B. 2020. Induksi Kalus secara In Vitro dari Daun Cengkeh (Syizigium aromaticum L.) dalam Media dengan Berbagai Konsentrasi Auksin. Jurnal Ilmu Pertanian Indonesia. 25(1). 67-72. https://doi.org/10.18343/jipi.25.1.67
Rohmah. 2007. Penggunaan BAP dan 2,4-D dalam Kultur in vitro Ilesiles (Amorphophallusmuelleri Blume). Tugas Akhir. Institut Pertanian Bogor. Bogor.
Rosdiana. 2010. Pertumbuhan anggrek bulan (Phalaenopsis amboinensis) endemik Sulawesi, pada beberapa jenis dan konsentrasi zat pengatur tumbuh secara in vitro. JAgrisistem. 6:8896.
Royani I, Zulkifli L, Sedijani P. 2015. Regenerasi Tunas dan Akar dari Kalus Daun Kacang Tanah (Arachis hypogaea L.). Bioscientist: Jurnal Ilmiah Biologi. 3(1): 6-10.
Song Y. 2014. Insight into the mode of action of 2,4-dichlorophenoxyacetic acid (2,4-D) as an herbicide. JIntegr Plant Biol. 56 (2): 106-113.
Susetio H, Hidayat SH. 2014. Respons Lima Varietas Kacang Panjang terhadap Bean common mosaic virus. Jurnal Fitopatologi Indonesia. 10(4): 112.
https://doi.org/10.14692/jfi.10.4.112
Tang W, Newton RJ. (2004). Increase of polyphenol oxidase and decrease of polyamines correlate with tissue browning in Virginia pine (Pinus virginiana Mill.). Plant Sci. 167(3):621-628.
Ulva M, Nurchayati Y, Prihastanti E, Setiari N. (2019). Pertumbuhan Kalus Tomat (Lycopersicon esculentum Mill.) Varietas Permata F1 dari Jenis Eksplan dan Konsentrasi Sukrosa yang Berbeda secara In Vitro. Life Science. 8 (2): 160-169.Yelnititis. 2012. Pembentukan Kalus Remah dari Eksplan Daun Ramin (Gonystylus bancanus (Miq) Kurz.). Jurnal Pemuliaan Tanaman Hutan. 6(3): 181-194.
203
Discussion and feedback