DAYA HAMBAT EKSTRAK KULIT DAUN LIDAH BUAYA (Aloe barbadensis Miller) TERHADAP PERTUMBUHAN BAKTERI Staphylococcus aureus ATCC 25923DAN Escherichia coli ATCC 25922
on
JURNAL BIOLOGI XVI (I) : 1 - 4
ISSN : 1410 5292
DAYA HAMBAT EKSTRAK KULIT DAUN LIDAH BUAYA (Aloe barbadensis Miller) TERHADAP PERTUMBUHAN BAKTERI Staphylococcus aureus ATCC 25923 DAN Escherichia coli ATCC 25922
THE INHIBITION OF ALOE (Aloe barbadensis Miller) RIND EXTRACT TO THE GROWTH OF BACTERIA Staphylococcus aureus ATCC 25923 AND Escherichia coli ATCC 25922
Ni Kadek Ariyanti, Ida Bagus Gede Darmayasa, Sang Ketut Sudirga
Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Kampus Bukit Jimbaran
Email: darm_aponk@yahoo.co.id
INTISARI
Penelitian ini bertujuan untuk mengetahui daya hambat ekstrak kulit daun lidah buaya (Aloe barbadensis Miller) terhadap pertumbuhan bakteri Staphylococcus aureus ATCC 25923 dan Escherichia coli ATCC 25922 dan konsentrasi yang paling efektif menghambat kedua bakteri tersebut. Ekstrak kulit daun lidah buaya dapat menghambat pertumbuhan bakteri Staphylococcus aureus ATCC 25923 dan Escherichia coli ATCC 25922, ditunjukkan dengan terbentuknya zona hambatan pada konsentrasi 100% dengan rata-rata diameter terbesar 11,58 mm pada Staphylococcus aureus dan 6,81 mm pada Escherichia coli. Konsentrasi ekstrak kulit daun lidah buaya yang paling tinggi menghambat pertumbuhan bakteri Staphylococcus aureus ATCC 25923 pada konsentrasi 100% dan Escherichia coli ATCC 25922 pada konsentrasi 75%.
Kata kunci: Aloe barbadensis Miller, Escherichia coli, Staphylococcus aureus, daya hambat
ABSTRACT
This research aimed to determine the inhibited effect of Aloe (Aloe barbadensis Miller) rind extract to the growth of bacteria Staphylococcus aureus and Escherichia coli and the most effective concentration for the resistance against both of bacteria tested. The results showed that the extracts of Aloe rind inhibited the growth of bacteria Staphylococcus aureus ATCC 25923 and Escherichia coli ATCC 25922. It was indicated by the formation of inhibition zones with the largest diameter average occurred concentrations of 100% with the size 11,58 mm for the Staphylococcus aureus and 6,81 mm in Escherichia coli. The highest concentration inhibited the growth of Staphylococcus aureus ATCC 25923 was 100% and 75% for the Escherichia coli ATCC 25922.
Keywords: Aloe barbadensis Miller, Escherichia coli, Staphylococcus aureus, inhibited
PENDAHULUAN
Kesehatan merupakan satu hal yang sangat penting dalam kehidupan manusia, namun untuk menjaganya perlu dilakukan tindakan pencegahan (preventif) dan pengobatan (kuratif) (Trisnayanti, 2003). Tindakan pencegahan dan pengobatan ini dilakukan untuk menghindari resiko terjadinya infeksi. Penyakit infeksi disebabkan oleh bakteri seperti bakteri Staphylococcus aureus dan Escherichia coli (Gibson, 1996).
Infeksi Staphylococcus aureus pada manusia dapat ditularkan secara langsung melalui selaput mukosa yang bertemu dengan kulit. Bakteri ini dapat menyebabkan endokarditis, osteomielitis akut hematogen, meningitis, ataupun infeksi paru-paru. Sedangkan bakteri Escherichia coli adalah bagian flora normal gastrointestinal manusia (Jawetz et al., 2005). Pada kondisi tertentu bakteri Escherichia coli menyebabkan penyakit diare, infeksi saluran kemih, pneumonia dan meningitis pada bayi baru
lahir serta infeksi luka dalam (Josodiwondo dkk.,1993).
Pemberian antibakteri merupakan salah satu pilihan dalam menangani penyakit infeksi. Namun penggunaan antibakteri yang tidak terkontrol dapat mendorong terjadinya perkembangan resistensi terhadap antibakteri yang diberikan (Wardani, 2008). Adanya resistensi ini dapat menimbulkan banyak masalah dalam pengobatan penyakit infeksi, sehingga diperlukan usaha untuk mengembangkan obat tradisional berbahan herbal yang dapat membunuh bakteri untuk menghindari terjadinya resistensi tersebut. Salah satu tanaman yang secara empiris digunakan sebagai bahan obat yaitu Aloe barbadensis Miller atau lebih dikenal sebagai lidah buaya.
Kandungan zat aktif lidah buaya yang sudah teridentifikasi antara lain Saponin, Sterol, Acemannan, Antrakuinon (Purbaya, 2003; Furnawanthi, 2004). Penelitian Isabela (2009), menyatakan bahwa ekstrak lidah buaya mampu menghambat pertumbuhan
Naskah diterima tanggal 5 Maret 2012, disetujui tanggal 21 Maret 2012.
Pseudomonas aeruginosa secara in vitro. Selain itu Aloe barbadensis Miller dan Aloe chinensis Baker mampu menghambat pertumbuhan Escherichia coli (Rahayu, 2006).
Dalam penelitian ini digunakan kulit daun lidah buaya sebagai ekstrak. Selain daging daun yang dapat dimanfaatkan sebagai bahan kosmetika, kulit daun lidah buaya dapat dimanfaatkan sebagai ekstrak untuk menghambat bakteri dan mengurangi limbah kulit daun dari produksi lidah buaya di ALOVEBALI (Kompri, 2010). Dari uraian latar belakang tersebut di atas, dilakukan penelitian tentang daya hambat ekstrak kulit daun lidah buaya (Aloe barbadensis Miller) terhadap pertumbuhan bakteri Staphylococcus aureus ATCC (American Type Culture Collection) 25923 dan Escherichia coli ATCC (American Type Culture Collection) 25922.
MATERI DAN METODE
Lokasi dan Tempat Penelitian
Penelitian dilaksanakan di Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Udayana dan di Laboratorium Biomarine Universitas Udayana pada bulan Maret 2011 sampai dengan bulan Mei 2011.
Teknik Pengambilan Sampel Daun Lidah Buaya (Aloe barbadensis Miller)
Sampel daun lidah buaya yang digunakan diperoleh dari Banjar Tengah Bonbiyu, Desa Saba, Kecamatan Blahbatuh, Kabupaten Gianyar. Daun lidah buaya yang digunakan adalah daun yang tua yaitu daun yang terletak paling bawah (daun 1 dan 2) yang diambil dari 10 tanaman lidah buaya secara acak pada satu petak kebun lidah buaya dengan umur tanaman yang sama. Masing-masing tanaman lidah buaya diambil satu daun lidah buaya, kemudian daun tersebut diambil kulit daunnya untuk digunakan sebagai bahan ekstrak.
Penyiapan Ekstrak Kulit Daun Lidah Buaya (Aloe barbadensis Miller)
Daun lidah buaya dikupas untuk memisahkan kulit daun lidah buaya dengan daging daun (gel) kemudian dikeringanginkan. Kulit daun lidah buaya dihaluskan dengan cara diblender dan ditimbang 100 gram untuk maserasi dengan 500 ml metanol pro analisis pada suhu kamar selama 72 jam. Filtrat yang diperoleh melalui penyaringan diuapkan dengan Vacum Rotary Evaporator pada suhu 35oC dengan tujuan untuk memisahkan solven dan ekstrak, sehingga diperoleh ekstrak kental.
Pembuatan Suspensi Bakteri S.aureus ATCC 25923 dan E.coli ATCC 25922
Bakteri Staphylococcus aureus ATCC 25923 dan Escherichia coli ATCC 25922 diperoleh dari Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Udayana. Pembuatan masing-masing suspensi bakteri dilakukan dengan cara mengambil 2-3 koloni dari media Tryptic Soy Agar (TSA) dengan ose steril, dimasukkan dan dihomogenkan ke dalam 4 ml Nutrient Broth (NB) dan diinkubasi pada suhu 37°C selama 24 jam. Suspensi
bakteri tersebut kekeruhannya disetarakan dengan standar McFarland 0,5 yang setara dengan 108 CFU/ml.
Uji Daya Hambat
Uji yang digunakan adalah uji sensitivitas dengan menggunakan metode Kirby-Bauer (Soemarno, 2000). Media Mueller Hinton Agar (MHA) ditambah 1 ml suspensi biakan bakteri Staphylococcus aureus dan Escherichia coli pada masing-masing cawan petri dan dihomogenkan dengan cara digoyang secara simultan. Kertas cakram didedahkan sebanyak 20 µl ekstrak kulit daun lidah buaya dengan konsentrasi 10%, 25%, 50%, 75%, 100% dan 0% sebagai kontrol tanpa ekstrak kulit daun lidah buaya, kertas cakram diletakkan pada media MHA dengan pinset steril dan diinkubasi pada suhu 37°C selama 24 jam dengan posisi terbalik. Zona hambat yang terbentuk menunjukkan tingkat kepekaan bakteri uji terhadap bahan antibakteri tersebut.
Rancangan Percobaan
Rancangan percobaan menggunakan Rancangan Acak Lengkap (RAL) sederhana karena tidak dicari interaksi dan tidak dibandingkan antara kuman uji dengan menggunakan 5 variasi konsentrasi ekstrak ditambah kontrol dan 2 jenis bakteri uji (Staphylococcus aureus dan Escherichia coli). Setiap perlakuan dilakukan pengulangan sebanyak tiga kali sehingga digunakan 36 unit percobaan.
Analisis Data
Data dianalisis dengan menggunakan sidik ragam (Anova) dan jika data yang diperoleh menunjukkan berbeda nyata pada taraf uji 5% (P≤0,05) maka dilanjutkan dengan menggunakan uji Duncan untuk mengetahui perbedaan antar perlakuan (Gasperz, 1995). Data dianalisis dengan menggunakan program SPSS (Statistical Program for Social Sciences) for Windows Series 15.0 Release 2006.
HASIL
Adanya aktivitas antibakteri ditunjukkan dengan ada atau tidaknya zona hambatan yang terbentuk pada media. Rata-rata zona hambatan pada konsentrasi 100% yaitu sebesar 11,58 mm pada bakteri Staphylococcus aureus dan 6,81 mm pada bakteri Escherichia coli. Pada kontrol (0%) yang hanya didedahkan pelarut, tidak membentuk zona hambatan pada kedua jenis bakteri yang diujikan. Pada uji bakteri Escherichia coli, kemampuan ekstrak kulit daun lidah buaya baru terlihat pada konsentrasi 75% dengan membentuk rata-rata diameter zona hambatan sebesar 6,92 mm dan mengalami penurunan rata-rata diameter zona hambatan pada konsentrasi 100% sebesar 6,81 mm. Data zona hambatan ekstrak kulit daun lidah buaya terhadap pertumbuhan bakteri Staphylococcus aureus ATCC 25923 dan Escherichia coli ATCC 25922 tersaji pada Gambar 1.
Daya Hambat Ekstrak Kulit Daun Lidah Buaya (Aloe barbadensis Miller) Terhadap Pertumbuhan Bakteri Staphylococcus aureus (Ni Kadek Ariyanti, dkk.)
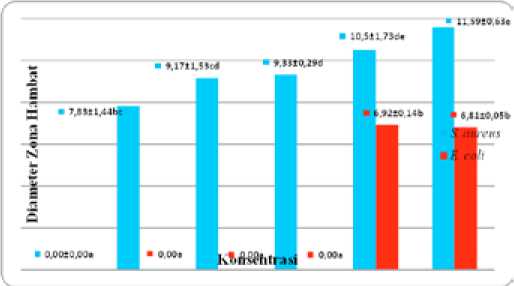
Gambar 1.Grafik rata-rata diameter zona hambatan ekstrak kulit daun lidah buaya terhadap pertumbuhan bakteri Staphylococcus aureus ATCC 25923 dan Escherichia coli ATCC 25922.
PEMBAHASAN
Zona hambatan yang terbentuk menunjukkan bahwa ekstrak kulit daun lidah buaya (Aloe barbadensis Miller) mampu menghambat pertumbuhan bakteri Staphylococcus aureus ATCC 25923 dan Escherichia coli ATCC 25922. Secara umum rata-rata diameter zona hambatan mengalami peningkatan seiring dengan peningkatan konsentrasi yang diberikan. Menurut Lingga dan Rustama (2005), semakin tinggi konsentrasi suatu bahan antibakteri maka aktivitas antibakterinya akan semakin kuat.
Pada kontrol (0%) yang hanya didedahkan pelarut, secara statistik ada perbedaan nyata dengan konsentrasi 10%, 25%, 50%, 75%, dan konsentrasi 100% pada bakteri S.aureus tetapi pada bakteri E.coli tidak ada perbedaan yang nyata antara kontrol dengan konsentrasi 10%, 25%, dan 50%. Hasil ini menandakan bahwa pada konsentrasi tersebut belum memberikan pengaruh terhadap pertumbuhan bakteri pada media MHA. Hal ini disebabkan karena konsentrasi ekstrak kulit daun lidah buaya masih rendah sehingga tidak mampu merusak membran sel dan mengganggu proses fisiologis sel (Cowan, 1999). Aktivitas antibakteri dari senyawa aktif juga dapat dihambat oleh mekanisme resistensi bakteri Escherichia coli (gram negatif) terhadap bahan antibakteri (Sanaz, 1999). Adanya struktur membran luar yang kompleks pada bakteri gram negatif membatasi akses senyawa aktif ekstrak kulit daun lidah buaya ke dalam membran sel, dan menjadikan bakteri Escherichia coli lebih resisten terhadap antibakteri (Geidam, 2007).
Kemampuan aktivitas antibakteri tertinggi ekstrak kulit daun lidah buaya terjadi pada konsentrasi 75% lalu mengalami penurunan rata-rata diameter zona hambatan pada konsentrasi 100%, walaupun secara statistik tidak menunjukkan perbedaan yang nyata dari kedua konsentrasi tersebut. Menurut Elifah (2010) dalam Dewi (2010), diameter daya hambat tidak selalu naik sebanding dengan naiknya konsentrasi antibakteri, kemungkinan ini terjadi karena perbedaan kecepatan difusi senyawa antibakteri pada media agar serta jenis dan konsentrasi senyawa antibakteri yang berbeda juga memberikan diameter zona hambat yang berbeda.
Sedangkan penelitian Iriano (2008), menunjukkan bahwa uji antibakteri infusum lidah buaya terhadap Porphyromonas gingivalis dengan metode difusi, zona hambatan paling besar pada konsentrasi 30% dan 90% yaitu 1,75 mm, sedangkan konsentrasi 40-80% memiliki zona hambatan yang lebih rendah yaitu berkisar antara 0,75-1 mm. Hal ini dapat disebabkan oleh banyaknya faktor yang berpengaruh terhadap besar zona hambatan yang dihasilkan pada metode difusi antara lain kecepatan difusi, sifat media agar yang digunakan, jumlah organisme yang diinokulasi, kecepatan tumbuh bakteri, konsentrasi bahan kimia, serta kondisi pada saat inkubasi sehingga diperlukan adanya standarisasi keadaan untuk memperoleh hasil yang dapat dipercaya (Anonim, 2011). Menurut Mickel et al., (2003), faktor lain yang berpengaruh seperti toksisitas bahan uji, interaksi antar komponen medium dan kondisi lingkungan mikro in vitro.
Ekstrak kulit daun lidah buaya mempunyai kandungan zat aktif yang sudah teridentifikasi seperti Saponin, Sterol, Acemannan (Purbaya, 2003; Furnawanthi, 2004). Menurut Soetan et al., (2006), bahwa saponin yang diekstrak dari Sorghum bicolor L. Moench konsentrasi 25 mg/ml, efektif menghambat pertumbuhan S.aureus, namun tidak efektif terhadap E.coli maupun Candida albicans karena saponin tidak cukup mampu melakukan penetrasi ke dalam membran sel bakteri. Penelitian tentang saponin juga dilakukan Rahayu (2008), saponin yang diisolasi dari Aloe barbadensis Miller baik bentuk pekat level 12,5 mg/ml maupun serbuk level 1,5 mg/ ml, memiliki kemampuan menghambat pertumbuhan S.aureus. Penelitian Iriano (2008), hasil uji identifikasi fitokimia ekstrak heksan, ekstrak etil asetat, ekstrak etanol dan infusum lidah buaya ditemukan kandungan Antrakuinon, sedangkan uji identifikasi fitokimia ekstrak etanol dan infusum lidah buaya ditemukan kandungan tanin dan fenol.
Mekanisme yang menyebabkan penghambatan dalam pertumbuhan bakteri diduga disebabkan adanya interaksi senyawa fenol dan turunannya dengan sel bakteri. Senyawa-senyawa ini berikatan dengan protein pada bakteri melalui ikatan non spesifik membentuk kompleks protein-fenol. Pada konsentrasi rendah, terbentuk kompleks protein-fenol dengan ikatan yang lemah dan segera mengalami peruraian, kemudian merusak membran sitoplasma dan menyebabkan kebocoran isi sel, sehingga pertumbuhan bakteri terhambat. Sedangkan pada konsentrasi tinggi, zat tersebut berkoagulasi dengan protein seluler dan membran sitoplasma mengalami lisis (Dinda, 2008; Wilson et al., 1984). Menurut Dwidjoseputro (1994), senyawa fenol masuk ke dalam sel bakteri melewati dinding sel bakteri dan membran sitoplasma, di dalam sel bakteri senyawa fenol menyebabkan penggumpalan (denaturasi) protein penyusun protoplasma sehingga dalam keadaan demikian metabolisme menjadi inaktif, dan pertumbuhan bakteri menjadi terhambat.
Penelitian Rahayu (2006), bahwa Aloe barbadensis Miller dan Aloe chinensis Baker mampu menghambat pertumbuhan Escherichia coli. Penelitian Hilvian
(2007) bahwa ekstrak lidah buaya dapat menghambat perkembangan Xanthomonas oryzae pv. oryzae pada tanaman padi (Oryza sativa L.). Ekstrak lidah buaya mampu menghambat pertumbuhan Pseudomonas aeruginosa secara in vitro (Isabela, 2009).
SIMPULAN
Ekstrak kulit daun lidah buaya (Aloe barbadensis Miller) memiliki kemampuan menghambat pertumbuhan bakteri Staphylococcus aureus ATCC 25923 dan bakteri Escherichia coli ATCC 25922. Konsentrasi ekstrak kulit daun lidah buaya yang paling tinggi menghambat pertumbuhan bakteri Staphylococcus aureus ATCC 25923 pada konsentrasi 100% dan Escherichia coli ATCC 25922 pada konsentrasi 75%.
KEPUSTAKAAN
Anonim. 2011. Microbiology. Available at : http://www.bioweb. wku.edu/course/Bio1208/Lab_Manual/208% week%204. pdf Opened : 14.09.2010
Cowan, M.M. 1999. Plant Product as Antimicrobial Agents. Clinical Mikrobiology Reviews. 12 (4): 564-582.
Dewi, F. K. 2010. Aktivitas Antibakteri Ekstrak Etanol Buah Mengkudu (Morinda citrifolia L.) terhadap Bakteri Pembusuk Daging Segar [Skripsi S-1], Jurusan Biologi FMIPA. Universitas Sebelas Maret. Surakarta.
Dinda. 2008. Minimal Inhibitor Concentraction (MIC). Available at :
http://medicafarma.blogspot.com/minimalinhibitor concentrac-tion Opened : 20.06.2011.
Dwidjoseputro, D. 1994. Dasar-Dasar Mikrobiologi. Djambatan. Jakarta.
Furnawanthi, I. 2004. Khasiat dan Manfaat Lidah Buaya Si Tanaman Ajaib. Agro Media Pustaka. Jakarta. Hal 1-21.
Gasperz, V. 1995. Teknik Analisis dalam Penelitian Percobaan. Tarsito. Bandung.
Geidam, Y.A., A.G. Ambali., P.A. Onyeyili. 2007. Preliminary Phytochemical and Bacterial Evaluation of Crude Aqueous Extract of Psidium guajava Leaf. Journal of Applied Sciences. 7(4):511-4.
Gibson, J. M. 1996. Mikrobiologi dan Patologi untuk Perawat. Diterjemahkan oleh Prasada, S. Cetakan I. Penerbit Buku Kedokteran EGC. Jakarta.
Hilvian. 2007. Pengaruh Ekstrak Tanaman Lidah Buaya, Sirih, dan Sereh terhadap Perkembangan Xanthomonas oryzae. Available at : http://hpt.unpad.ac.id, Opened : 14.09.2010
Iriano, A. 2008. Efek Antibakteri Infusum Aloe vera terhadap Porphyromonas gingivalis In Vitro (Perbandingan Metode Ekstraksi Maserasi dan Infundasi) [Skripsi S-1], Fakultas
Kedokteran Gigi Program Studi Pendidikan Dokter Gigi. Universitas Indonesia. Jakarta.
Isabela, A. 2009. Pengaruh Ekstrak Lidah Buaya (Aloe vera) terhadap Pertumbuhan Pseudomonas aeruginosa pada Pasien Os-teomielitis Bangsal Cempaka Rumah Sakit Ortopedi Prof.Dr. R.Soeharso Surakarta In Vitro [Abstrak], UPT Perpustakaan Universitas Sebelas Maret, Solo.
Jawetz, E., G.E. Melnick., C.A. Adelberg. 2005. Mikrobiologi Kedokteran. Buku 2. Diterjemahkan oleh dr. Nani Widorini. Penerbit Salemba Medika. Jakarta.
Josodiwondo, S. 1993. Mikrobiologi Kedokteran. Binarupa Aksara. Jakarta.
Lingga, M.A., M.M. Rustama. 2005. Uji Aktivitas Antibakteri dari Ekstrak Air dan Etanol Bawang Putih (Allium sativum L.) terhadap Bakteri Gram Negatif dan Gram Positif yang Diisolasi dari Udang Dogol (Metapenaeus monoceros), Udang Lobster (Panulirus sp.), dan Udang Rebon (Mysis Acetes). Jurusan Biologi FMPA Universitas Padjajaran. Bandung.
Mickel, A. K., P. Sharma., S, Chogle. 2003. Effectiveness of Stannous Fluoride and Calcium Hydroxide against Enterococcus faecalis. J. Endod 29 (4):259–60.
Purbaya, J.R. 2003. Mengenal dan Memanfaatkan Khasiat Aloe vera. cv Pionerjaya. Bandung. Hal 21-165.
Rahayu, I. D. 2006. Aloe barbadensis Miller dan Aloe chinensis Baker sebagai Antibiotik dalam Pengobatan Etnoveteriner Unggas secara In Vitro. Jurnal Protein 13(1).
. 2008. Aktivitas Antibakteri Saponin Hasil Isolasi Aloe barbadensis Miller terhadap Staphylococcus aureus Penyebab Mastitis pada Sapi Perah. Jurusan Peternakan Fakultas Peternakan dan Perikanan UMM. Malang.
Sanaz, S. 1999. Anaerobic Bacterial; Prevalence and Antibiotic Susceptibility. Available at: http//ki.se/odont/cariologi en-diodonti/exarb1999/sanaz-sabouri.pdf. Opened : 22.06.2011.
Soemarno. 2000. Isolasi dan Identifikasi Bakteri Klinik. Akademi Analisis Kesehatan. Yogyakarta.
Soetan, K.O., M.A. Oyekurie., O.O. Aiyelaagbe., M. A. Fafunso. 2006. Evolution of The Antibicrobial Activity of Saponins Extract of Sorghum bicolor Moench. African Journal of Biotechnology. 5: 2405-2407.
Trisnayanti, K. A. 2003. Daya Hambat Ekstrak Temu Putri (Curcuma petiola Roxb.) pada Beberapa Bakteri Gram Negatif [Skripsi S-1], Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana.
Wardani, A.K. 2008. Uji Aktivitas Antibakteri Fraksi Residu Ekstrak Etanolik Daun Arbenan (Duchesnea indica (Andr. Facke.) terhadap Staphylococcus aureus dan Pseudomonas aeruginosa Multiresisten Antibiotik Beserta Profil Kromatografi Lapis Tipis [Skripsi S-1], Fakultas Farmasi Universitas Muhammadiyah. Surakarta.
Wilson, S.G., H.M. Dick. 1984. Topley and Wilson Principle of Bacteriology, Virology and Immunity. 7th ed. London: Edward Arnold Ltd 1984:84.
4
Discussion and feedback