IDENTIFICATION OF VIBRIO BACTERIA CAUSED VIBRIOSIS ON FRESHWATER PRAWN LARVAE (Macrobrachium rosenbergii (de Man))
on
JURNAL BIOLOGI 20 (2) : 53 - 63
ISSN : 1410-5292
IDENTIFIKASI BAKTERI VIBRIO PENYEBAB VIBRIOSIS
PADA LARVA UDANG GALAH (Macrobrachium rosenbergii (de Man))
IDENTIFICATION OF VIBRIO BACTERIA CAUSED VIBRIOSIS ON FRESHWATER PRAWN LARVAE (Macrobrachium rosenbergii (de Man))
Ni Wayan Desi Bintari1), Retno Kawuri1), A.A. Gde Raka Dalem2)
-
1) Prodi Magister Ilmu Biologi, Program Pascasarjana, Universitas Udayana
-
2) Prodi Biologi, FMIPA, Universitas Udayana, Bukit Jimbaran, Bali
Email: desibintari@gmail.com
INTISARI
Budidaya udang galah (Macrobrachium rosenbergii (de Man)) di Bali perlu didukung oleh penyediaan benih yang sehat. Adanya infeksi vibriosis pada tingkat larva merupakan salah satu faktor pembatas karena menyebabkan tingkat kematian larva yang tinggi. Sehingga perlu dilakukan pemeriksaan bakteriologis untuk mengetahui bakteri penyebab vibriosis pada larva udang galah. Screening bakteri Vibrio dilakukan di UPT Pembenihan Dinas Kelautan dan Perikanan Provinsi Bali yang terletak di Desa Pesinggahan, Klungkung. Hasil isolasi dapat dikarakterisasi 5 isolat Vibrio (VSP01, VSP02, VSP04, VSP05 and VSP06) yang ditemukan paling dominan pada air kolam pembenihan larva. Uji postulat Koch menunjukkan isolat VSP06 dapat menyebabkan vibriosis pada larva udang galah. Identifikasi isolat VSP06 dengan menggunakan KIT BBL Cystal™ Identification Systems dan buku identifikasi Bergeys’s Manual of Determinative Bacteriology Ninth Edition (Holt et al., 1994), isolat teridentifikasi sebagai Vibrio anguillarum.
Kata kunci : Udang galah (Macrobrachium rosenbergii (de Man)), Vibriosis, Vibrio anguillarum
ABSTRACT
Freshwater prawn (Macrobrachium rosenbergii (de Man)) farming in Bali needs to be supported by the provision of healthy prawn larvae. Vibriosis infection can be a limiting factor on larval production system which cause high mass mortality in larvae. Therefore a bacteriological study is very important to identify of Vibrio species which can cause vibriosis in freshwater prawn larvae. Screening of Vibrio bacteria carried on larval rearing water at UPT Pembenihan Dinas Kelautan dan Perikanan Provinsi Bali which located in Pesinggahan Village, Klungkung. During study, 5 Vibrio isolates can be characterized (VSP01, VSP02, VSP04, VSP05 and VSP06) which were isolated as dominant Vibrio bacteria in larval rearing water. Koch postulate test results showed that VSP06 can cause vibriosis in freshwater prawn larvae. The result of identification by BBL Cystal™ Identification Systems and identification book Bergeys’s Manual of Determinative Bacteriology Ninth Edition (Holt et al., 1994), BL6 was identified as Vibrio anguillarum.
Keywords: Freshwater prawn ((Macrobrachium rosenbergii (de Man)), Vibriosis, Vibrio anguillarum
PENDAHULUAN
Budidaya udang galah mengalami perkembangan dan perluasan area tambak yang cukup pesat terutama di daerah Bali, Daerah Istimewa Yogyakarta dan Jawa Barat (Khairuman dan Amri, 2004). Sebagai upaya dalam peningkatan produksi, kualitas benih/benur yang digunakan untuk budidaya harus sangat diperhatikan. Benih yang terinfeksi patogen akan dapat menyebabkan peningkatan kejadian penyakit di tambak budidaya (Patang, 2012). Benih udang dapat terinfeksi beberapa penyakit yang dapat disebabkan oleh virus (Ravi et al., 2009), parasit (Shailender et al., 2012), jamur (Krishnika dan Ramasamy, 2014) dan bakteri (FAO, 2002). Infeksi
patogen pada tingkat benih menurut Shailender (2012) dapat terjadi pada tingkat stadium larva yang bervariasi. Hal tersebut terkait pada tingkat ketahanan larva, jenis patogen, kondisi lingkungan (salinitas, temperatur, pH) dan manajemen pemeliharaan.
Bakteri dari kelompok Vibrionaceae merupakan patogen utama pada tingkat pembenihan udang. Beberapa spesies Vibrio patogen telah banyak dilaporkan menyebabkan tingkat kematian benih yang sangat tinggi pada panti pembenihan di wilayah Asia Tenggara dan Selatan (Otta et al., 2001). Chatterjee dan Haldar (2012) menyatakan beberapa spesies Vibrio yang sering dilaporkan menyebabkan infeksi vibriosis diantaranya V. harveyi, V. parahaemolyticus, V. alginolyticus, V.
aguillarum dan V. vulnificus. Infeksi vibriosis menurut Surreshvarr et al. (2011) dapat terjadi pada semua stadium larva hingga post larva. Shailender (2012) menyatakan infeksi bakteri Vibrio luminescent pada larva M. rosenbergii banyak ditemukan pada stadium zoea dan post larva. Sementara itu Jayaprakash et al. (2006) melaporkan bakteri Vibrio alginolyticus (MRNL-3) yang diisolasi dari Rosen Fisheries Kerala, secara signifikan menyebabkan kematian larva M. rosenbergii pada stadium mysis ke-9.
Tujuan penelitian ini adalah menghitung total bakteri Vibrio, mengisolasi dan mengkarakterisasi isolat Vibrio yang terdapat di kolam pembenihan larva di UPT Pembenihan Dinas Kelautan dan Perikanan Provinsi Bali serta melakukan uji postulat Koch untuk mengetahui bakteri patogen penyebab vibriosis. Bakteri Vibrio patogen selanjutnya dilakukan identifikasi hingga tingkat spesies melalui uji secara biokimiawi.
MATERI DAN METODE
Isolasi Bakteri Vibrio
Isolasi bakteri Vibrio dilakukan di 4 kolam pembenihan larva milik UPT Pembenihan Dinas Kelautan dan Perikanan Provinsi Bali yang terletak di Desa Pesinggahan, Kecamatan Dawan, Kabupaten Klungkung Bali. Pengambilan sampel dilakukan sebanyak 3 kali, dengan 3 kali ulangan. Isolasi Vibrio pada sampel air dilakukan dengan metode pengenceran (serial dilution method) (Pelzar dan Chan, 2002) pada larutan trisalt (Kharisma dan Manan, 2012), hingga faktor pengenceran 10-4. Masing-masing faktor pengenceran ditanam secara pour plate (Pelzar dan Chan, 2002) pada media Thiosulfate Citrate Bile Salt Sucrose Agar (TCBS). Inkubasi dilakukan pada inkubator selama 24 jam pada suhu ± 300C (Chau et al., 2011). Masing-masing sampel dilakukan perhitungan total bakteri Vibrio (Hadioetomo, 1993). Isolat murni yang didapatkan dari hasil isolasi disimpan pada media TSA (Tryptic Soy Agar) miring yang mengandung 5% NaCl (Chau et al., 2011).
Uji Postulat Koch
-
a. Persiapan wadah uji dan hewan uji
Wadah uji menggunakan bak plastik dengan ukuran diameter 10 cm dan tinggi 15 cm. Wadah sebelum digunakan didesinfeksi dengan Bayclin™ dan deterjen. Larva udang galah yang digunakan untuk uji adalah larva udang galah stadium IV dengan kisaran usia 9-11 hari (Evan, 2009). Larva ditebar pada masing-masing wadah uji sebanyak 50 ekor/500 mL air payau (salinitas 10 ppt). Larva sebelum diberi perlakuan diaklimatisasi selama 1 hari dan dilakukan pengantian air wadah sebanyak 1020% sebelum diinokulasi bakteri. Larva diberi makan berupa Artemia sebanyak 4 naupli/ larva yang diberikan pada pagi pukul 08.00 WITA dan sore hari pukul 16.00 WITA (Evan, 2009; Velmurugan et al., 2015; Shailendar et al., 2014).
-
b. Perlakuan uji postulat Koch
Uji menggunakan isolat Vibrio yang paling dominan diisolasi dari air kolam pembenihan larva. Isolat Vibrio sp. untuk uji dikultur pada media Alkaline Peptone Water (APW) selama 24 jam pada suhu ± 300C (Chau et al., 2011). Bakteri dipanen dengan disentrifugasi pada kecepatan 5000 rpm selama 5 menit. Pelet yang didapatkan diresuspensi pada 10 mL NaCl 0,9% (w/v). Kultur distandarkan dengan standar McFarland 5% dengan estimasi kepadatan koloni 1x 107-108 CFU/ mL. Perhitungan kepadatan koloni kultur selanjutnya dilakukan dengan metode total plate count. Suspensi bakteri diinokulasikan pada masing-masing wadah percobaan sebanyak 5 mL pada konsentrasi 107-108 CFU/mL. Pada perlakuan kontrol tidak dilakukan inokulasi bakteri. Pengamatan dilakukan selama 48 jam dan dilakukan pengamatan visual berupa pengamatan pergerakan larva dan pencatatan beberapa parameter pengamatan yang meliputi :
-
1. Tingkat kelangsungan hidup larva udang (Goddard, 1996) dengan perhitungan :
Nt
SR = -x 100%
No
Keterangan :
SR : Tingkat kelangsungan hidup (%)
Nt : Jumlah larva udang yang hidup pada akhir pengamatan (ekor)
No : Jumlah larva udang pada awal pengamatan (ekor)
-
2. Kelimpahan total bakteri Vibrio sp. (Hadioetomo, 1993) dengan perhitungan :
1
Σ Bakteri = V x n × — f
Keterangan :
∑ bakteri : banyaknya sel bakteri (CFU/mL) n : jumlah koloni bakteri
v : volume sampel
f : faktor pengenceran
Identifikasi Bakteri Penyebab Vibriosis
Bakteri patogen penyebab vibriosis dikarakterisasi secara mikroskopis, uji Gram, uji serologi dan uji biokimia. Uji biokimia dilakukan dengan menggunakan KIT BBL Crystal™ Identification Systems. Hasil uji disesuaikan dengan kunci determinasi dari Bergey’s Manual of Determinative Bacteriology (Holt et al., 1994) untuk identifikasi hingga tingkat spesies.
HASIL
Total Bakteri Vibrio
Perhitungan total bakteri Vibrio menunjukkan air kolam pembenihan larva di UPT Pembenihan Dinas Perikanan dan Kelautan Provinsi Bali rata-rata memiliki
kelimpahan Vibrio sebanyak 10-103 CFU/mL. Total bakteri Vibrio tertinggi terdapat pada bak D yaitu rata-rata sebanyak 103 CFU/mL dan terendah pada Bak A (Tabel 1).
Tabel 1. Total Bakteri Vibrio pada Bak Pembenihan Larva
|
No. |
Kode Bak |
Kisaran umur larva |
Pengambilan samper 1 (CFU/mL) |
Pengambilan sampel 2 (CFU/mL) |
Pengambilan sampel 3 (CFU/mL) |
Total rata-rata Vibrio (CFU/ mL) |
|
1. |
Bak A |
1-5 hari |
27 |
80 |
126 |
7,7x101±49,54 |
|
2. |
Bak B |
7-11 hari |
366 |
396 |
290 |
3,5x102±54,63 |
|
3. |
Bak C |
14-18 hari |
717 |
716 |
760 |
7,3x102±25,12 |
|
4. |
Bak D |
21-35 hari |
1566 |
1360 |
1730 |
1,x103±185,40 |
Keterangan :
Masing-masing pengambilan sampel dilakukan 3 kali ulangan.
Karakterisasi Isolat Vibrio
Berdasarkan hasil isolasi pada sampel air, dapat dikarakterisasi tujuh isolat yang memiliki perbedaan karakteristik secara makroskopis dan mikroskopis (Tabel 2). Ketujuh isolat memiliki sel berbentuk batang bengkok (koma) dengan ukuran rata-rata 0,6 -2,2 µm dan bersifat Gram negatif, katalase positif, fermentasi sukrosa positif atau negatif, aerob atau aerob fakultatif dan motil. Ketujuh isolat yang dikarakterisasi memiliki persamaan karakteristik dengan genus Vibrio berdasarkan buku identifikasi Holt et al. (1994). Berdasarkan hasil tersebut maka ketujuh isolat diidentifikasi termasuk genus Vibrio.
Tabel 2. Karakteristik Isolat Vibrio Hasil Isolasi
No. Kode isolat
Karakteristik makroskopis (Pada Media TCBS) dan mikroskopis
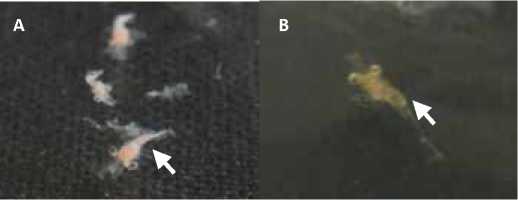
Gambar 1. Perubahan Warna Tubuh Larva Udang Galah. Larva udang galah yang terinfeksi vibriosis mengalami perubahan warna tubuh menjadi kemerahan (A) dibandingkan dengan larva udang galah sehat (kontrol) (B), memiliki tubuh berwarna transparan.
penurunan persentase kelangsungan hidup larva (Tabel 3) paling tinggi dan menyebabkan terjadinya abnormalitas pergerakan larva (Tabel 4). Total populasi VSP06 pada wadah pemeliharaan tercatat paling tinggi dibandingkan perlakuan kultur Vibrio lainnya (Tabel 5). Larva udang galah yang terinfeksi vibriosis juga mengalami perubahan warna tubuh dari transparan menjadi kemerahan (Gambar 1).
Tabel 3. Persentase Kelangsungan Hidup (SR) Larva Udang Galah pada Wadah Pemeliharaan
|
No. |
Kode Isolat |
% SR (A1) |
% SR (A2) |
% SR (A3) |
Rata-rata % SR |
|
1. |
Kontrol |
72,00 % |
80,00 % |
84,00 % |
78,67 % ± 0,06 |
|
2. |
VSP01 |
24,00 % |
12,00 % |
32,00 % |
22,67 % ± 0,10 |
|
3. |
VSP02 |
42,00 % |
56,00 % |
70,00 % |
56,00 % ± 0,14 |
|
4. |
VSP04 |
40,00 % |
36,00 % |
30,00 % |
35,33 % ± 0,05 |
|
5. |
VSP05 |
72,00 % |
58,00 % |
42,00 % |
57,33 % ± 0,15 |
|
6. |
VSP06 |
10,00 % |
12,00 % |
8,00 % |
10,00 % ± 0,02 |
Keterangan :
1). % SR (A1) : Tingkat kelangsungan hidup (%) larva di wadah pemeliharaan 1
% SR (A2) : Tingkat kelangsungan hidup (%) larva di wadah pemeliharaan 2
% SR (A3) : Tingkat kelangsungan hidup (%) larva di wadah pemeliharaan 3
Rata–rata % SR : Nilai rata-rata tingkat kelangsungan hidup (%) larva
2). Nilai-nilai pada tabel ± standar deviasi merupakan rata-rata dari tiga kali ulangan
Tabel 4. Pergerakan Larva Udang Galah Pasca Infeksi
|
No. |
Perlakuan kultur |
Hasil pengamatan | ||
|
Wadah pemeliharaan 1 |
Wadah pemeliharaan 2 |
Wadah pemeliharaan 3 | ||
|
1. |
Kontrol |
+++ |
+++ |
++ |
|
2. |
VSP01 |
++ |
++ |
++ |
|
3. |
VSP02 |
++ |
++ |
++ |
|
4. |
VSP04 |
++ |
++ |
++ |
|
5. |
VSP05 |
+++ |
++ |
+++ |
|
6. |
VSP06 |
++ |
+ |
++ |
|
Keterangan : 1). +++ : berenang normal (larva berenang di dinding kolom air) ++ : berenang tanpa arah (larva berenang tidak beraturan, berputar-putar) + : berenang lemah di dasar (sebagian besar larva berenang di dasar wadah pemeliharaan, pergerakan larva lambat) | ||||
Uji Postulat Koch Bakteri Vibrio Penyebab Vibriosis
Isolat yang digunakan untuk uji postulat Koch adalah isolat yang ditemukan paling dominan pada kolam larva yaitu isolat VSP01, VSP02, VSP04, VSP05 dan VSP06. Hasil uji menunjukkan isolat VSP06 merupakan bakteri penyebab vibriosis dimana dapat menyebabkan
Identifikasi Bakteri Penyebab Vibriosis
Isolat VSP06 dilakukan karakterisasi dan uji biokimia dengan menggunakan KIT BBL Crystal™ Identification Systems dan diidentifikasi dengan buku identifikasi Holt et al. (1994). Berdasarkan hasil karakterisasi dan uji biokimia (Tabel 6.), isolat VSP06 teridentifikasi sebagai Vibrio anguillarum.
Tabel 5. Kelimpahan Total Bakteri Vibrio pada masing-masing Wadah Perlakuan
|
No. |
Perlakuan kultur |
Total populasi di awal perlakuan (CFU/mL) |
Total populasi di akhir perlakuan (CFU/mL) |
|
1. |
Kontrol |
Tidak diinokulasi |
71±22,8 |
|
2. |
VSP01 |
1x107±0,00 |
1,4x104±5921,50 |
|
3. |
VSP02 |
1x107±0,00 |
7x102±458,25 |
|
4. |
VSP04 |
1x107±0,00 |
3,3x103±1154,70 |
|
5. |
VSP05 |
1x107±0,00 |
2,6x102±208,16 |
|
6. |
VSP06 |
1x107±0,00 |
1,6x104±4041,45 |
Keterangan :
1). Total populasi awal merupaka total populasi bakteri Vibrio yang digunakan untuk uji Postulat Koch.
2). Nilai-nilai pada tabel ± standar deviasi merupakan rata-rata dari tiga kali ulangan.
Bakteri V. anguillarum yang berhasil diidentifikasi memiliki karakteristik diantaranya tumbuh dengan baik pada media TCBS, McConkey dan nutrient broth yang diperkaya dengan 1-6 % NaCl. Isolat juga dapat dikultur dengan baik pada media TSA dengan konsentrasi NaCL 2% (Gambar 2 A). Adapun karakteristik pertumbuhan bakteri V. anguillarum tersebut pada media TSA diantaranya koloni tumbuh berbentuk bulat berwarna coklat mengkilat, tepi koloni utuh dan permukaan koloni timbul cembung (Gambar 2 B). Berdasarkan hasil pengujian Gram, isolat termasuk kelompok Gram negatif dan memiliki sel berbentuk batang bengkok (koma) dengan ukuran 1,1 – 1,9 µm (Gambar 2 C).
PEMBAHASAN
Total bakteri Vibrio pada kolam pembenihan larva di UPT Pembenihan Dinas Kelautan dan Perikanan Provinsi Bali rata-rata sebanyak 10-103 CFU/mL (Tabel 1). Total bakteri tersebut mengacu pada Shariff et al. (1992) telah melebihi ambang batas, dimana total ambang batas Vibrio yang disarankan untuk sistem hatchery adalah sebesar 1x102 CFU/mL. Total bakteri yang melebihi ambang batas menurut Kharisma dan Manan (2012) akan berpotensi meningkatkan infeksi penyakit. Adanya infeksi penyakit khususnya vibriosis pada tingkat larva merupakan salah satu kendala dalam upaya penyediaan benih udang yang sehat (Melki et al., 2011). Mariyono
Tabel 6. Hasil Karakterisasi Isolat VSP06 (V. anguillarum)
|
Karakterisasi/ uji biokimia |
Hasil |
Karakterisasi/ uji biokimia |
Hasil |
|
Oxidase |
+ |
Sucrose |
+ |
|
Katalase |
+ |
Melibiose |
- |
|
Gram |
- |
Rhamnose |
- |
|
Batang lurus |
- |
Sorbitol |
+ |
|
Motilitas |
+ |
Galactose |
+ |
|
Pertumbuhan pada : |
Adonitol |
- | |
|
280C |
+ |
Inositol |
- |
|
370C |
+ |
p-nitrophenyl phosphate |
+ |
|
400C |
- |
p-nitrophenyl α-β glucoside |
+ |
|
Pertumbuhan pada nutrient broth: |
p-nitrophenyl β-galactoside |
+ | |
|
0% NaCl |
- |
Proline nitroanilide |
+ |
|
1% NaCl |
+ |
p-nitrophenyl bis-phosphate |
+ |
|
3% NaCl |
+ |
p-nitrophenyl xyloside |
- |
|
6% NaCl |
+ |
p-nitrophenyl α arabinoside |
+ |
|
8% NaCl |
- |
p-nitrophenyl phosphorylcholine |
+ |
|
10% NaCl |
- |
p-nitrophenyl β-glucuronide |
- |
|
12% NaCl |
- |
p-nitrophenyl-N-acetyl glucosaminide |
+ |
|
Pertumbuhan pada McConkey |
+ |
γ-L-glutamyl p-nitroanilide |
+ |
|
Pertumbuhan pada TCBS agar |
+ |
Esculin |
- |
|
Antisera : |
p-nitro-DL-phenylalanine |
- | |
|
Ogawa |
- |
Urease |
- |
|
Inaba |
- |
Glycine |
- |
|
Indol |
+ |
Citrate |
+ |
|
Voges Praskauer |
+ |
Malonate |
- |
|
Arabinose |
+ |
Tetrazolium |
+ |
|
Mannose |
+ |
Arginine |
+ |
|
Mannitol |
+ |
Lysine decarboxylase |
- |
Hasil identifikasi VSP06 : Vibrio anguillarum
et al. (2000) melaporkan tingkat infeksi yang tinggi dapat menyebabkan kematian larva dalam skala besar selama pemeliharaan.
Hasil isolasi bakteri Vibrio dapat dikarakterisasi 7 isolat Vibrio yang memiliki perbedaan karakteristik makroskopis dan mikroskopis (Tabel 2). Lima isolat diantaranya ditemukan paling dominan pada air kolam

Gambar 2. Karakteristik V. anguillarum (isolat VSP06). (A) Koloni pada media TSA dengan usia kultur 24 jam, (B) koloni berbentuk bulat berwarna coklat mengkilat, (C) bakteri berbentuk batang bengkok (1,1-1,9 µm).
pembenihan yaitu isolat VSP01, VSP02, VSP04, VSP05 dan VSP06. Menurut Rao dan Surendran (2013), keragaman spesies Vibrio pada tingkat hatchery sangat tinggi. Tingkat keragaman Vibrio ini juga dilaporkan lebih tinggi dibandingkan pada tingkat pemeliharaan di kolam akuakultur. Bahkan dominansi dari Vibrio patogen ditemukan lebih tinggi pada tingkat hatchery dibandingkan pada tingkat tambak/ kolam akuakultur.
Menurut Otta et al. (2001), pada tingkat hatchery dapat terjadi peningkatan total populasi Vibrio hingga mencapai 60,3%. Hal tersebut menurut Sureshvarr et al. (2011) dapat disebabkan karena Vibrio merupakan salah satu flora normal yang berasosiasi pada sistem hatchery. Hameed et al. (2003) menyatakan Vibrio merupakan flora dominan pada telur, larva dan post larva udang. Meskipun demikian, Kent (2000) menyatakan bakteri Vibrio sangat potensial berkembang sebagai patogen opportunistic. Hal tersebut menurut Otta et al. (2011) dapat terjadi apabila terjadi peningkatan material organik yang bersumber dari pakan dan feses yang mendorong mikroflora berkembang menjadi patogen opportunistic.
Isolat VSP06 berdasarkan hasil uji Postulat Koch diketahui dapat menyebabkan penurunan persentase kelangsungan hidup larva (SR) selama uji. Nilai persentase SR larva setelah diinokulasi VSP06 selama 48 jam sebesar 10,00 % ± 0,02 (Tabel 3). Selain itu bakteri VSP06 berdasarkan perhitungan total bakteri memiliki rata-rata kelimpahan paling tinggi di akhir perlakuan yaitu sebanyak 1,6x104 ± 4041,45 CFU/mL (Tabel 5). Larva yang terinfeksi oleh VSP06 menunjukkan abnormalitas pergerakan dimana larva berenang tanpa arah/ tidak beraturan dan larva berenang lemah di dasar wadah pemeliharaan (Tabel 4). Abnormalitas pergerakan larva yang teramati menurut Evan (2009) merupakan salah satu gejala stress yang ditimbulkan akibat adanya infeksi vibriosis. Larva yang terinfeksi vibriosis juga mengalami perubahan warna tubuh dari bening/ transparan menjadi kemerahan (Gambar 1).
Infeksi vibriosis pada stadium larva menurut Huervana et al. (2006) akan menyebabkan peradangan pada organ hepatopankreas. Hal tersebut juga dibuktikan oleh Evan (2009) yang menyatakan bahwa larva udang galah yang terinfeksi V. harveyi mengalami kerusakan dan abnormalitas organ hepatopankreas. Robertson et al. (1998) menambahkan patogen yang menginfeksi sel hepatopankreas akan memproduksi produk ekstraseluler (ECP) yang dapat berupa enzim. Produksi enzim tersebut menyebabkan peningkatan vakuolalisasi sel sehingga mendorong tingginya pembentukan bolitas. Austin dan Zhang (2006) menyatakan pembentukan bolitas menyebabkan terhalanginya kelenjar pencernaan bagian atas akibat pembengkakan jaringan yang berbentuk seperti bola. Akibatnya larva tidak dapat mencerna makanan sehingga fungsi fisiologis terganggu dan berakibat pada perubahan prilaku dan pada tahap akhir menyebabkan kematian larva.
Isolat VSP06 berdasarkan hasil identifikasi secara
biokimia teridentifikasi sebagai V. anguillarum. Adanya infeksi V. anguillarum pada hewan akuakultur telah banyak dilaporkan sebelumnya. Bakteri tersebut diketahui dapat menyebabkan penyakit pada udang, moluska dan berbagai jenis ikan dengan tingkat mortalitas yang tinggi (Vaseeharan dan Ramasamy, 2003). Pada budidaya udang, V. anguillarum telah dilaporkan menginfeksi udang air tawar seperti Macrobrachium malcomsonii (Behura et al., 2015), M. rosenbergii (Pande et al., 2014; Rodriguez et al., 2001), udang penaida seperti Penaeus monodon (Veseeharan dan Ramasamy, 2003), P. indicus (Jayasree, 2009) dan udang vaname (Litopeneus vannamei) (Jang et al., 2014).
Kemampuan infeksi V. anguillarum dilaporkan lebih rendah dibandingkan beberapa spesies patogen Vibrio lainnya seperti V. alginolyticus dan V. parahaemolyticus. Meskipun demikian, pada populasi yang berlimpah kemampuan infeksi V. anguillarum akan meningkat drastis dengan tingkat mortalitas mencapai 100% (Thakur et al., 2013). Mancuso et al. (2015) lebih jauh menyatakan terjadinya outbreak vibriosis oleh V. anguillarum umumnya dipicu oleh perubahan kondisi lingkungan (perubahan suhu, salinitas dan lainnya) atau physiological stress. Hal tersebut menyebabkan selain sebagai patogen primer penyebab vibriosis, V. anguillarum juga merupakan patogen opportunistic pada hewan akuakultur.
SIMPULAN
Total bakteri Vibrio rata-rata pada kolam pembenihan larva di UPT Pembenihan Dinas Kelautan dan Perikanan Provinsi Bali rata-rata sebanyak 10-103 CFU/mL. Berdasarkan hasil isolasi dapat dikarakterisasi 5 isolat bakteri Vibrio yang ditemukan paling dominan pada kolam pembenihan larva. Hasil uji Postulat Koch menunjukkan isolat VSP06 dapat menyebabkan infeksi vibriosis pada larva udang galah (M. rosenbergii (de Man)). Isolat VSP06 berdasarkan hasil identifikasi secara biokimia teridentifikasi sebagai V. anguillarum.
UCAPAN TERIMAKASIH
Terimakasih kepada Dinas Perikanan dan Kelautan Pemerintah Provinsi Bali, Balai Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Denpasar, UPT Pembenihan Dinas Perikanan dan Kelautan Pemerintah Provinsi Bali dan UPT Balai Laboratorium Kesehatan Provinsi Bali.
KEPUSTAKAAN
Austin, B., X.H. Zhang. 2006. Under the microscope. Vibrio harveyi : a significant pathogen of marine vertebrates and invertebrates. Letters in Applied Microbiology 43 (2): 119-124.
Behura, B.B., B.K. Das., S.C. Mukherjee. 2015. Characterization and serological studies of Vibrio anguillarum isolated from
diseased freshwater prawn, Macrobrachium malcolmso-nii. Int. J. Curr.Microbiol.App. Sci. 4(11): 261-271.
Chatterjee, S., S. Haldar. 2012. Vibrio related diseases in aquaculture and development of rapid and accurate identification methods. J. Marine Sci Res Dev. 1-7.
Chau, N.T.T., N.X. Hieu., L.T.N. Thuan., M. Matsumoto., I. Miyajima. 2011. Identification and Characterization of Actinomyces Antagonistic to Pathogenic Vibrio Spp. Isolated From Shrimp Culture Pond Sediments in Thua Thien Hue-Viet Nam. J. Fac. Agr. Kyushu Univ. 56(1): 15-22.
Evan, Y. 2009. “Uji Ketahanan Beberapa Strain Larva Udang Galah (Macrobrachium rosenbergii De Man)Terhadap Bakteri Vibrio harveyi” Institut Pertanian Bogor. (Skripsi).
FAO. 2002. Cultured Aquatic Species Information Programme Macrobrachium rosenbergii (de Man, 1879). [Online]. Available:”http://www.fao.org”. [2 September 2015].
Goddard, S. 1996. Feed Management In Intensive Aquaculture. Chapmann and Hall. New York.
Hadioetomo, R.S. 1993. Mikrobiologi Dasar Dalam Praktek: Teknik Dan Prosedur Dasar Laboratorium. Gramedia Pustaka Utama. Jakarta.
Hameed, S.A.S., K.H. Rahaman., A. Alagan., K. Yoganandha. 2003. Antibiotic Resistance in Bacteria Isolated from Hatchery-reared Larvae and Post-larvae of Macrobrachium rosenbergii. Aquacult. 217: 39-48.
Holt, J.G, N.R Krieg, P.H.A Sneath, J.T Staley and S.T Wil-liams.1994. Bergey’s Manual of Determinative Bacteriology. Ninth Edition. Williams & Wilkins. Baltimore.
Huervana, F.H, J.J.Y. Cruz., C.M.A Caipang. 2006. Inhibition of luminous Vibrio harveyi by “green water” obtained from tank culture of tilapia, Oreochromis mossambicus. Acta Ichthyol. Piscat. 36 (1): 17-23.
Jang, I.K., G. Qiao., S.K. Kim. 2014. Effect of multiple infection with white spot syndrome virus and Vibrio anguillarum on Pacific white shrimp Litopenaeus vannamei (L.) : mortality and viral replication. J. of Fish Disease 37(10): 911-920.
Jayaprakash, N.S., S.S. Pal., R. Philip., I.S.B. Singh. 2006. Isolation of a Pathogenic Strain of Vibrio alginolyticus From Necrotic Larvae of Macrobachium rosenbergii (de Man). J. of Fish Diseases 29: 187-191.
Jayasree, S. 2009. Identification of immune cells interacting with Vibrio spp. and its in vitro post-phagocytic killing mechanism of haemocytes in the penaeid shrimp, Penaeus indi-cus H. Milne Edwards. J. of Fish Diseases. 32(4): 359-365.
Kent, M.L. 2000. Marine netpen farming and infections with some unusual parasites. Int. J. Parasitol. 30: 321-26.
Khairuman., K. dan Amri. 2004. Budidaya Udang Galah Secara Intensif. Jakarta : AgroMedia Pustaka.
Kharisma, A., A. Manan. 2012. Kelimpahan Bakteri Vibrio sp. Pada Air Pembesaran Udang Vannamei (Litopenaeus van-namei) Sebagai Deteksi Dini Serangan Penyakit Vibriosis. J.Ilmiah Perikanan dan Kelautan 4(2): 129-134.
Krishnika, A., P. Ramasamy. 2014. Legenidium sp. Infection in the Larval Stages of the Freshwater Prawn Macrobrachium rosenbergii (DeMan). Indian J.Fish 61(2): 90-96.
Mancuso, M., L. Genovese., G. Maricchiolo. 2015. Brown spot disease in Penaeus kerathurus eggs and larvae: a case report. Int. J. of Curr.Microbiology and Appl. Sci. 4(10): 938-944.
Mariyono, A. Wahyudi., Sutomo. 2002. Teknik penanggulangan penyakit udang menyala melalui pengendalian populasi bakteri di laboratorium. Buletin Teknik Pertanian 7(1): 25-27.
Melki, D. Soedharma., H. Effendi., A.Z. Mustofa. 2011. Biopo-tensi tumbuhan mangrove untuk pencegahan penyakit vibriosis pada udang windu. Maspari J. 2: 39-47.
Otta S.K., I. Karunasagar. 2001. Bacteriological Study of Shrimp Penaeus monodon Fabricius, Hatcheries In India. J Appl Ichthyology 17 (2): 59-63.
Pande, G.S.J., N.T. Suong., P. Bossier., T. Defoirdt. 2014. The catecholamine stress hormones norepinephrine and dopamine increase the virulence of pathogenic Vibrio anguillarum and Vibrio campbellii. FEMS Microbiol. Ecol. 90: 761-769.
Patang. 2012. Pengaruh Penggunaan Berbagai Antibiotik dan Probiotik dengan Dosis Berbeda Terhadap Pertumbuhan dan Kualitas Air Pada Larva Udang Windu (Penaeus monodon Fabricus). J. Agrisistem 8(2):77-86.
Pelczar, M.J. dan E.C.S. Chan. 2002. Dasar-dasar Mikrobiologi Jilid ke-1. Jakarta. UI-Press.
Rao, B.M., P.K. Surendran. 2013. Pathogenic Vibrios in Penaeus monodon shrimp hatcheries and aquaculture farms. Fishery Technology 50:161-167.
Ravi, M., A.N.Basha., M.Sarathi., H.H.R. Idalia., J.S. Widada., J.R. Bonami., A.S.S. Hameed. 2009. Studies on The Occurrence of White Tail Disease (WTD) Caused By Mrnv And XZV In Hatchery-Reared Post-Larvae of Penaeus indicus and P. monodon. Aquaculture 292:117-120.
Robertson P.A.W., C.O. Dowd., C. Burrell., P. William., B. Austin. 1998. Use of Carnobacterium sp. as a Probiotic for Atlantic Salmon (Salmo salar L.) and Rainbow trout, Oncorhyn-chus mykiss, Walbaum. Aquaculture 185:235–243.
Rodriguez, B., C. Lodeiros., G. Conroy. D. Conroy., C. Graziani. 2001. Pathobiological studies on cultured populations of the freshwater prawn, Macrobrachium rosenbergii (de Man, 1879), Margarita Island, Venezuela. Revista Cientifica 9(2):162-169.
Shailender, M., P.V. Krishna, S.B. Chand., B. Srikanth. 2012. Impact of Disease on the Growth and Survival of Giant Freshwater Prawn, Macrobrachium rosenbergiii (De Man) Larvae In the Hatchery Level. World J.of Fish and Marine Sci. 4(6):620-625.
Shariff, M., R.P. Subangsinghe., J.R. Arthus. 1992. Disease in Asian Aquaculture Fish I. Manila. Fish Health Section, Asian Fish.
Sureshvarr, K., M. Jayakumar., M. Prakash. 2011. Pretentious investigation of bacterial flora associated with fresh water prawn (Macrobrachium rosenbergii). Int. J. of Environ. Sci. and Ecotechnology 1(1): 45-53.
Thakur, A.B., R.B. Vaidya., S.A. Suryawanshi. 2013. Pathogenicity and antibiotic susceptibility of Vibrio species isolated from moribund shrimps. Indian J. of Marine Sci. 32(1):71-75.
Velmurugan, S., S.T. John., D.S. Nagaraj., T.A. Ashine., S. Kuma-ran., S.R. Pugazhvendan. 2015. Isolation of Actinomycetes From Shrimp Culture Pond and Antagonistic to Pathogenic Vibrio spp. and WSSV. Int. J. of Curr. Microbiology and Appl. Sci. 4(7):82-92.
Veseeharan, B., P. Ramasamy. 2003. Abudance of potentially pathogenic micro-organism in Penaeus monodon larvae rearing systems in India. Microbiol. Res. 158:299-308.
58
Discussion and feedback