PRODUKSI ETANOL DARI SISA GULA LIMBAH PABRIK BREM
on
JURNAL BIOLOGI 18 (2) : 37 - 40
ISSN : 1410-5292
PRODUKSI ETANOL DARI SISA GULA LIMBAH PABRIK BREM
ETHANOL PRODUCTION FROM WASTE OF RICE WINE FACTORY
I Putu Oka Suartama1, Yan Ramona2,3, I Gusti Ngurah Jemmy Anton Prasetya1
-
1 Jurusan Farmasi, Fakultas MIPA, Universitas Udayana
-
2 UPT Laboratorium Terpadu Biosain dan Bioteknologi, Universitas Udayana 3Jurusan Biologi, Fakultas MIPA, Universitas Udayana
Corresponding author : yan_ramona@yahoo.com
INTISARI
Penelitian ini bertujuan untuk mengetahui potensi gula yang terkandung dalam limbah pabrik brem untuk produksi etanol. Kadungan gula pereduksi dan kadar etanol ditentukan berturut-turut dengan metode luff schoorl and hydrometer. Hasil penelitian menunjukkan bahwa kandungan rata-rata gula pereduksi pada limbah pabrik brem sekitar 4,55% (b/v) dan jumlah ini cukup untuk difermentasi oleh Saccharomyces cerevisiae menjadi etanol. Pada akhir proses (hari ke 21) konsentrasi etanol yang terbentuk sebesar 2,9% (v/v) atau 22,64 g/liter atau 0,49 mol/liter. Hasil ini menunjukkan bahwa efisiensi proses pengubahan gula menjadi etanol mencapai 96%. Selama proses fermentasi terjadi penurunan pH dari 4,25 ±0.00 (pada hari ke 0) menjadi 3.58±0.10 (pada hari ke 21). Hasil penelitian ini memberikan gambaran bahwa limbah pabrik brem sangat berpotensi sebagai sumber gula pereduksi untuk produksi etanol.
Kata kunci: limbah pabrik Brem, fermentasi, etanol, Saccharomyces cerevisiae.
ABSTRACT
The main objective of this research was to investigate the reducing sugar content of rice wine processing waste and its potency in the ethanol production. The sugar content and ethanol concentration following fermentation process were analysed using the luff schoorl method and hydrometer, respectively. The results showed that averagely the waste contained 4.55% (w/v) reducing sugar which was sufficient for ethanol production in the process of fermentation by Saccharomyces cereviseae. On the completion of the process (day 21) the concentration of the ethanol was 2.9% (v/v) or 22.64 gram/liter or 0.49 mol/liter, indicating that the efficiency of the process reached 96%. During the process, a decrease in pH level was observed from 4.25±0.00 (day 0) to 3.58±0.10 (day 21). In conclusion, the waste of rice wine has a great potential as a reducing sugar source for ethanol production.
Keywords: rice wine waste, fermentation, ethanol, Saccharomyces cerevisiae.
PENDAHULUAN
Dalam beberapa tahun terakhir ini, etanol banyak dipakai sebagai bahan bakar alternatif karena cadangan bahan bakar minyak yang berasal dari fosil jumlahnya mulai sangat terbatas, bahkan suatu saat akan habis. Hal ini mendorong para ilmuwan untuk mencari bahan bakar alternatif sebagai pengganti bahan bakar fosil yang diperkirakan akan habis dalam 50 tahun ke depan (Hidayat, 2005 dan Gumienna et al., 2013). Salah satu alternatif yang mungkin dikembangkan adalah dengan memproduksi etanol atau bioetanol dengan menggunakan limbah sebagai bahan bakunya, sehingga etanol dapat diproduksi dalam waktu yang tidak terbatas.
Salah satu jenis limbah yang banyak dihasilkan di Bali dan sangat potensial untuk bahan dasar pembuatan etanol adalah limbah pabrik wine (brem). Limbah ini sangat potensial, karena jumlah limbah yang dihasilkan cukup besar dan di dalamnya masih mengandung gula pereduksi dalam jumlah yang cukup banyak. Berdasarkan hasil survei, pabrik brem yang ada di Bali menghasilkan
limbah sebanyak 50 - 100 kg per hari atau sekitar 1,5 - 3 ton per bulan. Selama ini limbah tersebut hanya dipakai sebagai ransum ternak atau dipakai untuk pupuk organik setelah dikomposkan. Bahkan dalam waktu-waktu tertentu, terutama pada saat laju produksi brem mencapai puncaknya, limbah ini sering dibuang oleh pelaku industri karena jumlahnya yang melimpah. Dalam situasi seperti ini, limbah tersebut merupakan bahan yang berpotensi mencemari lingkungan tanah atau badan air. Oleh karena itu, diperlukan suatu usaha untuk memanfaatkan limbah tersebut menjadi suatu produk yang bermanfaat bagi kehidupan manusia sehingga laju pencemaran lingkungan yang disebabkan oleh limbah ini dapat dikurangi atau bahkan dihentikan sama sekali.
Penelitian ini mengkaji potensi limbah yang dihasilkan oleh pabrik brem yang ada di Bali sebagai bahan baku untuk membuat etanol dengan cara fermentasinya dengan Saccharomyces cerevisiae J-2 menjadi etanol sehingga diperoleh produk yang mempunyai nilai ekonomi yang cukup tinggi.
BAHAN DAN METODE
Preparasi Sampel Limbah Padat Brem
Sampel limbah padat brem sebanyak 300 gram diambil dari 10 titik, dikompositkan, dilarutkan dengan aquades sebanyak 600 mL, diaduk hingga bubur limbah brem homogen, disaring dengan kain kafan, dipasteurisasi dengan pemanasan pada suhu 80ºC selama 15 menit, didinginkan pada suhu kamar, dan disimpan sampai diperlukan.
Pengukuran pH Awal
Sampel yang disiapkan di atas diencerkan dengan aquades (1:2) dan pH nya diukur (dengan menggunakan pH meter tipe Toa Ion Meter Im-40s yang telah dikalibrasi dengan larutan buffer pH 4 dan pH 7) sebelum difermentasi dengan menggunakan starter aktif Saccharomyces cerevisiae J-2.
Penentuan Kadar Gula dengan Metode Luff Schoorl
Sampel yang telah disiapkan pada preparasi sebelumnya, disaring dengan kertas saring, filtratnya diambil 10 mL dan ditambahkan dengan 5 mL HCl 4 N, dipanaskan dalam waterbath pada suhu 70ºC selama ± 15 menit, ditambahkan indikator titrasi (phenolphthalein) 3 tetes, dinetralkan dengan NaOH sampai muncul warna merah, ditambahkan asam asetat hingga warna merah tersebut menghilang, diencerkan dengan aquades sampai 100 mL, dan kemudian diambil filtratnya sebanyak 10 mL. Setelah itu, filtrat tersebut ditambahkan aquades sebanyak 10 mL, ditambahkan pereaksi luff schoorl sebanyak 25 mL, lalu direfluks selama 15 menit dari saat mendidih. Hasilnya didinginkan, ditambahkan H2SO4 26,5%, KI 20% sebanyak 5 mL dan amilum 1 tetes, dititrasi dengan asam tiosulfat (0,1 N) yang telah distandarkan hingga berwarna putih susu, dan dihitung persentase gulanya.
Penyiapan Starter Aktif
Starter disiapkan dengan cara menginokulasi sebanyak 0,4 mL biakan S. cerevisiae J - 2 ke dalam medium sukrosa yeast pepton steril dan dikocok dengan menggunakan shaker selama 48 jam dengan kecepatan 140 rpm sampai terlihat adanya pertumbuhan yeast pada medium tersebut yang ditandai oleh meningkatnya kekeruhan medium. Sebelum dipakai untuk inokulum aktif (starter), kemurnian kultur dikonfirmasi dengan cara mengamati suspensi biakan di bawah mikroskop.
Inokulasi dan Fermentasi
Sampel yang telah dipreparasi diatas diinokulasi dengan menggunakan biakan atau starter aktif S. Cerevisiae (yang telah disiapkan) dan diinkubasi selama 21 hari pada suhu kamar yang berkisar antara 20 - 30ºC. Adanya aktivitas yeast ini ditandai oleh terbentuknya gas pada cairan fermentasi. Setelah 21 hari terlampaui, cairan fermentasi disentrifugasi selama 15 menit dengan kecepatan 3000 rpm untuk memurnikan hasil fermentasi, dan selanjutnya dilakukan pengukuran beberapa parameter seperti: derajat keasaman, kerapatan populasi sel yeast, kadar gula, dan kadar etanol.
Penentuan Populasi sel Yeast
Total populasi yeast dalam cairan fermentasi dihitung dengan menggunakan metode dilution and pour plate count. Sebanyak 100 µL cairan fermentasi dimasukkan ke dalam tabung Effendorf yang telah berisi 900 µL NaCl 0,9% untuk mendapat tingkat pengenceran 10-1. Selanjutnya sampel ini dihomogenkan untuk diencerkan lebih lanjut sampai tingkat pengenceran 10-8. Kemudian, masing-masing sebanyak 100 µL cairan yang terdapat pada tabung pada tingkat pengenceran 10-4, 10-6, dan 10-8, dipipet, disebar pada permukaan media MEA, diinkubasi selama 48 jam pada suhu 38ºC, dan dihitung jumlah koloni yeast yang tumbuh. Proses penyebaran dilakukan 2 kali ulangan untuk tiap tingkat pengenceran, dan hasilnya dirata-ratakan.
Penentuan Kadar Etanol
Kadar etanol produk fermentasi ditentukan dengan menggunakan alat hydrometer. Sampel yang ditentukan kadar etanolnya mula-mula didestilasi dengan alat destilator. Sebanyak 100 mL cairan hasil fermentasi dimasukkan ke dalam labu didih dan didestilasi sampai diperoleh hasil destilat sebanyak 50% volume awal. Destilat ini ditampung dalam labu erlenmeyer yang direndam dalam air es (pada temperatur 20ºC) untuk menghindari terjadinya penguapan etanol dari erlenmeyer. Sebelum dilakukan pengukuran etanol, pada destilat ditambahkan aquades sampai volumenya sama dengan volume mula-mula. Hydrometer kemudian dimasukkan ke dalam destilat ini dan kadar etanol dibaca pada skala yang tertera pada alat hydrometer.
HASIL
Hasil pengukuran pH awal limbah menunjukkan nilai yang berada dalam kisaran pH optimum (4,25±0,01) yang diperlukan oleh yeast untuk aktivitas fermentasinya (Gambar 1). Selain pH ekstrak, dinamika beberapa parameter, seperti jumlah sel khamir, kadar etanol, dan kadar gula pereduksi substrat juga diukur selama proses fermentasi. Hasil pengukuran parameter-parameter tersebut ditampilkan pada gambar 1.
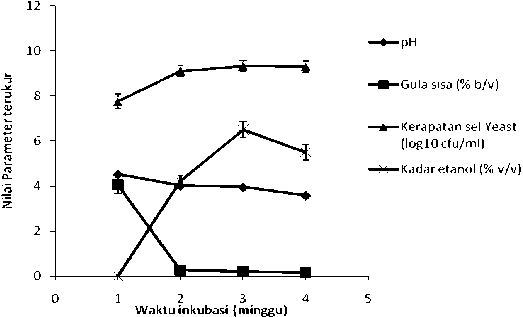
Gambar 1. Dinamika parameter terukur (pH, kadar gula pereduksi, total populasi sel yeast, dan kadar etanol) selama proses fermentasi. Setiap nilai pada gambar ± standart error merupakan rata-rata dari dua kali ulangan.
Produksi Etanol Dari Sisa Gula Limbah Pabrik Bremethanol Production From Waste Of Rice Wine Factory [I Putu Oka Suartama, dkk.].
Pada Gambar 1 terlihat bahwa terjadi pertumbuhan sel yeast yang cukup baik dari 6,3 x 107 cfu/mL pada hari ke 0 (waktu inokulasi) menjadi 1,38 x 109 cfu/ mL pada hari ke 21. Selama proses tumbuh ini, yeast memanfaatkan komponen gula yang ada di dalam medium fermentasi untuk membentuk etanol sehingga selama proses pertumbuhan ini kadar etanol di dalam medium fermentasi menjadi meningkat (Gambar 1). Etanol dikategorikan sebagai metabolit primer (Walker, 1999; dan Bai et al. 2008), karena etanol dihasilkan selama proses pertumbuhan dari sel yeast.
PEMBAHASAN
Gula pereduksi merupakan sumber karbon utama dalam produksi etanol pada proses fermentasi. Pada penelitian ini, kadar gula limbah yang dianalisis dengan menggunakan metode luff schoorl adalah 4,55% (b/v gula pereduksi), dan hasil ini jauh lebih rendah daripada yang dianjurkan oleh Prihandana et al. (2007) bila sampel tersebut akan difermentasi menjadi etanol. Menurut Prihandana et al. (2007) dan Itelima et al. (2013), konsentrasi gula pereduksi ideal yang ada pada sampel untuk fermentasi etanol adalah berkisar antara 10 -18% (b/v). Namun, Satria (2009) melaporkan bahwa kadar gula pereduksi sebesar 2,46% (b/v) masih bisa difermentasi oleh yeast untuk menjadi etanol. Jika berpedoman pada hasil yang dilaporkan oleh Satria (2009), maka kadar gula pereduksi yang terkandung pada sampel limbah brem yang dipakai pada penelitian ini memenuhi syarat dan berpotensi untuk dibuat menjadi etanol, walaupun perlu dilakukan pengaturan-pengaturan kondisi pada ekstrak, seperti pengaturan pH dan suhu sehingga menjadi optimum bagi yeast untuk melakukan aktivitasnya mengubah gula pereduksi yang ada menjadi etanol (Elevri dan Putra, 2006; Endah et al., 2007; Matsakas dan Christakopoulos, 2013). Menurut Walker (1999); Parmar dan Rupasinghe (2013); dan Itelima et al. (2013), pH optimum yang diperlukan oleh yeast untuk melakukan aktivitasnya selama fermentasi etanol adalah antara 4,0-5,0 sehingga pada sampel limbah pabrik brem ini tidak dilakukan pengaturan pH, karena pH nya berada pada kisaran pH optimum.
Pertumbuhan yeast yang terlibat dalam fermentasi etanol pada penelitian ini terlihat menunjukkan kecenderungan memasuki fase stasioner pada minggu ke 2 sejak diinokulasi (Gambar 1). Jika berdasarkan pada kecenderungan yang ditunjukkan oleh Gambar 1, penurunan laju pertumbuhan sel yeast yang terlibat dalam proses ini lebih banyak disebabkan oleh penurunan kadar gula pereduksi dan komponen medium lain yang berperan dalam pertumbuhan yeast. Dengan kata lain, peran metabolit, khususnya metabolit sekunder tampaknya tidak begitu nyata, karena sel yeast masih menunjukkan laju pertumbuhan yang cukup baik sampai minggu ketiga proses fermentasi (Gambar 1). Menurut Shuler dan Kargi (2002) dan Smedsgaard et al. (2005) metabolit sekunder akan dihasilkan pada saat laju pertumbuhan sel yeast mendekati nol.
Sementara itu, peran etanol sebagai faktor penghambat pertumbuhan tampaknya hampir tidak ada, karena
konsentrasinya masih sangat rendah sampai minggu ketiga (Gambar 1). Etanol umumnya akan memberi pengaruh nyata pada pertumbuhan yeast bila konsentrasinya mencapai di atas 7%, walaupun ada beberapa galur yeast yang resisten terhadap konsentrasi etanol sampai konsentrasi di atas 10%. Yeast yang dipakai dalam penelitian ini merupakan yeast yang diperoleh dari Hokkaido University dan diseleksi yang ketat sehingga mampu bertahan hidup sampai kadar etanol yang cukup tinggi (Sujaya et al., 2003). Berdasarkan informasi tersebut maka perlambatan pertumbuhan yeast pada penelitian ini sangat kecil kemungkinannya disebabkan oleh kadar etanol yang sudah terbentuk selama 3 minggu fermentasi.
Pada Gambar 1 terlihat jelas bahwa pemanfaatan komponen gula pereduksi dengan laju maksimum terjadi pada minggu pertama proses fermentasi, sehingga terjadi penurunan kadar gula sebesar 94,5%, dan setelah itu penurunannya tidak begitu signifikan. Hal ini ditandai dengan residu gula pereduksi yang relatif konstan pada kisaran 0,2% (b/v) (Gambar 1). Sejalan dengan pemanfaatan gula dengan laju maksimum pada minggu pertama proses, terjadi pula peningkatan konsentrasi etanol dengan laju maksimum pada minggu pertama ini. Hal ini menunjukkan bahwa sebagian gula diubah menjadi etanol oleh yeast.
Pada minggu kedua, terjadi penurunan laju pembentukan etanol pada medium dan bahkan pada minggu ketiga terjadi penurunan kadar etanol di dalam medium. Hal ini desebabkan oleh kadar gula pereduksi yang tersisa di dalam medium sudah tidak mencukupi lagi untuk menunjang pertumbuhan sel sehingga kemungkinan sel-sel yeast memanfaatkan etanol sebagai sumber energi untuk mengganti gula pereduksi yang persediaannya semakin menipis (Gambar 1). Hal serupa juga dilaporkan oleh Puspitasari (2009) yang melakukan proses fermentasi etanol dengan menggunakan nira sorgum sebagai subststratnya. Dalam keadaan miskin nutrien seperti yang terjadi pada proses fermentasi dengan menggunakan sistem batch atau sistem tertutup, maka sangat mungkin terjadi pemanfaatan metabolit primer sebagai sumber energi alternatif untuk mempertahankan keberadaan sel yang terlibat dalam proses tersebut (Walker, 1999; Shuler dan Kargi, 2002). Keadaan seperti ini akan menurunkan kadar metabolit primer tersebut di dalam medium fermentasi, seperti yang terjadi pada penelitian ini (Gambar 1).
Selama proses fermentasi tercatat terjadi penurunan nilai pH dari 4,25±0,01 pada hari ke nol menjadi 3,58±0,10 pada hari ke 21 (Gambar 1). Bila selama proses tidak terjadi kontaminasi oleh bakteri pembentuk asam, maka penurunan ini kemungkinan disebabkan oleh adanya reaksi antara CO2 yang dihasilkan sebagai produk sampingan dari proses pembentukan etanol dengan air. Hasil reaksi antara CO2 dan air akan membentuk H2CO3 yang berakibat pada penurunan nilai pH pada medium fermentasi (Paturau, 1982). Walaupun terjadi penurunan nilai pH, nilai yang dicapai pada akhir proses masih berkisar pada pH optimum yang dapat diadaptasi oleh yeast yang terlibat dalam proses fermentasi gula menjadi etanol. Berdasarkan kecenderungan ini, maka
penurunan laju pembentukan etanol pada penelitian ini lebih banyak disebabkan oleh konsentrasi gula pereduksi yang terdapat di dalam medium sudah mencapai limit minimum. Keasaman medium atau pH medium akan berpengaruh nyata pada laju fermentasi etanol apabila nilainya mencapai pH 3 atau lebih rendah (Volk dan Wheeler, 1993; Bai et al., 2008). Hal serupa juga pernah dilaporkan oleh Harvey (2008), yang melakukan proses fermentasi ampas rumput laut yang diinokulasi dengan yeast (Saccharomyces cerevisiae) sebagai starter aktifnya dan selama proses fermentasi terjadi penurunan nilai pH medium.
Seperti dijelaskan di atas, kadar gula pereduksi pada limbah pabrik brem adalah 45,5 gram per liter ekstrak. Kalau gula pereduksi tersebut diasumsikan seluruhnya berupa glukosa dengan berat molekul sebesar 180,16 gram/mol, maka dalam 1 liter ekstrak akan terkandung sebanyak 0,25 mol gula pereduksi. Dalam fermentasi etanol, satu mol glukosa yang difermentasi akan dihasilkan sebanyak 2 mol etanol (C2H5OH). Hal ini berarti bahwa untuk setiap 0,25 mol/liter glukosa yang dipakai pada penelitian ini, secara teoritis akan menghasilkan etanol sebanyak 0,51 mol per liter (23,51 gram per liter) etanol.
Hasil penelitian menunjukkan bahwa kadar rata-rata etanol maksimum adalah sebesar 2,9% (v/v). Hal ini berarti bahwa dalam setiap 1 liter campuran medium terdapat sebanyak 28,7 mL etanol. Bila massa jenis etanol adalah 0,789 gram/mL, maka massa etanol yang terbentuk selama proses fermentasi dalam penelitian ini adalah 22,64 gram/liter (0,49 mol/liter).
Berdasarkan pada perhitungan di atas, maka efisiensi proses pembentukan etanol dari gula pereduksi yang terdapat pada limbah pabrik brem adalah 96%. Nilai ini lebih rendah daripada nilai teoritisnya. Walaupun tidak dianalisis pada penelitian ini, kecenderungan nilai produk teoritis yang lebih tinggi daripada nilai praktisnya kemungkinan disebabkan oleh keterbatasan pengetahuan peneliti tentang jalur-jalur metabolisme yeast yang dipakai pada penelitian ini. Menurut Walker (1999) dan Jayaram et al. (2013) jalur metabolisme organisme sering menunjukkan jalur bercabang sehingga akan terbentuk beberapa jenis produk lain seperti senyawa golongan aldehid dan ester, selain produk utamanya. Pembentukan produk-produk lain, selain produk utamanya inilah yang kemungkinan menjadi penyebab utama nilai efisiensi fermentasi sebesar 96%. Hal ini terjadi karena pembentukan produk-produk lain tersebut juga memanfaatkan sumber nutrien yang sama atau gula pereduksi yang terdapat dalam ekstrak.
KESIMPULAN
Limbah pabrik brem mengandung 4,55% (b/v) gula pereduksi dan 96% diantaranya dibentuk menjadi etanol melalui proses fermentasi yang dikatalis oleh S. cerevisiae isolat J-2.
UCAPAN TERIMA KASIH
Penulis mengucapkan terimakasih kepada Ketua Laboratorium Biosain dan Bioteknologi yang telah
memberikan strain Saccharomyces cerevisiae J-2. Selain itu, penulis juga berterima kasih kepada Dr. rer. nat. I Made Agus Gelgel Wirasuta, M.Si., Apt., dan Ibu Ni Wayan Nursini, MP., atas fasilitas yang diberikan berturut-turut di Jurusan Farmasi dan Laboratorium Biosain dan Bioteknologi Universitas Udayana.
KEPUSTAKAAN
Bai, F. W., W. A. Anderson, and M. Moo-Young. 2008. Biotechnology Advances. Vol. 26 (1): 89-105.
Elevri, P. A., dan S. R. Putra. 2006. Produksi Etanol Menggunakan Saccharomyces cerevisiae yang Diamobilisasi dengan Agar Batang. Jurnal Akta Kimindo, Vol. 1 (2): 105–114.
Endah, R. D., D. Sperisa, N. Adrian, dan Paryanto. 2007. Pengaruh Kondisi Fermentasi terhadap Yield Etanol pada Pembuatan Bioetanol dari Pati Garut. Jurnal Gema Teknik, Vol. 2: 83 – 88.
Gumienna, M. , K. Szambelan, M. Lasik, H. Jelen, and Z. Czarnecki. 2013. Use of Saccharomyces cerevisiae and Zymomonas mobilis for Bioethanol Production from Sugar Beet Pulp and Raw Juice. African Journal of Biotechnology Vol. 12 (18): 2464-2470.
Hidayat, A. S. 2005. Konsumsi BBM dan Peluang Pengembangan Energi Alternatif. Jurnal Inovasi, Vol. 5 (17): 11–17.
Itelima, J., F. Onwuliri, E. Onwuliri, I. Onyimba, and S. Oforji. 2013. Bio-ethanol Production from Banana, Plantain and Pineapple Peels by Simultaneous Saccharification and Fermentation Process. International Journal of Environmental Science and Development. Vol. 4 (2): 213-216.
Jayaram, V. B., S. Cuyvers, B. Lagrain, K. J. Verstrepen, J. A. Del-cour, and C. M. Courtin. 2013. Food Chemistry. Vol. 136 ( 2): 301-308.
Paturau. 1982. By Product of the Come Sugar Industry. Amsterdam. Elsevier Scientific Publishing Company.
Matsakas, L. and P. Christakopoulos. 2013. Optimization of Ethanol Production from High Dry Matter Liquefied Dry Sweet Sorghum Stalks. Biomass and Bioenergy. Vol. 51: 91-98.
Parmar, I. and H. P. V. Rupasinghe. 2013. Bio-conversion of Apple Pomace into Ethanol and Acetic Acid: Enzymatic Hydrolysis and Fermentation. Bioresource Technology. Vol. 130: 613-620.
Prihandana, R., K. Noerwijati, P. G. Adinurani, D. Setyaningsih, S. Setiadi, dan R. Hendroko. 2007. Bioetanol Ubi Kayu Bahan Bakar Masa Depan. Tanggerang. PT. Agro Media Pustaka.
Puspitasari, R. P. 2009. Pembuatan Etanol dari Nira Sorgum dengan Proses Fermentasi. Skripsi. Semarang. Jurusan Teknik Kimia, Fakultas Teknik, Universitas Diponogoro.
Satria, H. 2009. Suksesi Mikroba dan Aspek Biokimia Fermentasi Mandai dengan Kadar Garam Rendah. Makara Sains. Vol. 13: 13–16.
Shuler, M. L. and F. Kargi. 2002. Bioprocess Engineering Basic Concepts. Edisi 2. New Jersey. Prentice Hall.
Smedsgaard, J., J. Nielsen, M. Burrell, and N. Smirnoff. 2005. Journal of Experimental Botany. Vol. 56( 410): 273-286.
Sujaya, I. N., N. S. Antara, T. Sone, Y. Tamura, W. R. Aryanta, A. Yokota, K. Asano, dan F. Tomita. 2003. Identification and Characterization of Yeast in Brem a Tradisional Balinese Rice Wine. World Journal of Microbiology & Biotechnology, Vol. 4 : 143–144.
Volk, W. A. and M. F. Wheeler. 1993. Mikrobiologi Dasar I. Edisi 5. Terjemahan, R. Sudiro. Erlangga. Jakarta.
Walker, G. 1999. Yeast Physiology and Biotechnology. John Wiley & Sons Ltd. London.
40
Discussion and feedback