POTENSI ENZIM KITINASE YANG DIHASILKAN BAKTERI KITINOLITIK YANG DIISOLASI DARI KULIT UDANG SEBAGAI KANDIDAT BIOKONTROL DALAM MENGENDALIKAN HAMA TANAMAN
on
SIMBIOSIS VIII (1 ):1-8 http://ojs.unud.ac.id/index.php/simbiosis
Program Studi Biologi FMIPA UNUD
eISSN: 2656-7784
Maret 2020
POTENSI ENZIM KITINASE YANG DIHASILKAN
BAKTERI KITINOLITIK YANG DIISOLASI DARI KULIT UDANG SEBAGAI KANDIDAT BIOKONTROL DALAM MENGENDALIKAN HAMA TANAMAN
THE POTENTIAL OF CHITINASE ENZYMES PRODUCED BY CHITINOLYTIC BACTERIA ISOLATED FROM SHRIMP SHELLS AS BIOCONTROL CANDIDATES IN CONTROLLING PLANT PESTS
Faldy Efriant Pangemanan1, Ida Bagus Gede Darmayasa2, Joko Wiryatno2
-
1 Program Studi Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam
-
2 Program Studi Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana Bukit Jimbaran
Email : faldyepangemanan@gmail.com
ABSTRAK
Organisme pengganggu tanaman (OPT) merupakan salah satu permasalahan di sektor pertanian yang menyebabkan penurunan produktivitas panen. Tingkat serangan OPT diperkirakan akan meningkat terutama pada musim hujan, sehingga perlu dilakukan pengendalian terhadap hama serangga. Pengendalian secara biologis dengan agen bakteri kitinolitik merupakan salah satu cara untuk menghindari penggunaan pestisida kimia. Penelitian bertujuan menemukan jenis bakteri kitinolitik dan memanfaatkan enzim kitinase sebagai biokontrol hama tanaman. Uji dilakukan dengan metode semprot (spray) sebanyak 5 mL dengan konsentrasi 10%, 20%, 30%, 40 dan 50% dengan 7 perlakuan termasuk kontrol negatif dan positif serta 3 kali pengulangan. Pengamatan kematian larva dilakukan selama 24 jam setelah penyemprotan, dimana setiap 6 jam dilakukan pengamatan pada larva uji coba. Pseudomonas merupakan genus bakteri yang berhasil diidentifikasi sebagai bakteri kitinolitik. Kematian larva dengan hasil persentase kematian yang tidak signifikan ditunjukkan pada konsentrasi 10% sampai dengan 30%. Hasil persentase kematian yang signifikan pada tingkat konsentrasi 40% sampai dengan 50%. Tingkat konsentrasi 40% dan 50% merupakan konsentrasi efektif dalam membunuh larva lalat buah (Drosophila sp.).
Kata kunci:kitinase, kitinolitik, Drosophila sp.
ABSTRACT
Plant pests is one of the problem in agriculture sector that can cause decreasing of harvest productivity. Plant pest invasion will be increased in rainy season, so it need to be controlled. Biological control by chitinolytic bacteria is one of many ways to avoid the using of chemical pesticide. The purpose of this research to find the type of chitinolytic bacteria and utilizing the enzyme chitinase as plant pest biocontrol. Test has been done with spray method of 5 mL with 10%, 20%. 30%, 40% and 50% concentration with 7 treatments include positive and negative controls and 3 repetition. Observation of larva death done for 24 hours after spray, where every 6 hours observations are made. Pseudomonas is a genus that has been identified as chitinolytic bacteria. Larva death is indicated by with percentage result insignificant death which is shown at the 10 – 30% concentration. The percentage result significant death which is shown at the 40 – 50% concentration. 40% and 50% is most effective concentration in killing fruit fly (Drosophila sp.).
Keywords:chitinase, chitinolytic, Drosophila sp.
PENDAHULUAN
Sektor Pertanian Indonesia merupakan sector terbesar yang dimiliki negara Indonesia karena Indonesia merupakan negara agraris. Hama merupakan organisme yang tidak diharapkan dalam aktivitas pertanian karena dapat mengakibatkan kerusakan dan kegagalan panen yang mengakibatkan penurunan hasil produksi serta mengganggu proses penyimpanan. Perubahan ekosistem merupakan salah satu penyebab mewabahnya hama, yang disebabkan oleh faktor alami atau faktor manusia sehingga menyebabkan semakin buruk dan tidak seimbangnya antara populasi Organisme Penganggu Tanaman (OPT) dengan musuh alaminya, sehingga potensi mewabahnya OPT cenderung tinggi (Jayanti et al., 2013).
Menurut Endah dan Novizan (2002) di sektor pertanian diperkirakan sepertiganya dirusak oleh hama dan penyakit yang menyerang tanaman. Kondisi lingkungan sangat mendukung untuk perkembangbiakan OPT berkembangbiak terutama pada musim hujan dimana.
Perlindungan terhadap pertanian sangat diperlukan untuk mencegah serangan OPT. Salah satu cara yang tepat untuk mengurangi tingkat kerusakan yang diakibatkan oleh OPT adalah melalui pendekatan secara mikrobiologis yaitu dengan memanfaatkan enzim kitinase yang dihasilkan bakteri kitinolitik yang dieksplorasi dari limbah kulit udang. Pemanfaatan kitin yang terdapat pada kulit udang untuk mendapatkan jenis bakteri kitinolitik sebagai agen hayati.
Kitin merupakan polisakarida yang mudah ditemukan. Beberapa diantaranya terdapat
pada hewan seperti crustaceae, moluska, insekta dan arthropoda karena sebagian besar tubuhnya tersusun atas kitin (Hanjaya et al., 2013). Kitin sudah banyak dimanfaatkan dalam beberapa bidang diantaranya biokimia, farmasi, dan biopestisida (Herdyastuti et al., 2009)
Bakteri yang mampu memanfaatkan kitin untuk diubah menjadi sumber karbon dan nitrogen disebut bakteri kitinolitik (Tsujibo et al., 1999). Enzim kitinase yang dihasilkan bakteri kitinolitik berpotensi untuk dimanfaatkan kembali, salah satunya dapat dijadikan sebagai biokontrol terhadap hama serangga tanaman.
Poernomo dan Purwanto (2003) berpendapat bahwa bakteri memiliki banyak kelebihan, diantaranya sel bakteri lebih mudah diperbanyak, memiliki pertumbuhan yang cepat, produksi sel yang dapat ditingkatkan, biaya relatif rendah, dan proses produksi yang pendek.
BAHAN DAN METODE
Pembuatan Media Agar Kitin
Bahan media dengan formulasi kitin dengan komposisi K2HPO4, KH2PO4, MgSO4.7H2O, FeSO4.7H2O, ZnSO4, MnCl2, Koloidal kitin, dan Agar disterilisasi mengguynakan autoclave pada suhu 1210C selama 20 menit, setelah dingin kemudian dicampurkan dalam keadaan steril dan kemudian dituang dalam cawan Petri
Teknik Pengambilan Sampel
Sampel limbah kulit udang diambil secara aseptik dari pabrik pengolahan udang di daerah Kedonganan Kabupaten Badung Bali. Sampel diambil sebanyak
kurang lebih 1 Kg, lalu dimasukkan ke dalam kantok plastik steril dan diletakkan dalam cool box, selanjutnya dibawa ke laboratorium untuk dilakukan tahap isolasi kandidat bakteri kitinolitik.
Isolasi Bakteri Kitinolitik pada Sampel Limbah Kulit Udang
Isolasi Bakteri kitinolitik dapat dilakukan dengan menggunakan metode pengenceran yang mengacu pada Kango (2009). Sampel diambil sebanyak 10 g ke dalam wadah steril, lalu ditambahkan 90 mL air steril, selanjutnya dihomogenkan dan didapatkan suspensi dengan pengenceran 10-1. Proses pengenceran dilakukan menggunakan 3 tabung reaksi, masing-masing telah terisi 9 mL air steril yang disiapkan untuk pengenceran. Suspensi pengenceran 10-1 dipipet sebanyak 1 mL ke dalam tabung pertama, kemudian dihomogenkan sehingga diperoleh pengenceran 10-2. Suspensi dari setiap pengenceran dipipet 1 mL ke dalam cawan Petri. Setiap cawan Petri dituangkan 15-20 mL media kitin, kemudian cawan Petri dihomogenkan hingga suspensi tersebar merata. Setelah media memadat, cawan diinkubasi pada suhu 360C selama 72 jam dengan posisi dibalik. Pertumbuhan bakteri kitinolitik ditunjukkan dengan adanya aktivitas kitinolitik yang ditandai dengan adanya zona bening pada sekitar koloni.
Pemurnian Bakteri Kitinolitik
Hasil isolasi yang menunjukkan zona bening, kemudian dimurnikan dan ditumbuhkan dalam media miring sebagai stok kultur. Selanjutnya isolat murni dilakukan karakterisasi secara makroskopis dan mikroskopis untuk diidentifikasi sampai tingkat genus yang mengacu pada buku Bergey’s.
Persiapan Produksi Kultur Filtrat
Sebanyak 1 ose inokulum bakteri yang menunjukkan adanya zone bening (clear zone) paling besar dimasukkan ke dalam 100 mL medium Nutrient Broth (NB) yang sudah dimodifikasi, kemudian diinkubasi selama 24-72 jam pada suhu ruangan sambil digoyang pada kecepatan 150 rpm. Kultur filtrat yang diperoleh siap diujikan pada larva serangga Drosophilla sp. sebagai serangga coba.
Prosedur Pengujian Aktivitas Kitinase pada Filtrat Secara In Vitro
Aktivitas kitinase pada filtrat yang dihasilkan oleh bakteri kitinolitik secara in vitro diujikan dengan menggunakan metode sumur difusi yaitu dengan cara membuat lubang berdiameter 0,5 mm pada media Agar yang mengandung kitin kemudian didepositkan sebanyak 40 µL filtrat lalu diinkubasi pada suhu kamar selama 24 jam. Hasil positif adanya aktivitas kitinase dapat dilihat dengan mengamati daerah bening (clear zone) di sekitar sumur difusi.
Prosedur Pemberian Kultur Filtrat pada Serangga
Kultur filtrat diberikan pada serangga dengan yaitu tujuh perlakuan termasuk kontrol dan tiga kali ulangan.. Adapun perlakuannya seperti ditampilkan pada Tabel 1.
Hasil produksi kultur filtrat yang diperoleh kemudian diaplikasikan pada larva serangga lalat buah (Drosophila sp.) dengan cara disiapkan cawan Petri steril yang diisi 15 ekor larva lalat buah disetiap perlakuan (10%, 20%, 30%, 40% dan 50%) dan buah yang dibuat dalam bentuk bubur. Selanjutnya dilakukan metode penyemprotan sebanyak 5 mL yang
diarahkan pada serangga coba, lalu dilakukan pengamatan jumlah ulat yang mati selama 24 jam setelah perlakuan. Efektivitas pengujian kultur filtrat terhadap serangga uji dilakukan dengan menghitung persentase ulat yang mati pada setiap pengamatan.
HASIL PEMBAHASAN
Hasil isolasi bakteri kitinolitik yang diperoleh dari limbah kulit udang diperoleh satu isolat yang menunjukkan aktivitas kitinolitik. Ditunjukkan dengan zona bening disekitar koloni yang ditumbuhkan pada media kitin (Gambar 1.b). Isolat tersebut memiliki ciri-ciri koloni berwarna putih susu, bulat halus dengan tepi rata, berbau seperti anggur dan berlendir (Gambar 1.a).
Tabel 1. Perlakuan Pemberian Kultur Filtrat Bakteri Kitinolitik pada Serangga Coba
Perlak uan
1
2
3
4
5
6
7
Keterangan
Kontrol (-)
Kontrol (+) (Kitinase 100%))
Pemberian kultur filtrat pada serangga konsentrasi 10%
Pemberian kultur filtrat pada serangga konsentrasi 20%
Pemberian kultur filtrat pada serangga konsentrasi 30%
Pemberian kultur filtrat pada serangga konsentrasi 40%
Pemberian kultur filtrat pada serangga konsentrasi 50%
Tahap pengamatan secara
mikroskopis dengan pembesaran 100x, sel
bakteri tersebut memiliki ciri berbentuk batang. Berdasarkan pewarnaan Gram, dinding selnya menampilkan warna merah yang mengindikasikan bakteri ini merupakan bakteri Gram negatif (Gambar 2).
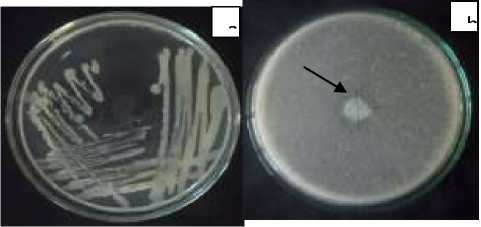
Gambar 1. (a). Hasil isolasi bakteri selama 24 jam pada limbah kulit udang pada media Nutrient Agar. (b). Zona bening di sekitar koloni bakteri
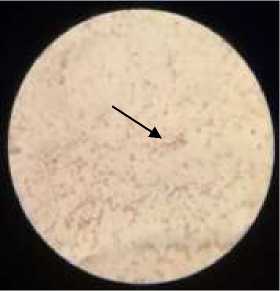
Gambar 2. Hasil uji pewarnaan Gram (Sumber: Dokumentasi Pribadi, 2019).
Hasil uji katalase bakteri yang diisolasi, hasil positif aerob ditunjukkan dengan adanya gelembung udara di permukaan objek glass yang diberikan H2O2 selengkapnya di tampilkan pada Gambar 3.

Gambar 3. Hasil uji katalase
Hasil uji motilitas dengan menggunakan media Sulfide Indole Motility (SIM) tampak adanya pergerakan yang ditandai dengan adanya seperti serat-serat kepermukaan media lihat pada Gambar 4.

Gambar 4. Hasil uji motilitas
Hasil Uji Aktivitas Kitinase pada Filtrat yang Dihasilkan oleh Pseudomonas sp. secara In Vitro
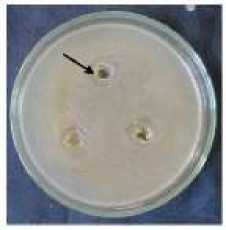
Gambar 5. Zona bening pada media yang mengandung kitin
Hasil uji filtrat secara in vitro menunjukkan adanya aktivitas kitinolitik yang terlihat di sekitar lubang difusi pada media kitin. Hal ini mengindikasikan, filtrat yang dihasilkan mengandung kitinase karena mampu mendegradasi kitin pada media. Ketiga ulangan uji filtrat pada media yang mengandung kitin seperti ditampilkan pada gambar 4.3, masing-masing
menunjukkan adanya zone bening di sekitar sumur.
Hasil Uji Konsentrasi Filtrat Kitinase dari Pseudomonas sp. Terhadap Larva Lalat Buah Drosophila sp.
Hasil pengamatan aktivitas filtrat kitinase dari bakteri Pseudomonas sp. terhadap larva lalat buah Drosophila sp. menunjukkan adanya kemampuan dari fitrat tersebut sebagai penyebab kematiannya. Hal ini dibuktikan pada perlakuan kontrol negatif selama pengamatan jam ke 24, persentase kamatian lalat buah tetap 0% tidak adanya tanda kematian. Namun sebaliknya pada perlakuan konsentrasi 50% filtrat dari bakteri Pseudomonas sp. pada pengamatan jam ke 12 sudah menyebabkan kematian sebesar 40% dari lalat buah tersebut. Kematian lalat buah terus mengalami peningkatan pada pengamatan jam ke 18 dan ke 24 masing-masing sebesar 53% Demikian juga pada pengamatan pada konsentrasi filtrat dengan konsentrasi 40%, kematian dari lalat buah mulai tampak pada pengamatan jam ke 12 yaitu sebesar 27% dan terjadi peningkatan kematian pada pengamatan jam ke 18 yaitu sebesar 33%. Pengamatan pemberian konsentarsi filtrat 10% dan 20% tidak memberikan pengaruh terhadap kematian lalat buah yang diujikan, hal ini tampak pada Tabel 2, dimana lalat buah yang diujikan tidak mengalami kematian. Kontrol positif lalat buah yang diberi perlakuan menunjukkan kematian pada pengamatan jam ke 12, kematian lalat buah terus mengalami peningkatan sampai 100 % pada jam ke 18 dan 24.
Tabel 2. Kematian Larva Lalat Buah
Drosophila sp. yang telah Diberi Perlakuan.
|
Perlakuan |
Kematian Lalat Buah | |||
|
6 jam |
12 jam |
18 jam |
24 jam | |
|
Kontrol (-) |
0±0,0a |
0±0,0a |
0±0,0a |
0±0,0a |
|
Kontrol(+) |
0,00a |
60,02b |
100a |
100b |
|
10 % |
0,00a |
0,00a |
0,00a |
0,00a |
|
20 % |
0,00a |
0,00a |
0,00a |
0,00a |
|
30 % |
0,00a |
0,00a |
0,00a |
0,00a |
|
40 % |
0,00a |
27,02c |
33,02c |
33,02c |
|
50 % |
0,00a |
40,02d |
53,02d |
53,02d |
Keterangan: Huruf yang sama dibelakang nilai rata- rata pada kolom yang sama menunjukkan tidak terdapat perbedaan yang nyata (P>0,05) berdasarkan uji Duncan.
Isolasi kandidat bakteri kitinolitik pada limbah kulit udang di daerah Kedonganan, Kabupaten Badung diperoleh 1 isolat. Hal ini didasari adanya zona bening di sekitar koloni bakteri yang tumbuh pada media Agar yang mengandung kitin. Clear zone yang terbentuk menandakan bakteri yang diisolasi memiliki kemampuan dalam menghasilkan kitinase untuk menguraikan kitin. Sumber karbon yang ada pada kitin setelah degradasi oleh bakteri kitinolotik dapat digunakan sebagai asupan karbon untuk pertumbuhan bakteri tersebut. Sesuai dengan pendapat Kasprzewka (2003) bahwa kitinase sendiri merupakan enzim yang memiliki kemampuan untuk mengkatalis pemecahan kitin menjadi komponen monomer dan banyak ditemukan di berbagai organisme seperti bakteri, serangga, jamur, hewan dan tumbuhan. Hasil uji pewarnaan Gram diperoleh bahwa isolat termasuk kedalam kelompok Gram negatif. Hasil ini sejalan dengan penelitian yang dilakukan oleh
Vaidya et al., (2003) yang mengatakan bahwa beberapa kelompok bakteri kitinolitik diantaranya adalah genus Pseudomonas yang merupakan bakteri kelompok Gram negatif dengan ditunjukkan dengan warna merah karena menyerap safranin. Hasil katalase positif mengindikasikan bahwa hydrogen
peroksida mampu diubah menjadi molekul oksigen (O2) dan air (H2O) oleh enzim katalase, ini ditunjukkan dengan adanya gelembung yang terbentuk (Hadioetomo, 1990). Uji motilitas berperan dalam mengetahui pergerakan bakteri, dan dinyatakan positif motil yang menunjukkan adanya serat-serat pada media uji yang berarti bakteri bergerak menuju permukaan karena membutuhkan oksigen (Aksoy dan Ozman-Sullivan 2008).
Hasil pengamatan menunjukkan, 6 jam pertama pada pengujian secara in vivo filtrat Pseudomonas sp. terhadap larva lalat buah pada semua perlakuan belum menunjukkan tanda kematian. Kematian larva coba dimulai setelah pengamatan jam ke 12 pada perlakuan kontrol positif, perlakuan konsentrasi 40% dan 50%. Pada kontrol positif kematian larva sebesar 60% sangat berbeda nyata (P<0,05) dengan semua perlakuan yang lainnya. Demikian juga dengan perlakuan pada konsentrasi 40% dan 50% juga berbeda sangat nyata (P<0,05). Namun pada perlakuan kontrol negatif, perlakuan 10% , 20% dan 30% tidak terdapat perbedaan yang nyata (P>0,05) pada data pengamatan 12 jam. Seiring dengan bertambahnya jam pengamatan jumlah larva yang mati terus mengalami peningkatan terutama pada perlakuan kontrol positif sampai mencapai 100% pada jam ke 24. Perlakuan 40% dan 50% masing-masing menyebabkan persentase kematian sebesar 33% dan 53%. Secara statistik kedua perlakuan tersebut 6
juga berbeda sangat nyata (P<0,05). Pada konsentrasi 40% dan 50% menunjukkan adanya aktivitas kematian pada larva uji coba, ditunjukkan pada perlakuan 40% diinterval kedua yaitu 12 jam jumlah kematian sebesar 27% dari total larva uji coba dan meningkat pada interval selanjutnya. Hal yang sama ditunjukkan pada perlakuan 50% jumlah kematian cukup tinggi yaitu 40% pada interval pertama dan terus meningkat pada interval selanjutnya sampai menyentuh angka 53%. Hal ini sejalan dengan pernyataan yang diberikan oleh Sri (2008) tinggi konsentrasi sangat berpengaruh terhadap tingkat kematian larva uji coba, ini juga berlaku terhadap pemberian konsentrasi kitinase yang diberikan.
Penelitian yang dilakukan oleh Thamthiankul (2001), komponen struktural dari larva nyamuk Aedes aegepty dapat dirusak oleh bakteri Bacillus, kerusakan morfologi terjadi terutama pada bagian thoraks, yang diduga karena Bacillus merupakan bakteri kitinolitik sehingga mampu mendegradasi kitin yang merupakan penyusun eksoskeleton larva nyamuk. Kitinase merusak kitin dengan menghidrolisis ikatan glikosidik polimer kitin yang menyebabkan kitin menjadi melunak dan rusak, sehingga organisme yang memiliki kandungan kitin akan mengalami lisis dan menyebabkan kematian (Herdyastuti et al., 2009). Hasil yang berbeda didapatkan pada penelitian ini, dimana perilaku larva sebelum diberi perlakuan umumnya sangat aktif mengkonsumsi pakan yang diberikan, karena fase instar merupakan fase yang penting untuk larva untuk memasuki fase prepupa (Strickberger, 1962). Larva yang telah diberi perlakuan menunjukkan adanya perubahan aktivitas, perubahan ini mulai terjadi saat pemberian konsentrasi 40% dan
50% dimana larva menunjukkan penurunan aktivitas mengkonsumsi pakan. Hal ini diduga karena kitinase merusak membran peritropik pada saluran pencernaan dan menyebabkan penurunan signifikan terhadap penyerapan nutrisi (Gilbert et al., 2005).
KESIMPULAN
Pseudomonas merupakan genus yang didapat dan berhasil diisolasi dari limbah kulit udang di Pasar ikan Kedonganan, Kabupaten Badung, Bali dan filtrat yang dihasilkan memiliki kemampuan untuk mendegradasi kitin, dibuktikan dengan adanya zona bening (clear zone) pada media yang mengandung kitin secara In Vitro serta tingkat konsentrasi yang diperlukan untuk membunuh larva serangga lalat buah (Drosophila sp.) adalah mulai dari konsentrasi 40% dan 50%.
SARAN
Bagi penelitian selanjutnya dianjurkan untuk melakukan pemurnian enzim secara modern untuk mendapatkan enzim kitinase yang murni.
UCAPAN TERIMA KASIH
Atas tersusunnya artikel ini, terima kasih kepada Civitas Akademika Program Studi Biologi Universitas Udayana
DAFTAR PUSTAKA
Aksoy, Ozman- Sullivan. 2008. Isolation of
Bacillus megaterium from Aphis pomi (Homotera: Aphididae) and assesment of its pathogenicity. Journal of Plant Pathology. 90:
449-452.
Gilbert, G.I., K. Iatrou, S.S. Gill. 2005.
Biochemistry of Digestion, In:
Comprehensive Molecular Insect Science Biochemical and Molecular Biology. 171-224. Elsevier Press, Oxford, UK.
Hadioetomo, R. S . 1990. Mikrobiologi
Dasar dalam Praktek. Jakarta: PT. Gramedia
Hanjaya, S., Darjito, P. Danar. 2013. Pengaruh Ph dan Waktu Kontak pada Adsorpsi Cd (II)
mengggunakan Adsorben Kitin Terfosforilasi dari Limbah
Cangkang Bekicot (Achatina
fulica). Kimia Student Journal.
2(2):503-509.
Herdyastuti, N., T. J. Raharjo, Mudasir, S. Matsjeh. 2009. Chitinase and
Chitinolytic Microorganism:
Isolation, Characterization and
Potential. Indonesian Journal Chemistry. 9(1):37-47.
Jayanti, H, W., Setiawati, A. Hasyim. 2013. Preferensi Kumbang Daun
Phyllotreta striolata Fab.
(Coleoptera : Chrysomelidae)
Terhadap Berbagai Tanaman Cruciferae dan Upaya
Pengendaliannya Dengan
Menggunakan Insektisida
Klorpirifos. Jurnal Hortikultura. 23(3):235-243.
Kasprzewska, Anna. 2003. Plant Chitinase – Regulation and Function. Cell Molec. Biol. Lett. (8) 809-824
Novizan. 2002. Petunjuk Pemupukan yang Efektif. Agromedia Pustaka : Jakarta
Poernomo A.T., D. A. Purwanto. 2003. Uji Aktifitas Crude Enzim Proteolitik Bacillus subtilis FNCC 0059 Hasil Fermentasi Curah. Majalah Farmasi Airlangga. 3: 103–107.
Sri, Pujianto. 2008. Menjelajahi Dunia Biologi 1, PT Tiga Serangkai Pustaka Mandiri : Jakarta.
Strickberger, M.W. 1962. Experiments in Genetics with drosophila. John Wiley and Sons Inc, NewYork.
Thamthiankul, S., S. Suan-Ngay., S. Tantimavanich. 2001. Chitinase from Bacillus thuringiensis subsp. Pakistani. Journal of Appl Microbiol Biotechnol. 56:395-401
Tsujibo, H., N. Kondo, K. Tanaka, K. N. B. Miyamoto., dan Y. Imamori. 1999. Molecular Analysis of The Gene Encoding a Novel
Transglycosylative Enzyme from Alteromonas sp. Strain 0-7 & Its Physiological Role in The Chitinolitic System. Jurnal Bacter. 81: 5461-5466.
Vaidya, R. J., S. L. A. Macmil., P. R. Vyas., H. S. Chhatpar. 2003. The novel Method for Isolating Chitinolitic Bacteria and its Application in Screening for Hyperchitinase Producing Mutant of Alcaligenes xylosoxydans. J. Appl. Microbiol. 36: 129–34.
8
Discussion and feedback