ISOLASI, IDENTIFIKASI DAN UJI POTENSI BAKTERI YANG BERPERAN PADA PENGOLAHAN AIR LIMBAH YANG MENGANDUNG RHODAMIN B DALAM BIOSISTEM TANAMAN
on
JURNAL SIMBIOSIS III (1): 301- 312
Jurusan Biologi FMIPA Universitas Udayana
ISSN: 2337-7224
Maret 2015
ISOLASI, IDENTIFIKASI DAN UJI POTENSI BAKTERI YANG BERPERAN PADA PENGOLAHAN AIR LIMBAH YANG MENGANDUNG RHODAMIN B DALAM BIOSISTEM TANAMAN
ISOLATION, IDENTIFICATION AND TEST POTENTIAL BACTERIA THAT PLAY A ROLE ON WASTE WATER TREATMENT CONTAINING RHODAMIN B IN PLANT BIOSYSTEM
Sang Ayu Sri Satya Laksmi Utari1, Ida Bagus Gede Darmayasa2, I Wayan Budiarsa Suyasa3 Jurusan Biologi Fakultas MIPA, Universitas Udayana1
Laboratorium Mikrobiologi, Jurusan Biologi Fakultas MIPA, Universitas Udayana2 Jurusan Kimia Fakultas MIPA, Universitas Udayana3
Email: sangayusri93@gmail.com
INTISARI
Rhodamin B adalah zat pewarna sintetis yang berbahaya digunakan sebagai pewarna kain di dalam industri tekstil. Biodegradasi adalah salah satu cara yang digunakan dalam pengolahan limbah cair Rhodamin B. Teknik biodegradasi adalah memanfaatkan kemampuan aktifitas mikroba mendegradasi atau mengeliminasi senyawa polutan. Tujuan dari penelitian ini adalah untuk mengetahui karakteristik bakteri yang mampu hidup pada air limbah yang mengandung Rhodamin B dan efektivitas isolat tunggal dan konsorsium mikroba dalam menurunkan Rhodamin B pada air limbah. Isolasi bakteri menggunakan platting method. Identifikasi bakteri pendegradasi Rhodamin B menggunakan kit API 20E. Uji potensi bakteri terhadap zat warna Rhodamin B dilakukan di Laboratorium Mikrobiologi, Jurusan Biologi FMIPA UNUD. Hasil penelitian menunjukkan ditemukan 5 isolat bakteri (Pseudomonas sp., Shigella spp., Stenotrophomonas sp., Pasteurella sp. dan Proteus sp). Efektivitas penurunan konsentrasi Rhodamin B dengan bakteri Pasteurella sp. adalah 40,55%. Kemampuan isolat Pasteurella sp. dan Proteus sp. menunjukkan perbedaan nyata (P<0,05) dibandingkan dengan kontrol.
Kata kunci: bakteri, biodegradasi, Rhodamin b
ABSTRACT
Rhodamin B is a dangerous synthetic dyes substances used as a fabric dye in the textile industry. Biodegradation is one way that is used in the processing of liquid waste Rhodamin B. Biodegradation technique is leveraging the ability of microbial activities degrade or eliminate pollutant compounds. The main objective of this research was to investigate the characteristic of bacteria that are capable of living on wastewater containing Rhodamin B and the effectiveness of single and microbial consortium isolates to degrade Rhodamin B on wastewater. The isolation of the bacteria was done by plating method and the identification of the bacteria by using a Kit API 20E. Test of bacterial potential of Rhodamin B dyes substance carried out in the Microbiology Laboratory, Biology Department, Faculty of Science, Udayana University. It was found in this research that five bacterial isolates were obtained (Pseudomonas sp., Shigella spp., Stenotrophomonas sp., Pasteurella sp. dan Proteus sp.). Pasteurella sp. had the highest percentage degrade effectiveness of 40.55%. Microbial potential degrade Rhodamin B by Pasteurella sp. dan Proteus sp. results showed significant differences (P <0.05) to control.
Keyword: bacteria, biodegradation, Rhodamin B
PENDAHULUAN
Industri tekstil mempunyai kontribusi yang besar dalam perekonomian Indonesia. Setelah masa krisis ekonomi pada tahun 1997, selama 10 tahun terakhir salah satu penyumbang devisa terbesar dari ekspor non migas adalah komoditas tekstil dan industri tekstil. Hal ini dapat dilihat pada tahun 2000 total devisa yang dihasilkan oleh industri tekstil di Indonesia adalah US$ 7,28 milyar atau 18,4 % dari total ekspor non migas. Selain itu industri tekstil juga industri yang menyediakan lapangan kerja yang tinggi bagi masyarakat Indonesia (Hermawan, 2011).
Limbah yang dihasilkan oleh industri tekstil mengandung bahan kimia yang bersifat racun dan berbahaya (Limbah Bahan Bahaya dan Beracun). Limbah B3 dapat menyebabkan pencemaran lingkungan serta memberikan dampak buruk bagi kesehatan orang yang terpapar langsung oleh limbah ini. Limbah ini dapat menyebabkan cacat fisik dan mental (Widowati dkk., 2008).
Instalasi Pengolah Air Limbah (IPAL) merupakan hal wajib bagi industri yang berwawasan lingkungan. Namun beberapa industri tekstil kecil hingga menengah tidak mempunyai IPAL. Industri tekstil yang tidak mempunyai IPAL cenderung membuang limbah industri ke dalam badan perairan. Bahan pewarna sintetis yang terkandung pada limbah tekstil sulit untuk diuraikan karena
mempunyai struktur kimia yang kompleks (Meitiniarti dan Krave, 2011).
Rhodamin B adalah zat pewarna sintetis yang sering digunakan sebagai pewarna kain dan pakaian di dalam industri tekstil. Berdasarkan Peraturan Menteri Kesehatan (Permenkes) No.239/Menkes/Per/V/85 Rhodamin B termasuk dalam 30 zat kimia yang berbahaya. Penggunaan Rhodamin B di beberapa negara telah dilarang karena Rhodamin B merupakan karsinogen yang kuat (Yuliarti, 2007).
Pengolahan limbah dengan bantuan mikrobia lebih banyak digunakan, proses ini sering disebut dengan proses biodegradasi. Bakteri merupakan agen biologi penting yang mempunyai kemampuan dalam biodegradasi limbah. Menurut Blumel et al. (1998) bakteri-bakteri yang mampu mendegradasikan zat warna secara umum dapat dijumpai pada tempat yang terpapar limbah zat warna. Berdasarkan uraian di atas maka dilakukan penelitian tentang isolasi, identifikasi dan uji potensi bakteri yang mampu mendegradasi Rhodamin B, merupakan zat warna yang banyak digunakan dalam berbagai industri pewarnaan, dengan metode biofiltrasi rhizodegradasi.
MATERI DAN METODE
Sampel tanah yang digunakan sebagai sampel penelitian diambil dari proses rhizodegradasi limbah Rhodamin B dalam
bak kaca dengan tanaman krangkungan (Ipomoea crassicaulis).
Pengambilan Sampel
Sampel tanah diambil sebanyak ± 10 gram pada setiap sudut bak kaca selama 48 jam dengan interval waktu 6 jam selama proses degradasi Rhodamin B berlangsung.
Isolasi Bakteri Pendegradasi Rhodamin B
Bakteri diisolasi dengan metode platting method (metode pengenceran). Sebanyak 10 gram tanah ditimbang dan dilakukan pengenceran (serial dilution method) hingga faktor pengenceran 10-8. Sampel ditanam secara pour plate pada media NA (Nutrient agar) pada pengenceran 10-5- 10-8. Koloni yang mempunyai ciri makroskopis yang berbeda selanjutnya dimurnikan dengan cara streak for single colony (Pelczar dan Chan, 2006).
Pengamatan Makroskopis dan Mikroskopis Koloni Bakteri
Ciri makroskopis bakteri yang diamati adalah warna, bentuk dan tekstur permukaan koloni bakteri (Dwijoseputro, 2003; Cowan and Talaro, 2006). Karakter mikroskopis koloni bakteri dengan pewarnaan Gram dan bentuk sel bakteri di bawah mikroskop.
Uji Biokimia Bakteri
Uji biokimia untuk identifikasi bakteri digunakan API 20E. Isolat murni bakteri ditumbuhkan pada media NA miring selanjutnya diinkubasi selama 24 jam pada suhu 37°C. Isolat yang telah dibiakkan selama 24 jam selanjutnya diambil 1 ose dan dibiakkan terlebih dahulu dalam 5 ml NaCl 0,85%. Suspensi bakteri selanjutnya dimasukkan ke dalam strip kertas API yang terdiri atas 20 mikrotabung yang telah berisi reagen kering. Setelah 24 jam diamati perubahan warna yang terjadi pada mikrotube. Data hasil uji biokimia selanjutnya dimasukkan ke dalam software API KIT 20E.
Uji Potensi Bakteri terhadap Rhodamin B
Media cair yang mengandung Rhodamin B dan nutrisi untuk pertumbuhan bakteri disiapkan sebanyak 30 ml dalam setiap botol dengan konsentrasi Rhodamin B 20 ppm yang diambil dari larutan baku 100 ppm. Kemudian 1ml suspensi bakteri yang telah diinkubasi selama 24 jam pada media Nutrient broth pada suhu 37ºC ditanam pada media cair selama 7 hari. Sementara untuk konsorsium bakteri enam isolat bakteri masing-masing dimasukkan dengan volume 1,67 µl. Selanjutnya hasil perombakan diambil untuk disentrifuge 2000 rpm selama 20 menit. Diukur konsentrasi Rhodamin-B pada media cair pada hari ke 7 dengan menggunakan
spektrofotometer UV vis dengan panjang gelombang maksimum 553,60 nm.
Adanya penurunan kadar limbah Rhodamin B ditentukan dengan persamaan sebagai berikut:
% Efektivitas = Q-—Q^ × 100% Qa
Keterangan : Qa = nilai Rhodamin B awal Qt = nilai Rhodamin B akhir
(pada waktu tertentu) HASIL
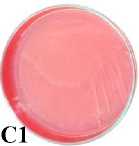
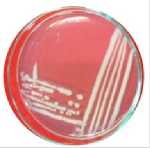
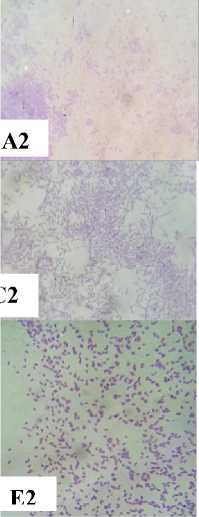
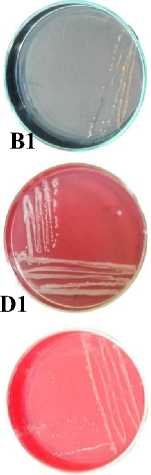
Berdasarkan hasil isolasi bakteri pada biosistem tanaman yang digunakan untuk menurunkan konsentrasi limbah Rhodamin B didapatkan 5 jenis bakteri dan 1 yeast. Kelima bakteri tersebut adalah Pseudomonas sp., Shigella spp., Stenotrophomonas sp., Pasteurella sp., Proteus sp. dan yeast (spesies x). Seluruh bakteri yang ditemukan adalah bakteri Gram negatif dan mempunyai bentuk sel batang sementara yeast mempunyai bentuk sel oval silindris, pola pertunasan multilateral dan tidak mempunyai pseudohifa (Gambar 1).
Hasil uji biokimia pada 5 isolat bakteri menunjukkan bakteri Pseudomonas sp. reaksi positif terhadap uji CIT. Uji biokimia bakteri Shigella spp. menunjukkan reaksi positif pada uji fermentasi glukosa dan rhamnase, hal ini menunjukkan bakteri ini mampu memfermentasi glukosa dan rhamnase. Uji
biokimia bakteri Stenotrophomonas sp. ini mempunyai enzim β-galaktosidase yang mampu mengkatalisis substrat ONPG, menghasilkan enzim citrase, mampu menghidrolisis urea dengan enzim urease dan menghidrolisis gelatin. Hasil positif uji biokimia bakteri Pateurella sp. ditunjukkan pada uji TDA, VP, dan gelatin sementara uji biokimia pada bakteri Proteus sp. menunjukkan reaksi positif pada tes ONPG, CIT, gelatinase, TDA, menghasilkan acetoin, mendekarboksilase ornitin, mampu memfermentasi glukosa dan menghasilkan enzim urease.
Hasil analisis data kemampuan isolat tunggal dan konsorsium bakteri dan yeast dalam menurunkan konsentrasi Rhodamin B dari konsentrasi awal 20 ppm menunjukkan isolat tunggal Pasteurella sp. dan isolat tunggal Proteus sp. menunjukkan perbedaan nyata dengan kontrol (P<0,05) (Tabel 1). Hasil persentase efektivitas menunjukkan seluruh perlakuan penurunan Rhodamin B <50 %. Persentase efektivitas terbesar diperoleh dari perlakuan isolat tunggal Pasteurella sp. (40,55%) sementara persentase efektivitas terendah diperoleh dari isolat tunggal Shigella spp. (17,30%) (Tabel 2).

A2
C1
E1
E2
F1
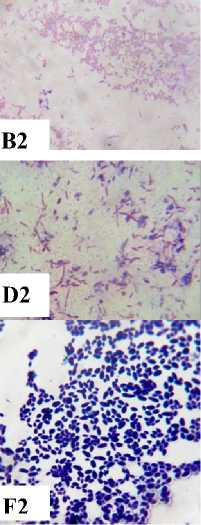
Gambar 1. Karakter makroskopis dan mikroskopis bakteri dan yeast yang ditemukan pada biosistem tanaman. (A1) Karakter makroskopis Pseudomonas sp. (A2) Struktur mikroskopis Pseudomonas sp. (perbesaran 1000x); (B1) Karakter makroskopis Shigella spp. (B2) Struktur mikroskopis Shigella spp. (perbesaran 1000x); (C1) Karakter makroskopis Stenotrophomonas sp. (C2) Struktur mikroskopis Stenotrophomonas sp. (perbesaran 1000x); (D1) Karakter makroskopis Pasteurellas sp. (D2) Struktur mikroskopis Pasteurella sp. (perbesaran 1000x); (E1) Karakter makroskopis Proteus sp. (E2) Struktur mikroskopis Proteus sp. (perbesaran 1000x); (F1) Karakter makroskopis Yeast (F2) Struktur mikroskopis Yeasts (perbesaran 400x)
Tabel 1. Rata-rata konsentrasi Rhodamin B
|
No. |
Perlakuan |
Rata-rata konsentrasi Rhodamin B setelah 7 hari diinkubasi (ppm) |
|
1 |
B0 |
19,93 ± 0,95b |
|
2 |
B1 |
15,16 ± 0,92ab |
|
3 |
B2 |
15,47 ± 2,90ab |
|
4 |
B3 |
16,54 ± 1,41ab |
|
5 |
B4 |
11,89 ± 5,38a |
|
6 |
B5 |
15,98 ± 2,38ab |
|
7 |
B6 |
13,73 ± 2,18a |
8 B7 15,69 ± 1,31ab
Keterangan: Nilai pada tabel 7 ± standar deviasi adalah rata-rata dari tiga kali ulangan, yang diikuti notasi huruf yang sama menunjukkan hasil yang tidak berbeda nyata berdasarkan uji Duncan (P<0,05), setelah dilakukan analisis ANOVA.
Tabel 2. Persentase efektivitas penurunan Rhodamin B
|
No. |
Perlakuan |
Persentase Efektivitas |
|
1 |
B0 |
0,35% |
|
2 |
B1 |
24,2 % |
|
3 |
B2 |
22,65% |
|
4 |
B3 |
17,3 % |
|
5 |
B4 |
40,55% |
|
6 |
B5 |
20,1 % |
|
7 |
B6 |
31,35% |
|
8 |
B7 |
21,55% |
Keterangan: B0 = kontrol negatif (tanpa suspensi bakteri); B1= Suspensi konsorsium bakteri dan yeast; B2= Suspensi isolat tunggal bakteri Pseudomonas sp.; B3=Suspensi isolat tunggal bakteri Shigella sp.; B4= Suspensi isolat tunggal bakteri Pasteurella sp.; B5= Suspensi isolat tunggal bakteri Stenotrophomonas sp. ; B6= Suspensi isolat tunggal bakteri Proteus sp. ; B7= Suspensi isolat tunggal yeast (spesies x).
PEMBAHASAN
Hasil identifikasi isolat bakteri dari bak perlakuan penurunan konsentrasi limbah Rhodamin B dengan sistem rhizodegradasi oleh tanaman krangkungan (Ipomoea crassicaulis) terdapat 5 isolat bakteri dan 1 yeast yang berhasil diisolasi. Proses bioremediasi beberapa tumbuhan berasosiasi dengan mikroorganisme dalam menurunkan konsentrasi bahan pencemar. Hal ini didukung dengan pernyataan Nwoko (2010) yaitu populasi mikroorganisme di daerah perakaran tanaman mengalami peningkatan karena tanaman mengeluarkan eksudat berupa gula, pati, protein dan asam-asam organik yang digunakan oleh mikroorganisme sebagai sumber karbon. Berdasarkan penelitian Mc Cutcheon and Schnoor
(2003), terjadi peningkatan biodegradasi polutan organik oleh mikroorganisme dalam proses rhizodegradasi.
Bakteri Shigella spp. mempunyai jumlah angka yang tinggi pada T0 namun bakteri Shigella spp. tidak ditemukan pada pengambilan sampel berikutnya. Hal ini dapat terjadi karena Shigella spp. berkompetisi dengan bakteri lain dalam perebutan nutrisi. Dwipayana dan Ariesyady (2010) menyatakan dengan adanya kompetisi dalam perebutan substrat dan nutrien pertumbuhan bakteri dapat terhambat.
Pseudomonas sp. termasuk kelompok bakteri aerob obligat yang mempunyai bentuk sel batang dengan
ukuran 0,5-1,0 µm (Carter and Wise, 2004).
Bakteri ini yang tersebar luas di alam dan bersifat predominan. Menurut Shah et al. (2013) dan Shah (2014) bakteri Pseudomonas sp. merupakan kunci penting dalam siklus karbon sehingga bakteri ini sering dimanfaatkan sebagai agen bioremediasi. P. putida, P. flurescens, P. aeruginosa merupakan jenis bakteri Pseudomonas yang sering digunakan sebagai agen bioremediasi limbah pewarna (zat warna azo, methyl orange, blue RR serta black B) dan logam berat.
Ditemukannya bakteri Pasteurella pada tanah yang terkontaminasi limbah cair Rhodamin B mengindikasikan bahwa Pasteurella mempunyai potensi dalam mendegradasi zat warna. Hal ini didukung oleh penelitian Leena and Selva (2008) yang menemukan bakteri Pasteurella sp. dari tanah yang terkontaminasi limbah pewarna di India.
Keberadaan Stenotrophomonas sp. pada limbah tekstil belum banyak ditemukan, namun berdasarkan penelitian Manjinder et al. (2005) Stenotrophomonas acidaminiphila pernah digunakan dalam konsorsium bakteri bersama Bacillus cereus, P. putida dan P. fluorescence bioreaktor untuk menurunkan konsentrasi limbah pewarna sintetis. Hal ini juga didukung oleh penelitian Rajeswari et al.
(2013) yang menggunakan isolat Stenotrophomonas malthophilia sebagai agen biodegradasi dan dekolorisasi limbah pewarna industri tekstil.
Wassif et al. (1995) dan Pfaller et al. (2009) menyebutkan bahwa genus Proteus termasuk dalam family enterobacteriaceae. Berdasarkan penelitian Saranraj et al. (2010) and Vivekanandan et al. (2013) bakteri Proteus mirabilis berhasil diisolasi dari tanah yang tercemar industri tekstil di daerah Perundurai dan digunakan sebagai biodegradasi pewarna yellow M, Blue MR, T blue G, Red MSB dan Orange M2K.
Selain bakteri salah satu mikroorganisme yang berhasil diisolasi dari tanah yang terpapar langsung limbah Rhodamin B adalah yeast atau khamir. Menurut Kanti (2006), yeast mempunyai kemampuan untuk hidup pada lingkungan ekstrem (gula, garam dan asam berlebih) dan lingkungan yang mengandung bahan organik tinggi. Beberapa jenis yeast yang pernah digunakan sebagai agen bioremediasi limbah pewarna tekstil (zat warna azo) adalah Candida zeylanoides dan Issatchenkia occidentalis (Martin et al., 1999; Patricia et al., 2014).
Hasil uji potensi isolat tunggal bakteri dan yeast serta konsorsium menunjukkan isolat tunggal Pasteurella sp. dan Proteus sp. pada penelitian ini menunjukkan perbedaan nyata
dibandingkan dengan kontrol. Isolat tunggal bakteri Pasteurella sp. mempunyai kemampuan yang tinggi dalam menurunkan konsentrasi Rhodamin B menjadi 11,89 ppm dari konsentrasi awal 20 ppm yang secara statistik menunjukkan perbedaan nyata dengan kontrol serta memiliki persentase efektivitas penurunan rhodamin B sebesar 40,55%.
Hasil ini mendekati persentase maksimum penurunan zat warna Reaktif Black B oleh Pasteurella sp. yaitu sebesar 41,73% dengan waktu inkubasi 7 hari (Leena and Selva, 2008). Adanya dekolorisasi diduga merupakan hasil dari aktivitas metabolisme mikroba. Hal ini didukung oleh Oranusi and Ogugbue (2005) bahwa dekolorisasi zat warna bukan disebabkan oleh faktor abiotik melainkan hasil dari aktivitas metabolisme mikroorganisme (bakteri, yeast atau jamur). Menurut Wilkolazka et al. (2002) dekolorisasi dapat diduga terjadi karena adanya aktivitas metabolisme dengan enzim sistematik dan adanya proses adsorbsi yang berfungsi untuk menghilangkan senyawa aromatik dan senyawa organik yang terlarut.
Isolat bakteri Proteus sp. memiliki tingkat persentase efektivitas sebesar 31,35% dan secara statistik berbeda nyata dengan kontrol. Chen et al. (1999) menyebutkan salah satu bakteri yang berpotensi merombak zat warna azo
ISSN: 2337-7224 Maret 2015 dengan menggunakan gula sebagai sumber karbon adalah Proteus mirabilis.
Penelitian Vivekanandan et al. (2013) menyebutkan bahwa Proteus mirabilis mampu menurunkan zat warna T Blue G >80%. Hal ini disebabkan bakteri Proteus vulgaris mempunyai enzim azoreduktase yang terletak pada intraseluler karena terdapat pada dinding membran dan di dalam sitoplasma sel.
Hasil uji potensi perlakuan konsorsium dan isolat tunggal bakteri Pseudomonas sp., Shigella spp., Stenotrophomonas sp. dan yeast menunjukkan tidak berbeda nyata dengan kontrol. Hasil konsorsium yang rendah dibandingkan isolat tunggal dapat terjadi akibat bakteri dan yeast mengalami kompetisi sumber karbon pada masa pertumbuhannya sehingga bakteri tidak mampu melakukan proses bioremediasi secara optimal. Konsorsium yang baik adalah saat seluruh isolat dalam tahap eksponensial (Dwipayana dan Ariesyady, 2009).
Persentase efektivitas penurunan Rhodamin B oleh isolat tunggal Pseudomonas sp. adalah 22,65%. Hardhianto (2010) menyatakan genus Pseudomonas sp. mampu menguraikan protein dan karbohidrat menjadi senyawa yang lebih sederhana serta menghasilkan enzim protease, lipase dan amilase. Penggunaan Pseudomonas sp. sebagai
pendegradasi zat warna ditunjukkan oleh penelitian Sriram et al. (2013) bahwa Pseudomonas aeruginosa merupakan isolat yang mempunyai persentase penurunan zat warna Congo red terbesar dibandingkan bakteri lain yaitu 93%.
Penggunaan yeast sebagai agen bioremediasi telah banyak dilakukan. Uji potensi pada yeast dilakukan untuk melihat kemampuan yeast dalam menurunkan konsentrasi Rhodamin B. Persentase efektivitas yang dimiliki oleh yeast pada penelitian ini adalah 21,55%. Penurunan zat warna Rhodamin B diduga adanya enzim yang dikeluarkan oleh yeast yang mampu memutus ikatan aromatik. Hal ini didukung oleh pernyataan Patricia et al. (2002) bahwa adanya aktivitas metabolisme dari yeast yang menyebabkan penurunan konsentrasi zat warna azo. Aktivitas ini sangat dipengaruhi oleh suhu, pH, dan sumber karbon.
Bakteri Stenotrophomonas sp. mempunyai tingkat persentase penurunan Rhodamin B sebesar 20,10%. Menurut Kamil et al. (2007) genus Stenotrophomonas dapat digunakan sebagai biokontrol. Jakobi et al. (1996), Dunne et al. (1997) dan Ernita dkk. (2010) menyatakan Stenotrophomonas sp. mampu menghasilkan siderofor berupa maltophilin dan enzim protease ekstraseluler.
Shigella spp. mempunyai persentase efektivitas penurunan
Rhodamin B terendah yaitu 17,30%. Kemampuan Shigella dalam menurunkan zat warna Rhodamin B yang rendah diduga diakibatkan oleh Shigella spp. tidak resisten terhadap konsentrasi Rhodamin B yang tinggi sehingga Shigella spp. tidak optimal dalam merombak Rhodamin B.
SIMPULAN
Berdasarkan uji karakteristik (makroskopis, mikroskopis dan uji biokimia) bakteri yang berperan dalam pengolahan air limbah yang mengandung Rhodamin B teridentifikasi sebagai Pseudomonas sp., Shigella sp., Stenotrophomonas sp., Pasteurella sp. dan Proteus sp. yang seluruhnya merupakan bakteri Gram negatif. Efektivitas penurunan konsentrasi Rhodamin B pada uji potensi bakteri dari yang tertinggi adalah Pasteurella sp. (40,55%), Proteus sp. konsorsium bakteri (24,2%), Pseudomonas sp. (22,65%),
Stenotrophomonas sp. (20,1%) dan
Shigella sp. (17,3). Kemampuan isolat Pasteurella sp. dan Proteus sp.
menunjukkan perbedaan nyata (P<0,05) dibandingkan dengan kontrol.
KEPUSTAKAAN
Blumel, S., M. Contzen, M. Lutz, A. Stolz, and H-J. Knackmuss. 1998. Isolation of Bacterial Strain with the Ability to Utilize the Sulfonated Azo Compound 4-carboxy-4’-sulfoazo-benzene as the
Sole Source of Carbon and Energy. Appl. Environ. Microbiol. 64 (6): 2315-2317
Carter, G. M. and D.J.Wise. 2004. Essentials of Veterinary Bacteriology and Mycology. 6th edition. Iowa: Iowa State Press.
Chen, K.., W. Huang, J. Wu and J. Houng. 1999. Microbial decolorization of azo dyes by Proteus mirabilis. J. of Microbiology and Biotechnology. 23: 686-690.
Cowan, M.K. and K.P. Talaro. 2006. Microbiology A Systems Approach. New York: McGraw-Hill
Companies.
Dwidjoseputro, D. 2003. Dasar-Dasar Mikrobiologi. Jakarta: Djambatan.
Dwipayana dan H.D. Ariesyady. 2010. Identifikasi Keberagaman Bakteri pada Lumpur Hasil Pengolahan Limbah Cat dengan Teknik Konvensional. Program Studi Teknik Lingkungan, Fakultas Teknik Sipil. Bandung
Dunne, C., J. J. Crowley., Y. Moenne-loccoz., D. N. Dowling., F. J. de Bruijn., and F. O’Gara. 1997. Biological control of Pythium ultimum by Stenotrophomonas maltophilia W81 is mediated by an extracellular proteolytic activity. Microbiology. 143: 3291-3931.
Ernita, M., N. Suharty., dan Nasrun. 2010. Karakterisasi dan Respon Fisiologis Bawang Merah yang Diinduksi Rizobakteri Indigenus. J. Embrio 3(2): 110-116.
Hardhianto, M. D. 2010. Efektifitas Bakteri Pseudomonas sebagai Pengurai Bahan Organik (Protein, Karbohidrat, Lemak) pada Air Limbah Pembenihan Ikan Lele Dumbo (Clarias sp.) Sistem Resirkulasi Tertutup. Fakultas Perikanan dan Kelautan Universitas Airlangga. Surabaya
Hermawan, I. 2011. Analisis Dampak Kebijakan Makroekonomi
Terhadap Perkembangan Industri
Tekstil dan Produk Tekstil di Indonesia. Buletin Ekonomi Moneter dan Perbankan. Jakarta.
Jakobi, M., G. Winkelmann., D. Kaiser., C. Kempter., G. Jung., G. Berg., and H. Bahl. 1996. A New Antifungal Compound Produced by Stenotrophomonas maltophilia R3089. J.Antibiotics. 49(11): 11011104.
Kamil, Z., M. Rizk., M. Saleh., dan S. Moustafa. 2007. Isolation and Identification of Rhizosphere Soil Chitinolytic Bacteria and their Potential in Antifungal Biocontrol. Global J Mole Sci, 2: 57-66.
Kanti, A. 2006. Marga Candida, Khamir Tanah Pelarut Posfat yang Diisolasi dari Tanah Kebun Biologi Wamena Papua. Biodiversitas. 7(2): 105-108.
Leena, R. and R.D. Selva. 2008. Bio-decolourization of Textile Effluent Containing Reactive Blac-B by Effluent- Adapted and NonAdapted Bacteria. J. of Biotechnology. 7(18).
Manjinder, S.K., H.S. Saini, B.S. Chadha and S.S. Chimni. 2005. Biotreatment of Synthetic Textile Wastewater Using Anoxic-Aerobic Sequential Bioreactor. Department of Microbiology, Guru Nanak Dev University, Punjab India.
Martin, M.A., M.H. Cardoso, M.J. Queiroz, M.T. Ramalho and A.M. Oliveira- Campos. 1999. Biodegradation of Azo Dyes by the Yeast Candida zeylanoides in Batch Aerated Cultures. Chemosphere. 38: 2455-2460.
Mc Cutcheon S.C. and J.L. Schnoor. 2003. Phytoremediation, Transformation and Control of Contaminants. Wiley-Interscience, A John Wiley & Sons. Inc. Pub. 987 pp.
Meitiniarti, I. dan A.S. Krave. 2011. Isolasi dan Identifikasi Bakteri Pendegradasi Pewarna Tekstil. Makalah Semnas Keanekaragaman
Hayati & Layanan Ekosistem. Universitas Padjajaran. Bandung.
Menteri Kesehatan Republik Indonesia. 1985. Peraturan Menteri Kesehatan
No.239/Men.Kes/Per/V/85 Tentang Zat Warna Tertentu yang Dinyatakan sebagai Bahan Berbahaya. Jakarta.
Nwoko, C.O. 2010. Trends in
Phytoremediation of Toxic
Elemental and Organic Pollutants. African Journal of Biotechnology. 9 (37): 6010-6016.
Oranusi, N. A., and C.J. Ogugbue. 2005. Effect of cosubstrates on primary biodegradation of
triphenylmethane dyes by Pseudomunas sp. African J. Appl. Zool Environ. Biol. 7: 38 – 44.
Patricia, A.R., M.H. Cardoso, A.C.Paulo and M.T. Ramalho. 2004. Chacterization of Azo Reduction Activity in a Novel Ascomycete Yeast Strain. Appl Environ Microbiol. 70 (4): 2279-2288.
Pelczar, M.J. dan E.C.S. Chan. 2003. Dasar-Dasar Mikrobiologi Jilid ke-1. Jakarta: UI-Press.
Pfaller, M., D. Diekema and W. Merz. 2009. Infection Caused by NonCandida, Non Cryptococcus Yeasts. In Anaissie, E., Mcginnis, M. & Pfaller, M. (Eds.) Clinical mycology. 2nd ed. Churchill Livingstone, Elsevier.
Rajeswari K., R. Subashkumar and K. Vijayaraman. 2013. Decolorization and Degradation of Textile Dyes by Stenotrophomonas maltophilia RSV-2. Journal of Environmental Bioremediation & Biodegradation. 1(2): 60-65.
Saranraj, P., V. Sumathi and D. Reetha. 2010. Decolourization and Degradation of Direct Azo Dyes and Biodegradation of Textile Dye Effluent by Using Bacteria Isolated
from Textile Dye Effluent. J. of Ecobiotechnology. 2(7): 7-11.
Shah, M.P., K.A. Patel and A.M. Darji. 2013. Microbial Degradation and Decolorization of Methyl Orange Dye by an Aplication of Pseudomonas spp. ETL-1982. J. of Environmental Bioremediation & Biodegradation. 1(1): 26-36.
Shah, M.P. 2014. Biodegradation of Azo Dyes by Three Isolated Bacterial Strains: An Environmental
Bioremedial Approach. J. Microbial Biochem Technol.
Sriram, N., D. Reetha, P. Saranraj. 2013. Biological Degradation of Reactive Dyes by Using Bacteria Isolated from Dye Effluent Contaminated Soil. Middle-East J. Sci. Res. 17 (12): 1695–1700.
Vivekanandan, N., V. Maharani, S. Vijayalakshmi and T. Balasubramanian. 2013.
Degradation and Detoxification of Reactive Azo Dyes by Native Bacterial Communities. African Journal of Microbiology Research. 7(20): 2274-2282.
Wassif C, D. Cheek and R. Belas. 1995. Molecular Analysis of a Metalloproteae from Proteus mirabilis. Journal of Bacteriology. 177: 5790-5798.
Widowati, W., A. Sastiono dan R. Jusuf. 2008. “Efek Toksik Logam” Pencegahan dan Penanggulangan Pencemaran. Penerbit ANDI Yogyakarta.
Wilkolazka A., J. Rdest, E. Malarczyk, W. Wardas and A. Leonowicz . 2002. Fungi and their Ability to Decolourize Azo and Anthraquinone Dyes. Journal of Enzyme and Microbial Technology. 30. 566-572.
Yuliarti. 2007. Bahaya di Balik Lezatnya Makanan. Jogjakarta: Penerbit Andi.
311
Discussion and feedback