Identifikasi Senyawa Fitokimia pada Daun Kersen (Muntingia calabura Linn.) dan Uji Toksisitasnya Terhadap Larva Udang Artemia salina Leach
on
Nandur
Vol. 1, No. 4, Oktober 2021 https://ojs.unud.ac.id/index.php/nandur
EISSN: 2746-6957 | Halaman 187-195 Fakultas Pertanian, Universitas Udayana
Identifikasi Senyawa Fitokimia pada Daun Kersen (Muntingia calabura Linn.) dan Uji Toksisitasnya Terhadap Larva Udang Artemia salina Leach
Ade Febrianto Umbu Romu Kolambani, Made Sritamin*), I Nyoman Wijaya Program Studi Agroekoteknologi, Fakultas Pertanian, Universitas Udayana Jl. PB. Sudirman Denpasar, Bali 80232
*)Email: madesritamin@gmail.com
Abstract
Singapore cherry (Muntingia calabura L.) is a plant that has shady trees, is often used as a shade and is easy to grow in various places. All parts of the cherry plant, including roots, bark, fruit, and leaves, contain secondary metabolites that can be used as traditional medicine. The purpose of this study was to determine the phytochemical compounds contained in cherry leaf extract and to determine the level of acute toxicity (LC50) using the Brine Shrimp Lethality Test (BSLT) method. Identification of phytochemical compounds was carried out by gas chromatography-mass spectrometry and acute toxicity test (LC50) was carried out using the BSLT method using the shrimp larvae test insect Artemia salina Leach. The acute toxicity test (LC50) consisted of 6 concentration treatments, namely 500 ppm, 250 ppm, 150 ppm, 100 ppm, 50 ppm, along with negative controls, each of which was repeated three times. The LC50 value is obtained from probit analysis in Microsoft Office Excel. There are 3 groups of bioactive compounds with the highest peak area in singapore cherry leaf extract, namely groups of flavonoids, phenols, and alkaloid. The result of acute toxicity test (LC50) of singapore cherry leaves extract was 84,029 ppm.
Keywords: Singapore Cherry, GC-MS, LC50, Artemia salina
-
1. Pendahuluan
Indonesia merupakan negara yang kaya akan keanekaragaman tumbuh-tumbuhan yang berpotensi sebagai bahan obat tradisional (Fahey, 2005). Sekitar 85% pengobatan tradisional melibatkan ekstrak tumbuhan. Penggunaan ekstrak tumbuhan dimulai dalam 20 tahun seiring meningkatnya kesadaran masyarakat akan bahaya toksisitas dan kesehatan dari obat sintesisis. Tumbuhan yang dimanfaatkan sebagai obat tradisional mengandung senyawa metabolit sekunder kelompok fenol,flavonoid, alkaloid,tanin, dan terpenoid yang berfungsi sebagai antioksidan, antibakteri, antiinflamasi, dan antikanker (Fahey, 2005). Salah satu tanaman yang digunakan sebagai obat tradisional yaitu tanaman kersen.
Kersen (Muntingia calabura L.) merupakan tanaman yang dapat tumbuh dan berbuah dengan sangat cepat sepanjang tahun dan telah dimanfaatkan/digunakan
sebagai Tanaman kersen dapat mengobati beberapa penyakit, antara lain sebagai obat batuk, obat sakit kuning dan obat asam urat (Nurhasanah, 2012). Bagian-bagian tumbuhan pada kersen (buah, akar, kulit batang, bunga dan daun) mengandung senyawa metabolit sekunder yaitu kelompok senyawa polifenol, flavonoid, tanin dan alkaloid. Berbagai penelitian mengenai tanaman kersen saat ini masih terbatas pada konsumsi buahnya, dan masih belum banyak yang meneliti penggunaan daun kersen sebagai bahan obat. Penggunaan daun kersen sebagai obat tradisional perlu dilakukan analisis senyawa fitokimia nya menggunakan analisis GCMS dan uji toksisitas menggunakan metode BSLT untuk mendapatkan senyawa bioaktif dan nilai LC50.
-
2. Bahan dan Metode
-
2.1 Waktu dan Tempat Pelaksanaan
-
Penelitian dilaksanakan sejak bulan Maret sampai dengan bulan Juli 2021. Tempat dilaksanakannya penelitian in adalah di Laboratorium Sumber Daya Genetika dan Biologi Molukuler, Universitas Udayana, Laboratorium Forensik Polda Bali serta dirumah. Sampel daun kersen diperoleh dari Kebun Percobaan Fakultas Pertanian, Universitas Udayana.
-
2.2 Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah daun kersen (Muntingia calabura), udang Artemia salina Leach, ekstrak ragi, dan pelarut etanol 96 %. Alat-alat yang digunakan dalam penelitian ini adalah GC-MS GC 7890B (SN US17213016) MSD (5977B (SN G7078B US1721D001), Sentrifuge, botol vial 30 ml, blender, vacuum rotary evaporator, timbangan analitik, mikropipet, gelas ukur, garam ikan, gelas beaker, pipet tetes, kertas saring, wadah kaca, corong kaca, kertas label, pengaduk, kamera handphone, petridish, pisau, aerator, lampu pijar 25 watt, serta wadah plastik.
-
2.3 Ekstraksi Sampel dengan Metode Maserasi
Daun kersen yang berwarna hijau tua diambil sebanyak 2 kg, lalu dikerngkan dibawah sinar matahari selama 3 hari. Setelah kering, daun kersen diblender sampai berbentuk serbuk lalu ditimbang dan diperoleh serbuk halus sebanyak 160 gram. Serbuk kering daun kersen sebanyak 160 gram kemudian direndam menggunakan pelarut etanol 96 % sebanyak 1,6 liter dengan perbandingan simplisia dan pelarut yaitu 1:10 selama 3x24 jam. Proses ekstraksi menggunakan metode maserasi menggunakan maserator dengan dilakukan pengadukan selama 10 menit. Hasil maserasi disaring menggunakan kertas saring sehingga didapatkan filtrat dan residu. Filtrat hasil maserasi kemudian diuapkan pelarutnya menggunakan vacuum rotary evaporator pada suhu 35˚C sehingga diperoleh ekstrak kental berupa pasta
-
2.4 Identifikasi Senyawa Aktif Menggunakan GC-MS
Analisis senyawa aktif dilakukan dengan menggunakan GC 7890B (SN US17213016) MSD 5977B (SN G7078B US1721D001), dengan kolom HP-5MS UI
dengan ukuran panjang kolom 30 m, diameter kolom 0,25 mm, dan ketebalan fase diam 0,25 µm. Analisis sampel ekstrak daun kersen menggunakan gas N2 sebagai carrier. Ekstrak kental daun kersen hasil maserasi dilakukan pengenceran 30 kali dengan cara mengambil ekstrak sebanyak 1 mg kemudian dilarutkan dengan pelarut etanol 96 % sebanyak 900 µl dan dimasukkan kedalam vial. Selanjutnya sampel di sentrifuge selama 3 menit. Kemudian sampel diambil sebanyak 1 µl lalu diinjeksikan kedalam injektor dengan gas N2 sebagai pembawa (carrier).
Temperatur oven diatur pada suhu 70˚C selama 3 menit, perlahan-lahan temperatur ditingkatkan rata-rata 10˚C per menit sampai suhu 290˚C dan suhu 290˚C dipertahankan selama 2 menit. Temperatur saat sampel diinjeksi pada suhu 230˚C. Senyawa yang terdapat dalam sampel di identifikasi dengan membandingkan waktu retensi masing-masing puncak kromatografi dengan senyawa yang terdapat didalam library/database.
-
2.5 Uji Toksisitas Menggunakan Metode BSLT
-
2.5.1 Penyiapan Larva Udang Artemia salina Leach
-
Langkah awal dalam penyiapan larva udang yaitu dengan menetaskan telur udang dalam wadah penetas yang berisi larutan air garam. Larutan air garam dibuat dengan cara melarutkan 40 gram garam ikan dalam 2 liter air dengan kisaran kadar garam 1035 per mil (Ainun, 2016). Alat penetas dilengkapi dengan lampu sebagai sember cahaya dan diberi aerator. Selanjutnya telur udang Artemia salina sebanyak 2 gram dimasukkan kedalam wadah yang berisi air garam dan akan menetas dalam waktu 24 jam. Setelah itu larva udang dipindahkan dalam wadah yang kecil, agar tidak tercampur dengan kulit cangkangnya. Setelah 2-3 hari larva udang sudah mencapai instar II yang bergerak aktif dan siap digunakan sebagai hewan uji.
-
2.5.2 Pembuatan Konsentrasi Larutan Uji dan Kontrol
Ekstrak dari daun kersen (Muntingia calabura) ditimbang sebanyak 50 mg. Kemudian ekstrak tersebut dilarutkan menggunakan pelarut etanol 96 % sebanyak 5 ml sehingga diperoleh larutan dengan konsentrasi 10.000 ppm sebagai larutan induk (stok). Konsentrasi larutan yang digunakan dalam penelitian ini yaitu konsentrasi 50 ppm, 100 ppm, 150 ppm, 200 ppm, 250 ppm, dan 0 ppm (larutan kontrol). Untuk membuat larutan 50 ppm, 100 ppm, 150 ppm, 200 ppm, 250 ppm dilakukan dengan mengambil larutan stok sebanyak 25 Pembuatan larutan uji dengan konsentrasi 250 ppm. 200 ppm, 150 ppm, 100 ppm, dan 50 ppm melalui pengenceran dengan rumus :
M1.V1 = M2.V2
Keterangan : M1 = Konsentrasi awal M2 = Konsentrasi akhir
V1 = Volume awal V2 = Volume akhir
-
2.5.3 Pelaksanaan Uji
Larutan uji dengan konsentrasi 50 ppm, 100 ppm, 150, ppm, 250 ppm, dan larutan kontrol 0 ppm masing-masing dimasukkan kedalam botol vial, kemudian diangin-
anginkan hingga pelarutnya hilang. Selanjutnya vial diisi dengan air laut sebanyak 1 ml, lalu 10 ekor larva udang Artemia salina berumur 48 jam yang sehat dimasukkan kedalam botol vial yang berisi sampel menggunakan pipet tetes ke dalam masing-masing konsentrasi, kemudian tambahkan satu tetes suspensi ragi Saccharomyces cerevisiae (3 mg/10 ml air laut) kedalam vial. Setelah itu, tambahkan air garam kedalam masing-masing vial hingga mencapai 5 ml. Percobaan ini dilakukan replikasi sebanyak 3 kali.
Jumlah total larva udang Artemia salina yang digunakan adalah 180 ekor yang dimasukkan kedalam 18 botol vial.setelah 24 jam perlakuan, larva udang Artemia salina diamati menggunakan lup. Pengamatan kematian larva udang Artemia salina dilihat dari pergerakan larva selama beberapa detik dan larva yang mati akan mengendap didalam dasar botol vial. Jika tidak ada pergerakan pada larva tersebut, maka dihitung kematian pada tiap-tiap konsentrasi menggunakan rumus :
% Mortalitas = Jumlah larva mati x 100 %
Jumlah larva uji
(Nurhayati et al.,2006)
-
2.5.4 Analisis dan Pengolahan Data
Setelah menghitung persen kematian larva dari tiap konsentrasi, nilai probit ditentukan melalui tabel probit berdasarkan nilai persen kematian yang didapatkan. Untuk mendapatkan nilai LC50 menggunakan persamaan regresi linear Y = mx + b, dimana m merupakan nilai slope, nilai b merupakan nilai intersept, Y adalah nilai probit, dan x merupakan log konsentrasi. Nilai slope dan intersept didapatkan dari analisis regresi melalui menu data analysis di Microsoft Office Excel 2013. Analisis regresi dilakukan dengan menginput sumbu y sebagai nilai probit tiap konsentrasi dan nilai x sebagai log konsentrasi. Selanjutnya akan mendapatkan nilai m (slope) dan b (intersept). Nilai Y adalah nilai probit LC50, dimana nilai probit 50 % dari hewan uji di tabel probit adalah 5. Lalu dari persamaan Y = mx + b, dihasilkan nilai x sebagai log konsentrasi.
-
3. Hasil dan Pembahasan
-
3.1 Hasil Ekstraksi Daun Kersen
-
Hasil ekstraksi menggunakan metode maserasi dengan merendam sampel kedalam pelarut menggunakan suhu ruangan. Hasil maserasi sampel daun kersen menghasilkan filtrat sebanyak 600 ml yang berwarna hijau kehitaman. Filtrat tersebut selanjutnya diuapkan menggunakan evaporator dan menghasilkan ekstrak kental dengan berat 25,8 gram. Ekstrak kental yang diperoleh dibungkus menggunakan kertas alumunium foil dan disimpan didalam lemari pendingin.
-
3.2 Hasil Uji GC-MS Ekstrak Daun Kersen
Hasil Analisis GC menunjukkan terdapat 31 puncak kromatogram dengan 81 senyawa yang terdeteksi melalui spektrum massa (MS). Persen area yang paling tinggi yaitu terdapat pada peak nomor 30 dengan waktu retensi 26,175 menit, disusul peak nomor 31 dengan waktu retensi 26,528 menit, peak nomor 18 dengan waktu retensi
22,835 menit, dan peak 19 dengan waktu retensi 22,964 menit. Hasil kromatogram ekstrak daun kersen dapat dilihat pada gambar di bawah (Gambar 1).
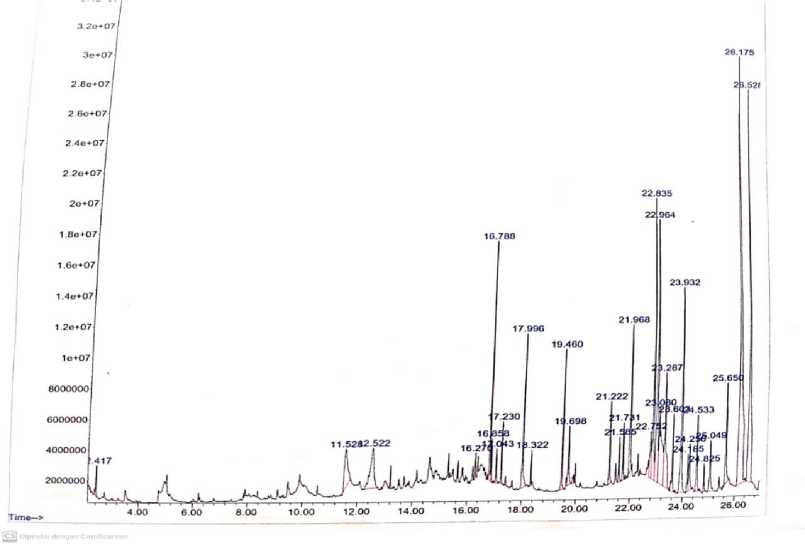
Gambar 1. Hasil Kromatogram Ekstrak Daun Kersen (Muntingia calabura)
Pada peak 30 terdapat 3 senyawa yang berhasil diidentifikasi yaitu senyawa dyhydroguaiaretic acid, 1,4-benzenediol, dan decasilane. Diketahui bahwa senyawa dyhydroguaiaretic acid merupakan senyawa metabolit sekunder jenis flavonoid yang memiliki fungsi sebagai antibakteri, dan antikanker. Selain itu juga senyawa dyhydroguaiaretic acid dapat berperan sebagai larvasida (Mishiwaki et al., 2015). Senyawa 1,4-benzenediol merupakan senyawa metabolit sekunder jenis fenolik yang memiliki fungsi sebagai penolak serangga (Puspitasari et al., 2013).
Pada peak 31 terdapat 3 senyawa yang berhasil diidentifikasi yaitu senyawa isoethylvanilin, senyawa keton, dan senyawa 4-Hydroxy-3-methoxybenzyl alcohol, di (2-methylpropyl) ether. Senyawa isoethylvanilin merupakan senyawa metabolit sekunder jenis asam fenolat yang berfungsi sebagai antioksidan (Hesti et al., 2017).
Pada peak 18 terdapat 3 senyawa yang berhasil diidentifikasi yaitu senyawa dihydrochalcones, senyawa acetylhaemanthamine, dan senyawa 4-metoxytyramine. Senyawa dihydrochalcones merupakan senyawa metabolit sekunder jenis flavonoid yang memiliki fungsi sebagai antibakteri, antikanker, dan antioksidan (Subarnas et al., 2015). Senyawa acetylhaemanthamine merupakan senyawa metabolit sekunder jenis alkaloid dalam pengobatan antistress/kecemasan, antiepilepsi dan antitumor (Labrana et al., 1999). Senyawa 4-metoxytyramine merupakan senyawa metabolit sekunder jenis fenolik dan turunan dari metil sinnamat. Senyawa ini merupakan senyawa aromatik. Selain itu,
senyawa ini juga berfungsi sebagai antibakteri, antidiabetes, dan antitumor (Kasetri et al., 2012).
Pada peak 19 terdapat 3 senyawa yang berhasil diidentifkasi yaitu senyawa 2',4'-dihydroxychalcone, senyawa 2,3 – dihydro - 1 ,4 - benzodioxin - 6 yl(phenyl) methanone, dan senyawa o-(p-(Dimethylamino)benzylideneamino) phenol. Senyawa senyawa 2',4'-dihydroxychalcone merupakan kelompok senyawa metabolit sekunder jenis flavonoid, sedangkan senyawa 2,3 – dihydro - 1 ,4 - benzodioxin - 6 yl(phenyl) methanone, dan senyawa o-(p-(Dimethylamino)benzylideneamino) phenol merupakan kelompok fenolik. Senyawa-senyawa ini diketahui memiliki aktivitas sebagai antikanker, dan antioksidan (Kasetri et al., 2012).
-
3.3 Hasil Uji Toksisitas
Tabel 1. Pengaruh berbagai konsentrasi ekstrak etanol daun kersen (Muntingia calabura terhadap larva udang Artemia salina Leach.
|
Konsentrasi (ppm) |
Perlakuan |
Total kematian |
Rata-rata kematian |
Persen kematian (%) | ||
|
Vial I |
Vial II |
Vial III | ||||
|
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
50 |
3 |
3 |
2 |
8 |
0.2667 |
26.67 |
|
100 |
5 |
6 |
6 |
17 |
0.5667 |
56.67 |
|
150 |
8 |
7 |
8 |
22 |
0.7667 |
76.67 |
|
200 |
8 |
8 |
9 |
25 |
0.8333 |
83.33 |
|
250 |
9 |
10 |
10 |
29 |
0.9667 |
96.67 |
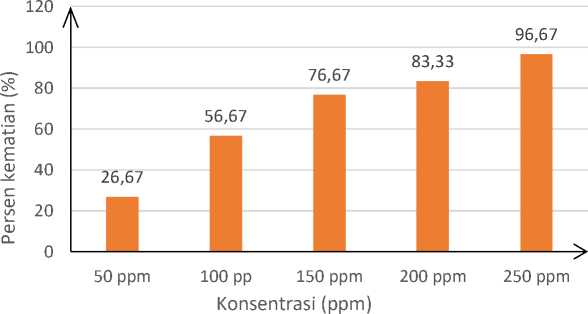
Gambar 2. Grafik Pengaruh berbagai konsentrasi ekstrak daun kersen terhadap kematian larva udang Artemia salina Leach
Pada Tabel 1 dan Gambar 2 dapat dilihat bahwa kematian larva tertinggi pada konsentrasi 250 ppm dan kematian larva terendah yaitu pada konsentrasi 50 ppm. Selain itu, terdapat peningkatan kematian larva Artemia salina Leach yang selaras dengan
peningkatan konsentrasi ekstrak etanol daun kersen (Muntingia calabura). Pada kontrol negatif (0 ppm) tidak didapatkan adanya larva yang mati, sehingga kematian larva udang Artemia salina Leach murni karena ekstrak yang diberikan bukan karena pengaruh air laut, ataupun makanannya.
-
3.4 Penentuan Nilai LC50
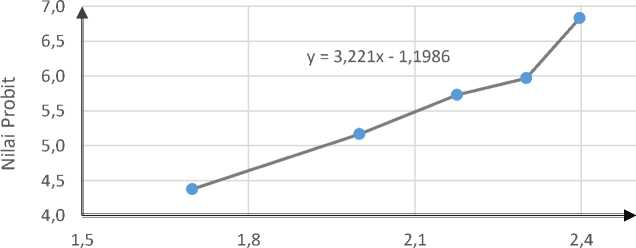
Tabel 2. Perhitungan nilai LC50 dengan metode analisis probit
|
Konsentrasi |
Log Konsentrasi (X) |
% kematian |
Probit (Y) |
|
0 |
0 |
0 |
0 |
|
50 |
1.698 |
26.67 |
4.3750 |
|
100 |
2 |
56.67 |
5.1662 |
|
150 |
2.176 |
53.33 |
5.7257 |
|
200 |
2.301 |
76.67 |
5.9661 |
|
250 |
2.398 |
96.67 |
6.8260134 |
|
Jumlah (Σ) |
10.559 |
300.01 |
26.921 |
Probit Analysis and LC50 Calculation
Log Konsentrasi (ppm)
Gambar 3. Grafik Regresi Linear Konsentrasi Ekstrak Etanol Daun Muntingia calabura Terhadap Nilai Probit
Berdasarkan Tabel 2 dan Gambar 3 nilai LC50 ekstrak etanol daun kersen (Muntingia calabura L.) yang didapatkan dari persamaan garis lurus menggunakan aplikasi Microsoft Excel 2013 yaitu 84,029 ppm. Dari hasil LC50 yang telah didapatkan, menunjukkan bahwa ekstrak etanol daun kersen (Muntingia calabura) bersifat toksik terhadap larva udang Artemia salina yang dapat dilihat dari nilai LC50 ≤ 1000 ppm.
Menurut Lenny (2006), jika nilai LC50 lebih rendah dari 1000 ppm maka senyawa yang terkandung dapat dinyatakan sebagai senyawa bioaktif, dan sebaliknya apabila nilai LC50 yang didapatkan lebih dari 1000 ppm maka senyawa yang terkandung dalam ekstrak merupakan senyawa bukan bioaktif. Senyawa-senyawa tersebut merupakan senyawa
metabolit sekunder berupa senyawa fenolik, alkaloid, dan flavonoid yang dapat dikembangkan lebih lanjut menjadi obat tradisional, larvasida, ataupun agen pengendali hayati.
-
4. Kesimpulan
Berdasarkan hasil dan pembahasan penelitian tersebut, maka dapat ditarik kesimpulan bahwa senyawa-senyawa metabolit sekunder yang diidentifikasi dari ekstrak etanol daun kersen (Muntingia calabura) menggunakan GC-MS termasuk dalam golongan senyawa flavonoid, fenolik, dan alkaloid. Hasil uji toksisitas ekstrak daun kersen (Muntingia calaburai L.) terhadap larva udang Artemia salina Leach menunjukkan bahwa semakin tinggi konsentrasi daun kersen, maka semakin tinggi pula tingkat kematian larva udang. Serta nilai LC50 ekstrak etanol daun kersen (Muntingia calabura L.) adalah 84,029 ppm (LC50 ≤ 1000 ppm), sehingga senyawa metabolit sekunder yang terkandung dalam ekstrak daun kersen merupakan senyawa bioaktif.
Daftar Pustaka
Ainun, S.H. (2016). Uji Toksisitas Fraksi Ektrak Etanol Daun Pedang-pedang (Sansevieria trifasciata Prain) tehadap Larva Udang (Artemia Salina Leach) dengan Menggunakan Metode BSLT. Skripsi. Universitas Negeri Islam Alauidin Makassar. Hal 1-97.
Fahey, J. W. (2005). Moringa oleifera: A Review of the Medical Evidence for its Nutritional, Therapeutic, and Prophylactic Properties. Part 1. Trees Life Journal. Vol. 1: 5.
Hesti, R. (2017). Skrining Fitokimia dan Identifikasi Metabolit Sekunder Senyawa Karpain pada Ekstrak Metanol Daun Carica pubescens. Skripsi. Jurusan Biologi. Fakultas Sains dan Teknologi. Universitas Islam Negeri (UIN) Maulana Malik Ibrahim. Malang. Hal. 1-68.
Kasetri, P. P., J. Thomas, Mathew, dan Skaria. (2012). Zingiberaceous . Medicinal and Aromatic Plants. India. 1-61.
Labrana, J., K. Alex, K. Vladimir, B. Reto, Carles, Codina, V. Frances, B. Jaume. (1999). Alkaloid from Narcissus angustifolius subsp. Transcarpathius (Amaryllidiceae). Journal of Phytochemistry. Vol.60. 847-852.
Lenny, S. (2006). Senyawa Flavonoida, Fenilpropanoida dan Alkaloida. Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara, Medan. Hal. 1-79.
Mishiwaki, A., T. (2015). In Vitro Acvities of Azole Antifungal Agents Against Propionibacterium acnes Isolated from Patients With Acne Vulgaris. Biol Pharm Bull. Journal Vol. 33(1): 125-127.
Nurhasanah, N. (2012). Isolasi Senyawa Antioksidan Ekstrak Etanol Daun Kersen (Muntingia calabura Linn). Skripsi. Fakultas Matematika dan Ilmu Pengetahuan Alam. Unnversitas Jendral Ahmada Yani : Cimahi.
Nurhayati, N., R. Abdulgani. (2006). Uji Toksisitas Ekstrak Alvaresii terhadap Artemia salina Leach. Sebagai Studi Pendahuluan Potensi Antikanker. Skripsi. Program Studi Biologi FMIPA Institut Teknologi Sepuluh November. Surabaya. Hal. 1-80.
Puspitasari, L., D.A. Swastini, C. I. S. Arisanti. (2013) Skrining Fitokimia Ekstrak Etanol 95% Kulit Buah Manggis (Garcinia mangostana L.). Jurnal Farmasi Udayana, Sl. 2(3):1-4, 2013 ISSN 2622-4607.
Subarnas, A., A. Diantini. (2015). Apoptosis Induced in MCF-7 Human Breast Cancer Cells by Dimethylchalcone Isolated from Eugenia aquea Burm f. Leaves. Oncology Letters (5), 2303- 2306.
195
Discussion and feedback