Analisis Kestabilan Model Insidensi Setengah Jenuh pada Epidemi Flu Burung
on
Jurnal Matematika Vol. 11, No.2, Desember 2021, pp. 87-101
Article DOI: 10.24843/JMAT.2021.v11.i02.p139
ISSN: 1693-1394
Analisis Kestabilan Model Insidensi Setengah Jenuh pada Epidemi Flu Burung
Yomi Kharisma Septika
Kampus IPB, Jl. Raya Dramaga, Babakan, Kec. Dramaga, Kota Bogor, Jawa Barat 16680 e-mail: yomikssundoro@gmail.com
Ali Kusnanto
Kampus IPB, Jl. Raya Dramaga, Babakan, Kec. Dramaga, Kota Bogor, Jawa Barat 16680 e-mail: ali_mat@apps.ipb.ac.id
Paian Sianturi
Kampus IPB, Jl. Raya Dramaga, Babakan, Kec. Dramaga, Kota Bogor, Jawa Barat 16680 e-mail: psianturi@apps.ipb.ac.id
Abstract: The H5N1 avian influenza is an example of a pathogen that is known to cause human disease outbreaks. This study focuses on selecting avian influenza control strategies using Half-Saturated Incidence (HSI) Models. In this study, a model was constructed by involving elements of human self-protection, poultry isolation and poultry vaccination. Furthermore, it is shown that the parameters that influence are the parameters of the population that apply personal protection and its effectiveness, the parameters of the rate of isolation of birds with avian influenza, and the parameters of vaccine coverage and its effectiveness. Increasing the value of this parameter can reduce the basic reproduction number so that disease-free conditions can occur. Hence, controlling the dynamics of disease spread can be done by increasing the value of these parameters.
Keywords: avian influenza, reproduction number, H5N1, half-saturated incidence
Abstrak: Flu burung H5N1 adalah contoh patogen yang diketahui sebagai penyebab terjadinya wabah penyakit pada manusia. Penelitian ini berfokus pada pemilihan strategi pengendalian penyakit flu burung dengan menggunakan Model Insidensi Setengah Jenuh (HSI). Dalam penelitian ini dikonstruksi model dengan pelibatan unsur perlindungan diri manusia, isolasi unggas dan vaksinasi unggas. Selanjutnya ditunjukkan bahwa parameter yang berpengaruh adalah parameter populasi yang menerapkan perlindungan diri dan efektivitasnya, parameter tingkat isolasi unggas yang terkena flu burung, serta parameter cakupan vaksin dan efektivitasnya. Peningkatan nilai parameter ini dapat menurunkan bilangan reproduksi dasar sehingga kondisi bebas penyakit dapat terjadi. Sehingga pengontrolan dinamika penyebaran penyakit dapat dilakukan dengan meningkatkan nilai parameter tersebut.
Kata Kunci: flu burung, bilangan reproduksi, H5N1, insidensi setengah jenuh flu burung, bilangan reproduksi, H5N1, insidensi setengah jenuh
Penyakit adalah kondisi buruk pada organ atau bagian tubuh tertentu yang disebabkan oleh patogen atau mikroorganisme berbahaya seperti bakteri, virus, luka, dan munculnya sel tidak sempurna. Patogen yang menimbulkan penyakit dapat disebabkan oleh lingkungan yang kurang sehat dan individu lain karena sifatnya yang menular. Flu burung H5N1 adalah contoh patogen yang diketahui sebagai penyebab terjadinya wabah penyakit pada manusia dan penularannya terjadi secara langsung maupun tidak langsung (Hewajuli dan Dharmayanti, 2014).
Menurut OIE (2011), kasus flu burung H5N1 di Indonesia pertama kali dilaporkan pada 2 Februari 2004 dengan total 710 unggas mati. Dengan demikian pendekatan pemodelan sangat penting untuk pengambilan keputusan tentang strategi pengendalian penyakit flu burung H5N1. Pemodelan epidemiologi penyakit menular flu burung H5N1 yang digunakan adalah model SI yang mengkategorikan individu dalam suatu populasi sebagai kelompok yang rentan terhadap penyakit (Susceptible) dan terinfeksi penyakit (Infected) dimana tingkat insidensi jenuh (Saturated Incidence/SI) sering digunakan dalam model epidemik.
Pemodelan matematika dengan tingkat insidensi setengah jenuh digunakan oleh Chong et al. (2014) untuk menggambarkan manusia rentan yang melakukan kontak efektif dengan burung ataupun manusia terinfeksi dengan mempertimbangkan efek penghambatan dari perubahan perilaku ataupun tindakan pengendalian yang diambil oleh manusia rentan. Tingkat insidensi setengah jenuh juga dipilih karena adanya pertimbangan efek kejenuhan (saturation effect). Dengan kata lain, ketika populasi terinfeksi meningkat atau mencapai titik jenuh, maka laju infeksi penyakit mengalami perlambatan (Ulfa, 2020).
Selanjutnya, Lee dan Lao (2018) mempelajari dinamika global penyebaran penyakit flu burung dengan tingkat insidensi bilinear dan insidensi setengah jenuh pada burung dan manusia. Berkaitan dengan hal tersebut, dalam penelitian ini akan dilakukan analisis model penyebaran penyakit flu burung dengan tingkat insidensi setengah jenuh. Selain itu, akan diberikan beberapa strategi penanganan untuk mencegah atau mengurangi penyebaran penyakit flu burung seperti penerapan perlindungan diri oleh manusia, isolasi unggas, dan vaksinasi unggas. Harapannya salah satu strategi yang disebutkan dapat membantu mengontrol penyebaran penyakit flu burung H5N1.
Metode yang digunakan dalam penelitian ini adalah dengan melakukan rekonstruksi model yang telah dikembangkan oleh Lee dan Lao (2018). Selanjutnya pengembangan
model dilakukan dengan beberapa strategi yaitu: perlindungan diri manusia, isolasi unggas, dan vaksinasi unggas. Dalam penelitian ini, setiap strategi akan memunculkan kompartemen baru sehingga menghasilkan model matematika yang baru. Sehingga fokus utama penelitian ini adalah membandingkan dinamika solusi empat model tersebut terhadap perubahan nilai parameter.
Langkah yang dilakukan dalam membandingkan empat model tersebut adalah dengan melihat kestabilan titik tetap, menentukan bilangan reproduksi dasar (#0) dan mengamati pengaruh parameter pada dinamika populasi manusia dan burung.
Bilangan reproduksi dasar (dilambangkan dengan #0) didefinisikan sebagai nilai yang diharapkan terjadi infeksi dalam suatu populasi yang sangat rentan yang dihasilkan oleh individu terinfeksi. Untuk mencari #0 akan digunakan matriks next generation. Menurut Driessche dan Watmough (2002), klasifikasi bilangan reproduksi dasar, #0 dibagi menjadi :
-
1. Jika #0 < 1, maka jumlah individu yang terinfeksi penyakit akan mengalami penurunan pada setiap waktu, sehingga penyakit tidak akan menyebar dalam suatu populasi.
-
2. Jika ^0 > 1, maka jumlah individu yang terinfeksi penyakit akan mengalami peningkatan pada setiap waktu, sehingga penyakit akan menyebar dalam suatu populasi.
-
3. Hasil dan Pembahasan
-
3.1 Model Matematika
-
Model I : Model Dasar
Model Flu burung yang digunakan dalam penelitian ini dikembangkan oleh Lee dan Lao (2018). Interaksi antara manusia dan burung dan antar burung menggunakan model insidensi setengah jenuh (Half-Saturated Incidence/HSI). Populasi manusia terbagi menjadi Sh, populasi manusia rentan (Susceptible) dan Ih, populasi manusia terinfeksi (Infected). Sedangkan populasi burung terbagi menjadi dua kelas yaitu Sb, populasi burung yang berisiko tertular penyakit (Susceptible) dan Ib, populasi burung yang terinfeksi parasit (Infected). Total populasi manusia dilambangkan dengan Nh dan total populasi burung dilambangkan dengan Nb. Secara skematis, model ini dapat digambarkan dalam diagram kompartemen pada Gambar 1a.
Model II : Penerapan Perlindungan Diri oleh Manusia
Kurangnya perlindungan diri seperti mengonsumsi unggas yang terinfeksi dan tidak dimasak dengan matang, terpapar debu infeksi, dan kebersihan lingkungan yang buruk adalah beberapa kemungkinan penyebab tertularnya penyakit flu burung H5N1. Oleh karena itu, penerapan perlindungan diri diperlukan oleh manusia untuk meminimalisir tingkat penyebaran penyakit. Selanjutnya, akan diperiksa efek penerapan perlindungan diri dalam mengendalikan transmisi penyakit pada manusia dengan mengubah parameter βbh menjadi (1 - cq)βbh∙ Kemudian model mengalami modifikasi dan digambarkan ulang ke dalam diagram kompartemen pada Gambar 1b.
Model III : Isolasi Unggas
Pada strategi ini ditambahkan kompartemen baru yaitu populasi burung yang diisolasi (dilambangkan dengan Tb(t)) dan burung yang pulih (dilambangkan dengan Rb(t)). Dikarenakan isolasi burung tidak berpengaruh terhadap penularan penyakit pada populasi manusia, maka akan dipertimbangkan populasi unggas saja. Namun, untuk menyelidiki bagaimana strategi isolasi unggas bekerja untuk meminimalkan penyebaran penyakit, maka banyaknya burung yang terinfeksi per satuan waktu mengalami modifikasi. Selain itu, juga ditambahkan γb (tingkat kepulihan unggas yang terinfeksi) dan ψb (tingkat isolasi unggas yang terinfeksi). Kemudian model mengalami modifikasi dan digambarkan ulang ke dalam diagram kompartemen pada Gambar 1c.
Model IV : Vaksinasi Unggas
Untuk mencegah penyebaran penyakit pada hewan, para peneliti telah mengembangkan vaksin virus flu burung H5N1. Oleh karena itu, akan diterapkan program vaksinasi sebagai strategi pengendalian terhadap unggas. Kemudian akan ditambahkan kompartemen baru mewakili dinamika unggas yang divaksinasi (direpresentasikan oleh Vb(t)). Selanjutnya, akan dilakukan modifikasi terhadap banyaknya burung yang rentan dan terinfeksi per satuan waktu dengan menambahkan parameter persentase unggas yang divaksinasi (dilambangkan dengan p) dan tingkat kemanjuran vaksinasi unggas (dilambangkan dengan φ). Asumsi vaksinasi dapat mengurangi kemungkinan tertular flu burung sebesar 50% dibandingkan populasi unggas rentan yang tidak mendapatkan vaksinasi. Kemudian model mengalami modifikasi dan digambarkan ulang ke dalam diagram kompartemen pada Gambar 1d.

a. Kompartemen model I
b. Kompartemen model II

d. Kompartemen model IV
c. Kompartemen model III
Gambar 1. Diagram Kompartemen
Sistem persamaan diferensial yang digambarkan dalam diagram kompartemen di atas, dapat dituliskan dalam persamaan-persamaan berikut :
dSb βbSbIb
7 — -d b UbSb : ~,
dt hb + Ib
dSb
“ — Ab ^bSb
βbSb!b hb + Ib
dlb βbSbIb
dt Jib + Ib
- (⅛ + Sb)lv
dSh _ λ c PbhSbJb : — Λh [IhSh : ”,
dt ⅛1 + 4
(1)
di b dt
βbSbIb
⅛ +/b
~ (⅛ + Sb)Ib,
dSh
— = Λh-μhSh-(I — cq)
TT
T+1 b
(2)
dlh PTJh
dt T+1 b
-T+‘P T
Sistem Persamaan Diferensial
Model I
Sistem Persamaan Diferensial Model II
dSb βbSbIb
7 -- ^li WbiSb 7 7”*
dt Λb 4- /b
dlb βbSb!b r x
TΓ1^7b-^+δb+^
dSb βbSbIb
77- J1 “ P^^ - μbSb - y—, O t ∏b^∖^lb
dTb ,
-^=ψiJb- (⅛+ ½+∕b) Tb,
(3)
dVb λ βvVbIb
— = pΛb-^-φ}-- ^Vh,
(4)
dRb
— = γbTb-μbRb,
dlb βbSblb , BvVbIb ,
λ^≡ + 0^⅛-⅛a⅛
Sistem Persamaan Diferensial
Model III
Sistem Persamaan Diferensial
Model IV
Keterangan :
Sb(t): Banyaknya burung yang rentan pada waktu t Ih (t): Banyaknya burung yang terinfeksi pada waktu t Sh (t): Banyaknya manusia yang rentan pada waktu t Ih (t): Banyaknya manusia yang terinfeksi pada waktu t Tb(t): Banyaknya burung yang diisolasi pada waktu t Rb (t): Banyaknya burung yang pulih pada waktu t Vh (t) : Banyaknya burung yang divaksinasi pada waktu t ^b (t): Banyaknya populasi burung pada waktu t Nb(t): Banyaknya populasi manusia pada waktu t Sb (0): Banyaknya burung yang rentan pada waktu t = 0 Ib (0): Banyaknya burung yang terinfeksi pada waktu t = 0 Sh (0): Banyaknya manusia yang rentan pada waktu t = 0 Ih (0): Banyaknya manusia yang terinfeksi pada waktu t = 0 Th (0): Banyaknya burung yang diisolasi pada waktu t = 0 Rh (0): Banyaknya burung yang pulih pada waktu t = 0 V(0): Banyaknya burung yang divaksinasi pada waktu t = 0
∕h: Laju kelahiran burung
∕h: Laju kelahiran manusia
μb: Laju kematian alami burung
μh: Laju kematian alami manusia
βb: Tingkat penularan penyakit pada burung βh: Tingkat penularan penyakit dari burung ke manusia
Rb: Konstanta setengah jenuh untuk burung tertular flu burung
Rb ft: Konstanta setengah jenuh untuk manusia tertular flu burung dari unggas yang terinfeksi d : Laju kematian akibat penyakit flu burung pada manusia
db: Laju kematian akibat penyakit flu burung pada burung
-
q: Tingkat efisiensi perlindungan diri
-
c: Persentase populasi manusia yang menerapkan perlindungan diri
-
yh: Tingkat kepulihan unggas
^h: Tingkat isolasi unggas
βv: Tingkat penularan penyakit pada burung yang divaksinasi
Rv: Konstanta setengah jenuh untuk burung yang divaksinasi tertular flu burung
φ: Tingkat kemanjuran vaksinasi
p : Persentase populasi unggas yang divaksinasi
-
3.2 Titik Tetap dan Bilangan Reproduksi Dasar
Model I
Titik tetap bebas penyakit, ^o _ ^ 0 ^ 0 ^ 0 j o^ _ (^b q ⅞ qA b , b , h , h ∖μb' 'μh' /
Titik tetap endemik, E* = (Sb*,Ib*,Sh*,Ih*)
dengan
„ * _ hb(μb + ^b) + ^b
Sb = (μb+βb) '
I * _ ^bβb - μbhb(μb + ^b) b (μb + ^b)(μb + βb)
S * ___________^ħ[hbh(μb + ^b)(μb + βb) + ^bβb - μbhb(μb + ^b)__________
-
μb(μb + ^b)[μhhbh - hb(μh + βbh) + βb[^bβbh + μh[hbh(μb + ^b) + ^b]l
I * _ _____________________^[>bh[Ab β b-μbhb(μb+δb)]______________________
[μb(μb+δb)[μhhbh-hb(μh+βbh)]+βb[Λbβbh+μh[hbh(μb+δb)+Λb]]](d+μh)
di mana konstanta Abβb > μbhb(μb + δb).
Bilangan reproduksi dasar, ^ _ ^bβb
0 μbhb(μb+δb)
Model II
Titik tetap bebas penyakit, ^ o _^o ^o ^o ^ o^_ Λbn. Q Λ⅛ q^
Titik tetap endemik, epp* = (Sb*,Ib*,Sh*,Ih*)
dengan :
* -hb(μb + ^bβ + Λ
Sb =
(μb + βb)
b
,
I * _ ^bβb — μbhb(μb + δb) b (μb + δb)(μb + βb)
S * =_____________ΛhEbhμμ+δμ)(.μμ+β2+Λ.bβ-μbbbiμμ+δμL_____________,
b μb(μb+δb)[μhbbh-bbμh+(cq-l)βbhbb]+βb[(Λb-ΛbCq)βbh+μh[hbh(μb+δb)+Λb]]
Ih = —
___________________________Λh(cq-1)βbh[Λbβb-μbhb(μh+δh)]___________________________ [μb(μb+βb)[μhbbh-bbμh+(cq-l)hbβbh]+βb[CΛb-Λbcq)βbh+μh[hbh(μb+δb)+Λb]]](d+μh)
di mana konstanta Λbβb > μbhb(μb + δb)∙
Bilangan reproduksi dasar,
Rpd
(1-cq)Λhβbh μhhbh(μb+δb)
Model III
Titik tetap bebas penyakit,ιpθ (Sb1Jb1JplJpH {~,o^^
Titik tetap endemik, ei* = (Sb*, Ib*, Tb*, Rb*) dengan :
c * hb(fib + Sb + ψb) + A
b
,
^b =
(fib + β b)
I * _ Abβb - fibhb(μb + Sb +Ψb)
b (μb + sb + Ψb)(fib + βb)
T * _ ΛbβbΨb - fibhbψb(fib + Sb + ψb)
b (fib + sb + ψb)(fib + βb)(fib + Sb + Yb)
r*=X⅛^p^^
di mana konstanta Abβb > μbhb(μb + Sb+ ψb).
Bilangan reproduksi dasar, ^ _ ^bPb
1 μbhb(μb+δb+Ψb)
Model IV
Titik tetap bebas penyakit, ^ 0 _ ^ 0 y 0 ∣ o^ _ ((.ι-p^)Λb P ^b ^ θλ
b , b , b p μb ’ μb ’ /
Bilangan reproduksi dasar, ^ _ Λb Γ(ι-p)βb ψ ∩ _ a Pv p!
Pb(Pb+Sbi) hb ħv 1
Simulasi numerik dilakukan dengan menggunakan nilai parameter seperti terlihat pada Tabel 1.
|
Tabel 1. Nilai |
parameter dari model | ||
|
Parameter |
Nilai |
Parameter |
Nilai |
|
^b |
ι.00o individu per hari 365 |
d |
_______6_______per hari (108 x 106) x 912.5 |
|
^h |
is.59 w⅛(0) per hari 365 x 1000 |
hb |
1.405 individu |
|
Vb |
1 per hari 2 x 365 |
hbh |
20.000 individu |
|
Vh |
1 per hari 67.4x365 |
Sb(O) |
2.279 burung |
|
βb |
710 per hari 4.709x30 |
Zb(O) |
300 burung |
|
βbh |
_______16_______per hari (108 x 106) x 912.5 |
Sh(O) |
22.675 manusia |
|
Sb |
817 per hari 4.709x30 |
Zh(O) |
0 manusia |
Dengan melakukan substitusi nilai parameter pada Tabel 1 ke dalam model, maka akan diperoleh grafik dinamika populasi pada model HSI seperti dalam Gambar 2 berikut :

Gambar 2. Dinamika populasi pada model HSI
Dalam kondisi ini titik tetap endemik bersifat stabil sehingga penyakit masih ada di dalam populasi. Untuk menanggulanginya, akan disusun strategi-strategi seperti dalam Model II, Model III, dan Model IV.
Model II
Simulasi numerik dilakukan dengan menambah nilai parameter c dan q. Simulasi pengaruh persentase populasi manusia yang menerapkan perlindungan diri terhadap dinamika penyebaran penyakit dilakukan menggunakan nilai parameter sesuai pada Tabel 1. Hal ini dapat dijelaskan melalui hasil simulasi dengan perubahan nilai parameter q yang disajikan pada Tabel 2.
Tabel 2. Hasil simulasi perubahan nilai parameter c
|
Nilai parameter q |
Nilai parameter c |
^PD |
|
0.1 |
0.000001 |
1.08253 |
|
0.1 |
0.1 |
1.07171 |
|
0.1 |
0.3 |
1.05006 |
|
0.1 |
0.5 |
1.02841 |
|
0.1 |
0.8 |
0.99593 |
|
0.1 |
0.9 |
0.985105 |
Berdasarkan Tabel 2, diperoleh ^pd > 1 untuk c yang bernilai 0.000001,0.1,0.3, dan 0.5 yang menghasilkan titik kestabilan endemik yang bersifat stabil. Selain itu, diperoleh ^PD < 1 untuk c yang bernilai 0.8 dan 0.9 yang menghasilkan titik kestabilan bebas penyakit yang bersifat sadel. Dinamika populasi manusia terinfeksi dari perubahan nilai parameter c dilihat dapat pada Gambar 3.

Gambar 3. Dinamika populasi manusia terinfeksi akibat perubahan nilai c
Hasil simulasi pada perubahan parameter c menunjukkan bahwa pada saat c ditingkatkan dari 0.5 sampai 0.8 akan menurunkan #pD dari 1.02841 sampai 0.99593. Pada kasus ini, batas untuk terjadinya endemik maupun bebas penyakit dapat ditentukan secara analitik yaitu ketika c sebesar 0.762402 dengan asumsi nilai parameter lain tetap.
Simulasi pengaruh tingkat efisiensi perlindungan diri terhadap dinamika penyebaran penyakit dilakukan menggunakan nilai parameter sesuai pada Tabel 1. Hal ini dapat dijelaskan melalui hasil simulasi dengan perubahan nilai parameter q yang disajikan pada Tabel 3.
Tabel 3. Hasil simulasi perubahan nilai parameter q
|
Nilai parameter c |
Nilai parameter q |
^PD |
|
0.1 |
0.000001 |
1.08253 |
|
0.1 |
0.1 |
1.07171 |
|
0.1 |
0.3 |
1.05006 |
|
0.1 |
0.5 |
1.02841 |
|
0.1 |
0.8 |
0.99593 |
|
0.1 |
0.9 |
0.985105 |
Berdasarkan Tabel 3, untuk q yang bernilai 0.000001,0.1,0.3, dan 0.5 menghasilkan nilai Spd > 1 dan titik tetapnya bersifat stabil, sedangkan untuk q yang bernilai 0.8 dan 0.9 menghasilkan nilai Spd < 1 dan titik tetapnya bersifat sadel. Dinamika populasi manusia terinfeksi dari perubahan nilai parameter q dapat dilihat pada Gambar 4.

Gambar 4. Dinamika populasi manusia terinfeksi akibat perubahan nilai q
Hasil simulasi pada perubahan parameter q menunjukkan bahwa pada saat q ditingkatkan dari 0.5 sampai 0.8, maka akan menurunkan Spd dari 1.02841 sampai 0.99593. Pada kasus ini, batas untuk terjadinya endemik maupun bebas penyakit dapat ditentukan secara analitik ketika q sebesar 0.762402 dengan nilai parameter lain tetap.
Model III
Simulasi numerik dilakukan untuk memperlihatkan dinamika solusi dengan nilai parameter yang digunakan adalah ψb dimana nilai ψb berubah-ubah dengan nilai parameter lainnya dibuat tetap. Asumsi nilai awal Tb (0) = 0 dan Rb(0) = 0.
Simulasi pengaruh tingkat isolasi unggas terhadap dinamika penyebaran penyakit dilakukan menggunakan nilai parameter ψb = [0,1]. Hal ini dapat dijelaskan melalui hasil simulasi dengan perubahan nilai parameter ψb yang disajikan pada Tabel 4.
Tabel 4. Hasil simulasi perubahan nilai parameter ψb
|
Nilai parameter ψh |
Si |
|
0.000001 |
1.00001 |
|
0.1 |
0.0667663 |
|
0.3 |
0.023292 |
|
0.5 |
0.0141066 |
|
0.8 |
0.00886352 |
|
0.9 |
0.00788645 |
Berdasarkan Tabel 4, diperoleh Sj >1 untuk ψb yang bernilai 0.000001 yang menghasilkan titik kestabilan endemik yang bersifat stabil. Selain itu, diperoleh Sj < 1
untuk ψb yang bernilai 0.1,0.3,0.5,0.8, dan 0.9 yang menghasilkan titik kestabilan bebas penyakit yang bersifat stabil. Dinamika populasi burung diisolasi dari perubahan nilai parameter ψb dapat dilihat pada Gambar 5.
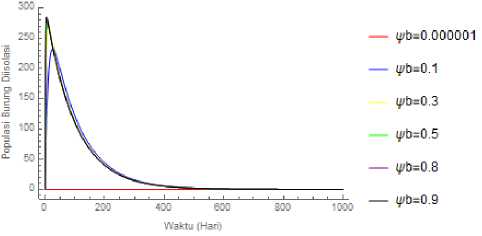
Gambar 5. Dinamika populasi burung diisolasi akibat perubahan nilai ψb
Hasil simulasi pada perubahan parameter φb menunjukkan bahwa pada saat ^ ditingkatkan dari 0.000001 sampai 0.1, maka akan menurunkan ^1 dari 1.00001 sampab 0.0667663. Pada kasus ini, batas untuk terjadinya endemik maupun bebas penyakit dapat ditentukan secara analitik yaitu ketika populasi burung yang diisolasi sebesar 0.00000110144 dengan asumsi nilai parameter lain tetap.
Model IV
Simulasi numerik dilakukan dengan menambah nilai parameter p dan φ. Simulasi pengaruh persentase populasi burung yang divaksinasi terhadap dinamika penyebaran penyakit dilakukan menggunakan nilai parameter sesuai pada Tabel 1 dengan asumsi nilai awal kj,(0) = 0. Hal ini dapat dijelaskan melalui hasil simulasi dengan perubahan nilai parameter p yang disajikan pada Tabel 5.
Tabel 5. Hasil simulasi perubahan nilai parameter p
|
Nilai parameter φ |
Nilai parameter p |
^Vb |
|
0.1 |
0.000001 |
1.00015 |
|
0.1 |
0.1 |
0.974535 |
|
0.1 |
0.3 |
0.923296 |
|
0.1 |
0.5 |
0.872058 |
|
0.1 |
0.8 |
0.795201 |
|
0.1 |
0.9 |
0.769581 |
Berdasarkan Tabel 5, diperoleh ^vb > 1 untuk p yang bernilai 0.000001 yang menghasilkan titik kestabilan endemik yang bersifat stabil. Selain itu, diperoleh ^vb < 1 untuk p yang bernilai 0.1,0.3,0.5,0.8, dan 0.9 menghasilkan titik kestabilan bebas
penyakit yang bersifat stabil. Dinamika populasi burung divaksinasi dari perubahan nilai parameter p dapat dilihat pada Gambar 6.

Gambar 6. Dinamika populasi burung divaksinasi akibat perubahan nilai p
Hasil simulasi pada perubahan parameter p menunjukkan bahwa pada saat p ditingkatkan dari 0.000001 sampai 0.1, maka akan menurunkan ^vb dari 1.00015 sampai 0.974535. Pada kasus ini, batas untuk terjadinya endemik maupun bebas penyakit dapat ditentukan secara analitik yaitu ketika p sebesar 0.000390381 dengan asumsi nilai parameter lain tetap.
Simulasi pengaruh tingkat kemanjuran vaksinasi terhadap dinamika penyebaran penyakit dilakukan menggunakan nilai parameter sesuai pada Tabel 1. Hal ini dapat dijelaskan melalui hasil simulasi dengan perubahan nilai parameter φ yang disajikan pada Tabel 6.
Tabel 6. Hasil simulasi perubahan nilai parameter φ
|
Nilai parameter p |
Nilai parameter φ |
^Vb |
|
0.0002 |
0.000001 |
1.00012 |
|
0.0002 |
0.1 |
1.0001 |
|
0.0002 |
0.3 |
1.0007 |
|
0.0002 |
0.5 |
1.00004 |
|
0.0002 |
0.8 |
0.999987 |
|
0.0002 |
0.9 |
0.99997 |
Berdasarkan Tabel 6, untuk φ yang bernilai 0.000001,0.1,0.3, dan 0.5 menghasilkan nilai ^vb > 1 dan titik tetap endemik bersifat stabil, sedangkan untuk φ yang bernilai 0.8 dan 0.9 menghasilkan nilai ^vb < 1 dan titik tetap bebas penyakit bersifat stabil. Dinamika populasi burung divaksinasi dari perubahan nilai parameter φ dapat dilihat pada Gambar 7.

Gambar 7. Dinamika populasi burung divaksinasi akibat perubahan nilai φ
Hasil simulasi pada perubahan parameter φ menunjukkan bahwa pada saat φ ditingkatkan dari 0.5 sampai 0.8, maka akan menurunkan ^vb dari 1.00004 sampai 0.999987. Pada kasus ini, batas untuk terjadinya endemik maupun bebas penyakit dapat ditentukan secara analitik yaitu ketika φ sebesar 0.394992 dengan asumsi nilai parameter lain tetap.
4. Kesimpulan dan Saran
Kesimpulan
Pada penelitian ini dilakukan analisis model Insidensi Setengah Jenuh (HSI) dan diperoleh hasil bahwa model memiliki titik tetap bebas penyakit dan titik tetap endemik. Titik tetap bebas penyakit bersifat stabil asimtotik lokal jika bilangan reproduksi dasar yang diperoleh bernilai kurang dari satu dan titik tetap endemik bersifat stabil asimtotik lokal jika bilangan reproduksi dasar yang diperoleh bernilai lebih dari satu.
Pada simulasi numerik strategi perlindungan diri terlihat bahwa jika parameter populasi manusia yang menerapkan perlindungan diri dan tingkat keefektifannya ditingkatkan maka dapat menurunkan bilangan reproduksi dasar. Kedua parameter tersebut sama cepatnya dalam membuat populasi menuju keadaan endemik. Dinamika penyebaran penyakit dapat dikontrol dengan menambah populasi manusia yang menerapkan perlindungan diri atau dengan menambah tingkat keefektifannya. Batas nilai kedua parameter dapat ditentukan secara analitik dan diperoleh hasil bahwa kedua parameter tersebut memiliki hubungan linear.
Pada simulasi numerik strategi isolasi unggas terlihat bahwa jika parameter tingkat isolasi unggas ditingkatkan maka dapat menurunkan bilangan reproduksi dasar. Dinamika penyebaran penyakit dapat dikontrol dengan menambah tingkat isolasi unggas. Batas nilai parameter tersebut dapat ditentukan secara analitik yaitu dengan menghitung batas perubahan nilai bilangan reproduksi dasarnya untuk menentukan terjadinya kejadian bebas penyakit atau endemik.
Pada simulasi numerik strategi vaksinasi unggas terlihat bahwa jika parameter populasi unggas yang divaksinasi dan tingkat kemanjurannya ditingkatkan maka dapat menurunkan bilangan reproduksi dasar. Dinamika penyebaran penyakit dapat dikontrol dengan menambah populasi unggas yang divaksinasi atau dengan menambah tingkat kemanjuran vaksinasi. Batas nilai kedua parameter dapat ditentukan secara analitik dan diperoleh hasil bahwa kedua parameter tersebut memiliki hubungan tak linear. Populasi unggas yang divaksinasi lebih cepat membuat populasi menuju keadaan endemik dibandingkan tingkat kemanjuran vaksinasi. Hal ini dikarenakan betapa pun tingkat kemanjuran vaksin tersebut, jika mayoritas populasi tidak divaksinasi, maka akan sulit untuk mengontrol dan mencegah penularan penyakit infeksi.
Saran
Penelitian ini diharapkan dapat dikembangkan lebih lanjut dengan penambahan asumsi populasi burung yang tidak tertutup, yaitu adanya migrasi yang terjadi di dalam populasi burung.
Ucapan Terima Kasih
Penulis mengucapkan terima kasih kepada Departemen Matematika IPB yang telah memberi dukungan financial terhadap penelitian/makalah ini.
Daftar Pustaka
Chong, N.S., Tchuenche, J.M., & Smith, R.J. (2014). A Mathematical Model of Avian
Influenza with Half-Saturated Incidence. Theory in Biosciences,133(2014), 23-38.
Driessche, P.V.D., Watmough, J. (2002). Reproduction Numbers and Sub-Threshold Endemic Equilibria for Compartmental Models of Disease Transmission.
Mathematical Biosciences, 180(2002), 2948.
Hewajuli, D.A., & Dharmayanti, N.L.P.I. (2014). Identifikasi Flu Burung H5N1 pada Unggas di Sekitar Kasus Flu Burung pada Manusia Tahun 2011 di Bekasi. Jurnal Veteriner,15(1), 68-78.
Lee, H., & Lao, A. (2018). Transmission Dynamics and Control Strategies Assessment of Avian Influenza A (H5N6) in the Philippines. Infectious Disease Modelling, 3(2018), 35-59.
[OIE] Office International des Epizooties. (2011). Update on Avian Influenza in
Animals (Types H5 and H7) [internet]. [diacu 2020 Desember 10]. Tersedia dari: http://web.oie.int/waHSI/reports/en_fup_0000011040_20110921_161632.pdf.
Ulfa, S.A. (2020). Analisis Kestabilan Model Penyebaran Penyakit Pada Tanaman Jatropha Curcas [skripsi thesis]. Surabaya (ID) : Universitas Airlangga.
101
Discussion and feedback