Regenerasi Jaringan pada Ikan Kerapu Cantang (Epinephelus fuscoguttatus lanceolatus) yang Terpapar Limbah Deterjen Melalui Perendaman Ekstrak Padina australis dengan Dosis Berbeda
on
Journal of Marine and Aquatic Sciences 8(2), 303-310 (2022)
Regenerasi Jaringan pada Ikan Kerapu Cantang (Epinephelus fuscoguttatus lanceolatus) yang Terpapar Limbah Deterjen Melalui Perendaman Ekstrak Padina australis dengan Dosis Berbeda
Farah Diba Sani a*, Marcelien Dj. Ratoe Oedjoe a, Ade Yulita Hesti Lukas a
a Program studi Budidaya Perairan, Fakultas Peternakan, Kelautan dan Perikanan, Universitas Nusa Cendana. Jl. Adisucipto Penfui, Kota Kupang, Provinsi NTT, Indonesia
* Penulis koresponden. Tel.: +62-81236043542
Alamat e-mail: lfarahrauf09@gmail.com
Diterima (received) 14 November 2020; disetujui (accepted) 26 November 2022; tersedia secara online (available online) 1 Desember 2022
Abstract
Padina australis has bioactive compounds as antimicrobials in the form of phenols and their derivatives (flavonoids) which can inhibit the growth of bacteria that interfere with the function of the cytoplasmic membrane and can prevent spoilage and damage by microorganisms. This research was conducted from October to November 2022 at the Faculty of Animal Husbandry, Maritime Affairs and Fisheries, Nusa Cendana University, Kupang. The purpose of this study was to determine how many doses of Padina australis were effective in treating skin, gill and liver tissue damage of cantang grouper (Epinephelus fuscoguttatus lanceolatus) exposed to detergent. The method used is an experiment with a completely randomized design (CRD) with 3 treatments and 3 replications. The treatments used were control without detergent and Padina australis, 0.25g/l detergent and treatment with Padina australis with doses of 0.5%, 1% and 1.5%. The fish used was grouper cantang (Epinephelus fuscoguttatus lanceolatus) with a size of 8-9 cm. Treatment was done by soaking the fish for 10 minutes with the extract for 3 consecutive days. The fish were then fixed with 95% alcohol solution for further histology. The results showed that the administration of Padina autralis effect on changes in the histology of the skin, gill, and liver of cantang grouper. Changes that occur in the skin in the form of degeneration of vacuoles, in the gill lamellae hemorrhage occurs and the liver undergoes vacuole degeneration and necrosis. The best dose is found in the 1.5% treatment but it has not been effective in treating liver tissue.
Keywords: histology; Padina australis; Epinephelus fuscoguttatus lanceolatus; skin; gills; liver.
Abstrak
Padina australis memiliki senyawa bioaktif sebagai antimikrobia berupa fenol dan turunannya (flavonoid) yang dapat menghambat pertumbuhan bakteri yang menggangu fungsi membran sitoplasma serta dapat mencegah terjadinya pembusukan dan kerusakkan oleh mikroorgasnime. Penelitian ini telah dilaksanakan pada bulan Oktober sampai November 2022 di Fakultas Peternakan, Kelautan dan Perikanan Universitas Nusa Cendana Kupang. Tujuan dari penelitian ini adalah untuk mengetahui berapa dosis ekstrak Padina australis yang efektif dalam mengobati kerusakan jaringan kulit, insang dan hati ikan kerapu cantang (Epinephelus fuscoguttatus lanceolatus) yang terkena deterjen. Metode yang dipakai adalah eksperimen dengan Rancangan Acak Lengkap (RAL) dengan 3 perlakuan dan 3 ulangan. Perlakuan yang digunakan adalah kontrol tanpa pemberian deterjen dan ekstrak Padina australis, pemberian deterjen sebanyak 0,25g/l dan pengobatan dengan ekstrak Padina australis dengan dosis 0,5%, 1% dan 1,5%. Ikan yang digunakan adalah kerapu cantang (Epinephelus fuscoguttatus lanceolatus) dengan ukuran 8-9 cm. Pengobatan dilakukan dengan cara merendam ikan 10 menit dengan ekstrak selama 3 hari berturut-turut. Ikan kemudian difiksasi dengan larutan Alkohol 95% untuk dihistologi lebih lanjut. Hasil penelitian menunjukkan bahwa pemberian ekstrak Padina autralis berpengaruh terhadap perubahan histologi kulit, insang dan hati ikan kerapu
cantang. Perubahan yang terjadi pada kulit berupa degenerasi vakuola, pada insang terjadi hemoragi lamella dan pada hati mengalami degenerasi vakuola dan nekrosis. Dosis terbaik terdapat pada perlakuan 1,5% namun belum efektif mengobati jaringan hati.
Kata Kunci: histologi; Padina australis; Epinephelus fuscoguttatus lanceolatus; kulit; insang; hati.
Ikan kerapu cantang (Epinephelus fuscoguttatus lanceolatus) merupakan jenis ikan konsumsi yang saat ini digemari oleh masyarakat dan memiliki nilai ekonomis dengan harga jual Rp 110.000-120.000/kg (KKP, 2018). Dalam pemeliharaannya masih menemui beberapa kendala salah satunya pencemaran lingkungan yang berasal dari limbah masyarakat yang tinggal di pesisir pantai, contohnya deterjen. Masuknya deterjen secara terus-menerus kedalam perairan dapat menyebabkan terganggunya biota yang ada diperairan hingga dapat menyebabkan kematian (Taufik, 2006). Deterjen yang masuk ke perairan dengan konsentrasi yang tinggi dapat berpengaruh pada organ ikan dan dapat merusak sistem jaringan ikan. Untuk itu perlu dilakukannya pengobatan menggunakan tumbuhan alami yang dapat mengobati rusaknya jaringan yang disebabkan oleh deterjen (Taufik, 2006).
Upaya organisme memperbaiki jaringan yang rusak menjadi nomal kembali sehingga dapat beraktivitas dan menjalankan fungsi seperti semula disebut sebagai regenerasi jaringan. Penyembuhan luka merupakan tahap pertama proses regenerasi, dimana tahapan ini menentukan keberhasilan proses regenerasi jaringan (Novianti, 2022). Namun tidak semua proses penyembuhan luka dapat berhasil dengan baik secara alami, sehingga diperlukan tindakan pengobatan untuk mempercepat proses penyembuhan luka.
Makroalga P. australis sering digunakan sebagai obat untuk ikan yang terserang bakteri karena tumbuhan ini memiliki senyawa bioaktif sebagai antimikrobia yaitu senyawa fenol dan turunannya (flavonoid) yang dapat menghambat tumbuh kembangnya bakteri yang menggangu fungsi membran sitoplasma (Kumar et al., 2013). Pada penelitian ini memanfaatkan makroalga Padina australis untuk melihat apakah ekstrak Padina australis mampu memperbaiki kerusakan jaringan ikan kerapu cantang (Epinephelus fuscoguttatus lanceolatus) yang diakibatkan oleh deterjen.
Penelitian ini dilakukan pada bulan Oktober sampai November 2022 di Fakultas Peternakan, Kelautan dan Perikanan Universitas Nusa Cendana Kupang.
-
2.2 Metode Penelitian
Metode yang digunakan dalam penelitian ini adalah metode eksperimen Rancangan Acak Lengkap (RAL) dengan 3 perlakuan dan 3 ulangan. Berikut gambaran perlakuan yang diberikan:
Perlakuan K: Kontrol (tanpa pemberian deterjen dan ekstrak Padina australis)
Perlakuan A: 0,5% ekstrak Padina australis
Perlakuan B: 1% ekstrak Padina australis
Perlakuan C: 1,5% ekstrak Padina australis
-
2.3 Prosedur Penelitian
-
2.3.1. Pemeliharaan Ikan
-
Proses pemeliharaan ikan kerapu cantang selama penelitian akan ditampilkan pada gambar berikut ini.
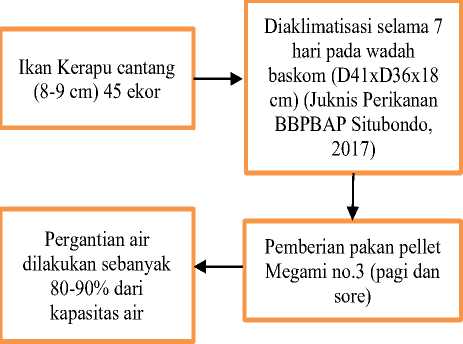
Gambar 1. Diagram Pemeliharaan Ikan Uji
Setelah masa pemeliharaan selesai, ikan kerapu cantang akan langsung diberi perlakuan yang telah disiapkan.
-
2.3.2. Pembuatan Ekstrak Padina australis
Padina australis diambil langsung dari laut lalu dicuci bersih dan dikeringkan dengan cara diangin-anginkan pada suhu ruangan. Setelah kering Padina australis akan dihaluskan menggunakan blender untuk dilakukannya maserasi. Maserasi dilakukan dengan cara merendam simplisia Padina asutralis yang telah dihaluskan dengan pelarut Alkohol 95% dengan perbandingan 1:2, yaitu 600 gr simplisia P. australis direndam dengan 2 L Alkohol 95%. Wadah penyimpanan ditutup rapat dengan tujuan pelarut tidak mengalami proses penguapan. Proses maserasi dilakukan selama 24 jam. Setelah didiamkan selama 24 jam sampel disaring menggunakan kertas saring untuk memperoleh filtrat dan residu (Alif dkk., 2021). Selanjutnya akan dilakukan kembali remaserasi (perendaman kembali menggunakan pelarut dengan cara yang sama) terhadap residu sebanyak 3 kali pengulangan. setelah didapat filtrat selama 3 pengulangan akan dilakukannya proses evaporasi untuk didapat ekstrak kental dari P. australis.
-
2.3.3. Pemberian Detergen dan Ekstrak Padina australis
Setelah masa aklimatisasi berakhir, ikan akan
diberi deterjen sebanyak 0,25gr/l. Selanjutnya akan diamati selama 3 hari untuk melihat gejala klinis dan morfologi ikan. Setelah masa pemaparan selesai, ikan akan diambil secara acak untuk dilakukan pengamatan kondisi kulit, insang dan hati.
-
2.3.4. Pengukuran Kualitas Air
Parameter kualitas air yang diukur selama masa penelitian adalah suhu, salinitas, pH, DO dan TAN. Pengukuran kualitas air dilakukan sebelum dan sesudah perlakuan dengan deterjen.
-
2.4 Analisis Data
Data diambil dengan melihat perubahan yang terdapat pada kulit, insang dan hati ikan kerapu cantang yang disajikan dalam bentuk tabel dan gambar. Selanjutnya akan dianalisis secara deskriptif.
Gejala klinis ikan kerapu cantang pada perlakuan kontrol tidak mengalami perubahan yaitu warna tubuh normal, pergerakan aktif, nafsu makan baik, tidak terdapat lendir pada wadah dan tidak memiliki luka pada tubuh (KKP, 2018). Pada pemberian deterjen sebanyak 0,25 gr/l ikan
a




Gambar 2. Morfologi ikan kerapu cantang pada setiap perlakuan. Keterangan: a. Ikan normal (o: Operkulum normal, tidak ada luka, warna tubuh normal), b. Terpapar deterjen (o: terdapat luka pada operkulum, badan dan perut), c. Pemberian P. australis 0,5% (o: operkulum mengalami perubahan warna, warna tubuh tampak normal), d. Pemberian P. australis 1% (o: operkulum dan pangkal ekor mengalami proses pengembalian warna), e. Pemberian P. australis 1,5% (kulit kembali normal dan tidak ada luka).
mengalami luka pada bagian kepala, punggung dan perut, tidak memiliki nafsu makan, peroduksi lendir berlebih dan warna tubuh pucat. Pemberian ekstrak P. australis dengan dosis 0,5% belum adanya nafsu makan, produksi lendir berkurang, warna tubuh tampak normal dan masih minimnya pergerakkan. Sedangkan pada pemberian ekstrak P. australis dengan dosis 1% dan 1,5% memiliki persamaan perubahan yaitu ikan sudah cepat merespon makan, tidak adanya lendir pada wadah, tidak ada luka pada tubuh dan pergerakan kembali lincah. Gambaran morfologi ikan kerapu cantang setelah diberi perlakuan dapat dilihat pada Gambar 1.
Gambaran normal ikan kerapu cantang normal ditandai dengan struktur tubuh yang terdapat luka dan warna pada tubuh normal (100%). Pada pemberian deterjen sebanyak 0,25gr/l morfologi tubuh ikan mengalami luka pada operkulum, badan dan perut serta warna tubuh yang pucat (50%). Setelah diberi perendaman menggunakan P. australis 0,5% tubuh ikan mengalami proses penyembuuhan dimana warna tubuh mulai kembali normal (60%). Hal ini juga terjadi pada pemberian P. australis dengan dosis 1% yaitu kembalinya warna tubuh ikan ke normal (75%) dan pada pemberian P. australis dosis 1,5% tubuh ikan kembali pada kondisi normal dimana tidak terdapat luka dan warna tubuh kembali normal (98%).
-
3.2 Histologi Kulit Ikan Kerapu Cantang
Kulit merupakan lapisan terluar yang menyelimuti tubuh ikan yaitu sebagai tempat pertama yang memberi tempat perlindungan terhadap gesekkan serta untuk beradaptasi terhadap lingkungannya (Mardiyastoeti, 2001). Karena kulit berada paling luar tubuh maka organ ini yang bersentuhan langsung dengan lingkungan diluar tubuh. oleh sebab itu, jaringan kulit bisa mengalami perubahan jika lingkungan disekitar ikan mengalami perubahan seperti terjadinya pencemaran lingkungan. Jaringan kulit yang normal terdiri dari beberapa lapisan yaitu epidermis pada bagian luar yang selalu mengeluarkan lendir sebagai pertahanan tubuhnya dan lapisan dermis bagian dalam yang terdapat pembuluh darah, saraf dan jaringan pengikat (Burhanuddin, 2016).
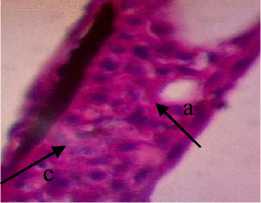
Berdasarkan dari hasil pengamatan histopatologi kulit ikan kerapu cantang yang diberi deterjen 0,25gr/l menunjukkan adanya perubahan yaitu mengalami degenerasi vakuola. Degenerasi vakuoa pada kulit ditandai dengan vakuola yang membesar pada sitoplasma (Chusniati dkk., 2006). Jika dilihat pada Gambar 1, nampak ruang-ruang kosong pada sitoplasma.
Pada pemberian ekstrak P. australis dengan dosis 0,5% dan 1% struktur jaringan kulit tidak mengalami perubahan yaitu masih mengalami degenerasi vakuola sedangkan pada pemberian
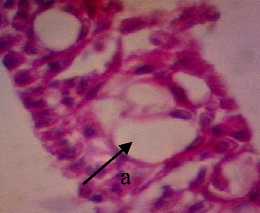
D
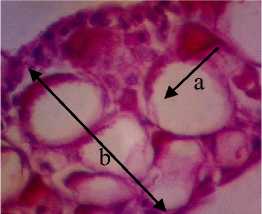
P1
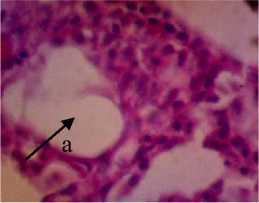
P2
P3
Gambar 3. Struktur Jaringan Kulit Ikan Kerapu Cantang (Epinephelus fuscoguttatus lanceolatus). Keterangan: D: Degenerasi Vakuola (a) (400x), P1: Degenerasi Vakuola (a) dan Hiperplasia (b) (400x), P2: Degenerasi Vakuola (a) (400x), P3: Degenerasi Vakuola (a) dan Sel Radang (c) (400x).
dengan dosis 1,5% mengalami perubahan yaitu ukuran vakuola pada jaringan berkurang dan terjadi infiltrasi atau peradangan. Herdiani dan Putri (2018) menyatakan bahwa peradangan berfungsi untuk menghancurkan atau membatasi agen yang merugikan lalu memulihkan dan mengganti jaringan yang rusak.
-
3.3 Histologi Insang Ikan Kerapu Cantang
Insang merupakan alat pernapasan ikan yang berfungsi sebagai tempat pertukaran oksigen dan karbon dioksida didalam air. pada insang ikan terdapat filamen yang terdiri atas banyaknya lamella yang berfungsi sebagai tempat pertukaran gas (Riauwaty, 2012). Insang sebagai organ vital pada ikan memiliki sensitivitas yang tinggi terhadap racun diperairan sebab masuknya zat toksik pada perairan mampu membuat insang ikan menjadi terganggu fungsi kerjanya.
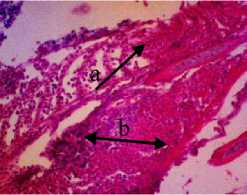
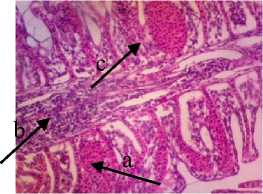
Gambaran histologi insang yang normal terdiri dari beberapa filamen insang dan banyaknya lamella. Struktur lamella terdiri dari sel-sel epitel yang tipis pada bagian luar, membran dasar dan sel tiang untuk penyangga pada bagian dalam yang biasa disebut sebagai lamella primer dan lamella sekunder (Riauwaty, 2012). Dari hasil pengamatan histologi didapati terjadinya
perubahan pada struktur lamella ketika diberi deterjen sebanyak 0,25 gr/l yaitu terjadinya hemoragi dan infiltrasi pada lamella sekunder hingga rusaknya struktur lamella. Menurut Kuniasih (1999), hemoragi yang terjadi pada lamella sekunder disebabkan oleh deterjen yang mengalami kontak langsung pada saat respirasi.
Pengamatan histologi jaringan insang ikan kerapu cantang ketika diberi ekstrak P. australis dengan dosis 0,5% terjadinya peradangan pada lamella primer, congesti dan hemoragi pada lamella sekunder. Sedangkan pada pemberian dosis 1% dan 1,5% terjadi perubahan signifikan yaitu kembalinya struktur lamella primer dan lamella sekunder. Pada gambar 2 terlihat susunan lamella primer dan lamella sekunder kembali normal meskipun masih terjadi congesti, adesi dan hemoragi pada lamella primer dan sekunder. Hal ini membuktikan bahwa P. australis dengan dosis dari 1,5% mampu memperbaiki struktur lamella yang rusak oleh deterjen.
-
3.4 Histologi Hati Ikan Kerapu Cantang
Hati merupakan organ yang berperan sebagai penetral racun yang masuk ke dalam tubuh. Hati berwarna merah kecoklatan yang tersusun oleh sel-sel hati (hepatosit) (Riauwaty, 2012). Perubahan
D
P1
P2
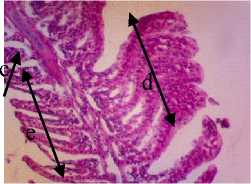
P3
Gambar 4. Struktur Jaringan Insang Ikan Kerapu Cantang (Epinephelus fuscoguttatus lanceolatus). Keterangan: D: Hemoragi Lamella (a) dan Sel Radang (b) (100x), P1: Congesti Lamella Sekunder (c), Sel Radang Lamella Primer (b) dan Hemoragi Lamella Sekunder (a) (100x), P2: Congesti Lamella Primer (c) dan Adesi (d) dan Hemoragi Lamella Sekunder (a) (100x), P3: Congesti Lamella Primer (c), Adesi Lamella Sekunder (d) dan Lamella Sekunder Normal (e) (100x).
lingkungan perairan yang ekstrem dapat mengakibatkan terganggunya fungsi hati. Lu (1995) mengatakan organ hati sangat rentan terhadap pengaruh zat kimia yang masuk ke dalam tubuh dan menjadi sasaran utama dari zat beracun. Hal ini terjadi akibat hati dilewati oleh darah yang membawa polutan untuk dibawa ke seluruh tubuh (Permana, 2009).
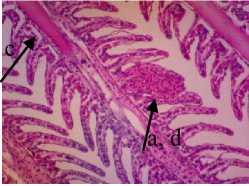
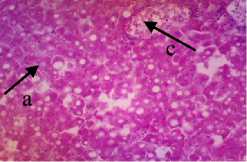
Struktur jaringan hati normal ditandai dengan adanya vena sentralis, hepatosit (sel-sel hati), inti sel dan sinusoid pada komposisi lobulus hati. Jaringan hati normal akan terlihat sel hati yang bulat dan penampakkan sinusoid yang jelas (Riauwaty, 2012). Berdasarkan dari hasil pengamatan jaringan hati ikan kerapu cantang yang diberi deterjen 0,25 gr/l mengalami degenerasi vakuola. Degenerasi vakuola dapat diketahui dengan penampakan ruang-ruang kosong didalam sitoplasma dari sel dengan vakuola terlihat membesar yang membuat nukleus terdesak ke tepi sel (Triadayani dkk., 2010). Pengamatan struktur jaringan hati yang diberi ekstrak P. australis dengan dosis 0,5%, 1% dan 1,5% tidak mengalami perubahan yaitu masih terjadinya degenerasi vakuola. Pada dosis 1% ditemukan sel yang mengalami nekrosis atau kematian sel (Lu, 1995). Hal ini diduga kandungan senyawa pada ekstrak dalam dosis yang tinggi dapat menyebabkan munculnya sifat anti nutrien dan toksik pada ikan.
Winarsih dkk. (2012) menyatakan jika paparan zat toksik pada sel berlangsung cukup lama dapat menyebabkan kematian sel/nekrosis. Flavonoid
pada P. autralis juga dapat menjadi penyebab terjadinya sel mengalami hemoragi dan nekrosis jika digunakan pada dosis yang berlebih (Alif et al., 2021). Sedangkan pada gambaran histologi hati dengan dosis 1,5% menunjukkan adanya congesti pada jaringan hati. Congesti adalah Pendarahan pada jaringan akibat serangan patologik yang ditandai dengan jaringan berwarna merah tua hingga ungu (Sirinukunwattana et al., 2015). Congesti terjadi akibat keluarnya darah dari pembuluh darah atau hemoragi sehingga menyebabkan pembuluh darah menjadi rusak (Andayani dkk. 2018). Kematian sel atau nekrosis terjadi pada jaringan hati yang diberi pengobatan dengan dosis 1%, sedangkan pada pemberian dosis 1,5% sel tidak mengalami nekrosis. Hal ini diduga pada setiap ikan memiliki pertahanan tubuh yang berbeda-beda begitu pula dengan organnya. Nekrosis yang terjadi pada perlakuan P2 (1%) diduga diakibatkan oleh berbagai macam faktor seperti yang dikatakan Alif dkk. (2021) yaitu seperti faktor lingkungan, patogen, makanan serta zat lain yang masuk ke dalam tubuh ikan.
-
3.5 Kualitas Air
Kualitas air sangat berperan penting dalam proses pemeliharaan ikan budidaya. Hal ini dilakukan agar tetap menjaga kondisi lingkungan perairan tetap dalam batas toleransi ikan yang dipelihara juga untuk meningkatkan sistem imun ikan uji sebelum diberi perlakuan. Parameter yang diukur pada penelitian ini meliputi suhu, salinitas, DO,
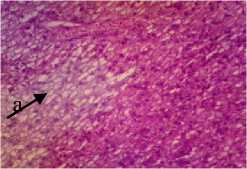
D
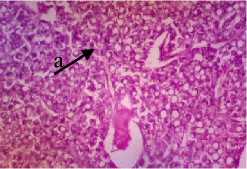
P1
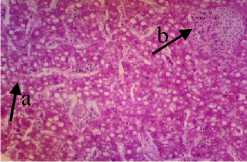
P2
P3
Gambar 5. Struktur Jaringan Hati Ikan Kerapu Cantang (Epinephelus fuscoguttatus x Epinephelus lanceolatus) Keterangan: D: Degenerasi Vakuola (a) (100x), P1: Degenerasi Vakuola (a) (100x), P2: Degenerasi Vakuola (a) dan Nekrosis Sel Hati (b) (100x), P3: Degenerasi Vakuola (a) dan Congesti (c) (100x)
Tabel 1
Alternatif Lokasi Pelabuhan [masukan Tabel disini bila terlalu besar dan tidak mencukupi untuk 1 kolom] Parameter Awal Pemeliharaan Akhir Baku Mutu
Pemeliharaan (SNI. 8036.2:2014)
|
Suhu |
26oC - 28oC |
29C - 30C |
28C - 32C |
|
Salinitas |
32 ppt |
30 ppt - 31 ppt |
24 ppt - 33 ppt |
|
pH |
7,1 - 7,5 |
7,0 |
7,5 - 8,5 |
|
DO (Oksigen Terlarut) |
4,9 mg/l - 4,3 mg/l |
6,7 mg/l - 6,8 mg/l |
Minimal 4 mg/l |
|
TAN |
0,0096 mg/l |
0,0080mg/l |
Maksimal 0,01 mg/l |
pH dan TAN (Total Amonia Nitrogen). Pengukuran kualitas air dilakukan sebelum dan sesudah diberikannya deterjen. Data pengukuran kualitas air dapat dilihat pada Tabel 1.
Pengukuran kualitas dari disesuaikan berdasarkan (KKP, 2018). Data pada awal pemeliharaan sesuai dengan baku mutu yaitu suhu 26 oC - 28oC, salinitas 32 ppt, pH 7,1 - 7,5, DO 4,9 mg/l - 4,3 mg/l dan TAN 0,0096 mg/l. Pada akhir pemeliharaan suhu, salinitas, pH dan TAN masih dalam batas baku mutu sedangkan DO melebih batas normal yaitu 6,7 mg/l - 6,8 mg/l. Hal ini diduga karena busa-busa yang dihasilkan oleh deterjen. Busa yang dihasilkan deterjen dapat menyebabkan ketidak nyamanan ikan yang dipelihara sebab mengganggu proses respirasi sehingga mengganggu setiap fungsi organ pada ikan. Sejalan dengan pernyataan Taufik (2006) yaitu busa pada deterjen mengganggu pertukaran oksigen dari udara kedalam perairan yang secara tidak langsung dapat mengganggu kehidupan ikan yang dipelihara dan dapat mengakibatkan kematian pada ikan.
Pemberian deterjen sebanyak 0,25 gr/l menyebabkan terjadinya perubahan pada struktur jaringan kulit, insang dan hati ikan kerapu cantang yaitu degenerasi vakuola pada kulit dan hati serta hemoragi pada lamella insang. Pemberian ekstrak P. australis dengan dosis 1,5% dapat mengurangi kerusakan jaringan kulit dan insang.
Ucapan terimakasih
Ucapan terima kasih disampaikan kepada seluruh dosen Program Studi Budidaya Perairan Universitas Nusa Cendana Kupang dan teman-teman yang membantu dalam proses penelitian dan penulisan jurnal.
Daftar Pustaka
Alif, A., Syawal, H., & Riauwaty, M. (2021).
Histopatologi hati dan usus ikan jambal siam (Pangasionodon hypophthalmus) yang diberi pakan mengandung ekstrak daun Rhizophora apiculata. Jurnal Ilmu Perairan, 9(2), 152-161.
Andayani, S., Heny, S., & Ifatul, M. (2018). Pengaruh pemberian ekstrak kasar kulit buah naga (Hylocereus costaricensis) terhadap histopatologi hati ikan nila (Oreochromis niloticus) yang Terinfeksi Aeromonas
hydrophila. Journal of Fisheries and Marine Research, 3(2), 149-296.
Burhanuddin, A. I. (2016). Ikhtiologi, ikan dan segala aspek kehidupannya. Yogyakarta, Indonesia: Deepublish.
Chusniati, S., Huda, U., Yuharni, V., & Suwanti, L. T. (2006). Pengaruh pemberian biji pepaya (Carica papaya) terhadap gambaran histopatologi hepar ayam yang diinfeksi telur cacing Ascaridia galli. Journal of Poultry Science, 1(1), 32-35.
Herdiani, N., & Putri, B. P. (2018). Gambaran
histopatologi paru tikus wistar setelah diberi paparan asap rokok. Medical and Health Science Journal 2(2), 714.
KKP. (2018). Kementerian Kelautan dan Perikanan. Satu Data. [online]. Tersedia di:
https://kkp.go.id/djpb/artikel/304-kkp-tegaskan-kinerja-neraca-perdagangan-ikan-kerapu-positif, [diakese: 10 Oktober 2020].
KKP. (2018). SNI Benih Kerapu Macan. Jakarta, Indonesia: Kementerian Kelautan dan Perikanan.
Kurniasih. (1999). Deskripsi histopatologi dari beberapa penyakit ikan. Laboratorium Patologi Fakultas Kedoktean Hewan. UGM. Yogyakarta.
Kumar, S. R., Hosokawa, M., & Miyashita, K. (2013). Fucoxanthin: A marine carotenoid exerting anticancer effects by affecting multiple mechanisms. Marine Drugs, 11, 51305147.
Lu, C. F. (1995). Toksikologi dasar. (2nd ed.). Jakarta,
Indonesia: Univesitas Indonesia.
Mardiyastoeti, R. D. (2001). Pengaruh deterjen terhadap struktur kulit dan insang ikan tawes (Puntius javanicus Blkr). Skripsi. Yogyakarta, Indonesia: Fakultas Biologi, Universitas Atma Jaya Yogyakarta.
Novianti, T. (2022) Dinamika Ekspresi Gen pada Proses Regenerasi Jaringan. (1st ed.). Jakarta, Indonesia:
Intan Cendekia Mandiri.
Permana, R. (2009). Studi histopatologi pada ikan arwana super red Scleropages formosus. Skripsi. Bogor, Indonesia: Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Riauwaty, M. (2012). Histopatologi hati dan ginjal ikan patin (Pangasius hypopthalmus) yang terinfeksi Aeromonas hydrophila dan diobati dengan temulawak (Curcuma xanthorrhiza ROXB). Laporan Penelitian. Pekanbaru, Indonesia: Fakultas Perikanan dan
Kelautan, Universitas Riau.
Sirinukunwattana, K., Khan, A. M., & Rajpoot, N. M. (2015). Cell words: Modelling the visual appearance
of cells in histopathology images. Computerized Medical Imaging and Graphics, 42, 16–24.
Taufik, I. (2006). Pencemaran deterjen dalam perairan dan dampaknya terhadap organisme air. Media Akuakultur, 1(1), 25-32.
Triadayani, A. E., Aryawaty, R., & Diansyah, G. (2010). Pengaruh logam timbal (Pb) terhadap jaringan hati ikan kerapu bebek (Cromileptes altivelis). Maspari Journal, 1(1), 42-47.
Winarsih, W., Wientarsih, I., Sulistyawati, N. P., &
Wahyudina, I. (2012). Uji toksisitas akut ekstrak rimpang kunyit pada mencit: kajian histopatologis lambung, hati dan ginjal. Jurnal Veteriner, 13(4), 402409.
© 2022 by the authors; licensee Udayana University, Indonesia. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution license (http://creativecommons.org/licenses/by/3.0/).
J. Mar. Aquat. Sci. 8(2): 303-310 (2022)
Discussion and feedback