Simpanan Karbon pada Padang Lamun di Perairan Tanjung Benoa, Bali
on
Journal of Marine and Aquatic Sciences 6(1), 13-21 (2020)
Simpanan Karbon pada Padang Lamun di Perairan Tanjung Benoa, Bali
I Komang Agus Parnata a*, I Dewa Nyoman Nurweda Putra a, Gede Surya Indrawan a
a ProgramaStudi Ilmu Kelautan, Fakultas Kelautan dan Perikanan, Kampus UNUD Bukit Jimbaran, Bali 80361, Indonesia
*Penulis koresponden. Tel.: +62-898-632-8360
Alamat e-mail: kmagusparnata@gmail.com
Diterima (received) 10 November 2019; disetujui (accepted) 21 Agustus 2020; tersedia secara online (available online) 26 Agustus 2020
Abstract
Human activities are the biggest contributor to carbon dioxide (CO2) gas into the air. Coastal ecosystems that have the ability to absorb and store carbon over a relatively long period of time are seagrass beds. Seagrass is able to absorb carbon with an average of 0.21 tons / ha. Research on Carbon Deposits in Seagrass in Tanjung Benoa Waters, Bali was conducted in February 2019. Determination of the sampling point was done by purposive sampling method. This research uses the dry ashing method which is carried out by crushing the sample components at 500˚C in an electric furnace. Seagrass species obtained in Tanjung Benoa waters are Cymodocea Serrulata, Cymodocea Rotundata, Thalassia hemprichii, Syringodium isoetifolium, Halodule pinifolia, Halophila ovalis and Halodule uninevis. The results showed the seagrass density of Tanjung Benoa waters, Bali was included in the sparse to dense category with density values ranging from 195-1252 stands / m2. The content of seagrass carbon at the bottom of the substrate (roots and rhizoma) is 86.421 grams of dry weight (gbk / m2), while the top of the substrate (leaves) is 33.774 grams of dry weight (gbk / m2). The carbon content at the bottom of the substrate is higher than the top of the substrate because at the bottom of the substrate is not too affected by environmental physical factors. where the highest carbon content is Cymodocea Rotundata seagrass with a value of 625.36 gC / m², while the lowest carbon content is Syringodium isoetifolium with a value of 89.91 gC / m².
Keywords: seagrass; coastal ecosystem; CO2 ; Tanjung Benoa
Abstrak
Penyumbang gas karbon dioksida (CO2) terbanyak ke udara adalah dari berbagai aktivitas manusia. Ekosistem pesisir mempunyai kemampuan untuk menyerap dan meyimpan karbon dalam rentang waktu yang relatif lama yakni padang lamun. Ekosistem padangalamun dapat menyerap karbon sampai rata-rata 0,21 ton/ha. Penelitian mengenai simpananakarbon pada padang lamun di Perairan Tanjung Benoa, Bali telah dilakukan pada bulan februari 2019. Penentuan titik pengambilan sampel dilakukan dengan metode purposive sampling. Penelitian menggunakan metode yakni pengabuan kering yang dilakukan dengan menghancurkan komponen sampel pada suhu 500˚C di dalam tanur listrik. Jenis lamun yang didapat di perairan Tanjung Benoa yaituaCymodocea Serrulata, Cymodocea Rotundata, Thalassia hemprichii, Syringodium isoetifolium, Halodule pinifolia, Halophila ovalis dan Halodule uninervis. Hasil penelitian menunjukkan kerapatan lamun perairan Tanjung Benoa, Bali termasuk dalam kategori jarang hingga rapat dengan nilai kerapatan berkisar antara 195 – 1.252 tegakan/m2. Kandungan karbon lamun pada bagian bawah substrat (akar dan rhizoma) sebesar 86,421 gram berat kering (gbk/m2), sedangkan bagian atas substrat (daun) 33,774 gram berat kering (gbk/m2). Bagian bawah substrat memiliki kandungan karbon lebih tinggi daripada bagian atas substrat dikarenakan pada bagian bawah substrat tidak terlalu mendapatkan pengaruh faktor fisik lingkungan, dimana kandungan karbon tertinggi yaitu jenis lamun Cymodocea rotundata dengan nilai 625,36 gC/m², sedangkan kandungan karbon terendah yaitu Syringodium isoetifolium dengan nilai sebesar 89,91 gC/m².
Kata Kunci: lamun; ekosistem pesisir; CO2;Tanjung Benoa
Industri di Indonesia telah berkembang dan berpotensi meningkatkan perekonomian di berbagai daerah, dampak negatif yang dapat terjadi dari perkembangan industri adalah meningkatnya emisi gas rumah kaca (Indriani dkk., 2017). Gas CO2 merupakan Emisi gas rumah kaca yang paling besar. Akumulasi gas rumah kaca tersebut mengakibatkan pemanasan global dan perubahan iklim yang memiliki dampak pada perubahan pola cuaca, ketahanan pangan dan kesejahteraan manusia. Aspek penting dalam mitigasi perubahan iklim ialah memelihara dan mengembangkan kemampuan hutan dan lautan guna menyerap serta menyimpan karbon (Rahmawati, 2011).
Pemanfaatan hutan sebagai upaya mitigasi telah banyak dilakukan, sedangkan penerapan fungsi lautan belum terlihat secara signifikan. Ekosistem pesisir dan laut memiliki peran besar di suatu siklus karbon global, sekitar 93% CO2 di bumi disirkulasikan dan disimpan di dalam lautan Rahmawati (2011). Ekosistem laut mampu menyimpan karbon dengan jumlah yang banyak serta dalam jangka waktu relatif lebih lama dibandingkan ekosistem lainnya Rahmawati (2011). Ekosistem pesisir memiliki kemampuan menyerap dan meyimpan karbon dalam waktu yang relatif
lama salah satunya adalah ekosistem padang lamun (Graha dkk., 2016).
Karbon diserap padang lamun sampai rata-rata 0,21 ton/ha (Graha dkk., 2016). Menurut Rahadiarta dkk. (2018), penyerapan ekosistem lamun sebesar 1.15 ton/ha, dengan kandungan karbon di bawah substrat sebesar 0.88 ton/ha (76.3%), lebih tinggi dibanding karbon di atas substrat yang hanya 0.27 ton/ha (23,7%). Bagian bawah substrat merupakan potensi yang dimana simpanan karbon pada padang lamun memiliki peluang tersimpan lebih lama serta terus bertambah bila ekosistem lamun terjaga dari kerusakan, sementara bagian atas substrat lebih banyak termanfaatkan dalam suatu rantai makanan (Rustam dkk., 2014).
Salah satu lokasi yang memiliki komunitas lamun melimpah adalah daerah Tanjung Benoa. Lamun didaerah ini menyebar di sepanjang pantai bagian Timur kawasan ini dikenal sebagai daerah wisata yang memiliki berbagai aktifitas wisata mulai dari aktifitas pinggir pantai seperti berenang, mandi maupun aktifitas water sports (Faiqoh dan Atmaja, 2015).
Penelitian mengenai stok karbon pada lamun telah dilakukan oleh Graha dkk. (2016), di kawasan pantai sanur dan Rahadiarta dkk. (2018), di Pantai Mengiat Nusa Dua, Bali. Sedangkan penelitian mengenai lamun di kawasan Tanjung
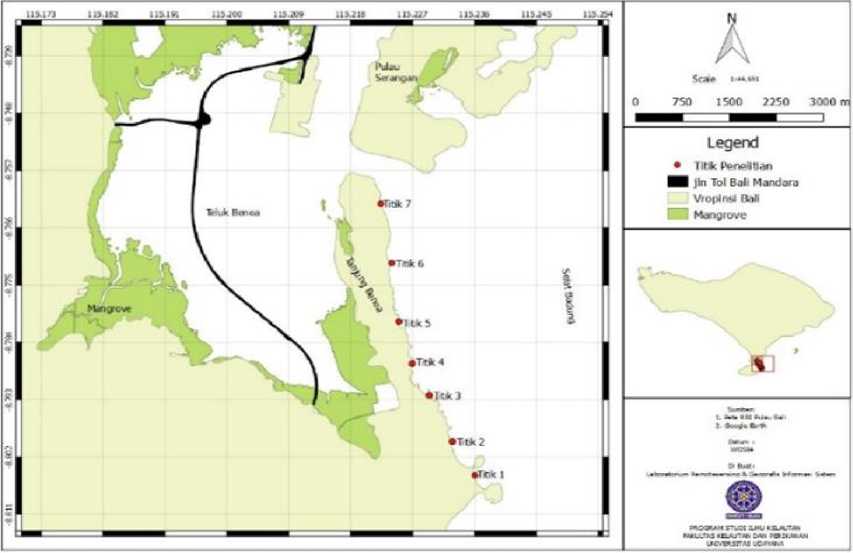
Gambar 1. Lokasi penelitian Tanjung Benoa, Bali
Benoa telah dilakukan oleh Santoso dkk. (2018), namun hanya melihat produktivitas lamun Thalassia hemprichii. Mengingat pentingnya lamun dalam mendukung penyerapan karbon di alam dan di Pulau Bali khususnya, maka diperlukan penelitian yang menghasilkan data kuantitatif tentang seberapa penyerapan karbon dengan pendekatan biomassa maka dilakukan penelitian ini guna mengetahui simpanan stok karbon pada setiap jenis lamun yang berada di perairan Tanjung Benoa, Sebagai data awal dan landasan pengelolaan lingkungan dengan tepat, sehingga dapat menjamin keberadaan ekosistem padang lamun secara berkelanjutan di suatu daerah.
Penelitian ini dilaksanakan pada bulan Februari 2019 yang berlokasi di perairan Tanjung Benoa Bali (Gambar 1). Penentuan titik stasiun pengamatan dilakukan secara purposive sampling yang dibagi menjadi 7 titik dan berpatokan pada kerapatan lamun yang dianggap bisa mewakili keadaan perairan tersebut. Analisis sampel dilakukan di Laboratorium Tanah Fakultas Teknologi Pertanian dan Laboratorium Ilmu Kelautan Fakultas Kelautan dan Perikanan Universitas Udayana.
-
2.2 Alat dan Bahan
Objek yang diamati pada penelitian ini adalah tumbuhan lamun perairan Tanjung Benoa, Bali. Alat yang digunakan pada penelitian ini adalah transek kuadrat untuk mengamati ekosistem lamun, thermometer untuk mengukur suhu, refractometer untuk mengukur salinitas, pH meter untuk mengukur tingkat derajat keasaman perairan, DO meter untuk mengukur oksigen terlarut, oven dan tanur listrik untuk analisis biomassa lamun serta GPS untuk menentukan titik lokasi penelitian.
-
2.3 Pengambilan Sampel di Lapangan
-
2.3.1. Kerapatan lamun
-
Kerapatan lamun didapatkan berdasarkan Buku Panduan Monitoring Padang Lamun 2014 yaitu dengan menghitung tegakan lamun tiap jenis pada transek kuadrat berukuran 1 m x 1 m2. Untuk
memudahkan pengamatan transek dibagi menjadi 25 sub petak yang berukuran 20 cm x 20 cm (Gambar 2). Pengamatan dilakukan pada saat perairan Tanjung Benoa mengalami surut, hal ini dilakukan untuk memudahkan proses penghitungan kerapatan sampel lamun.

Gambar 2. Transek Kuadrat
-
2.3.2. Pengambilan sampel biomassa lamun
Pengambilan sampel lamun untuk menentukan biomassa mengacu pada Rahadiarta dkk., (2018). Pengambilan sampel lamun dilakukan dengan pengambilan pada 5 sub kotak yang berada pada setiap pojok transek dan bagian tengah transek, yang dimana untuk luasan transek dari ke 5 sub petak berukuran 0,2 m2. Hal tersebut dilakukan untuk menjaga kelestarian lamun di Tanjung Benoa, Bali. Sampel diambil dengan menggunakan centok sampai kedalaman penetrasi akar.
Rhizoma yang menjalar ke samping (transek) dipotong dengan menggunakan centok untuk mempermudah pengambilan. Sampel yang sudah didapat dimasukkan ke kantong sampel kemudian dibersihkan dari kotoran seperti substrat dan dibedakan perjenisnya.
-
2.4 Analisis Sampel di Laboratorium
-
2.4.1. Biomassa Lamun
-
Biomassa dihtung dengan mengambl tegakan sampel lamun dari tiap jenis yang terdapat di dalam transek. Lamun yang di ambil harus memiliki kebutuhan sampel dalam pengujian laboratorium dengan berat kering sampel 1 - 2 gram dan untuk nilai biomassa lamun di bagi menjadi tiga bagian yakni daun, rhizoma dan akar.
Lamun dibersihkan dari epifit kemudian di identifikasi per jenis - jenis lamun dan dihitung jumlah tegakannya. Satukan semua sampel lamun menurut per jenisnya pada setiap titik. Lamun dikeringkan dan dipisahkan antara daun, rhizoma dan akar lalu di timbang kemudian dimasukan ke dalam aluminium foil. Sampel lamun kemudian dikeringkan pada suhu ruangan, lalu setelah cukup kering dimasukkan ke wadah berupa kertas. Semua sampel lamun dikeringkan dalam oven dengan suhu 60°C selama 24 jam, kemudian ditimbang guna mengetahui berat kering menggunakan neraca analitik.
-
2.4.2. Kandungan Karbon
Menurut Helrich (1990), penghitungan nilai untuk kandungan karbon lamun perbagian (daun, Rhizoma dan akar) dianalisis menggunakan metode pengabuan yaitu oven sampel terlebih dahulu kedalam dry oven selama 2 jam lalu dimasukannya sampel ke dalam tanur listrik selama kurang lebih 3 hingga 6 jam pada suhu 500°C. Metode pengabuan memiliki tujuan oksidasi dari semua zat organik pada suhu tinggi, kemudian dilakukan penimbangan zat yang tertinggal setelah proses pembakaran. Sterilkan cawan porselin dengan menggunakan tanur listrik selama 2 hingga 3 jam pada suhu 500°C. Cawan di masukan ke dalam desikator selama 30 menit ini sebagai cawan kosong. Sampel yang sudah kering dimasukan ke dalam cawan dicatat sebagai berat cawan dan berat sampel. Sampel di bakar dalam tanur listrik selama 3 hingga 6 jam pada suhu 500°C hingga menjadi abu yang ditandai dengan warna putih keabu - abuan. lalu sampel dalam desikator ditimbang sebagai berat cawan dan berat abu, kemudian sampel diambil guna memenuhi kebutuhan pengujian laboratorium akan konversi ke satuan satu meter persegi.
-
2.5 Analisis Data
-
2.5.1. Kerapatan Lamun
-
Persamaan yang dipakai untuk menghitung kerapatan lamun ditunjukkan oleh persamaan berikut (Ira dkk., 2013) :
ni
Di =∑ — (1)
Ai (1)
dimana Di adalah kerapatan jenis (tegakan/m2); ni adalah jumlah total tegakan spesies; dan Ai adalah luas daerah sampling (m2).
Skala yang dapat digunakan pada peneliti kali ini megacu pada kerapatan bisa diakategorikan menjadialima acuan guna mengambil sampel memakai transek kuadrat.
Tabel 1
Skala kondisi padang lamun berdasarkan kerapatan setiap titi sampling.
|
Skala |
Kerapatan (Tegakan/m2) |
Kondisi |
|
5 |
≥625 |
Sangat Rapat |
|
4 |
425 - 624 |
Rapat |
|
3 |
225 - 424 |
Agak rapat |
|
2 |
25 - 224 |
Jarang |
|
1 |
<25 |
Sagat jarang |
-
2.5.2. Biomassa lamun dan Kandungan Karbon
Biomassa lamun bisa dicari dengan menghitung berat kering dibagi per luasan area menggunakan persamaan berikut (Santoso dkk., 2018):
B = W / A
(2)
dimana B ialah biomassa lamun (gbk/m2); W ialah berat kering lamun (gbk); dan A ialah luas area transek (m2). Hasil dari perhitungan biomassa digunakan untuk perhitungan kadar abu dan kadar bahan organik menjadi berat sampel. Rumus yang dipakai guna menghitung kadar abu pada jaringan lamun dengan metode pengabuan dapat ditunjukkan oleh persamaan berikut (Huriawati dkk., 2016):
dimana a ialah berat cawan; b ialah berat cawan ditambah berat sampel; c ialah berat cawan ditambah berat abu. Guna menghitung bahan organik menggunakan metode pengabuan bisa ditentukan dengan menghitung pengurangan berat saat pengabuan sebagai berikut (Helrich, 1990):
kadar bahan organik = [(c—a)—(c—a)] *100% & (b — a)
(4)
setelah memeroleh hasil kadar bahan organik, kemudian menghtung kandungan karbon jaringan lamun menggunakan persamaan berikut (Helrich, 1990):
Bahanorganik kadar bahan organik = (5)
dimana 1,724 adalah Konstanta nilai bahan organik. Menurut Graha dkk. (2016), nilai hasil kandungan karbon diatas menunjukan rata-rata sebagai nilai kandungan karbon jaringan lamun.
Berdasarkan hasil pengamatan kerapatan jenis lamun dari ke tujuh (7) stasiun, dilihat pada Tabel 2. Nilai kerapatan lamun tertinggi terdapat pada titik 3 yaitu sebesar 1.252 tegakan/m2, sedangkan nilai total kerapatan terendah terdapat pada titik 7 yaitu sebesar 195 tegakan/m2. Kerapatan jenis lamun yang diperoleh pada Tanjung Benoa lebih tinggi jika dibandingkan dengan kerapatan lamun di perairan Pulau Serangan yang diperoleh Martha dkk. (2019), yaitu berkisar antara 4–777 tegakan/m2. Berdasarkan kategori kondisi kerapatan lamun Amran (2010), maka ekosistem lamun pada titik 3 termasuk dalam kondisi sangat rapat, sedangkan pada titik 7 temasuk dalam kondisi jarang. Rendahnya nilai kerapatan pada titik 7 diduga terjadi karena adanya aktivitas manusia seperti water sports dan kegiatan kapal nelayan. Kegiatan antropogenik di wilayah pesisir seperti aktifitas nelayan, berlabuhnya kapal-kapal kecil dan
rekreasi atau wisata pantai, baik itu langsung maupun secara tidak langsung juga dapat
mempengaruhi eksistensi di lamun.
Kerapatan jenis lamun Tanjung Benoa memiliki nilai yang beragam, diketahui untuk jenis lamun
Cymodocea Serrulata nilai kerapatan yaitu 115-275 tegakan/m2, Cymodocea Rotundata nilai kerapatan didapatkan 8-735 tegakan/m2, Thalassia hemprichii nilai kerapatan sebesar 32-100 tegakan/m2, lamun Syringodium isoetifolium mempunyai nilai kerapatan sebesar 341 tegakan/m2, Halodule pinifolia diketahui mempunyai nilai kerapatan sebesar 67 – 362 tegakan/m2, Halophila ovalis memiliki nilai kerapatan sebesar 56 -250 tegakan/m2 dan nilai kerapatan sebesar 34-120 tegakan/m2 terdapat pada jenis lamun Halodule uninervis. Kerapatan jenis lamun tertinggi terdapat pada spesies Cymodocea Rotundata, hal tersebut sesuai dengan pernyataan Wicaksono dkk. (2012), bahwa jenis Cymodocea Rotundata merupakan jenis lamun kosmopolit, yaitu dapat tumbuh hampir di semua kategori habitat. Kerapatan jenis terendah terdapat pada spesies Halophila ovalis. Rendahnya nilai kerapatan lamun spesies Halophila ovalis disebabkan karena spesies ini rentan terhadap kondisi arus (Setyawati dkk., 2014).
-
3.2 Biomassa Lamun
Berdasakan penelitian yang telah dilakukan didapatkan hasil (Gambar 3). jenis lamun yang memiliki biomassa tertinggi adalah Thalassia hemprichii dengan nilai sebesar 3199,5 (gbk/m2), Cymodocea Serrulata sebesar 2769,6 (gbk/m2), Cymodocea Rotundata 2624,9 (gbk/m2), Halodule uninervis 1460,9 (gbk/m2), Halodule pinifolia 1453,9 (gbk/m2), Syringodium isoetifolium 403,5 (gbk/m2), dan nilai biomassa terendah adalah jenis lamun Halophila ovalis dengan nilai biomassa sebesar 107,2 (gbk/m2).Tingginya nilai biomassa lamun Thalassia hemprichii dikarenakan morfologi lamun tersebut lebih besar dari jenis lamunnya, sedangkan rendahnya nilai biomassa lamun Halophila ovalis dikarenakan morfologi lamun jenis Halophila ovalis paling kecil dari jenis lainnya. Menurut Runtuboi
Tabel2
Kerapatan lamun di Perairan Tanjung Benoa berdasarkan (Amran, 2010)
|
Titik |
Jenis Lamun |
Total (tegakan/m2) |
Kondisi | ||||||
|
Cs |
Cr |
Th |
Si |
Hp |
Ho |
Hu | |||
|
1 |
115 |
272 |
32 |
342 |
362 |
- |
- |
1122 |
Sangat rapat |
|
2 |
- |
275 |
100 |
- |
67 |
56 |
34 |
532 |
Rapat |
|
3 |
125 |
735 |
13 |
- |
86 |
- |
43 |
1252 |
Sangat rapat |
|
4 |
145 |
375 |
68 |
- |
84 |
- |
120 |
792 |
Sangat rapat |
|
5 |
275 |
12 |
- |
- |
- |
- |
- |
287 |
Agak rapat |
|
6 |
168 |
- |
70 |
- |
- |
- |
81 |
319 |
Agak rapat |
|
7 |
142 |
8 |
45 |
- |
- |
- |
- |
195 |
jarang |
Ket: Cs = Cymodocea serrulata, Cr = Cymodocea rotundata, Th = Thalassia hemprichii, Si = Syringodiumisoetifolium, Hp = Halodule pinifolia, Ho = Halofila ovalis, Hu = Halodule uniervis.
dkk. (2018), besarnya nilai biomassa yang dimiliki oleh Thalassia hemprichii dikarenakan memiliki ukuran morfologi yang relative lebih besar baik pada bagian daun, rhizoma maupun akar, sebaliknya pada jenis lamun lainnya yang memiliki ukuran morfologi yang lebih kecil sehingga dapat mempengaruhi kandungan biomassa dari lamun tersebut. Biomassa padang lamun memiliki peran penting pada siklus karbon pada lamun. Semakin besar ukuran morfologi yang dimiliki oleh lamun, maka jumlah individu yang dimiliki lamun tersebut suatu luasan tertentu akan berkurang Gunawan dkk., (2019).
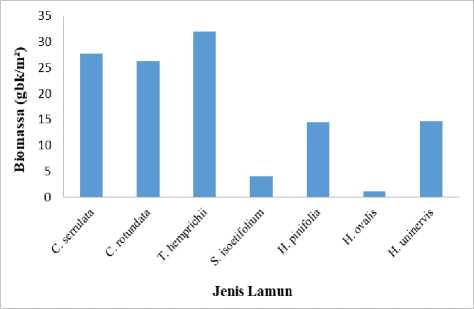
Gambar 3. Biomassa lamun per jenis di perairan
Tanjung Benoa
Hasil pengamatan biomassa lamun pada bagian atas dan bawah substrat memiliki hasil sangat berbeda dengan nilai total biomassa pada bagian atas dari setiap jenis lamun yang dijumpai di lokasi penelitian yakni sebesar 3377,4 (gbk/m2) (Gambar 4). Nilai dari bagian atas substrat lebih rendah dari pada bagian bawah substrat yang memiliki nilai biomassa sebesar 8642,1 gram berat kering (gbk/m2). Hasil penelitian ini serupa dengan hasil penelitian yang diperoleh Rahadiarta dkk. (2018), di perairan pantai Mengiat Nusa Dua bahwa biomassa lamun pada atas substrat 767,7 gbk/m2 lebih rendah dibandingkan dengan bagian bawah substrat yaitu 1335,5 gbk/m2. Menurut Alelo dkk. (2018), salah satu adaptasi lamun mengumpulkan banyak biomassa di bagian bawah substrat ini diketahui dibawah substrat sendiri bisa menahan sedimen dengan kuat, ini dapat diketahui rhizoma dan akar lamun terbenam di bawah susbtrat. Menurut Christon dkk. (2012), akar dan rhizoma diketahui dapat meresap banyak unsur hara dalam substrat yang diperkirakan dapat mempengaruhi biomassa pada lamun.
Rata-rata biomassa dibawah substrat lebih dari tiga kali lipat dibanding kan biomassa pada atas substrat. Pernyataan tersebut sesuai dengan hasil nilai biomassa yang telah didapatkan pada penelitian kali ini. Hal ini dapat dikaitkan dengan morfologi tumbuhan lamun dimana ukuran lamun yang ditemukan di Perairan Tanjung Benoa, Bali dari hasil pengamatan yakni didominasi memiliki ukuran yang relative besar dan kerapatan lamun per meter persegi lebih jarang sehingga mempengaruhi nilai biomassa lamun tersebut.
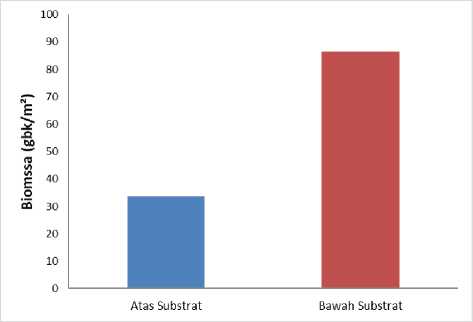
Gambar 4. Biomassa lamun atas dan bawah substrat
-
3.3 Parameter Lingkungan
Kualitas perairan yang yang diukur pada penelitian ini adalah DO (Dissolved Oxygen), pH air, suhu dan salinitas yang disajikan pada Tabel 3. Nilai DO perairan Tanjung Benoa merupakan nilai DO optimal yang berkisar antara 6,8 – 8,4 (mg/L). Hal tersebut sesuai dengan pernyataan Tatangindatu dkk. (2013), mengemukakan nilai oksigen terlarut (DO) di suatu perairan harus berkisar antara 6 sampai 8 mg/L. Kadar oksigen yang terdapat didalam air laut akan bertambah dengan semakin rendahnya suhu dan berkurang semakin tingginya salinitas.
Nilai dari pH air di perairan Tanjung Benoa berkisar antara 7 sampai 7.5 ini berdasarkan Putri dkk. (2018), bahwa nilai derajat keasaman (pH) di perairan sangat dipengaruhi oleh dekomposisi tanah dan dipengaruhi juga oleh keadaan lingkungan disekitarnya. Hasil pengukuran salinitas di perairan Tanjung Benoa memiliki nilai 31-32‰ dan dapat dikatakan salinitas perairan Tanjung benoa optimum bagi pertumbuhan lamun. Hal tersebut sesuai dengan pernyataan Hilwan dan Nurjannah (2014), bahwa nilai kisaran salinitas yang berkisar antara 24 - 35‰ dapat
mendukung pertumbuhan komunitas lamun. Indonesia sendiri perairan yang dapat diketahui iklimnya termasuk iklim tropis yang dimana salinitas meningkat dari arah barat ke timur dengan kisaran antara 30-35 ‰ Hilwan dan Nurjannah (2014).
Tabel 3
Parameter perairan Tanjung Benoa, Bali.
|
Titik |
DO (mg/L) |
pH Air |
Salinitas (‰) |
Jenis Substrat |
|
1 |
8.4 |
7.3 |
31 |
Pasir |
|
2 |
8 |
7.2 |
31 |
Berlumpur Pasir |
|
3 |
7.3 |
7.5 |
32 |
Pasir |
|
4 |
7.4 |
7.2 |
32 |
Pasir |
|
5 |
7.2 |
7 |
31 |
Pasir |
|
6 |
7 |
7.5 |
31 |
Pasir |
|
7 |
6.8 |
7.3 |
32 |
Pasir |
|
berlumpur |
Jenis substrat yang ditemukan di perairan Tanjung Benoa, terdapat dua jenis yaitu pasir dan pasir berlumpur. Lamun dapat hidup pada substrat berlumpur, berpasir, tanah liat dan yang lainnya. Biasanya jenis substrat yang di tempati oleh jenis lamun diantaranya ada yang substrat pasir dan pasir berlumpur. Jenis substrat juga mempengaruhi penyerapan karbon organik. Menurut Hartati dkk. (2017), penyerapan karbon organik dapat dipengaruhi oleh besarnya butiran pada substrat, ini diketahui apabila semakin besar butiran substrat dapat melemahkan kemampuran menyerap bahan organik.
-
3.4 Kadar Abu dan Bahan Organik
Hasil analisis yang telah didapatkan persentase bahan organik dan kadar abu dibagian atas dan bawah substrat, nilai bahan organik pada bagian bawah memiliki presentase lebih tinggi dari pada atas substrat. Nilai kadar abu pada bagian atas substrat memiliki nilai sebesar 34% dan untuk nilai kandungan bahan organik sebesar 66% (Gambar 5). Sedangkan pada bagian bawah substrat nilai kadar abu diketahui sebesar 34% sedangkan untuk nilai bahan organik pada bagian bawah memiliki persentase nilai 66% ini di perkirakan adanya suatu sampel yang mengalami penguapan selama pengabuan berlangsung, diketahui bahan mineral yang terdapat pada sampel diperkirakan lebih
banyak di bagian bawah substrat (Gambar 5). Biasanya sisa dari berat kering pada sampel terjadi proses penguapan selama dilakukannya pengovenan berupa mineral organik. Kandungan bahan organik juga dipengaruhi oleh kerapatan (Handayani, 2015). Semakin tinggi kerapatan ekosistem lamun diketahui juga semakin banyak bahan organik yang terikat. Paparan cahaya matahari dan gelombang juga dapat mengakibatkan terjadinya kandungan bahan organik diatas substrat merendah (Riniatsih, 2015). Menurut Supriadi dkk. (2012), menyatakan rendahnya nilai bahan organik di bagian atas substrat itu berkaitan dalam posisi yang langsung terkena oleh suatu kualitas fisik perairan, semacam gelombang atau kekeringan akibat dari paparan cahaya matahari.
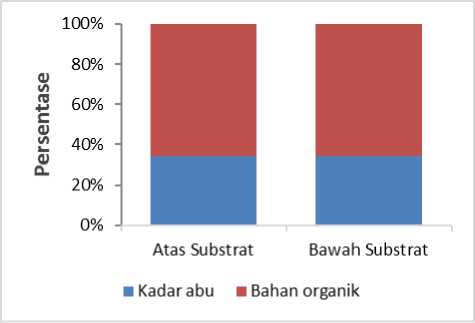
Gambar 5. Kadar abu bawah substrat
dan bahan organik atas dan
-
3.5 Kandungan Karbon
Menurut Carruthers et al. (2007), kandungan karbon pada lamun menggambarkan seberapa besar lamun tersebut mengikat CO2 dari udara dan biasanya kandungan karbon sendiri juga diartikan sebagai banyaknya karbon yang mampu diserap oleh lamun biasanya dalam bentuk biomassa. Berdasarkan hasil yang diperoleh yang disajikan pada (Gambar 6). Diketahui bahwa kandungan karbon tertinggi terdapat pada jenis lamun dengan nilai Thalassia hemprichii 625,36 gC/m², Cymodocea serrulata dengan kandungan karbon 412,71 gC/m², Cymodocea rotundata 232,50 gC/m², Halodule pinifolia 146,38 gC/m², jenis lamun Syringodium isoetifolium dengan nilai 111,57 gC/m², kemudian ada jenis lamun Halodule uninervis dengan nilai 109,70 gC/m², dan yang terendah jenis lamun Halophila ovalis dengan nilai sebesar 89,91 gC/m². Potensi kandungan karbon itu berkaitan erat dengan
besarnya nilai biomassa yang dimiliki dan hasil kandungan karbon pada penelitian ini dikatakan berbanding dengan pernyataan dari Yuniwati (2014) ia mengemukakan bahwa bila semakin besar kandungan biomassa yang dimiliki suatu jenis lamun, maka kandungan karbon jenis lamun tersebut semakin tinggi. Ini juga dapat diketahui dari penelitian (Rahadiarta dkk. 2018), juga mengemukakan apabila biomassa pada ekosistem lamun tinggi maka kandungan karbon di lamun juga tinggi.
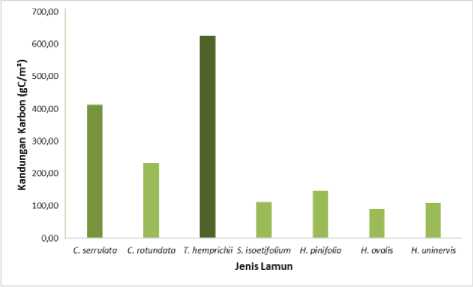
Gambar 6. Kandungan Karbon tiap jenis (gC/m²)
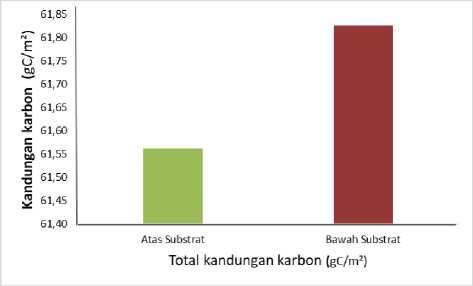
Gambar 7. Estimasi total kandungan karbon
Pada (Gambar 7) dapat dilihat nilai rata - rata kandungan karbon tinggi pada bagian bawah substrat dengan nilai 61,83 gC/m2 sedangkan nilai rata - rata pada bagian atas substrat yaitu sebesar 61,56 gC/m2 yang dimana nilai rata - rata kandungan karbon tidak terlalu beda jauh atas substrat mapun bawah susbtrat (Gambar 7). Hasil penelitian ini serupa dengan penelitian Rahadiarta dkk. (2018), bahwa di bawah susbtrat kandungan karbon lebih tinggi dibandingkan dengan diatas substrat. Kandungan karbon tinggi karena pada bagian bawah substrat sangat penting karena karbon akan terakumulasi oleh sedimen (Supriadi dkk., 2012). Adanya perbedaan simpanan karbon disebabkan oleh kerapatan tegakan, umur lama
tinggalnya tegakan lamun, kualitas tempat tumbuh ekosistem lamun, iklim, topografi, karakteristik substrat, komposisi umur tumbuhan, dan perlakuan yang ada di lingkungan ekosistem lamun (Feryatun dkk., 2012).
Total kerapatan ekosistem padang lamun di perairan Tanjung Benoa, Bali termasuk dalam kategori jarang hingga sangat rapat. Jenis lamun yang memiliki kerapatan tertinggi adalah Thalassia hemprichii, sedangkan jenis lamun yang memiliki kerapatan terendah adalah Halophila ovalis. Kualitas perairan Tanjung Benoa, Bali secara umum masih sesuai dan mendukung untuk pertumbuhan lamun. Simpanan karbon lamun perairan Tanjung Benoa, Bali diketahui bagian bawah substrat lebih tinggi dari pada simpanan karbon padang lamun pada bagian atas substrat.
Daftar Pustaka
Alelo, M. L., Kondoy, K. I. F., & Moningkey, R. D. (2018).
Biomassa Tumbuhan Lamun Jenis Thalassia hemprichii Kecamatan Kema Minahasa Utara. Jurnal Ilmiah PLATAX, 6(1), 142-148.
Amran, M. A. (2010). Estimation of seagrass coverage by depth invariant indices on quickbird imagery.
BIOTROPIA Journal, 17(1), 42-50.
Barus, T. A. (2004). Faktor-faktor lingkungan abiotik dan keanekaragaman plankton sebagai indikator kualitas perairan Danau Toba. Jurnal Manusia dan Lingkungan, 11(2), 64-72.
Carruthers, T. J. B., Dennison, W. C., Kendrick, G. A., Waycott, M., Walker, D. I., & Cambridge, M. L. (2007). Seagrasses of south-west Australia: A conceptual synthesis of the world's most diverse and extensive seagrass meadows. Journal of Experimental Marine Biology and Ecology, 350(1-2), 21-45.
Christon, Djunaedi, O. S., & Purba, N. P. (2012).
Pengaruh tinggi pasang surut terhadap pertumbuhan dan biomassa daun lamun Enhalus acoroides di Pulau Pari Kepulauan Seribu Jakarta. Jurnal Perikanan dan Kelautan Unpad, 3(3), 287-294.
Duarte, C. M., Middelburg J. J., & Caraco, N. (2004). Major role of marine vegetation on the oceanic carbon cycle. Biogeosciences discussions, 1(1), 659-679.
Faiqoh, E., & Atmaja, P. S. P, (2015). Distribusi spasial dan identifikasi biodiversitas lamun di perairan Tanjung Benoa. Dalam Prosiding Seminar Nasional Sains & Teknologi II 2015. Kuta, Bali, Indonesia, 29-30 Oktober 2015 (pp. 2173 -2180).
Feryatun, F., Hendrarto, B., & Widyorini, N. (2012). Kerapatan dan Distribusi Lamun (Seagrass) Berdasarkan Zona Kegiatan yang Berbeda di Perairan Pulau Pramuka, Kepulauan Seribu. Management of Aquatic Resources Journal, 1(1), 44-50.
Graha, Y. I., Arthana, I. W., & Karang, I. W. G. A. (2016). Simpanan karbon padang lamun di kawasan Pantai Sanur, Kota Denpasar. ECOTROPHIC: Jurnal Ilmu Lingkungan (Journal of Environmental Science), 10(1), 46-53.
Gunawan, J. V., Parengkuan, M., Wahyudi, A. J., & Zulpikar, F. (2019). Estimasi Stok Karbon pada Biomassa Lamun di Pulau Semak Daun, Kepulauan Seribu. OLDI (Oseanologi dan Limnologi di Indonesia), 4(2), 89-99.
Handayani. (2015). Analisis Kualitas Kimia Susu Pasteurisasi dengan Penambahan Sari Buah Sirsak.
Skripsi. Makassar, Indonesia: Fakultas Peternakan, Universitas Hasanuddin.
Hartati, R., Pratikto, I., & Pratiwi, T. N. (2017). Biomassa dan Estimasi Simpanan Karbon pada Ekosistem Padang Lamun di Pulau Menjangan Kecil dan Pulau Sintok, Kepulauan Karimunjawa. Buletin Oseanografi Marina, 6(1), 74-81.
Helrich, K. (1990). Official Methods of Analysis Of The Association Of Official Analytical Chemists. (10th ed.). Virginia, USA: Association Of Official Analytical Chemists, Inc.
Hilwan, I., & Nurjannah, A. S. (2014). Potensi Simpanan Karbon Pada Tegakan Revegetasi Lahan Pasca Tambang Di Pt Jorong Barutama Greston, Kalimantan Selatan. Jurnal Silvikultur Tropika, 5(3), 188-195.
Huriawati, F., Yuhanna, W. L., & Mayasari, T. (2016). Pengaruh Metode Pengeringan Terhadap Kualitas Serbuk Seresah Enhalus acoroides Dari Pantai Tawang Pacitan. Bioeksperimen: Jurnal Penelitian Biologi, 2(1), 35-43.
Indriani, Wahyudi, A. J., & Yona, D. (2017). Cadangan Karbon di Area Padang Lamun Pesisir Pulau Bintan, Kepulauan Riau. OLDI (Oseanologi dan Limnologi di Indonesia), 2(3), 1-11.
Ira, I., Oetama, D., & Juliati, J. (2013). Kerapatan dan Penutupan Lamun Pada Daerah Tanggul Pemecah Ombak di Perairan Desa Terebino Propinsi Sulawesi Tengah. AQUASAINS: Jurnal Ilmu Kelautan dan Perairan, 2(1), 88-96.
Martha, L. G. M. R., Julyantoro, P. G. S., & Sari, A. H. W.
-
(2019) . Kondisi dan Keanekaragaman Jenis Lamun di Perairan Pulau Serangan, Provinsi Bali. Journal of Marine and Aquatic Sciences, 5(1), 131-141.
Putri, I. G. A. R. M., Dirgayusa, I. G. N. P., & Faiqoh, E. (2018). Perbandingan Morfometrik dan Meristik Lamun Halophila ovalis di Perairan Pulau Serangan dan Tanjung Benoa, Bali. Journal of Marine and Aquatic Sciences, 4(2), 213-224.
Rahadiarta, I. K. V. S., Putra, I. D. N. N., & Suteja Y. (2018). Simpanan karbon pada padang lamun di kawasan Pantai Mengiat, Nusa Dua Bali. Journal of Marine and Aquatic Sciences, 5(1), 1-10.
Riniatsih, I. (2015). Distribusi muatan padatan tersuspensi (MPT) di padang lamun di perairan Teluk Awur dan Pantai Prawean Jepara. Jurnal Kelautan Tropis, 18(3), 121-126.
Runtuboi, F., Nugroho, J., & Rahakratat, Y. (2018).
Biomassa dan Penyerapan Karbon oleh Lamun Enhalus acorodes di Pesisir Teluk Gunung Botak Papua Barat. Jurnal Sumberdaya Akuatik Indopasifik, 2(2), 91-101.
Rustam, A., Kepel, T. L., Afiati, R. N., Salim, H. L., Astrid, M., Daulat, A., Mangindan, P., Sudirman, N., Puspitaningsih, Y., Dwiyanti, D., & Hutahaean, A. (2014). Peran ekosistem lamun sebagai blue carbon dalam mitigasi perubahan iklim, studi kasus Tanjung Lesung, Banten. Jurnal Segara. 10(2), 107-117.
Santoso, B., Dharma, I. G. B. S., & Faiqoh, E. (2018). Pertumbuhan dan produktivitas daun lamun Thalassia hemprichii (Ehrenb) Ascherson di perairan Tanjung Benoa, Bali. Journal of Marine and Aquatic Sciences, 4(2), 278-285.
Setyawati, Y., Subiyanto, & Ruswahyuni. (2014). Hubungan antara kelimpahan epifauna dasar dengan tingkatan kerapatan lamun yang berbeda di Pulau Panjang dan Teluk Awur Jepara. Management of Aquatic Resources Journal, 3(4), 235-242.
Supriadi, Kaswadji, R. F., Bengen, D. G., & Hutomo, M. (2012). Produktivitas komunitas lamun di pulau Barranglompo Makassar. Jurnal Akuatika, 3(2), 159-168.
Tatangindatu, F., Kalesaran, O., & Rompas, R. (2013). Studi parameter fisika kimia air pada areal budidaya ikan di Danau Tondano, Desa Paleloan, Kabupaten Minahasa. E-Journal Budidaya Perairan, 1(2), 8-19.
Wicaksono, S. G., Widianingsih, Hartati, S. T. (2012). Struktur vegetasi dan kerapatan jenis lamun di Perairan Kepulauan Karimunjawa Kabupaten Jepara. Journal of Marine Research, 1(2), 1-7.
Yuniwati, Y., & Suhartana, S. (2014). Potensi karbon pada limbah pemanenan kayu Acacia crassicarpa. Jurnal Ilmu Lingkungan, 12(1), 21-31.
© 2020 by the authors; licensee Udayana University, Indonesia. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution license (http://creativecommons.org/licenses/by/3.0/).
J. Mar. Aquat. Sci. 6: 13-21 (2020)
Discussion and feedback