Sensitifitas dan Spesifisitas Teknik Imunohistokimia Rabies
on
Jurnal Ilmu dan Kesehatan Hewan, Pebruari 2014
Vol 2 No 1: 49-59
Sensitifitas dan Spesifisitas Teknik Imunohistokimia Rabies
The Sensitivity and Spesificity of Rabies Immunohistochemical Technique
I Ketut Wirata1*, I Ketut Berata2, I Ketut Puja2
-
1 Balai Besar Veteriner Denpasar Jl Raya Sesetan Denpasar
-
2 Fakultas Kedokteran Hewan Universitas Udayana Jl. PB Sudirmn, Denpasar *Corresponding author email: wirata_dvm@yahoo.com
ABSTRACT
Fluorescent Antibody Test (FAT) is a golden standard for rabies diagnosis, but it requires many sample preconditions before testing. Immunohistochemical technique (IHC) has the same principle as the FAT, however, it is more simple. This study was conducted to examine the sensitivity and specificity of IHC compare to FAT. The sensitivity and specificity were calculated using the formula of 2 x 2 contingency table and statistical analysis of the chi-square. Out of 40 samples that rabies positive on FAT, 27 samples (67.5%) showed rabies positive on IHC and 13 samples (32.5%) showed rabies negative on IHC. All samples that rabies negative on FAT were also rabies negative on IHC. The IHC has the sensitivity and specificity level 67.5% and 100% respectively. The IHC has a lower sensitivity than FAT, however, IHC has many advantages such as it can be performed on formalin fixed-samples. A further research is necessary to improve the sensitivity of IHC on detecting the rabies.
Key words: rabies, dog, sensitivitas, FAT, IHC
ABSTRAK
Flourescent Antibody Test (FAT) adalah baku emas untuk diagnosa rabies, tetapi FAT membutuhkan beberapa persyaratan sampel sebelum pengujian. Teknik imunohistokimia (IHC) memiliki prinsip sama dengan FAT, namun teknik ini lebih sederhana. Penelitian ini dilakukan untuk menganalisis sensitifitas dan spesifisitas IHC dibandingkan dengan FAT. Sensitifitas dan spesifisitas dihitung menggunakan rumus Tabel 2 x 2 dan analisa statistik dengan chi-square. Dari 40 sampel yang positif rabies pada FAT, 27 sampel (67,5%) menunjukkan positif rabies pada IHC dan 13 sampel (32,5%) menunjukkan negatif rabies pada IHC. Seluruh sampel yang negatif rabies pada FAT juga menunjukkan negatif rabies pada IHC. IHC memiliki tingkat sensitifitas dan spesifisitas berturut-turut sebesar 67,5% dan 100%. Meskipun IHC memiliki sensitifitas yang lebih rendah dari FAT, IHC mempunyai beberapa keunggulan seperti dapat diterapkan pada sample yang diformalin. Penelitian lebih masih dibutuhkan untuk meningkatkan sensitifitas IHC dalam mendeteksi rabies.
Kata kunci : rabies, anjing, sensitifitas ,FAT, IHC
PENDAHULUAN
Rabies adalah penyakit viral yang menginfeksi sistem saraf pusat (SSP) pada hewan yang berdarah panas dan manusia (Anjaria et al., 1985; Akoso, 2007). Penyakit rabies merupakan infeksi akut pada sistem saraf pusat dan dan hampir semua kejadian infeksinya berakhir dengan kematian (Yousaf et al., 2012) Penyakit rabies disebabkan oleh virus dari genus Lyssavirus (Blanton et al., 2010). Virus rabies bersifat neurotropik, berbentuk seperti peluru dengan ukuran diameter 75 nanometer dan panjang 100130 nanometer. Materi genetik virus tersusun atas untaian rantai tunggal RNA. Ada 7 serotipe dari lyssavirus yaitu: serotipe 1 adalah virus rabies klasik telah menyebar ke suluruh dunia; serotipe 2 adalah Lagos bat virus ditemukan di Afrika; serotipe 3 adalah Mokola rhabdovirus ditemukan di Afrika; serotipe 4 adalah Duvenhage rhabdovirus ditemukan di Afrika bagian selatan; European Bat Lyssavirus (EBL) dibagi dalam 2 biotipe yaitu EBL 1 dan EBL 2; dan terakhir serotipe 7 yaitu Australian Bat Lyssavirus (Bowen-Davis and Lowings, 2000).
Sejak mewabahnya rabies pertama kali di Provinsi Bali, tepatnya di Kabupaten Badung bulan Nopember 2008,
kasus rabies telah meluas di semua Kabupaten/Kota di Bali, secara berturut-turut: Kabupaten Badung, Kota Denpasar, Tabanan, Gianyar, Karangasem, Buleleng, Bangli, Klungkung dan Jembrana. Wabah yang terjadi pada hewan dan manusia telah mengakibatkan kematian.Kematian umumnya disebabkan oleh tidak adanya perlakuan atau kurangnya perlakuan yang baik (post exposure treatment) terhadap korban yang terkena Rabies. Tindakan vaksinasi dan pemberian serum anti rabies sebagai tindakan post exposure treatment (PET) telah meningkatkan keberhasilan pengobatan bagi korban terutama manusia yang terkena gigitan anjing.
Tingginya jumlah kasus gigitan oleh anjing akan berdampak terhadap tingginya permintaan vaksin anti rabies (VAR) yang diperuntukkan bagi korban gigitan, sehingga ini akan sangat membebani pemerintah, karena untuk daerah yang endemis rabies seperti di Bali, biaya VAR atau perlakuan paska terpapar penyakit rabies ditanggung sepenuhnya oleh pemerintah. Karena dampaknya pada manusia, keberadaan rabies telah mengganggu ketentraman batin, rasa aman dan menimbulkan rasa takut, kekhawatiran serta keresahan masyarakat di daerah tertular.
Kurangnya informasi bagi masyarakat tentang penyakit rabies sering
menimbulkan ketakutan yang berlebihan atau tidak berdasar. Sehingga terkadang masyarakat tidak mau tahu dan cenderung memaksa untuk mendapatkan VAR setiap kali tergigit oleh anjing, padahal tidak semua gigitan oleh anjing terinfeksi rabies.
Informasi tentang sejarah kasus atau riwayat gigitan dan gejala klinis hewan penular rabies (HPR) yang menggigit diperlukan dalam mendiagnosa kasus rabies disamping pemeriksaan atau pengujian secara laboratorium. Diagnosa berdasarkan anamnesa dan hasil pemeriksaan laboratorium terhadap spesimen otak anjing yang menggigit diharapkan bisa dijadikan sebagai pedoman atau dasar dalam pengambilan keputusan untuk pemberian vaksin anti rabies (VAR).
Pemeriksaaan laboratorium yang biasa dilakukan terhadap spesimen otak yang diduga rabies diantaranya adalah : pewarnaan Seller, FAT (Flourescent Antibody Test), histopatologi, imunohistokimia (IHK), Mouse Inoculation Test (MIT), maupun teknik molekular lainnya seperti Polymerase Chain Reaction (PCR). Sedangkan uji serologi yang direkomendasikan oleh Office Internationale des Epizooties (OIE, 2008) adalah Fluorescent Antibody Virus Neutralization Test (FAVN). Bahkan dengan beberapa kelebihan yang dimiliki
teknik FAT (Flourescent Antibody Test) seperti tingkat sensitifitas yang tinggi dan waktu pengujian yang relatif cepat, Organisasi Kesehatan Hewan Dunia (OIE) menjadikan FAT sebagai baku emas untuk diagnosa penyakit rabies (Shankar, 2009).
Pengujian rabies dengan teknik FAT memerlukan spesimen otak dalam keadaan segar atau segar beku atau dengan pengawet glycerin 50%. Hal ini sering menjadi kendala di lapangan karena tidak semua spesimen bisa diterima di laboratorium untuk diperiksa dalam keadaan segar. Pada spesimen yang diberi pengawet glycerin 50% masa penyimpanannya juga relatif singkat karena apabila terlalu lama dalam glycerin spesimen otak akan rusak dan tidak bisa diperiksa dengan uji FAT. Oleh karena itu diperlukan suatu teknik diagnostik yang cepat dan akurat dan mampu mengatasi kendala jarak pengiriman dan masa penyimpanan spesimen.
Salah satu teknik uji lain untuk mendiagnosa rabies seperti yang disebutkan di atas adalah teknik imunohistokimia (IHK). Teknik IHK mempunyai prinsip yang sama dengan FAT yaitu untuk melihat adanya ikatan antigen-antibodi spesifik rabies. Teknik ini mempunyai sensitivitas sama dengan FAT (Singatia et al., 2012). Perbedaannya adalah pada teknik IHK pengujian bisa
dilakukan pada jaringan yang sudah difiksasi dalam formalin buffer netral 10% sehingga spesimen dapat disimpan dalam waktu yang relatif lebih lama pada suhu ruang tanpa diperlukan perlakuan khusus seperti harus disimpan pada suhu dingin, terlindung dari sinar, dan sebagainya. Namun perlu kiranya dilakukan suatu penelitian untuk mengetahui tingkat sensitifitas dan spesifisitas teknik IHK terhadap FAT yang merupakan baku emas untuk pemeriksaan rabies yang direkomendasikan oleh OIE.
METODE PENELITIAN
Teknik FAT Rabies
Pengujian dengan teknik FAT dilakukan dengan membuat preparat apus otak yang difiksasi dengan aseton pada suhu -20˚C selama 30 menit. Setelah dikeringkan pada suhu ruang, preparat apus digenangi dengan conjugate rabies-anti nucleocapsid. Inkubasi dilakukan dalam inkubator suhu 37˚C dengan memberi kelembaban secukupnya. Setelah 30 menit, preparat dicuci dengan larutan PBS pH 7,2 sebanyak 3 kali dilanjutkan dengan menambahkan aquos mounting media dan ditutup dengan cover slip. Selanjutnya pemeriksaan dilakukan dibawah mikroskop flourescen, dan sel-sel neuron yang terinfeksi virus rabies akan
ditandai dengan adanya warna hijau (apple green) yang berpendar (OIE, 2008).
Teknik IHC Rabies
Pengujian dengan teknik IHC rabies dilakukan terhadap sampel yang dinyatakan positif dan negatif rabies. Teknik IHC mempergunakan sampel otak yang terdiri dari bagian cerebrum, cerebellum dan bagian hippocampus. Sampel otak kemudian difiksasi dengan formalin buffer netral 10% dan selanjutnya diproses dalam tissue processor untuk selanjutnya dilakukan proses embedding sampai dalam bentuk blok paraffin. Jaringan dalam blok paraffin selanjutnya dipotong dengan microtome dengan ketebalan 3-4 µm, kemudian jaringan ditempelkan pada gelas obyek yang sudah dilapisi dengan poly L- Lysin. Selanjutnya preparat (obyek gelas yang sudah tertempel jaringan) diperlakukan sesuai dengan tahapan prosedur teknik IHC.
Teknik IHK menggunakan streptavidin yang sudah dilabel, yang sudah tersedia dalam satu kemasan kit komersial (LSAB-2 System peroxidase universal kit, DAKO, No. K 0672, Denmark). Enzim trypsin sebagai proteolitik dipergunakan sebagai antigen retrieval dengan cara mendigesti jaringan, antibodi monoklonal rabies sebagai antibodi primer, goat-anti mouse
biotinylated sebagai antibodi sekunder dan streptavidin peroksidase sebagai label. Diaminobenzidine (DAB) dipergunakan untuk memberikan efek presipitasi berwarna pada ikatan antigen-antibodi.
Analisis Data
Data hasil yang diperoleh pada penelitian ini selanjutnya akan dianalisis dengan menggunakan Tabel Kontingensi 2 x 2 seperti yang terlihat pada Tabel1.
Tabel 1. Tabel Kontingensi 2 X 2
IHC
Pos Neg Jml
TP FN
O
FP TN
Persentase sensitifitas dan spesifisitas dihitung dengen formula sebagai berikut.
TP TN
Sentifitas= ×100% ; Spesifisitas= ×100% .
TP (true positif): sampel positif rabies dengan FAT, dan tetap menunjukkan positif rabies dengan IHC.
FN (false negatif): sampel positif rabies dengan FAT, tetapi menunjukkan negatif rabies dengan teknik IHC.
FP (false positif): sampel negatif rabies dengan FAT, tetapi menunjukkan positif rabies dengan teknik IHC.
TN (true negatif): sampel negatif rabies dengan FAT, dan tetap menunjukkan negatif dengan IHC.
Dengan asumsi bahwa teknik FAT adalah baku emas untuk diagnosa rabies dan dengan menggunakan metode analisis di atas, maka sensitifitas dan spesifisitas
teknik imunohistokimia (IHC) dapat ditentukan. Apabila pada penghitungan sensitifitas maupun spesifisitas menunjukkan perbedaan, maka akan
dilanjutkan dengan menggunakan analisis statistik Chi-square.
HASIL DAN PEMBAHASAN
Hasil
Pengujian sampel otak anjing dengan FAT
Wilayah Provinsi Bali dikonfirmasi rabies secara laboratorium pada 28 November 2008 dan secara resmi dinyatakan terjangkit rabies sejak 01-122008 dengan SK MENTAN No: 1637.1/Kpts/PD.640/12/2008 tentang
Pernyataan Berjangkitnya Wabah Penyakit Anjing Gila (Rabies) Di Kabupaten Badung Provinsi Bali. Selama kurun waktu Desember 2008 sampai Desember 2011 telah tercatat sampel sebanyak 4300 sampel. Dari jumlah sampel tersebut,
setelah diperiksa dengan teknik FAT sebanyak 624 sampel (14,5%) dinyatakan positif rabies (BBV Denpasar, 2011).
Pengujian sampel otak anjing dengan IHC
Sampel yang dinyatakan positif dan negatif rabies pada pemeriksaan FAT, masing-masing diambil 40 sampel untuk selanjutnya diperiksa dengan menggunakan IHC. Dari 40 sampel positif rabies pada FAT, sebanyak 27 (67,5%) sampel menunjukkan positif (Gambar 1) dan 13 (32,5%) sampel menunjukkan hasil negatif rabies pada IHC. Sedangkan seluruh sampel yang negatif rabies pada FAT (40 sampel), juga seluruhnya menunjukkan negatif rabies pada IHC (Tabel 1).
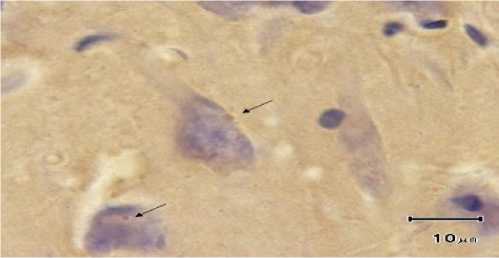
Gambar 1. Badan negri berwarna coklat pada area definitif intrasitoplasmik sel neuron. (Pewarnaan IHC dengan label streptavidin biotin dan DAB x 400).
Tingkat sensitifitas IHC terhadap FAT adalah sebesar 67,5% dengan tingkat spesifisitasnya sebesar 100%. Hal ini
berarti bahwa pengujian sampel dengan menggunakan teknik IHC hanya mampu mendeteksi 67,5% dari total sampel positif 54
berdasarkan hasil uji FAT. Sedangkan sampel negatif dengan teknik FAT terdeteksi negatif 100% dengan menggunakan teknik IHC. Perbedaan nilai sensitifitas antara IHC dan FAT (32,5%) sangat nyata (P<0,01).
Tabel 5.1. Tabel Kontingensi 2 X 2
IHC
|
Pos |
Neg |
Jml | |
|
CZi O |
27 |
13 |
40 |
|
W O Z |
0 |
40 |
40 |
|
27 |
53 |
80 |
Pembahasan
Kejadian rabies di dunia masih tinggi. Hal ini mendorong untuk terus dilakukan penelitian terkait penyakit rabies. Berbagai metoda dan teknik pengujian terus dikembangkan, baik untuk mengidentifikasi agen maupun uji serologi. Diagnosa rabies pada hewan dapat dibuat dengan direct florescent antibody, teknik inokulasi pada mencit, kultur jaringan dan polymerase chain reaction. Teknik diagnosa tersebut telah direkomendasi oleh WHO (Bourhy et al., 2005).
Teknik yang diakui dunia sebagai teknik pilihan untuk mendiagnosa rabies adalah FAT (Subramaniam dan Madhusudana, 2013). Fluorescent Antibody Test (FAT) adalah suatu metoda uji yang memiliki beberapa kelebihan dibandingkan dengan metoda uji yang lain seperti kecepatan dalam memperoleh hasil (± 2 jam), mempunyai reliabilitas diagnosa 98 – 100% dari kasus apabila mempergunakan konjugat yang sesuai, sehingga FAT merupakan golden standard untuk diagnosa rabies (OIE, 2000). Walaupun demikian, agar teknik ini dapat menghasilkan sesuai dengan yang diharapkan ada beberapa persyaratan yang harus dipenuhi ketika melakukan pemeriksaan.
Reliabilitas hasil pengujian FAT ditentukan oleh sampel yang diuji. FAT akan sangat sensitif pada sampel otak segar, akan tetapi dapat juga digunakan sampel jaringan yang telah diberi tripsin atau enzym lainnya (Whitfield et al., 2001) atau sampel yang pengiriman maupun penyimpanannya harus pada suhu dingin atau beku, atau diberi media pengawet glyserin 50% dalam PBS (OIE, 2000).
Pada kondisi tertentu, persyaratan sampel yang akan diperiksa tidak dapat memenuhi persyaratan, misalnya karena keterbatasan alat pendinginan. Pendinginan penting artinya pada
pengiriman sampel. Sampel yang dikirim tanpa pendingin bisa mengakibatkan kerusakan jaringan sampel dan berpeluang meningkatkan kemungkinan hasil negatif palsu (Umoh et al., 1981).
Banyak kejadian bahwa sampel yang dikirim ke laboratorium dalam kondisi yang sudah rusak. Bila hal ini tetap dilakukan pemeriksaan dengan FAT dikhawatirkan akan menghasilkan negatif palsu. Karena itu, teknik pemeriksaan yang memungkinkan dapat memeriksa sampel yang sudah rusak sangat diperlukan.
Kemajuan pengetahuan di bidang pemeriksaan suatu agen penyakit ataupun serologi berbasis molekuler-seluler telah berkembang pesat. Salah satu tehnik alternatif adalah teknik imunohistokimia (IHC). Teknik IHC pada dasarnya merupakan perpaduan 3 disiplin ilmu yaitu imunologi, histologi dan kimia. Prinsip teknik IHC adalah adanya ikatan antigen-antibodi spesifik yang sudah dilabel, dan teknik ini tidak membutuhkan mikroskop flourescen (Subramaniam dan Madhusudana, 2013).
Dalam penelitian ini didapatkan bahwa pemeriksaan sampel yang sebelumnya positif pada pemeriksaan dengan FAT, ada yang negatif pada pemeriksaan IHC. Sensitifitas uji IHC lebih rendah dari FAT. Hal ini menunjukkan bahwa IHC sebagai
alternatif uji belum bisa digunakan sebagai teknik pemeriksaan rabies, meskipun penggunaan metode IHC mempunyai beberapa kelebihan dibanding FAT. Teknik IHC dapat diaplikasikan dengan baik pada sampel yang dipreservasi dengan larutan gliserol selama 15 bulan dan dalam keadaan beku selama 2 tahun (Subramaniam and Madhusudana, 2013). Disamping itu kelebihan penggunaan IHC adalah dapat digunakan untuk studi retrospektif terhadap kasus-kasus terdahulu.
Dalam penelitian ini, teknik IHC mempunyai tingkat sensitifitas sebesar 67,5% dan tingkat spesifisitas sebesar 100% dibandingkan dengan teknik FAT pada pengujian sampel otak anjing yang berasal dari wilayah Bali. Beberapa hal yang mungkin mempengaruhi hasil pengujian adalah: lamanya spesimen dalam fiksasi formalin, lama digesti oleh enzim proteolitik, konsentrasi antibodi pendeteksi, distribusi antigen pada spesimen, ukuran spesimen, dan tentu saja hal yang bersifat subyektif yaitu penguji.
Pada penelitian ini diperoleh hasil bahwa tingkat sensitifitas teknik IHK lebih rendah atau hanya sebesar 67,5% dari teknik FAT. Hal ini bisa dimungkinkan karena terdapat perbedaan lamanya waktu fiksasi dalam formalin. Pada sampel yang disimpan cukup lama dalam formalin
mungkin akan membutuhkan waktu ataupun konsentrasi enzim proteolitik yang berbeda dengan sampel yang difiksasi dalam waktu yang relatif singkat. Waktu dan konsentrasi enzim proteolitik yang optimal sangat berpengaruh terhadap hasil pengujian.
Konsentrasi dan lama proses digesti oleh enzim proteolitik/proteinase akan mempengaruhi sensitifitas hasil (Cynthia et al., 1997). Proses digesti ini sangat penting dalam mengekspos/menemukan kembali antigen target yang ada di dalam jaringan yang sudah difiksasi dengan formalin. Proses digesti dan konsentrasi enzim yang berlebihan akan merusak jaringan bahkan bisa melepaskan jaringan dari slide. Waktu optimal untuk kerja enzim adalah 30 menit pada suhu 37°C untuk sampel yang difiksasi dalam formalin selama beberapa hari. Sedangkan sampel yang difiksasi formalin untuk waktu yang lebih lama, akan membutuhkan waktu sampai 45 menit untuk proses digesti oleh proteinase (Cynthia et al., 1997). Dalam penelitian ini menemui kesulitan untuk menentukan waktu optimal digesti diakibatkan sampel yang digunakan waktu fiksasinya berbeda.
Konsentrasi antibodi pendeteksi berperan terhadap hasil. Pada umumnya, bila sampel difiksasi dengan formalin akan membutuhkan konsentrasi antibodi
pendeteksi 75–100% lebih tinggi dibanding pada sampel yang difiksasi dengan acetone. Pada pemeriksaan sampel yang difiksasi dengan formalin kemungkinan belum menggunakan konsentrasi antibodi pendeteksi yang optimal.
Akurasi diagnosa rabies sangat tergantung dari kualitas sampel, distribusi antigen virus dan bagian organ sampel yang diuji. Tidak ada pola yang pasti untuk distribusi virus rabies di dalam jaringan susunan saraf pusat hewan yang terinfeksi (Sylvia et al., 2001). Hal ini mungkin menjadi salah satu penyebab terjadinya perbedaan hasil pengujiaan pada penelitian ini. Pada penelitian ini menggunakan sampel otak anjing dengan ukuran sampel yang cukup besar, atau sebaliknya sampel otak yang sudah dalam bentuk potongan kecil. Hal ini sangat menyulitkan untuk menentukan bagian yang harus diambil untuk dilakukan pengujian.
Ukuran sampel menjadi permasalahan yang penting pada hewan-hewan dengan ukuran organ otak yang besar. Hal ini dikarenakan banyak bagian dari otak yang tidak diperiksa/diuji. Semestinya beberapa bagian dari otak yang diduga terinfeksi rabies seperti: batang otak, hipokampus dan serebelum harus diambil untuk diperiksa pada kasus yang diduga rabies.
Pada kondisi dimana tersedia seluruh bagian dari organ otak, khususnya pada hewan kecil, pemotongan membujur pada organ otak akan memberikan gambaran distribusi yang lebih jelas pada pengujian. Hasil negatif pada pemeriksaan dengan teknik IHC kemungkinan karena tidak adanya antigen pada bagian organ yang diperiksa atau mungkin belum terdistribusikan ke bagian yang diperiksa sehingga tidak terdeteksi adanya antigen pada bagian potongan tersebut. Hal lain yang bisa menjelaskan hal ini adalah tidak semua hewan yang diperiksa sampel otaknya berasal dari hewan yang mati dengan gejala klinis rabies. Banyak sampel yang diperiksa dalam penelitian ini berasal dari hewan yang dieutanasia karena mulai menunjukkan gejala klinis rabies, kasus gigitan, atau bahkan merupakan hasil eliminasi terhadap anjing liar. Beragamnya sejarah sampel yang diperiksa tentu akan memberikan gambaran distribusi antigen yang berbeda di dalam jaringan otak. Ini terkait dengan lamanya virus sudah berada di dalam tubuh hewan (masa inkubasi) sampai hewan diambil sebagai sampel.
Pemeriksaan rabies secara laboratorium tentu membutuhkan keterampilan khusus bagi penguji. Begitu juga dengan pemeriksaan rabies dengan teknik IHC yang juga memerlukan keterampilan khusus, ketelitian dan
pengalaman yang cukup untuk terbiasa melihat perubahan /reaksi yang terjadi pada preparat yang diperiksa/diuji. Pada beberapa sampel positif rabies, tidak ditemukan adanya negri bodi intra sitoplasmik tetapi tampak adanya imunoreaktif dengan antigen virus rabies pada beberapa neuron. Hal ini mungkin saja akan terlewatkan oleh penguji apabila tidak melakukan pemeriksaan dengan cermat dan teliti. Pada penelitian ini juga tidak menutup kemungkinan akan
terjadinya hal tersebut.
SIMPULAN DAN SARAN
Simpulan
Teknik IHC memiliki tingkat sensitifitas yang lebih rendah dibadingkn dengan FAT, namun tingkat spesifisitasnya sama dengan FAT pada pengujian sampel otak anjing yang berasal dari wilayah Bali.
Saran
Penelitian lebih lanjut perlu dilakukan unutk meningkatkan sensitifitas teknik IHC.
UCAPAN TERIMAKASIH
Kami sampaikan ucapan terima kasih kepada Kepala Balai Besar Veteriner
Denpasar , drh I Ketut Diarmita, MP, yang telah berkenan memberikan ijin dan fasilitas penelitian. Apresiasi juga kami layangkan kepada staf Balai Besar Veteriner Denpasar yakni drh Gd Agus J, IW Sudira, IK Widia dan F. Indra K atas keterlibatnya dalam penanganan dan pengujian spesimen rabies.
DAFTAR PUSTAKA
Akoso BT. 2007. Pencegahan dan Pengendalian Rabies. Penerbit Kanisius (Anggota IKAPI)
Yogyakarta.
Anjaria JM, Jhala CI. 1985. Immunoperoxidase reaction in diagnosis of Rabies. Int. J. Zoonoses 12(4): 267 – 275.
Blanton JD, Palmer D,Dyer J, Rupprecht CE. 2010. Rabies surveillance in the United States during 2010. JAVMA, 239 (6): 773-783.
Bourhy H, Dacheux L, Strady C, Mailles A. 2005. Rabies in Europe in 2005. Euro Surveillance, 10:11.
Bowen-Davies J, Lowings P. 2000.
Current perspectives on rabies.1. The biology of rabies and rabies-related viruses. In practice, March 2000, 118124.
Cynthia K, Warner, Sylvia G, Whitfield, Fekadu M, Hue H. 1997. Procedures
for reproducible detection of rabies virus antigen mRNA and genome in situ in formalin-fixed tissues. Journal of Virological Methods 67 (1997) 512.
Shankar BP. 2002. Advances in diagnosis of rabies. Veterinary World.2(2): 7478.
Subramaniam R, Madhusudana SN. 2013. Laboratory Diagnosis of Human Rabies: Recent Advances. The
Scientific World Journal, 1-10.
Singathia R, Dutta P, Yadav R, Gupta SR, Gangil R, Gattani A. 2012. Current Update on Rabies Diagnosis. IJAVMS, 6: 229-240.
Umoh JU, Blenden DC. 1981. Immunofluorescent staining of rabies virus antigen in formalin-fixed tissue after treatment with trypsin. Bulletin of the World Health Organization, 59 (5): 737-744.
Yousaf MZ, Qasim M, Zia S, Khna MR, Ashfaq UA, Khan S. 2012. Rabies molecular virology, diagnosis, prevention and treatment. Virology Journal , 9:50.
Whitfield SG, Fekadu M, Shaddock JH. 2001. A comparative study of the fluorescent antibody test for rabies diagnosis in fresh and formalin-fixed brain tissue specimens. J. Virol. Methods.95:145– 151.
59
Discussion and feedback