In Silico Study of Soursop Leaf Compounds (Annona muricata L.) As Inhibitors of BRAF V600E Kinase in Melanoma Cancer
on

JURNAL FARMASI UDAYANA | pISSN: 2301-7716; eISSN: 2622-4607 | VOL. 11, NO. 2, 2023
https://doi.org/10.24843/JFU.2022.v11.i02.p07
Studi In Silico Senyawa Daun Sirsak (Annona muricata L.) Sebagai Inhibitor BRAF V600E Kinase Pada Kanker Melanoma
Audry Rahma Dewayani1, Salsabil Ghaliya1, Natashya Parameswari1, Alya Puteri Agustina Pribadi1, Husna Muharram Ahadi1, Diah Lia Aulifa1, Angela Alysia Elaine1 dan Bernap Dwi Putra Sitinjak1
-
1 Departemen Analisis Farmasi dan Kimia Medisinal, Fakultas Farmasi, Universitas Padjadjaran, Sumedang, Jawa Barat, Indonesia, 45363
Reception date of the manuscript: 2022-07-03
Acceptance date of the manuscript: 2022-01-22
Publication date: 2023-01-31
Abstract—Melanoma is a cancer that develops in melanocytes and manifests itself on the skin as lumps and uneven skin pigmentation. A chemotherapeutic medication called Vemurafenib is one of the medicines used to treat this malignancy. However, the use of chemotherapeutic drugs must be limited due to the risk of resistance following therapy. Therefore, this study is carried out to identify V600E inhibitor compounds that could substitute chemotherapy drugs like vemurafenib with the same therapeutic profiles and efficacy through molecular docking simulations. This research was conducted with in silico method, which included molecular docking utilizing the softwares such as ChemDraw Ultra 12.0, Chem3D Pro 12.0, AutoDockTools-1.5.6., and BIOVIA Discovery Studio 2021 Client. Lipinski’s Rule of 5 and PreADMET were also used to predict the pharmacokinetic profiles with references from the SwissADME, PreADMET, and PubChem websites. Compounds found in soursop leaves (Annona muricata L.) have been shown to inhibit cell division by interacting with the BRAF V600E receptor. Reticuline has a Gibbs energy of -8.78; a 395.39 nM inhibition constant; and binds to the amino acids GLN A:530, CYS A: 532, and ASP A: 594. Reticuline, which is found in the leaves of the soursop plant, has the greatest potential to inhibit the growth of cancer cells.
Keywords—melanoma cancer; molecular docking; soursop leaf; Annona muricata; BRAF V600E
Abstrak—Kanker melanoma merupakan sebuah keganasan yang terjadi pada sel melanosit. Karakteristik dari kanker ini yaitu tonjolan dan warna yang tidak beraturan pada kulit. Pengobatan yang digunakan saat ini salah satunya adalah agen kemoterapi vemurafenib. Namun, pengobatan dengan agen kemoterapi dapat mengakibatkan resistensi sehingga penggunaannya terbatas. Maka dari itu, dilakukan penelitian yang bertujuan untuk mencari senyawa inhibitor V600E yang dapat mengantikan agen kemoterapi seperti vemurafenib dengan karakteristik terapeutik dan efikasi yang sama melalui simulasi penambatan molekuler. Penelitian ini dilakukan dengan metode in silico, yakni penambatan molekuler dengan menggunakan perangkat lunak ChemDraw Ultra 12.0, Chem3D Pro 12.0, AutoDockTools-1.5.6., dan BIOVIA Discovery Studio 2021 Client. Dilakukan juga prediksi terhadap profil farmakokinetik menggunakan aturan Lipinski dan PreADMET dengan referensi melalui website SwissADME, PreADMET, dan PubChem. Senyawa dari daun tanaman sirsak (Annona muricata L.) diketahui memiliki potensi untuk menghambat aktivitas pembelahan sel melalui interaksi dengan reseptor BRAF V600E. Reticuline diketahui memiliki nilai energi Gibbs sebesar -8,78; nilai konstanta inhibisi sebesar 395.39 nM; dan berikatan pada asam amino GLN A:530, CYS A:532; ASP A:594. Reticuline merupakan senyawa dari daun tanaman sirsak yang memiliki potensi terbesar dalam menghambat pertumbuhan sel kanker.
Kata Kunci—kanker melanoma; penambatan molekuler; daun sirsak; Annona muricata; BRAF V600E
Kanker merupakan penyakit yang ditandai dengan adanya sel abnormal yang berkembang tanpa terkendali dan memiliki kemampuan untuk menyerang dan berpindah antar sel dan
Penulis koresponden: Natashya Parameswari,
Email:natashya20001@mail.unpad.ac.id
jaringan tubuh. Kanker merupakan penyakit penyebab kematian tertinggi dimana terhitung hampir 10 juta kematian pada tahun 2020. Kanker paru merupakan kanker dengan angka kematian tertinggi (1,8 juta kematian), diikuti dengan kanker kolon dan rektum (916 ribu kematian), kanker hati (830 ribu kematian), kanker perut (769 ribu kematian) dan disusul kanker payudara (685 ribu kematian) (WHO, 2022).
Melanoma dilaporkan merupakan kanker paling umum ke-19 di seluruh dunia, dengan perkiraan tingkat insiden standar
usia 2,8-3,1 per 100.000. Ada variasi yang cukup besar dalam kejadian antar negara, dengan tingkat tertinggi dilaporkan di Australia (37 per 100.000) dan terendah di Asia Tengah bagian Selatan (0,2 per 100.000). Insiden melanoma di seluruh dunia telah meningkat pesat selama 50 tahun terakhir. Melanoma paling banyak terjadi pada populasi berkulit putih, dan di daerah dengan garis lintang yang lebih rendah. Melanoma pada dasarnya lebih sering terjadi pada populasi geriatri, tetapi melanoma juga merupakan kanker yang paling umum ditemukan pada populasi remaja dan dewasa muda. Dengan perkiraan 325.000 kasus baru pada tahun 2020, melanoma pada kulit menyumbang 1,7 % dari diagnosis kanker global. (Ali et al, 2013; Saginala et al, 2021).
Melanoma adalah malignansi dari melanosit, sel penghasil melanin (pigmen) di lapisan basal epidermis. Melanosit merupakan sel yang berasal dari krista syaraf sehingga melanoma dapat timbul di lokasi lain dimana sel-sel krista saraf bermigrasi (Ott, 2019; Tarhini et.al.,2019). Hal ini juga didukung dengan kemampuannya mengekspresikan banyak molekul sinyal serta faktor yang berperan dalam metastasis dan migrasinya (Saginala et al, 2021). Pada sel mela-nosit, proliferasi sel diatur melalui jalur MAPK (mitogen-activated protein kinase) terdiri dari RAS, RAF, MEK dan ERK (Inamdar et.al.,2011). Pada sel normal adanya aktivasi RAS (KRAS, NRAS, dan HRAS) akan mengadopsi keadaan aktifnya, RAS-GTP,yang berikatan di membran untuk mengaktifkan protein RAF (ARAF, BRFA, CRAF). Selanjutnya hal itu mengaktifkan MEK 1/2, yang selanjutnya memfos-forilasi ERKI dan ERK2. ERK yang teraktivasi akan mem-fosforilasi serangkaian substrat yang mengatur ekspresi gen pada muskuloskeletal, metabolisme, diferensiasi, proliferasi dan penuaan hingga kematian seluler yang berperan besar dalam pertumbuhan tumor (Santarpia et.al.,2012). Adanya mutasi pada gen-gen yang mengkode protein-protein komponen MAPK menyebabkan proliferasi yang tidak terkontrol pada sel melanosit (Arijana et.al.,2011).
Salah satu mutasi yang paling sering terjadi adalah mutasi BRAF, yang ditemukan pada 7 % kanker, dimana 90 % dian-taranya adalah mutasi V600E. Mutasi V600E terjadi di dekat motif DFG pada activation segment dimana terjadi substitusi valine (V) oleh asam glutamat (E) yang terletak di posisi 600 pada urutan asam amino (Ottaviano, M. et al, 2021). Adanya mutasi BRAF diketahui terjadi pada kanker melanoma (92 %). Mutasi ini menyebabkan protein dalam keadaan aktif secara terus menerus dan aktivitasnya meningkat hingga 500x (Angeline Kodariah, 2016).
Saat ini, pengobatan untuk kanker melanoma adalah menggunakan agen kemoterapi seperti paclitaxel, cisplatin, carboplatin, dacarbazine, temozolomide (American Cancer Society, 2019). Selain itu, terapi target juga sudah digunakan seperti vemurafenib, dabrafenib, trametinib, cobimeti-nib, encorafenib, dan binimetinib (National Cancer Institute, 2021). Namun, penggunaan terapi target diketahui kurang efektif sehingga digunakan dengan cara kombinasi (Syakir dan Anggraini, 2020).
Pengobatan-pengobatan tersebut diketahui menimbulkan banyak efek samping pada tubuh khususnya pada agen kemoterapi. Kemoterapi tidak hanya mempengaruhi sel kanker, namun dengan kemoterapi juga mempengaruhi semua sel lain dalam tubuh. Secara khusus, sel-sel yang paling terpengaruh oleh efek sitotoksik kemoterapi adalah sel-sel
yang memiliki karakteristik yang sama dengan sel-sel tumor, terutama pembelahan sel berkecepatan tinggi, seperti folikel rambut, sumsum tulang, sel-sel saluran pencernaan, dan sel-sel sistem reproduksi (Prieto-Callejero et al, 2020). Selain itu, kemoterapi dapat menyebabkan imunosupresi dimana biasanya pasien rentan terkena infeksi oportunis (Ma, C. Armstrong, A. W., 2013). Untuk mengatasi efek samping dari pengobatan dengan kemoterapi dapat digunakan kombinasi senyawa bioaktif alami dengan obat kemoterapi tradisional yang memiliki potensi meningkatkan efikasi antikanker dan mengurangi efek samping kemoterapi. Dalam beberapa kasus, penambahan senyawa bioaktif dapat mengatasi kemo atau radio-resistensi sel kanker. Dari penelitian yang ada efek sinergis dari senyawa nutraceutical seperti flavonoid, stilbenes, terpen, kurkumin, dan lain-lain berpotensi untuk dijadikan salah satu komponen untuk kombinasi senyawa bioaktif alami dengan obat kemoterapi tradisional, oleh sebab itu perlu dilakukan penelitian lebih lanjut terhadap senyawa bioak-tif yang dapat digunakan untuk mengatasi kanker (Nurgali et al, 2018).
Annona muricata merupakan tumbuhan yang biasa dikenal dengan tumbuhan sirsak di Indonesia. Tumbuhan ini banyak dibudidayakan di daerah tropis dan subtropis di Amerika Tengah dan Selatan, dan Asia Tenggara. A. muricata banyak digunakan dalam pengobatan tradisional untuk menyembuhkan berbagai penyakit di banyak negara. Studi fitokimia telah dilakukan pada A. muricata dan ditemukan 212 senyawa yang telah diisolasi dan diidentifikasi. Penyelidikan menyeluruh menunjukkan bahwa daunnya adalah sumber utama senyawa etnomedisinal yang digunakan untuk melawan tumor dan kanker. Banyak bukti menunjukkan bahwa ekstrak daun A. muricata menekan pertumbuhan tumor pada model hewan. Sementara itu, pemeriksaan in vitro menunjukkan bahwa daun A. muricata memiliki efek sitotoksik terhadap sel kanker pankreas, sel kanker payudara, dan sel karsinoma paru-paru (Wahab et al, 2018).
Adanya sifat sitotoksik ini dikarenakan sirsak, terutama bagian daunnya, memiliki kandungan acetogenin. Acetogenin memiliki dua unit fungsional tetrahydrofuran hydroxylated (THF), dan cincin γ - l akt on-β -unsat urat ed. Rantai furanone dalam gugus hydrofuranone memiliki aktivitas sito-toksik yang tinggi, dimana dapat menghambat dan menghentikan pertumbuhan sel kanker (Siswarni, M. et al, 2016). Selain golongan acetogenin, daun sirsak juga mengandung beberapa senyawa yang termasuk ke dalam golongan alkaloid. Pada daun sirsak ditemukan beberapa senyawa alkaloid seperti reticuline, higenamine, remerine, isoboldine, liriodeni-ne, isopulegol, dan asimilobine (Wahab et al, 2018). Telah banyak penelitian yang menyatakan bahwa senyawa alkaloid yang dihasilkan dari tanaman obat menunjukkan adanya kemampuan untuk menghambat proliferasi serta metastasis dari sel kanker seperti kanker payudara, kanker prostat, dan kanker kolon, baik secara in vitro, in vitro, maupun in silico (Mondal et al, 2019). Namun, belum terdapat penelitian yang membahas mengenai senyawa dari daun sirsak dapat menghambat proliferasi sel melanoma. Oleh karena itu, penulis tertarik melakukan studi in silico, untuk melihat potensi dari senyawa yang terkandung Annona muricata dalam menghambat proliferasi melanoma.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah struktur reseptor BRAF V600E (PDB ID: 3OG7) dalam format PDB yang diperoleh dari RCSB Protein Data Bank (https://www.rcsb.org/), struktur senyawa uji dari daun sirsak yaitu anonaine, xylopine, annonacin A, coclaurine, annomuricin B, annomuricin C, annomuricin E, reticuline, higenamine, remerine, isoboldine, liriodeni-ne, isopulegol, asimilobine, asam heksanoat, kaempferol, serta struktur pembanding vemurafenib. Alat yang digunakan dalam penelitian ini berupa perangkat keras ber-merk Lenovo dengan prosesor AMD Ryzen 3 3200U Radeon Vega Mobile Gfx, CPU 2.60 GHz, dan 8 GB RAM. Sementara itu program yang digunakan adalah Chem-Draw Ultra 12.0, Chem3D Pro 12.0, AutoDockTools-1.5.6 (The Scripps Research Institute, USA), serta BIOVIA Discovery Studio 2021 Client. Selain itu digunakan juga website SwissADME (http://www.swissadme.ch/), PreAD-MET (https://preadmet.webservice.bmdrc.org/), dan Pub-Chem (https://pubchem.ncbi.nlm.nih.gov/).
Metode
Prediksi Kesesuaian Senyawa Terhadap Aturan Lipinski
Prediksi kesesuaian senyawa terhadap aturan Lipinski dilakukan pada website SwissADME (http://www.swissadme.ch/) dengan cara memasukkan kode SMILES masing-masing senyawa, kemudian program secara otomatis akan menampilkan prediksi kesesuaian terhadap aturan Lipinski. Suatu senyawa dapat diberikan secara oral harus memenuhi kriteria seperti pada aturan Lipinski, yaitu berat molekul senyawa ≤ 500 Da, koefisien partisi ≤ 5, donor ikatan hidrogen ≤ 5, dan akseptor ikatan hidrogen ≤ 10.
Prediksi Absorpsi, Distribusi, dan Toksisitas
Prediksi absorpsi, distribusi, metabolisme, dan ekskresi dilakukan pada website PreADMET (https://preadmet.webservice.bmdrc.org/) dengan cara memasukkan kode MOLFile masing-masing senyawa, kemudian program secara otomatis akan menampilkan nilai prediksi ADMET.
Preparasi Struktur Protein dan Ligan Uji
Struktur protein BRAF V600E (PDB ID: 3OG7) yang telah diunduh dari website RCSB Protein Data Bank di-preparasi menggunakan program BIOVIA Discovery Studio 2021 Client. Sementara itu native ligand dipreparasi menggunakan program ChemDraw Ultra 12.0 dan Chem3D Pro 12.0 serta ligan uji diunduh dari website PubChem (https://pubchem.ncbi.nlm.nih.gov/) dan dipreparasi menggunakan program Chem3D Pro 12.0.
Validasi Penambatan Molekuler
Validasi dilakukan dengan redocking native ligand dengan reseptor yang telah dipisahkan dengan native ligand-nya menggunakan program AutoDockTools-1.5.6. Kriteria keberterimaan validasi apabila nilai reference RMSD ≤ 2.
Simulasi Penambatan Molekuler
Simulasi penambatan molekuler senyawa uji daun sirsak dan senyawa pembanding terhadap reseptor dilakukan dengan menggunakan program AutoDockTools-1.5.6 dengan ukuran grid box 48 x 24 x 24; grid coordinate x: 2.643, y: -2.28, z: -19.403; jarak 0,375 Å; dan docking parameters 100 GA. Hasil konformasi kemudian divisualisasikan secara dua dimensi dan tiga dimensi menggunakan program BIOVIA Discovery Studio 2021 Client.
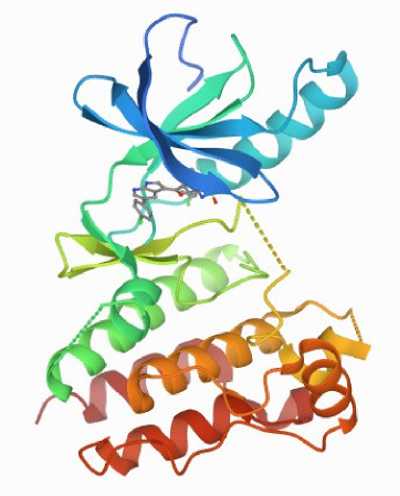
Gambar. 1: Struktur Reseptor BRAF V600E (PDB ID: 3OG7)
Prediksi Kesesuaian Senyawa Terhadap Aturan Lipinski
Tabel 1 menunjukkan hasil dari prediksi Lipinski, dimana prediksi ini dapat menggambarkan permeabilitas suatu senyawa yang diwakili oleh parameter-parameter seperti berat molekul, log P, ikatan hidrogen akseptor, dan ikatan hidrogen donor. Hasil prediksi menunjukkan bahwa senyawa annona-cin A, annomuricin B, annomuricin C, dan annomuricin E memiliki pelanggaran lebih dari 2, sementara senyawa lainnya masih memenuhi persyaratan.
Prediksi Absorpsi, Distribusi, dan Toksisitas
Hasil prediksi di bawah ini menunjukkan gambaran profil farmakokinetik suatu senyawa. Parameter yang ditinjau untuk absorpsi adalah HIA (Human Intestinal Absorption) dan Caco2; untuk distribusi adalah PPB (Plasma Protein Binding) dan BBB (Blood Brain Barrier); serta untuk toksisi-tas adalah Ames Test yang mendeskripsikan mutagenisitas dan Rodent carcinogenicity yang mendeskripsikan karsino-genisitas. Hasil dari prediksi profil farmakokinetik menunjukkan senyawa isoboldine dan reticuline memiliki nilai prediksi yang paling baik diantara senyawa lainnya.
Validasi Penambatan Molekuler
Pada hasil proses redocking, diperhatikan pada reference RMSD. Metode yang valid apabila nilai reference RMSD ≤
Tabel 1: HASIL PREDIKSI KESESUAIAN SENYAWA TERHADAP ATURAN LIPINSKI
|
Nama Senyawa |
Parameter Berat molekul (Da) |
Log P |
Ikatan hidrogen akseptor |
Ikatan hidrogen donor |
Violation |
Drug likeness |
|
Anonaine |
265,31 |
2,88 |
1 |
3 |
- |
Suitable |
|
Xylopine |
295,33 |
2,88 |
1 |
4 |
- |
Suitable |
|
Annonacin A |
596,88 |
6,93 |
4 |
7 |
2 |
Unsuitable |
|
Coclaurine |
285,34 |
2,36 |
3 |
4 |
- |
Suitable |
|
Annomuricin B |
612,88 |
6,11 |
5 |
8 |
2 |
Unsuitable |
|
Annomuricin C |
612,88 |
6,18 |
5 |
8 |
2 |
Unsuitable |
|
Annomuricin E |
612,88 |
6,08 |
5 |
8 |
2 |
Unsuitable |
|
Reticuline |
329,39 |
2,64 |
2 |
5 |
- |
Suitable |
|
Higenamine |
271,31 |
1,93 |
4 |
4 |
- |
Suitable |
|
Remerine |
279,33 |
3,13 |
0 |
3 |
- |
Suitable |
|
Isoboldine |
327,37 |
2,45 |
2 |
5 |
- |
Suitable |
|
Liriodenine |
275,26 |
2,88 |
0 |
4 |
- |
Suitable |
|
Isopulegol |
154,25 |
2,42 |
1 |
1 |
- |
Suitable |
|
Asimilobine |
267,32 |
2,65 |
2 |
3 |
- |
Suitable |
|
Asam heksanoat |
265,42 |
4,19 |
1 |
2 |
- |
Suitable |
Tabel 2: HASIL PREDIKSI ABSORPSI, DISTRIBUSI, DAN TOKSISITAS
|
Nama senyawa |
Absorbsi |
Distribusi |
Toksisitas | ||||
|
HIA (%) |
Caco2 (nm/sec) |
PPB ( %) |
BBB |
Mutagen |
Karsinogen (rat) |
Karsinogen (mouse) | |
|
Anonaine |
96,5 |
476,818 |
65,56 |
0,985 |
Mutagen |
Negative |
Negative |
|
Xylopine |
95,78 |
49,183 |
60,23 |
0,85 |
Mutagen |
Negative |
Negative |
|
Annonacin A |
89,002 |
42,019 |
100 |
7,149 |
Non-mutagen |
Negative |
Positive |
|
Coclaurine |
89,64 |
7,299 |
97,170 |
0,693 |
Mutagen |
Negative |
Negative |
|
Annomuricin B |
82,250 |
21,498 |
100 |
4,925 |
Non-mutagen |
Negative |
Positive |
|
Annomuricin C |
82,250 |
21,498 |
100 |
4,925 |
Non-mutagen |
Negative |
Positive |
|
Annomuricin E |
82,250 |
21,498 |
100 |
4,925 |
Non-mutagen |
Negative |
Positive |
|
Reticuline |
93,264 |
12,256 |
83,959 |
1,008 |
Non-mutagen |
Negative |
Negative |
|
Higenamine |
84,178 |
5,850 |
100 |
0,919 |
Mutagen |
Negative |
Negative |
|
Remerine |
100 |
56,772 |
74,322 |
1,804 |
Mutagen |
Negative |
Negative |
|
Isoboldine |
93,265 |
245,565 |
61,235 |
1,518 |
Non-mutagen |
Negative |
Negative |
|
Liriodenine |
97,448 |
27,536 |
87,245 |
2,918 |
Mutagen |
Positive |
Negative |
|
Isopulegol |
100 |
38,716 |
100 |
5,640 |
Mutagen |
Negative |
Negative |
|
Asimilobine |
93,174 |
26,308 |
63,678 |
2,468 |
Mutagen |
Negative |
Positive |
|
Asam heksanoat |
98,297 |
260,735 |
100 |
8,218 |
Mutagen |
Negative |
Positive |
|
Kaempferol |
79,439 |
9,577 |
89,608 |
0,286 |
Mutagen |
Positive |
Negative |
2. Hasil redocking yang telah dilakukan menunjukkan bahwa reference RMSD ≤ 2.
Simulasi Penambatan Molekuler
Tabel 3 menunjukkan luaran dari simulasi penambatan molekuler senyawa uji dari daun sirsak dan senyawa pembanding (Vemurafenib) terhadap reseptor BRAF V600E. Luaran tersebut menunjukkan nilai-nilai berupa energi bebas Gibbs, konstanta inhibisi, dan ikatan asam amino yang terbentuk antara senyawa dengan reseptor. Senyawa yang paling mendekati dengan nilai-nilai dari senyawa pembanding yaitu reticuline. Sementara itu, senyawa yang paling tidak mendekati nilai senyawa pembanding yaitu annomuricin E.
Melanoma merupakan jenis kanker kulit berbahaya yang terjadi pada melanosit karena adanya perkembangbiakan sel-sel kulit yang sangat cepat dipengaruhi mutasi DNA akibat paparan sinar UV. Salah satu terapi target penghambat pertumbuhan melanoma adalah Vemurafenib, yang juga merupakan senyawa pembanding pada simulasi penambatan molekuler di penelitian ini. Vemurafenib bekerja dengan
penghambatan aktivitas kinase BRAF, yakni mencegah adanya pensinyalan dari jalur kinase Mitogen-Activated Pathway (MAP) serta memblokir proliferasi sel ganas yang memiliki mutasi spesifik. Meskipun Vemurafenib memiliki efikasi untuk mengatasi melanoma, obat ini justru dapat menyebabkan efek samping yang signifikan pada kulit, seperti karsinoma sel skuamosa dan keratoakantoma (Khaddour et al., 2022). Maka dari itu, dilakukan kajian untuk mendapatkan senyawa alternatif yang memiliki efek samping sekecil mungkin agar meminimalkan komplikasi penggunaan Vemurafenib untuk mengobati melanoma.
Tabel 3: LUARAN SIMULASI PENAMBATAN MOLEKUL
|
Nama Senyawa |
Energi bebas Gibbs (kkal/mol) |
Parameter Konstanta inhibisi (nM) |
Ikatan hidrogen |
Ikatan lainnya |
|
Vemurafenib |
-11.58 |
3.22 |
ASP A:594 GLY A:596 PHE A:595 GLN A:530 CYS A:532 GLY A:593 |
TRP A:531 ALA A:481 LEU A:514 LYS A:483 THR A:529 LEU A:505 PHE A:583 |
|
Anonaine |
-7.53 |
3010 |
PHE A:595 ASP A:594 LYS A:483 CYS A:532 |
VAL A:471 TRP A:531 ILE A:463 ILE A:527 LEU A:505 PHE A:583 |
|
Xylopine |
-6.99 |
7580 |
CYS A:532 LYS A:483 GLN A:530 |
LEU A:514 PHE A:583 GLN A:530 TRP A:531 ALA A:481 ILE A:463 VAL A:471 |
|
Annonacin A |
-8,54 |
652.93 |
PHE A:595 ASP A:594 LYS A:483 CYS A:532 |
LEU A:505 ILE A:527 ILE A:527 LYS A:483 VAL A:471 PHE A:583 TRP A:531 |
|
Coclaurine |
-7.02 |
7100 |
ASP A:594 CYS A:532 |
LEU A:505 LEU A:514 TP A:531 THR A: 529 ALA A:491 LYS A:483 ILE A:527 |
|
Annomuricin B |
-4.18 |
870.04 |
CYS A:532 |
ILE A:463 TRP A:531 ALA A:431 LEU A:505 VAL A:471 PHE A:583 LYS A:483 LEU A:514 PHE A:595 LEU A:505 |
|
Annomuricin C |
-5.83 |
53000 |
GLN A:530 |
VAL A:471 ALA A:481 VYS A:532 PHE A:583 TRP A:531 LEU A:514 LYS A:483 ILE A:527 LEU A:505 PHE A:595 |
|
Annomuricin E |
-5.44 |
102990 |
PHE A:595 GLY A:596 ASP A:594 |
LYS A: 483 ALA A:481 VAL A:471 |
ILE A: 463
TRP A:531
CYS A:532
PHE A:583
LEU A:514
Tabel 3: LUARAN SIMULASI PENAMBATAN MOLEKUL
|
Nama Senyawa |
Energi bebas Gibbs (kkal/mol) |
Parameter Konstanta inhibisi (nM) |
Ikatan hidrogen |
Ikatan lainnya |
|
Reticuline |
-8,78 |
395.39 |
GLN 1:539 CYS A:532 ASP A:594 |
ALA A:481 VAL A:471 LEU A:514 LYS A:483 ILE A:527 LEU A:505 |
|
Higenamine |
-7.25 |
4840 |
CYS A:532 THE A:529 ASP A:594 |
GLY A:596 ILE A:527 LYS A:483 ALA A:481 PHE A:583 LEU A:514 TRP A:531 |
|
Remerine |
-7 |
7410 |
CYS A:532 GLN A:530 |
TRP A:531 LEU A:541 ALA A:481 PHE A:583 VAL A:471 ILE A:463 |
|
Isoboldine |
-7.5 |
3210 |
CYS A:532 |
ILE A:527 LYS A:483 PHE A:468 VA; A:471 ALA A:481 TRP A:481 TRP A:531 LEU A:514 PHE A:583 ASP A:594 ASN A:581 |
|
Liriodenine |
-7.84 |
1780 |
CYS A:532 |
LEU A:514 PHE A:583 VAL A:471 ALA A:481 TRP A:531 ILE A:463 |
|
Isopulegol |
-6.32 |
23370 |
ASP A:594 |
ILE A:527 LYS A:483 LEU A:505 PHE A:595 LEU A:514 |
|
Asimilobine |
-6.75 |
11260 |
GLN A:530 CYS A:532 |
LEU A:514 PHE A:583 VAL A:471 ALA A:481 TRP A:531 |
|
Asam heksanoat |
-4.69 |
279700 |
GLY A:596 LYS A:483 ASP A:594 |
LEU A:514 LEU A:505 PHE A:595 |
|
Kaempferol |
-7 |
7370 |
GLY A:534 CYS A:532 GLN A:530 THR A:529 LYS A:483 |
TRP A:531 ALA A:481 VAL A:471 LEU A:514 |
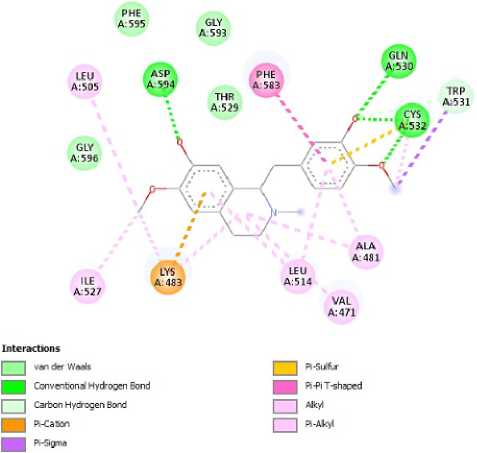
Gambar. 2: Hasil Visualisasi 2 Dimensi Senyawa Reticuline dengan BRAF V600E
Pada proses pencarian senyawa obat baru, Lipinski’s Rule of Five merupakan acuan yang digunakan untuk memprediksi sifat kemiripan obat, terutama sifat fisikokimia suatu senyawa terhadap tingkat penyerapan oral yang tinggi dalam tubuh manusia (Doak et al., 2014). Parameter yang ditetapkan pada Lipinski’s Rule of Five adalah nilai koefisien partisi (Log P) ≤ 5, berat molekul ≤ 500 g/mol, ikatan hidrogen akseptor 10, dan ikatan hidrogen donor ≥ 5 (Goodwin et al., 2017). Ketika suatu senyawa memenuhi kelima prinsip tersebut, maka senyawa tersebut akan meningkatkan sifat far-makokinetik dan bioavailabilitas dalam proses metabolisme organisme.
Koefisien partisi berhubungan dengan tingkat lipofilisitas obat karena hal ini mempengaruhi kemampuan suatu senyawa untuk menembus membran sel yang terdiri dari lipid. Apabila nilai log P semakin besar, maka sifat hidrofobisitas senyawa semakin besar dan kemampuan untuk berpenetrasi ke dalam membran sel semakin kuat. Namun, jika koefisien partisi melebihi 5, suatu senyawa akan tertahan lebih lama pada membran sehingga menyebabkan toksisitas yang lebih tinggi dan terjadi pengurangan selektivitas ikatan antara senyawa obat dan protein target. Kemudian, senyawa obat yang baik adalah senyawa yang memiliki berat molekul kurang dari 500 g/mol karena apabila berat molekul obat melebihi nilai tersebut, kemampuannya untuk menembus membran biologis kurang baik. Pada parameter ikatan hidrogen, jumlah ikatan hidrogen akseptor dan donor yang baik adalah masing-masing tidak melebihi 10 dan 5. Jika jumlah ikatan hidrogen semakin banyak, maka semakin besar energi yang diperlukan untuk melakukan proses absorpsi (Kilo et al., 2019). Berdasarkan hasil pengujian (Tabel 1), senyawa reticuline, anonaine, xylopine, coclaurine, reticuline, higena-mine, remerine, isoboldine, liriodenine, isopulegol, asimilo-bine, asam heksanoat, dan kaempferol yang terkandung dalam daun sirsak (Annona muricata) telah memenuhi persyaratan aturan Lipinski sehingga senyawa ini dapat digunakan secara oral.
Prediksi ADMET dilakukan dengan tujuan untuk mengetahui profil farmakokinetik dari suatu senyawa. Prediksi yang
dilakukan pada penelitian ini adalah absorpsi, distribusi, serta toksisitas. Parameter absorpsi yang ditinjau meliputi HIA (Human Intestinal Absorption) yang memprediksi absorpsi pada usus dan Caco2 yang memprediksi permeabilitas perpindahan obat melalui sel epitel usus dari sel kolon adeno-karsinoma. Nilai HIA 0-20 % dideskripsikan dengan kurang baik, 20-70 % dideskripsikan dengan baik, dan 70-100 % dideskripsikan dengan baik. Sementara itu, nilai Caco2 kurang dari 4 nm/detik berarti memiliki kemampuan absorpsi yang rendah, 4-70 nm/detik memiliki kemampuan absorpsi sedang, dan lebih dari 70 nm/detik memiliki kemampuan absorpsi yang tinggi. Setelah dilakukan pengujian, diketahui bahwa seluruh senyawa yang diuji memiliki nilai HIA yang baik karena berkisar antara 70-100 %. Sementara itu, pada pengujian Caco2 diketahui bahwa seluruh senyawa memiliki nilai parameter Caco2 yang sedang karena berada pada rentang 4-70 nm/detik.
Sementara itu, parameter distribusi yang ditinjau meliputi PPB (Plasma Protein Binding) dan BBB (Blood Brain Barrier). PPB menunjukkan apakah suatu senyawa berikatan dengan protein dalam darah. Semakin rendah nilai PPB, maka suatu senyawa hanya sedikit dalam bentuk tidak terikat oleh plasma sehingga mudah untuk berdifusi dan berinteraksi dengan target. Kriteria nilai PPB >90 % menunjukkan senyawa terikat kuat dengan plasma dan nilai PPB <90 % menunjukkan senyawa terikat lemah dengan plasma. Senyawa an-nonaine, xylopine, reticuline, roemerine, isoboldine, liriode-nine, asimilobine, dan kaempferol memiliki nilai PPB kurang dari 90 %, sementara itu senyawa annonacin A, annomuricin B, annomuricin C, annomuricin E, coclaurine, higenamine, isopulegol, dan asam heksanoat memiliki nilai PPB lebih dari 90%. BBB merupakan parameter yang menunjukkan apakah senyawa obat mampu menembus sawar darah otak. Nilai BBB <1 menunjukkan senyawa memiliki kemampuan penetrasi terhadap sawar darah otak yang rendah, nilai 1 - 2 sedang, dan >2 tinggi. Hasil prediksi menunjukkan bahwa senyawa annonaine, xylopine, coclaurine, higenamine, dan kaempferol memiliki nilai BBB <1. Sementara itu senyawa reticuline, roemerine, dan isoboldine memiliki nilai BBB 1 -2 dan senyawa lainnya memiliki nilai BBB >2.
Sedangkan untuk parameter toksisitas yang digunakan yaitu Ames test dan Rodent carcinogenicity. Ames test dilakukan untuk melihat apakah senyawa yang diteliti bersifat mutagen untuk menginduksi mutasi pada DNA didalam sel baik secara in-vitro maupun in-vivo yang akan berpengaruh pada struktur DNA. Sementara itu, Rodent carcinogenicity merupakan pengujian pada tikus dan mencit untuk melihat apakah senyawa uji bersifat karsinogen. Hasil pengujian mo-tagenisitas menunjukkan senyawa annonacin A, annomuricin B, annomuricin C, annomuricin E, reticuline, dan isoboldine tidak memiliki potensi mutagenik. Sementara senyawa lainnya diketahui memiliki potensi mutagenik. Hasil pengujian karsinogenisitas menunjukkan beberapa senyawa berpotensi karsinogen pada tikus yaitu liriodenine dan pada mencit yaitu annonacin A, annomuricin B, annomuricin C, annomuricin E, asimilobine, dan asam heksanoat serta senyawa lainnya tidak menunjukkan potensi karsinogenik. Dari hasil pengujian farmakokinetik, diketahui senyawa dengan profil farmakoki-netik yang terbaik adalah reticuline dan isoboldine.
Setelah dilakukan pengujian PreADME dan Toksisitas, pengujian dilanjutkan dengan Molecular Docking. Molecu-

Gambar. 3: Hasil Visualisasi 3 Dimensi Senyawa Reticuline dengan BRAF V600E
lar docking dilakukan untuk memprediksi pengikatan suatu model calon obat dengan target proteinnya, memprediksi afinitas dari aktivitas suatu molekul calon obat serta melihat geometri tiga dimensi dari senyawa yang terikat pada sisi aktif protein (Pratama et al.,2017). Sebelum tahap ini dilakukan, dilakukan validasi dengan menambatkan ulang ligan bawaan dari protein BRAF V600E. Validasi ini bertujuan memastikan metode yang digunakan baik dan dapat digunakan untuk tahap penelitian selanjutnya dengan melihat parameter RMSD (Lestari et al.,2015). RMSD adalah pengukuran dua pose dengan cara membandingkan posisi atom antara struktur eksperimental terhadap struktur yang di docking. Metode docking dikatakan valid apabila diperoleh nilai RMSD 2Å (Mustika et al.,2021). Hasil penambatan ulang ligan alami menunjukkan nilai RMSD kurang dari 2 yang berarti metode valid dan dapat digunakan pada penambatan molekuler dengan senyawa uji.
Setelah dilakukan molecular docking dengan senyawa uji, akan didapatkan nilai energi ikat (△G) dan konstanta inhi-bisi (Ki) yang menunjukkan afinitas antara ligan uji dengan protein. Energi Gibbs ini memberikan gambaran kestabilan ikatan yang terbentuk, dimana semakin negatif tingkat kestabilan akan semakin baik antara ligan dan reseptor sehingga ikatan yang terbentuk semakin kuat (Syahputra et al.,2014). Ketika dilakukan penambahan molekuler terhadap ke - 16 senyawa, diketahui bahwa senyawa dengan konstanta inhi-bisi terendah, energi Gibbs terkecil dan residu asam amino yang paling mirip dengan senyawa pembanding adalah senyawa reticuline. Selain parameter tersebut, ditinjau pula terkait residu asam amino. Interaksi asam amino menunjukkan bahwa adanya kontak yang terjadi antara senyawa dengan reseptor dan memungkinkan adanya aktivitas. Interaksi asam amino terletak pada binding site atau area ikatan. Semakin banyak kemiripan asam amino pada senyawa pemban-ding/asam amino kunci terhadap BRAF V600E, kemungkinan senyawa tersebut memiliki aktivitas yang sama atau lebih baik. Asam amino kunci yang terkait dengan reseptor BRAF V600E adalah GLN A:530, CYS A:532; ASP A:594; THR A:529. Pada senyawa reticuline, asam amino yang berikatan hidrogen yang sama dengan senyawa pembanding Vemurafe-nib/asam amino kunci yakni GLN 530 dan ASP 549. Selain itu, terdapat ikatan lain yang sama seperti LEU 505 dan LYS 483.
Dari rangkaian penelitian ini, dapat diperoleh kesimpulan senyawa reticuline merupakan senyawa yang berpotensi sebagai inhibitor BRAF V600E. Jika dilihat dari hasil penambatan molekuler, dimana senyawa ini memiliki nilai energi Gibbs terendah sebesar -8,78 kkal/mol, konstanta inhibisi yang paling rendah sebesar 395,39 nM, dan nilainya paling mendekati dengan senyawa pembanding. Asam amino yang berikatan dengan reseptor juga merupakan asam amino kunci dari reseptor BRAF V600E, yaitu GLN A:530, CYS A:532; ASP A:594. Selain itu, senyawa ini memiliki hasil prediksi ADMET yang cukup baik, dimana absorbsinya tergolong tinggi, nilai plasma binding proteinnya yang rendah, dan memiliki sifat non mutagen, serta non karsinogenik. Maka dari itu, dapat disimpulkan bahwa senyawa reticuline memiliki potensi dalam menghambat perkembangan kanker melanoma yang bekerja pada reseptor BRAF V600E.
Penulis mengucapkan terima kasih kepada semua pihak atas saran dan bantuannya dalam melakukan penelitian serta penulisan artikel ilmiah ini.
Ali, Z., Yousaf, N., Larkin, J. (2013). Melanoma epidemiology, biology and prognosis. EJC : official journal of EORTC, European Organization for Research and Treatment of Cancer. 11(2), 81–91. https://doi.org/10.1016/j.ejcsup.2013.07.012
American Cancer Society. (2019). Chemotherapy for Melanoma Skin Cancer. https://www.cancer.org/cancer/melanoma-skin-cancer/treating/chemotherapy.htmlref erences
Doak, B.C., Over, B., Giordanetto, F., dan Kihlberg, J. (2014). Oral Druggable Spade Beyond The Rule of 5: Insights from Drugs and Clinical Candidates. Chemistry Biology, 21 (9), 1115-1142. https://doi.org/10.1016/j.chembiol.2014.08.013
Goodwin, R.J.A., Bunch, J., dan McGinnity, D.F. 2017. Mass Spectrometry Imaging in Oncology Drug Discovery. Advances in Cancer Research, 134, 133-171. https://doi.org/10.1016/bs.acr.2016.11.005
Khaddour, K., Kurn, H., dan Zito, P.M. (2022). Vemurafenib. https://www.ncbi.nlm.nih.gov/books/NBK535429/
Kilo, A.L., Aman, L. O., Sabihi, I., dan Kilo, J.L. (2019). Studi Potensi Pirazolin Tersubstitusi 1-N dari Tiosemikarbazon sebagai Agen Antimuba Melalui Uji in silico. Indo. J. Chem. Res., 7 (1), 9-16. https://ojs3.unpatti.ac.id/index.php/ijcr/article/view/725
Kumar, R., Giri, A., Nadendla, R. R. (2018). in si-lico ADME Profiling Of CDK9 Inhibitors. Journal of Scientific Research in Pharmacy. 7(3): 3034. https://doi.org/10.5281/zenodo.1207094 Lestari, T. 2015. Studi Interaksi Senyawa Turunan 1,3- Diben-zoiltiourea sebagai Ribonukleotida Reduktase Inhibitor. Jurnal Farmasi Indonesia. Vol. 7: 163–169
Ma, C. Armstrong, A. W. (2013). Severe adverse events from the treatment of advanced melanoma: a systematic review of severe side effects associated with ipilimumab, vemurafenib, interferon alfa-2b, dacarbazine and interleukin-2. Journal of Dermatological Treatment, 25(5), 401–408. https://doi.org/10.3109/09546634.2013.813897
Mustika, D.N.,dan Fakih, T.M., Aprilia, H. 2021. Uji In-Silico Aktivitas Melanogenesis Senyawa Turunan Betacyanin Buah Naga Merah
(Hylocereus Polyhizuz) sebagai Inhibitor Enzim Tirosinase. Prosiding Farmasi, 7(2): 443446. https://karyailmiah.unisba.ac.id/index.php/ farmasi/article/view/29391/ National Cancer Institute. (2021). Melanoma Treatment. https://www.cancer.gov/types/skin/hp/melanoma-treatment-pdq
Nurgali, K., Jagoe, R. T., Abalo, R. (2018). Editorial: Adverse Effects of Cancer Chemotherapy: Anything New to Improve Tolerance and Reduce Sequelae?. Frontiers in pharmacology, 9, 245. https://doi.org/10.3389/fphar.2018.00245
Ott PA.(2019). Intralesional Cancer Immunotherapies. Hematol Oncol Clin North Am, 33(2), 249-260. https://doi.org/10.1016/j.hoc.2018.12.009 Prata-ma, A.A., Rifai, Y., Marzuki,A. (2017). Docking Molekuler Senyawa 5,5’-Dibromometilsesamin. Majalah Farmasi dan Farmakologi, 21(3), 67-69. https://doi.org/10.20956/mff.v21i3.6857
Prieto-Callejero, B., Rivera, F., Fagundo-Rivera, J., Romero, A., Romero-Martín, M., Gómez-Salgado, J., Ruiz-Frutos, C. (2020). Relationship between chemotherapy-induced adverse reactions and health-related quality of life in patients with breast cancer. Medicine, 99(33), 21695. https://doi.org/10.1097/MD.0000000000021695
Saginala, K.,Barsouk, A., Aluru, J.S., Rawla, P., Barsouk,A. (2021). Epidemiology of Melanoma. Medical Science, 9(4), 63. https://doi.org/10.3390
Santarpia, L., Lippman, S.L., dan El-Naggar, A. 2012. Targeting the Mitogen-Activated Protein Kinase RAS-RAF Signaling Pathway in Cancer Therapy. Expert Opinion in Theurapeutic Targets, 16(1), 113-119. https://doi.org/10.1517/14728222.2011.645805 Siswar-ni, M., Nurhayani., Sinaga, S. 2016. Ekstraksi asetoge-nin dari daun dan biji Sirsak (Annona muricata L.) dengan Pelarut Aseton. Jurnal Teknik Kimia USU, 5(2), 14. https://doi.org/10.32734/jtk.v5i2.1533
Syakir, M. A. dan Anggraini, D. I. (2020). Terapi Imunologi Pada Melanoma. Jurnal Ilmiah Kedokteran Indonesia, 8(2), 103–110. https://doi.org/10.53366/jimki.v8i2.118
Syahputra, B., Ambarsari, L., dan Sumaryada, T. (2014). Simulasi Docking Kurkumin Enol, Bisdemetoksi-kurkumin dan Analognya sebagai Inhibitor Enzim 12-Lipooksigenase. Jurnal Biofisika, 10(1): 55-67. https://journal.ipb.ac.id/index.php/biofisika/article/view /9354/7334
Tarhini A, Atzinger C, Gupte-Singh K, Johnson C, Macahi-lig C, Rao S. (2019). Treatment patterns and outcomes for patients with unresectable stage III and metastatic melanoma in the USA. J Comp Eff Res, 8(7), 461-473. https://doi.org/10.2217/cer-2019-0003 WHO. (2022). Cancer pada Mei 2022. https://www.who.int/news-room/fact-sheets/detail/cancer
Wahab, S.M.A., Jantan, I., Haque, Md.A., dan Arshad, L. 2018. Exploring the Leaves of Annona muricata L. as a Source of Potential Anti-inflammatory and Anticancer Agents. Frontiers in Pharmacology, 9(661), 1-20. https://doi.org/10.3389 %2Ffphar.2018.00661
DEWAYANI, DKK.
88
Discussion and feedback