UJI PENANGKAPAN RADIKAL 2,2-DIFENIL-1-PIKRIHIDRAZIL DAN PROFIL BIOAUTOGRAFI EKSTRAK ETANOL KULIT BATANG BIDARA (Ziziphus mauritiana Auct. non Lamk.)
on
JUNAL FARMASI UDAYANA
Vol. 6 No 1 Tahun 2017 ISSN 2301-7716
UJI PENANGKAPAN RADIKAL 2,2-DIFENIL-1-PIKRIHIDRAZIL DAN PROFIL BIOAUTOGRAFI EKSTRAK ETANOL KULIT BATANG
BIDARA (Ziziphus mauritiana Auct. non Lamk.)
Samirana, P. O.1, Putra, P. A. S.1, Leliqia, N. P. E.1
1Jurusan Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana
Korespondensi: Putu Oka Samirana
Jurusan Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana Jalan Kampus Unud-Jimbaran, Jimbaran-Bali, Indonesia 80364 Telp/Fax: 0361-703837
Email: oka_samirana@unud.ac.id
ABSTRAK
Bidara atau yang dikenal dalam bahasa latin Ziziphus mauritiana Auct. non Lamk. telah dilaporkan memiliki aktivitas antioksidan. Aktivitas antioksidan yang dimiliki tanaman ini berasal dari metabolit sekunder yang tekandung didalamnya. Penelitian ini bertujuan untuk menguji aktivitas antioksidan dari ekstrak etanol 96% kulit batang Ziziphus mauritiana dan mengetahui golongan senyawa apa yang berperan dalam menciptakan aktivitas antioksidan dengan profil bioautografi.
Uji penangkapan radikal bebas DPPH dilakukan untuk mengetahui aktivitas antioksidan yang dimiliki ekstrak etanol 96% kulit batang Z. Mauritiana dengan parameter nilai IC50. Penentuan profil bioautografi dilakukan untuk mengetahui golongan senyawa apa saja yang berperan dalam aktivitas antioksidan yang meliputi pemeriksaan terhadap senyawa golongan triterpenoid, saponin, flavonoid, dan alkaloid.
Hasil pengujian menunjukkan, ekstrak etanol 96% kulit batang Z. Mauritiana memiliki kemampuan penangkapan radikal bebas dengan IC50 19,32±0,17 µg/mL. Senyawa golongan saponin dan flavonoid yang terkandung dalam ekstrak diketahui memiliki aktivitas antioksidan.
Kata Kunci: Bidara, Ziziphus mauritiana, Kulit Batang, Ekstrak Etanol, Antioksidan, Bioautografi
ROS (reactive oxygen species) dapat diproduksi di dalam tubuh selama metabolisme sel normal dan apabila jumlahnya berlebih, maka ROS dapat menyerang molekul biologis seperti lipid, protein, dan enzim yang selanjutnya dapat menyebabkan kerusakan sel atau jaringan.
Antioksidan merupakan senyawa yang mampu menunda, memperlambat atau mencegah proses oksidasi. Dalam hal
kesehatan manusia, antioksidan merupakan salah satu komponen yang mampu menghambat ROS, spesies nitrogen reaktif, dan juga radikal bebas di dalam tubuh. Tubuh manusia memiliki antioksidan alami di dalamnya, akan tetapi terkadang antioksidan di dalam tubuh ini jumlahnya tidak cukup untuk mengatasi semua radikal yang ada di dalam tubuh. Sehingga diperlukan antioksidan dari luar tubuh yang dapat diperoleh dari alam.
Tumbuhan merupakan salah satu sumber antioksidan di alam. Kandungan metabolit sekunder tumbuhan dapat memiliki aktivitas antioksidan yang dapat dimanfaatkan manusia. Salah satu tumbuhan yang telah diketahui memiliki aktivitas antioksidan adalah bidara
Bidara atau Ziziphus mauritiana telah dilaporkan memiliki aktivitas antioksidan (Samirana et al., 2014). Perumal et al. (2012), melaporkan bahwa ekstrak metanol kulit batang Z. mauritiana memiliki aktivitas penangkapan radikal bebas DPPH dengan nilai IC50 20,09 ± 0,19 μg/mL dibandingkan dengan standar BHT yang memiliki nilai IC50 sebesar 18,50 ± 0,19 μg/mL. Perbedaan tempat tumbuh dapat mempengaruhi kualitas dari metabolit sekunder yang dihasilkan yang berdampak pada khasiat dari tanaman itu sendiri (Ekka et al., 2008). Sehigga penelitian ini bertujuan untuk menguji aktivitas antioksidan dari kulit batang tumbuhan bidara yang ada di daerah Bukit Jimbaran Bali dan mengetahui golongan senyawa apa yang berperan sebagai antioksidan.
Kulit batang Z. mauritiana dari daerah Bukit Jimbaran, Kabupaten Badung, Bali, etanol 96%, plat silika gel GF254 (Merck), DPPH (2,2-difenil-1-pikrilhidrazil), pereaksi vanilin-asam sulfat, vitamin C, pelarut seperti amonia, etil asetat, butanol, asam asetat, kloroform, metanol dan toluen
yang masing-masing berderajat pro analisis dan Aquadest yang berderajat teknis.
-
2.2 Alat Penelitian
Toples kaca, blender, sudip, sendok tanduk, pisau, alat gelas, timbangan analitik (AND®), kertas saring, Rotary evaporator (Eyela®), Spektrofoto meter UV-VIS (Shimadzu 1240 UV Mini) dan alat semprot
-
2.3 Preparasi Sampel
Kulit batang Z. mauritiana diperoleh dari daerah Bukit Jimbaran, Bali. Sampel kulit batang selanjutnya dikeringkan terhindar dari sinar matahari langsung. Serbuk simplisia selanjutnya dibuat dengan menggunakan blender dan pengayak.
-
2.4 Ekstraksi
Sebanyak 1 kg serbuk kulit batang Z.mauritiana kering dimaserasi dengan etanol 96% selama ±24 jam. Pengadukan dilakukan sesekali selama maserasi. Maserat yang didapat kemudian disaring dan residu dimaserasi kembali. Remaserasi dilakukan sebanyak 2 kali. Filtrat yang didapat kemudian ditampung menjadi satu dan diuapkan dengan menggunakan Rotary evaporator pada suhu 45-50oC. Rendemen ekstrak hasil maserasi kemudian dihitung dengan persamaan 1.
%Rendemen = A1/A0 x 100%..............(1)
Keterangan:
A1 = Bobot ekstrak yang diperoleh
A0 = Bobot serbuk simplisia yang dimaserasi
-
2.5 Uji Penangkapan Radikal DPPH
Uji penangkapan radikal bebas DPPH dilakukan sesuai dengan metode yang diajukan oleh Kikuzaki et al. (2002). Ekstrak etanol 96% kulit batang Z. mauritiana dilarutkan dan diencerkan dengan metanol hingga diperoleh
beberapa seri konsentrasi. Vitamin C digunakan sebagai kontrol positif yang dibuat dengan beberapa seri konsentrasi dalam metanol. Larutan DPPH disiapkan dengan menimbang 15,8 mg serbuk DPPH, kemudian dilarutkan dalam labu ukur 100 mL dengan metanol hingga tanda batas. Sampel uji ditambahkan dengan 1,0 mL DPPH 0,4 mM dan 3,950 mL methanol yang kemudian divorteks dan dibiarkan selama 30 menit. Absorbansi sampel kemudian diukur pada panjang gelombang 515 nm dengan blanko yang digunakan adalah metanol. Pengukuran absorbansi juga dilakukan terhadap kontrol yang terdiri atas 1,0 mL DPPH dan 4,0 mL metanol. Nilai IC50 selanjutnya diperoleh dengan membuat persamaan regresi linier. Semakin kecil nilai dari IC50, maka semakin kuat senyawa uji tersebut sebagai penangkap radikal DPPH.
-
2.6 Penentuan Profil Bioautografi Penentuan profil bioautografi mengadaptasi metode yang diajukan Rahman (2012). Ekstrak kulit batang Z. mauritiana dilarutkan ke dalam metanol dan ditotolkan pada plat silika gel GF254. Plat kemudian di elusi menggunakan sistem pelarut yang sesuai dengan golongan senyawa kimia yang akan diidentifikasi. Fase gerak yang digunakan dapat dilihat pada tabel 1.
Alkaloid Toluen:Amonia (90:10 v/v)
Plat KLT dielusi sampai tanda batas dalam bejana pengembang yang telah dijenuhkan. Setelah dielusi, plat KLT dikeluarkan dan dikeringkan pada suhu ruang. Plat kemudian disemprot dengan 0,02% DPPH dalam metanol. Diamati adanya perubahan warna spot selama kurang lebih 10 menit. Hasil positif adanya penangkapan radikal DPPH oleh senyawa antioksidan ditunjukkan dengan perubahan warna area spot yang semula ungu (setelah disemprot DPPH) menjadi warna kuning.
-
2.7 Analisis Data
Data aktivitas antioksidan berupa IC50 dibandingkan dengan menggunakan uji indenpendet t-test.
Ekstrak kental yang diperoleh dari proses maserasi dengan etanol 96% sebanyak 76,2098 gram dengan rendemen ekstrak sebesar 7,6 % b/b.
-
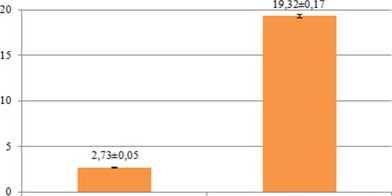
3.2 Uji Penangkapan Radikal DPPH Berdasarkan hasil penelitian didapatkan perbandingan kemampuan penangkapan radikal bebas DPPH antara vitamin C dengan ekstrak etanol 96% kulit batang Z. mauritiana yang dapat dilihat pada gambar 1.
Tabel 1. Sistem Fase Gerak untuk penentuan profil bioautografi (Harborne, 1987; Reich and Blatter, 2003; Markham, 1988).
Golongan Senyawa Flavonoid
Sistem Fase Gerak
Butanol: Asam Asetat: Air (4:1:5 v/v)
Triterpenoid Kloroform: Metanol
(20:1 v/v)
Saponin Kloroform: Metanol:
Air (70:30:4 v/v)
Ekstrak etanol 96° o kulit batang Z maurtttana
Gambar 1. Diagram rata-rata nilai IC50
-
3.3 Penentuan Profil Bioautografi
Berdasarkan hasil penyemprotan DPPH didapatkan hasil seperti yang dapat dilihat pada gambar 2.
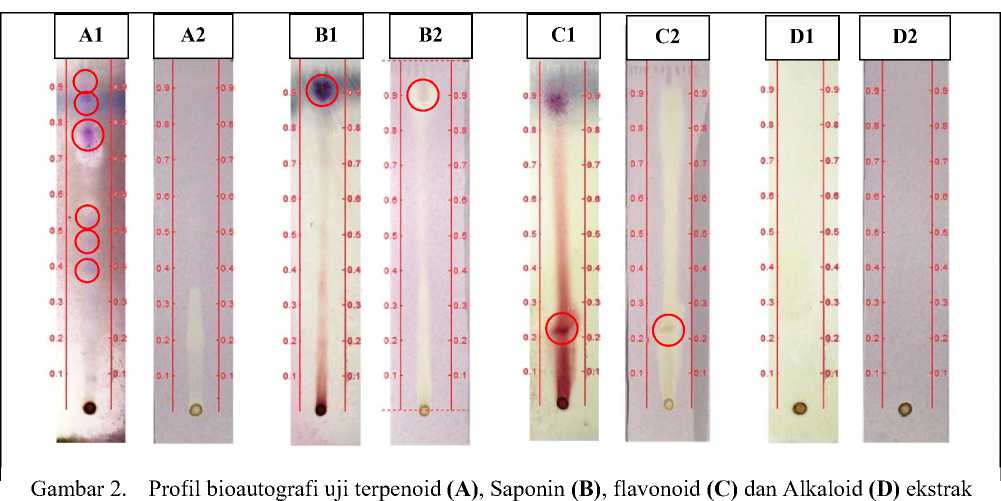
etanol kulit batang Z. mauritiana setelah disemprot vanilin-asam sulfat (1) dan DPPH (2).
bercak menjadi kuning pada bercak yang
Berdasarkan hasil uji konfirmasi aktivitas antioksidan, didapatkan nilai rata-rata IC50 dari vitamin C sebesar 2,73±0,05 µg/mL dan ekstrak etanol 96% kulit batang Z. mauritiana sebesar 19,32±0,17 µg/mL. Hasil analisis menunjukkan nilai IC50 ekstrak etanol 96% kulit batang Z. mauritiana lebih besar dan berbeda bermakna dibandingkan dengan nilai IC50 vitamin C. Hal ini menandakan bahwa ekstrak etanol 96% kulit batang Z. mauritiana membutuhkan konsentrasi yang lebih banyak untuk menghambat 50% dari jumlah radikal DPPH yang ada dibandingkan dengan vitamin C. Sehingga potensi aktivitas antioksidan dari ekstrak etanol 96% kulit batang Z. mauritiana masih lebih rendah dibandingkan dengan vitamin C.
Berdasarkan Gambar 2, Pada uji golongan senyawa terpenoid dengan penyemprotan pereaksi vanilin-asam sulfat diamati terdapat beberapa bercak berwarna ungu yang menunjukkan hasil positif adanya golongan senyawa triterpenoid.
diduga sebagai senyawa golongan triterpenoid. Hasil ini menandakan bahwa senyawa golongan triterpenoid yang ada pada ekstrak tidak memiliki aktivitas antioksidan.
Pada uji golongan senyawa saponin dengan penyemprotan pereaksi vanilin-asam sulfat diamati terdapat bercak berwarna ungu yang menunjukkan hasil positif adanya golongan senyawa saponin (Harbone, 1987). Penyemprotan dengan DPPH menunjukkan adanya perubahan warna bercak menjadi kuning pada bercak yang menunjukkan bahwa golongan senyawa saponin yang terkandung dalam ekstrak memiliki aktivitas antioksidan.
Pada uji golongan senyawa flavonoid dengan penyemprotan pereaksi vanilin-asam sulfat diamati terdapat bercak berwarna merah lembayung yang menunjukkan hasil positif adanya golongan senyawa flavonoid (Harbone, 1987). Penyemprotan dengan DPPH menunjukkan
adanya perubahan warna bercak menjadi kuning. Hal ini menunjukkan bahwa golongan senyawa flavonoid yang terkandung dalam ekstrak memiliki aktivitas antioksidan.
Pada uji golongan senyawa alkaloid, tidak nampak perubahan warna apapun setelah dilakukan penyemprotan baik menggunakan vanilin-asam sulfat ataupun dengan DPPH. Hasil ini menunjukkan tidak adanya senyawa alkaloid yang terkandung di dalam ekstrak. Hasil ini berbeda dengan hasil beberapa pustaka yang melaporkan bahwa kulit batang Z. mauritiana mengandung senyawa alkaloid (Gaur and Sharma, 2013; Jain et al., 2012). Kondisi lingkungan tempat tumbuh diduga menjadi salah satu faktor penyebab tidak terdapatnya senyawa golongan alkaloid pada ekstrak kulit batang Z. mauritiana. Hal ini didukung anggapan yang diajukan Kardono (2003) yang menyatakan bahwa perbedaan kondisi lingkungan tempat tumbuh dapat menyebabkan perbedaan jenis dan jumlah metabolit sekunder yang terkandung dalam suatu tanaman.
Ekstrak etanol 96% kulit batang Z. Mauritiana memiliki kemampuan penangkapan radikal bebas DPPH dengan IC50 sebesar 19,32±0,17 µg/mL. Aktivitas antioksidan dari ekstrak etanol 96% kulit batang Z. Mauritiana tidak terlepas dari peran golongan senyawa yang terkandung didalamnya yaitu senyawa golongan saponin dan flavonoid.
Pustaka
Ekka, N. R., K. P. Namdeo, and P. K. Samal. 2008. Standardization Strategies for Herbal Drugs An Overview. Research Journal of Pharmacy and Technology. 1(4): 1-3.
Gaur A. and G. N. Sharma. 2013. Ziziphus mauritiana Lam-an overview. Indo
American Journal of Pharm Research. 3(6): 4560-4566.
Harborne, J.B. 1987. Phytochemical Methods: A Guide to Modern Techniques of Plant Analysis. 2nd edition. New York: Chapman and Hall Ltd. Page 33-211.
Jain A., S.B. Dhyani. 2012. Phytochemical Screening of Secondary Metabolites of Zizphus mauritiana lam. bark. International Journal of Current Pharmaceutical Research. 4(3): 156159.
Kardono, L. B. S. 2003. Kajian Kandungan Kimia Mahkota Dewa (Phaleria marcocarpa). Jakarta: Pusat Penelitian dan Pengembangan Farmasi dan Obat Tradisional Badan Penelitian dan Pengembangan Kesehatan. Halaman 56.
Kikuzaki, H., M. Hisamoto, K . Hirose, K. Akiyama, and H. Taniguchi. 2002. Antioxidants Properties of Ferulic Acid and Its Related Compounds. Journal of Agricultural and Food Chemistry. 50: 2161-2168.
Markham, K.R. 1988. Cara Mengidentifikasi Flavonoid. Bandung: Penerbit ITB. Halaman 25-26.
Marks, D. B., D. M. Allan, and M. S. Collen. 2000. Biokimia Kedokteran Dasar. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 323.
Perumal, S., R. Mahmud, S.P. Piaru, L.W. Cai and S. Ramanathan. 2012. Potential Antiradical Activity and Cytotoxycity Assesment of Ziziphus mauritiana and Syzygium polyanthum. International Journal of Pharmacology. 8(6): 535541.
Rahman, S. 2012. Antioxidant, Analgesic, Cytotoxic and Anthidiarrheal Activities of Ethanolic Zizyphus mauritiana Bark Extract. Oriental Pharmacy and Experimental Medicine, 12: 67-73.
Reich, E. and A. Blatter. 2003. Modern TLC : A Key Technique of Identification and Quality Control of Botanical and Dietary Supplements. Journal of Planar Chromatography-Modern TLC. 18: 34-37.
Samirana, Oka. 2014. Isolasi dan Identifikasi Senyawa Penangkap Radikal 2,2-Difenil-1-Pikrihidrazil dari Kulit Batang Bidara (Zizyphus mauritiana Auct non Lamk.) (Tesis). Yogyakarta: Universitas Gadjah Mada.
61
Discussion and feedback