Stabilitas pH Antosianin Terhadap Profil Fingerprint Umbi Ubi Jalar Ungu (Ipomoea BatatasL.)
on
Stabilitas pH Antosianin Terhadap Profil Fingerprint Umbi Ubi Jalar Ungu (Ipomoea BatatasL.)
(Dewi, L. P. M. K., Sumawirawan, K. D., Sugosha, M. J., Guna, I. M. A. W., Sukawati, C. B. A. C.,
Sari, P. M. N. A.,Jawi, I. M.,Wirasuta, I. M. A. G.)
Stabilitas pH Antosianin Terhadap Profil Fingerprint Umbi Ubi Jalar Ungu (Ipomoea BatatasL.)
Dewi, L. P. M. K.1, Sumawirawan, K. D.1 , Sugosha, M. J.1, Guna, I. M. A. W.1, Sukawati, C. B. A. C.1, Sari, P. M. N. A.1,Jawi, I. M.2, Wirasuta, I. M. A. G.1
1Jurusan Farmasi Fakultas Matematika Dan Ilmu Pengetahuan Alam Universitas Udayana 2Bagian Farmakologi Fakultas Kedokteran Universitas Udayana
Korespondensi: Kadek Dedi Sumawirawan
Jurusan Farmasi – Fakultas Matematika Dan Ilmu Pengetahuan Alam – Universitas Udayana Jalan Kampus Unud-Jimbaran, Jimbaran-Bali, Indonesia 80364 Telp/Fax: 0361-703837
Email : dedi.sumawirawan@gmail.com
ABSTRAK
Umbi ubi jalar ungu diketahui memiliki kandungan antosianin yang cukup tinggi, yakni sekitar 110-210 mg per 100 gram umbi. Kandungan antosianin tersebut menyebabkan umbi ubi jalar ungu memiliki beberapa efek farmakologi seperti antioksidan, antiinflamasi, dan hepatoprotektif. Antosianin merupakan senyawa flavonoid yang tidak stabil. Stabilitas antosianin sangat dipengaruhi oleh pH larutannya. Antosianin lebih stabil pada pH asam dari pada dalam suasana basa ataupun netral. Stabilitas antosianin yang rendah ini dapat menyebabkan perbedaan pada suatu ekstrak dan berujung pada perbedaan aktivitas yang dihasilkan.
Penelitian ini bertujuan untuk mengetahui kondisi stabil dilakukannya kromatografi fingerprint pada ubi jalar ungu. Sampel serbuk umbi ubi jalar ungu diekstraksi menggunakan larutan metanol yang memiliki pH bervariasi (1, 3, 5, dan 7). Ekstrak dianalisis menggunakan metode KLT-Spektrofotodensitometri dengan fase diam berupa silika gel 60 F 254 dan fase gerak n-butanol : asam asetat glacial : air (4:1:2 v/v) dalam penelitian ini. Data yang didapatkan kemudian diolah menggunakan analisis fungsi kosinus.
Hasil penelitian menunjukkan sampel yang diekstraksi dengan metanol pH 1 merupakan pH stabil dilakukannya analisis kromatografi fingerprint, karena ekstrak pada pH 1 mempunyai warna antosianin yang stabil, yakni warna merah. Pada fingerprint ekstrak pH 1 juga memiliki tambahan puncak pada Rf 0,23 yang diduga merupakan antosianin dalam bentuk kation flavilium yang stabil di pH sangat asam.
Kata kunci : Ipomoea batatasL., antosianin, KLT-Spektrofotodensitometri, pH, fingerprint.
-
1. PENDAHULUAN
Ubi jalar ungu (Ipomoea batatas L.) merupakan anggota dari family Convolvulaceae. Umbi ubi jalar ungu memiliki memiliki aktivitas farmakologi seperti antioksidan (Jawiet al., 2007), antiinflamasi (Wang et al., 1999), antikarsinogenik (Wang et al., 1999), antitumor (Kong et al., 2003), antidiabetik (Jayaprakasmet al., 2005), neuroprotektif (Wang et al., 1999), antimutagenik dan hepatoprotektif (Kong et al., 2003). Khasiat tersebut timbul berkat adanya
kandungan antosianin yang cukup tinggi pada umbi ubi jalar ungu. Penelitian menunjukkan bahwa dalam 100 gram umbi, terdapat 110-210 mg antosianin (Supraptaet al., 2004). Berdasarkan hal tersebut dapat diketahui bahwa ubi jalar ungu memiliki manfaat yang sangat penting bagi kesehatan sehingga sangat berpotensi untuk digunakan sebagai obat herbal.
Molekul antosianin disusun dari sebuah aglikon (antosianidin) yang teresterifikasi dengan satu atau lebih gula (glikon) (Markakis,
1982). Sianidin dan peonidin merupakan antosianidin utama pada ubi jalar ungu (Jiao et al., 2012). Sianidin dan peonidin berperan dalam memberikan warna merah dan biru pada ubi jalar ungu. (Truong et al., 2010). Kultivar ubi jalar ungu yang berbeda akan memiliki komposisi antosianin yang berbeda pula (Jiao et al., 2012), sehingga potensi ubi jalar ungu sangat tergantung dari kandungan antosianin yang dimiliki. Maka dari itu diperlukan suatu standarisasi ubi jalar ungu yang mampu menetapkan kualitas ubi jalar ungusebagai obat herbal.
Salah satu standarisasi yang di syaratkan oleh WHO untuk produk herbal yaitu kromatografi fingerprint. Kromatoragi fingerprint merupakan suatu bentuk kromatografi darisenyawa aktif dan juga zat kimia lain yang terkandung dalam produk herbal (MacLennan et al., 2002). Metode yang digunakan dalam penentuan fingerprint antara lain HPLC – UV (DAD), HPLC – MS, GC – MS dan TLC – Densitometri (Giriet al., 2010). KLT– Spektrofotodensitometri merupakan pilihan yang paling tepat digunakan untuk mengetahui kromatogram fingerprint dari suatu produk herbal. Keuntungan penggunaan KLT adalah penggunaannya yang sederhana, serba guna, mempunyai kecepatan dan sensitivitas tinggi, serta kemudahan dalam preparasi sampelnya. Dikombinasikan dengan scanning secara digital, penggambaran data hasil KLT memudahkan interpretasi hasil analisis senyawa-senyawa yang terdapat dalam suatu produk herbal (Amanzadeh, 2007).
Namun, hasil kromatografi fingerprint yang dilakukan pada ekstrak ubi jalar ungu bias menjadi tidak valid, karena sifat antosianin yang kurang stabil (Oancea, 2011). Diperlukan suatu uji stabilitas untuk dapat mengetahui kondisi optimal dilakukannya kromatografi fingerprint umbi ubi jalar ungu sebagai obat herbal, salah
satunya dengan uji stabilitas antosianin terhadap derajat pH yang bervariasi.
-
2. BAHAN DAN METODE
-
2.1. Bahan Penelitian
-
Bahan kimia yang digunakan adalah pelarut dan bahan kimia analisis perkualitas pro analisis n-butanol, asam asetat glasial, akuades, AlCl3, FeCl3, asam klorida, dan natrium hidroksida, jug aplat KLT Si G 60 F 254 (Merck-Germany). Umbi ubi jalar ungu didapat dari daerah Petang, kabupaten Badung, Bali.
-
2.2. Alat Penelitian
Digunakan alat-alat gelas (IWAKI pyrex), timbangan analitik (AND), pH meter (Mettler Toledo), sonikator (Branson), alat sentrifugasi (PLC series), chamber (CAMAG), Oven (Memmert), Linomat V, dan spektrofotodensitometer CAMAG TLC Scanner 3.
-
2.3. ProsedurPenelitian
Ditimbangmasing-masing 1 gram serbukumbiubijalarungu. Tambahkan 2 mL pelarut yang berbeda, yaknimetanol-HCldengan pH 1, 3, 5, dan 7. Kemudiandisonikasiselama 5 menit, dan disentrifugasiselama 10 menit. Supernatan yang terbentukdiambil dan digunakansebagailarutanuji.
Plat KLT dicuci dengan metanol, diaktivasi pada suhu 110o C selama 30 menit. Ditotolkan masing-masing larutan uji sebanyak 10 µL pada plat menggunakan Linomat. Plat dielus dalam chamber dengan fase gerak n-butanol : asam asetat glacial : air dengan perbandingan 4:1:2 v/v. Plat dipindai dengan spektrofotodensitometer TLC Scanner 3 pada panjang gelombang 540 nm dan rentang 190600 nm.
-
3. HASIL
Hasil ekstraksi serbuk umbi ubi jalar ungu dengan pH yang berbeda ditunjukkan pada gambar 1.

Ket: A. pH 1; B. pH 3; C. pH 5; D. pH 7
Gambar 1. Larutan Hasil Ekstraksi dengan pH Larutan yang Bervariasi
Secara visual, gambar 1. Menunjukkan bahwa ekstrak umbi ubi jalar ungu yang diekstraksi dengan larutan metanol-HCl pH 1 berwarna kemerahan, sedangkan ekstrak yang diekstraksi dengan pH 3, 5, dan 7 menghasilkan warna kekuningan. Hasil kromatografi fingerprint pada gambar 2. Menunjukkan adanya profil fingerprint yang berbeda antara serbuk umbi ubi jalar ungu yang diekstraksi menggunakan larutan pH 1 dengan larutan pH 3, 5, dan 7.
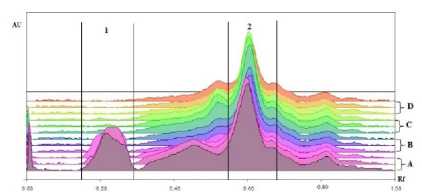
Ket: A. pH 1; B. pH 3; C. pH 5; D. pH 7
Gambar 2. Kromatogram Fingerprint Umbi Ubi Jalar Ungu pada Variasi pH Larutan
-
4. PEMBAHASAN
Antosianin merupakan suatu pigmen warna larut air yang menyebabkan warna merah (Harborne, 1987). Pada gambar 1., terlihat bahwa larutan yang berwarna merah hanya terdapat pada sampel A, yakni serbuk umbi ubi jalar ungu yang diesktraksi dengan larutan metanol-HCl pH 1. Hal tersebut menunjukkan bahwa antosianin yang terdapat pada umbi ubi jalar ungu stabil pada pH 1, dan semakin tidak
stabil dengan adanya peningkatan pH yang ditunjukkan oleh hilangnya warna merah pada ekstrak umbi ubi jalar ungu yang lain (sampel B, C, dan D).
Dari fingerprint yang ditunjukkan pada gambar 2. Juga menunjukkan adanya perbedaan. Pada profil fingerprint sampel A, terdapat puncak tambahan pada Rf 0,23 yang tidak dimiliki oleh profil fingerprint sampel lainnya. Puncak tersebut diduga merupakan antosianin dalam bentuk kation flaviliumnya, karena bentuk kation flavilium dari antosianin sangat stabil dalam pH asam kuat. Pada peningkatan pH, bentuk kation flavilium dapat berubah menjadi bentuk karbinol pseudo basa maupun basa kuinoidal karena kurangnya konsentrasi H+ dalam larutan yang menyebabkan sampel B, C, dan D kehilangan warna merahnya (Xu, 2013).
-
5. KESIMPULAN
Berdasarkan hasil penelitian, serbuk umbi ubi jalar ungu yang diesktraksi dengan larutan metanol-HCl pH 1 menujukkan stabilitas antosianin yang cukup tinggi dibuktikan dengan warna merah yang dapat terlihat pada ekstrak. Larutan ekstrak dengan pH 1 merupakan kondisi terbaik dilakukannya kromatografi fingerprint pada umbi ubi jalar ungu, karena antosianin yang terdapat pada umbi ubi jalar ungu stabil pada pH tersebut.
UCAPAN TERIMA KASIH
Staf Laboratorium Toksikologi Forensik, Lembaga Forensik Sains dan Kriminologi, Universitas Udayana atas bantuan dan dukungannya. Direktorat Jendral Pendidikkan Tinggi atas bantuan dana dalam penelitian ini.
DAFTAR PUSTAKA
Amanzadeh, Y. 2002. High-Performance Thin-Layer Chromatographic Fingerprints of Flavonoids and Phenol Carboxylic Acids for Standardization of Iranian Species of the Genus Crataegus L. Iranian Journal of Pharmaceutical Sciences. Vol. 3(3). Pp. 143152.
Giri, L., H. C. Andola, V. K. Purohit, M. S. M. Rawat, R. S. Rawal and I. D. Bhatt. 2010. Chromatographic and Spectral Fingerprinting Standardization of Traditional Medicines: an Overview as Modern Tools. Res. J. Phytochem. Vol. 4. pp. 234-241.
Sweet potato. Kansas: Kansas State
University. p. 40
Harborne, J. B. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Bandung: Institut Teknologi Bandung.
Jawi, I N., D. N. Suprapta, I W. P. Sutirta. 2007. Efek Antioksidan Ekstrak Umbi Ubi Jalar Ungu (Ipomoea batatas L.) Terhadap Hati .Dexa Media.No. 3, Vol. 20.
Jiao, Y., Y. Jiang, W. Zhaidan Z. Yang. 2012. Studies on antioxidant capacity of anthocyanin extract from purple sweet potato (Ipomoea batatas L.). African Journal of Biotechnology.
Kong, J. M., L. S. Chia, N. K. Goh, T. F. Chia, R. Brouillard . 2003. Analysis and Biological Activities of Anthocyanins. Phytochemistry. Vol. 64. pp. 923-933.
MacLennan, A.H., D. H. Wilson, A. W. Taylor. 2002. Prev. Med. Vol. 35. p. 166.
Markakis P. 1982. Stability ofAnthocyanins in Food. Di dalam: Markakis P, editor. Anthocyaninsas Food Colors. Academic Press, New York.
Oancea, simona. 2011. Anthocyanins, from Biosynthesis in Plants to Human Health Benefits. Romania. University of Sibiu.
Truong V. D., N. Deightoon, R. T. Thompson, R. F. McFeeters, L. O. Dean, K. V. Pecota dan G. C. Yencho. 2010. Characterization of anthocyanins and anthocyanidins in purple-fleshed sweetpotatoes by HPLC-DAD/ESI-MS/MS. Journal of Agricultural and Food Chemistry 58, 404-410.
Wang, H., M. G. Nair, G. M. Strasburg, Y. C. Chang, A. M. Booren, J. I. Gray, D. L. DeWitt. 1999. Antioxidant and Antiinflamatory Activities of Anthocyanins and Their Aglycon, Cyanidin, from Tart Cherries. J Nat Prod.Vol. 62. pp. 294-296.
Xu, J. 2013. Identification and Stability of AcylatedAnthocyanins in Purple-Fleshed
52
Discussion and feedback