PROSES AMPLIFIKASI DAERAH PROMOTER inhA PADAISOLAT P11Mycobacterium tuberculosis MULTIDRUG RESISTANCE DI BALI DENGAN TEKNIK POLYMERASE CHAIN REACTION
on
Proses Amplifikasi Daerah Promoter inhA pada Isolat P11 Mycobacterium tuberculosis Multidrug
Resistance di Bali dengan Teknik Polymerase Chain Reaction
(Asmara, A. A. R., Yustiantara, S., Yowani, S.C.)
PROSES AMPLIFIKASI DAERAH PROMOTER inhA PADAISOLAT P11Mycobacterium tuberculosis MULTIDRUG RESISTANCE DI BALI DENGAN TEKNIK POLYMERASE CHAIN REACTION
Asmara, A. A. R.1), Yustiantara, P. S.1,2), Yowani, S.C. 1,2) 1)Jurusan Farmasi-Fakultas Matematika dan Ilmu Pengetahuan Alam-Universitas Udayana 2)Kelompok Studi MDR& XDR-TB-Fakultas Matematika dan Ilmu Pengetahuan Alam-Universitas
Udayana
Korespondensi: Asmara, A. A. R.
Jurusan Farmasi-Fakultas Matematika dan Ilmu Pengetahuan Alam-Universitas Udayana
Jalan Kampus Unud-Jimbaran, Jimbaran-Bali, Indonesia 80364 Telp/Fax: 0361-703837
Email: ria_asmara@yahoo.com
ABSTRAK
Saat ini, Multidrug resistance Mycobacterium tuberculosis (MDR-TB) menjadi salah satu masalah kesehatan di dunia. Resistensi terhadap isoniazid dapat dipengaruhi oleh mutasi pada daerah promoter inhA. Untuk memperoleh titik mutasi di daerah promoter inhA maka terlebih dahulu dilakukan amplifikasi fragmen DNA target. Penelitian ini bertujuan untuk mengetahui suhu annealing optimum primer yang dapat mengamplifikasi fragmen target daerah promoter inhA. Fragmen target diamplifikasi dengan teknik PCR menggunakan sepasang primer yaitu primer forward (mabA-inhA-promoter-FS) dengan urutan 5’ACATACCTGCTGCGCAAT3’ dan primer reverse (mabA-inhA-promoter-R) dengan urutan 5’CTCCGGTAACCAGGACTGAA3’. Dari hasil penelitian menunjukkan bahwa sepasang primer yang digunakan pada suhu annealing 54º telah dapat mengamplifikasi fragmen 0,3 kb daerah promoter inhA.
Kata Kunci: MDR-TB, Daerah promoter inhA, Suhu annealing, PCR
-
1. LATAR BELAKANG
Tuberkulosis adalah penyakit infeksi yang disebabkan oleh bakteri Mycobacterium tuberculosis). Pada tahun 2011, tuberkulosis menempati urutan kedua penyebab kematian setelah HIV (Human Immunodeficiency Virus) (WHO, 2012). Pada tahun 2011 di Provinsi Bali terdapat 1450 kasus penderita TB paru dan sebanyak 513 kasus (35%) ditemukan di Kota Denpasar (Agung dkk., 2013).
Upaya pengendalian terhadap tuberkulosis semakin sulit dengan munculnya kasus Multidrug Resistance Tuberkulosis (MDR-TB). WHO (2012) mendefinisikan MDR-TB sebagai penyakit tuberkulosis yang disebabkan oleh M. tuberculosis yang resistensetidaknya terhadap isoniazid dan rifampisin yang merupakan obat antituberkulosis lini pertama yang paling efektif.Resistensi terhadap isoniazid dapat
terjadi akibat adanya mutasi pada inhA. Studi terhadap inhA mengungkapkan bahwa telah ditemukan mutasi pada daerah ORF (Open Reading Frame) inhA sebanyak 9 dari 41 isolat (22%). Sedangkan sebanyak 27 dari total 41 isolat (66%) menunjukkan mutasi pada daerah promoter inhA yaitu pada posisi -15 (Morlock et. al., 2003).Hazbon et al. (2003) melaporkan frekuensi terjadinya mutasi pada daerah promoter inhA sebesar 8-20% dibandingkan pada ORF (Open Reading Frame) yaitu 0-5%.Tingginya persentase mutasi yang terjadi pada daerah promoterinhA ini mendorong pentingnya dilakukan penelitian untuk menemukan titik mutasi yang mengakibatkan resistensi terhadap isoniazid. Mutasi pada daerah promoter inhA dapat menyebabkan ekspresi berlebihan dari protein InhA, peningkatan level target obat dan resistensi INH melalui
mekanisme titrasi dosis (Ramaswamy dan Musser, 1998; Zhang dan Yew, 2009).
Optimasi suhu annealing terhadap primer forward dan reverseini dilakukan untuk memperoleh satu suhu annealing yang optimal sehingga primer dapat menempel dengan tepat pada fragmen daerah target dan selanjutnya memperbanyak fragmen target. Penggunaan suhu annealing yang tepat diharapkan akandiperoleh produk PCR yang optimal.Penentuan variasi suhu yang akan digunakan pada proses optimasi suhu annealing primer didasarkan pada nilai Tm primer yang diperoleh melalui analisis in silico dengan menggunakan program Clone Manager Suite 6.
Adanya resistensi terhadap obat lini pertama tuberkulosis mendorong pentingnya deteksi cepat M. tuberculosis untuk menentukan terapi yang tepat bagi pasien. Pada penelitian ini dilakukan amplifikasi fragmen target pada daerah promoter inhA dengan menggunakan teknik PCR pada isolat MDR-TB di provinsi Bali. Tahap awal penelitian ini yaitu melakukan pemilihan primer yang tepat untuk dapat mengamplifikasi fragmen target daerah promoter inhA dan penentuan suhu annealingprimer sehingga dapat diperoleh produk PCR yang optimal.
-
2. BAHAN DAN METODE
-
2.1 Bahan Penelitian
-
Bahan yang digunakan dalam penelitian ini adalah isolat P11 MDR-TB, larutan pelisis L6 (GuSCN, Tris-HCl, EDTA dan Triton-X), suspensi diatom, buffer L2 (GuSCN, Tris-HCl), aquadest, etanol 70% dan aseton untuk proses isolasi DNA. Sepasang primer(primer forward (mabA-inhA-promoter-FS) dengan urutan 5’ACATACCTGCTGCGCAAT3’ dan primer reverse (mabA-inhA-promoter-R) dengan urutan 5’CTCCGGTAACCAGGACTGAA3’), H2O, PCR mix untuk tahap amplifikasi dengan PCR.Gel agarosa 1,5% (Promega), marker 100 bp DNA ladder,TBE (Tris-Boric Acid-EDTA) (Invitrogen) dan etidium bromide (Promega) untuk deteksi PCR dengan elektroforesis gel agarosa.
-
2.2 Prosedur Penelitian
-
2.2.1 Pemilihan dan Analisis Primer
-
Primer yang digunakan dalam proses amplifikasi fragmen target promoter inhA dengan metode PCR ditentukan melalui studi pustaka terhadap database yang terdapat pada NCBI. Pada penelitian ini digunakan sepasang primer oligonukleotida (GenBank:
U66801.1)berdasarkan penelitian oleh Chen et al. (2011) yaitu primer forward (mabA-inhA-promoter-FS) 5’ACATACCTGCTGCGCAAT3’ dan primer reverse (mabA-inhA-promoter-R) dengan urutan
5’CTCCGGTAACCAGGACTGAA3’. Analisis primer dilakukan dengan menggunakan program Clone Manager Suite 6 untuk menentukanprimer yang digunakan telah memenuhi kriteria primer dalam program dan dapat digunakan dalam proses amplifikasi dengan PCR.
-
2.2.2 Isolasi DNA M. tuberculosisMDR
Isolasi DNA M. tuberculosisdalam penelitian ini dilakukan dengan menggunakan metode Boomyang telah dimodifikasi (Boom et al., 1990).
-
2.2.3 Optimasi terhadap Suhu
AnnealingPrimerForward dan Reverse
Proses optimasi tahap awal terhadap suhu annealing dilakukan pada 6 suhu berbeda yaitu suhu 52ºC, 54ºC, 56ºC, 58ºC, 60ºC dan 62ºC. Optimasi dilakukan terhadap suhu annealing primer forward dan reverse. Pada optimasi tahap pertama dilakukan optimasi terhadap suhu annealing yaitu dengan kondisi predenaturasi pada suhu 95ºC selama 15 menit; 45 siklus PCR yang terdiri atas denaturasi pada suhu 94ºC selama 1 menit, gradien suhu annealing selama 1 menit, ekstensi pada suhu 72ºC selama 1 menit; serta ekstensi akhir pada suhu 72ºC selama 10 menit.
Optimasi tahap kedua terhadap suhu annealing dilakukan pada 3 suhu berbeda dengan perbedaan antar suhu sebesar 1ºC. Suhu yaitu suhu 54, 55 dan 56ºC. Kondisi PCR yang digunakan sama dengan kondisi PCR pada optimasi tahap pertama.Templat DNA yang
digunakan dalam formula PCR merupakan templat tanpa pengenceran.
-
2.2.4 Deteksi Produk PCR menggunakan
Elektroforesis Gel Agarosa 1,5%
Produk akhir PCR dideteksi dengan metode elektroforesis menggunakan gel agarosa 1,5% b/v yang dilarutkan dalam TBE 1x yang mengandung etidium bromida.Sampel hasil PCR sebanyak 3 µL dimasukkan ke dalam sumur gel agarosa 1,5%. Marker yang digunakan adalah marker 100 bp DNA ladder (Invitrogen) sebanyak 3 µL. Elektroforesis dilakukan selama 35 menit pada tegangan 65 volt. Visualisasi dan dokumentasi hasil elektroforesis dilakukan dengan menggunakan alat UV Transluminator Gel Doc XR System (BioRad®).
-
3 HASIL
-
3.1 Pemilihan dan Analisis Primer
-
Berdasarkan hasil analisis in silico dengan program Clone Manager Suite 6, primer forward dan reverse yang digunakan telah memnuhi kriteria primer yang baik dan dapat digunakan dalam tahap amplifikasi untuk mengamplifikasi daerah target yang diharapkan.Primer ini digunakan untuk mengamplifikasi fragmen target daerah promoter inhA sebesar 284 bp.
-
3.2 Optimasi Suhu Annealing PrimerForward dan Reverse
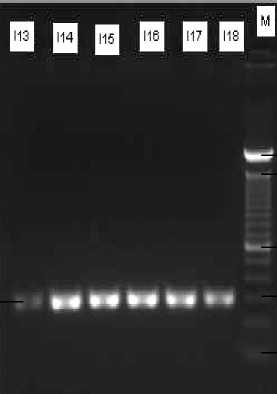
Berdasarkan hasil optimasi tahap awal diperoleh adanya pita pada isolat P11 yang menunjukkan bahwa primer yang digunakan telah berhasil mengamplifikasi sekuen DNA templat yang diinginkan. Hasil optimasi primer tahap pertama ditunjukkan pada Gambar 1.
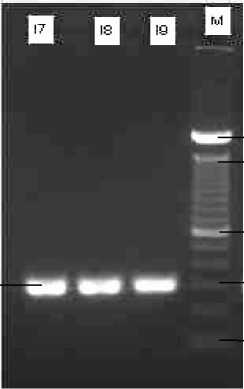
Pada hasil optimasi primer tahap pertama belum dapat ditentukan suhu annealing primer yang optimum. Untuk itu dilakukan optimasi PCR tahap kedua menggunakan tiga suhu berbeda. Hasil optimasi primer tahap kedua ditunjukkan pada Gambar 2.
284 bp <
600 bp
300 bp
100 bp
2072 bp
1500 bp
Gambar 1 Elektroforegram produk PCR hasil optimasi tahap pertama primer forward dan reverse. I13-I18: pita fragmen promoter inhAM. tuberculosis isolat P11 pada suhu 52ºC (I13), 54ºC (I14), 56ºC (I15), 58ºC (I16), 60ºC (I17), 62ºC (I18); M: Marker 100 bp DNA ladder.
284 bp
600 bp
300 bp
100 bp
2072 bp
1500 bp
Gambar 2 Elektroforegram produk PCR hasil optimasi tahap kedua primer forward dan reverse. M: Marker 100 bp DNA ladder; I7-I9: pita fragmen promoter inhAM. tuberculosis isolat P11 pada suhu 54ºC (I7), 55ºC (I8), 56ºC (I9).
-
4 PEMBAHASAN
-
4.1 Optimasi Suhu Annealing PrimerForward dan Reverse
-
Proses amplifikasi promoter inhA pada isolat P11 MDR-TB dengan teknik PCR dilakukan dengan menggunakan sepasang primer yaitu primer forward (mabA-inhA-promoter-FS) 5’ACATACCTGCTGCGCAAT3’ dan primer reverse (mabA-inhA-promoter-R) 5’CTCCGGTAACCAGGACTGAA3’ (Chen et al., 2011). Tahap annealing merupakan salah satu tahap penting dalam PCR (Handoyo dan Ari, 2001). Optimasi terhadap suhu annealingprimer forward dan reversedilakukan untuk menentukan Ta optimal agar primer dapat menempel secara spesifik pada DNA templat dan diperoleh produk PCR yang optimal.
Proses optimasi tahap awal terhadap suhu annealing dilakukan pada 6 suhu yang berbeda dengan perbedaan suhu sebesar 2ºC. Suhu yang digunakan yaitu 52ºC, 54ºC, 56ºC, 58ºC, 60ºC dan 62ºC. Pemilihan suhu tersebut didasarkan atas nilainya yang mendekati nilai Ta yang disarankan pada program Clone Manager Suite 6 yaitu suhu 55ºC. Berdasarkan hasil optimasi PCR tahap pertama (Gambar 1) diperoleh pita pada isolat P11. Hal ini menunjukkan bahwa primer yang digunakan telah berhasil mengamplifikasi sekuen DNA templat yang diinginkan. Spesifisitas penempelan primer ditunjukkan dari hanya terdapat satu fragmen DNA hasil amplifikasi dengan PCR. Produk PCR (amplikon) yang dihasilkan ditunjukkan oleh adanya pita dengan ukuran fragmen sebesar 284 pb.
Pada Gambar 1 terlihat bahwa pita fragmen promoter inhA yang dihasilkan untuk isolat P11 pada suhu annealing 54ºC, 56ºC, 58ºC dan 60ºC memiliki tebal yang relatif sama, namun pita pada suhu 62ºC relatif lebih tipis. Sementara itu, pita fragmen promoter inhA yang dihasilkan pada suhu 52ºC sangat tipis. Pita yang sangat tipis ini diasumsikan dapat disebabkan oleh perbedaan kualitas isolat dan konsentrasi DNA pada isolat. Tipisnya pita yang dihasilkan dipengaruhi oleh sedikitnya jumlah DNA yang terdapat pada sampel dan penyimpanan yang cukup lama dalam larutan sehingga terjadi
pengurangan jumlah produk (templat DNA) (McPherson dan Simon, 2006). Hasil optimasi PCR tahap pertama belum dapat menunjukkan suhu annealing yang optimum untuk digunakan pada tahap amplifikasi. Oleh karena itu, untuk menentukan suhu annealing yang optimum dilakukan kembali optimasi terhadap suhu annealing.
Pada optimasi tahap kedua ini, suhu yang dipilih yaitu mendekati nilai Ta yang disarankan pada program Clone Manager Suite 6 yaitu suhu 55ºC. Selain itu dipilih juga suhu 54ºC dan 56ºC karena berdasarkan hasil elektroforegram pada optimasi tahap pertama, visualisasi pita fragmen promoter inhA pada suhu 54ºC dan 56ºC menunjukkan pita yang relatif lebih tebal dibandingkan pada suhu lainnya. Suhu annealing yang digunakan pada optimasi tahap kedua ini adalah suhu 54, 55 dan 56ºC. Pada Gambar 2 terlihat bahwa pita fragmen promoter inhA pada isolat P11 memiliki tebal yang relatif sama pada ketiga suhu. Namun pada suhu annealing 54°C menghasilkan pita DNA yang relatif tebal secara konstan dan suhu ini memiliki kedekatan suhu annealing dengan hasil analisis in silico primer. Oleh karena itu, suhu annealing primer yang akan dipilih sebagai suhu optimum saat proses amplifikasi dengan metode PCR adalah suhu 54ºC. Hal ini karena dengan suhu yang lebih rendah diharapkan akan mempermudah terjadinya hibridisasi primer pada templat (Borah, 2011).
Hasil deteksi produk PCR dengan elektroforesis gel menunjukkan bahwa amplifikasi fragmen promoter inhA telah berhasil dilakukan yang ditunjukkan dengan adanya pita DNA berukuran 0,3 kb. Hal ini sesuai dengan hasil produk PCR (amplikon) yang diharapkan saat analisis primer yaitu sebesar 284 pb.Visualisasi elektroforegram menunjukkan pita fragmen promoter inhA yang cukup tebal sehingga dapat digunakan sebagai templat dalam proses sekuensing.Hasil tersebut menunjukkan bahwa primer forward (mabA-inhA-promoter-FS) yaitu dengan urutan 5’ACATACCTGCTGCGCAAT3’ dan primer reverse (mabA-inhA-promoter-R) dengan urutan 5’CTCCGGTAACCAGGACTGAA3’ ini telah
mampu mengamplifikasi fragmen 0,3 kb daerah promoter inhA.
-
5 KESIMPULAN
Suhu annealing optimum primer yang digunakan adalah 54ºC dan amplifikasi fragmen 0,3 kb daerah promoter inhA dengan teknik PCR telah berhasil dilakukan dengan menggunakan sepasang primer (primer forward (mabA-inhA-promoter-FS) dan primer reverse (mabA-inhA-promoter-R).
UCAPAN TERIMAKASIH
Terimakasih kami ucapkan kepada Kepala Bagian Mikrobiologi Klinik RSUP Sanglah yang telah menyediakan isolat MDR-TB dan seluruh staf Laboratorium Biomolekular Fakultas kedokteran Universitas Udayana yang telah banyak membantu dalam penelitian ini.
DAFTAR PUSTAKA
Agung, A.A. G., Sawitri, A. A., dan Wirawan, D.N.(2013). Rendahnya Proporsi Kontak yang Melakukan Deteksi Dini Tuberculosis Paru di Puskesmas I Denpasar Selatan tahun 2012. Public Health and Preventive Medicine Archive,1(1),55- 62
Boom, R., Sol, C. J. A., Salimans, M. M. M.,Jansen, C. L.,van Dillen, P. M. E. W. dan Van Der Noordaa, J. (1990). Rapid and Simple Method for Purification of Nucleic Acids. JClin Microbiol, 28(3), 495-503
Borah, P. 2011. Primer Designing for PCR.
Science Vision, 11(3), 134-136
Chen, X., Kong, F., Wang, Q., Li,C., Zhang, J. danGilbert, G. L. (2011). Rapid Detection of Isoniazid, Rifampin, and Ofloxacin Resistance in Mycobacterium tuberculosis Clinical Isolates Using High-Resolution Melting Analysis. JClin Microbiol, 49(10), 3450-3457
Handoyo, D. danRudiretna, A. (2001). Prinsip Umum dan Pelaksanaan Polymerase Chain Reaction (PCR). Unitas, 9(1), 17-29
McPherson, M. dan Moller, S. (2006). PCR 2nd Edition. UK: Taylor & Francis Group
Morlock, G. P., Metchock,B., Sikes, D., Crawford, J. T. dan Cooksey, R. C. (2003).
ethA, inhA, dan, katG Loci of EthionamideResistant Clinical Mycobacterium tuberculosis Isolates. J Clin Microbiol, 47(12), 3799-3805
Ramaswamy, S. dan Musser, J. S. (1998). Molecular Genetic Basic of Antimicrobial Agent Resistance in Mycobacterium Tuberculosis: 1998 Update. Tubercle and Lung Dis, 79(1), 3-29
WHO. (2012). Global Tuberculosis Report 2012. Switzerland: WHO Press. P. 1-6
Zhang Y. dan Yew, W. (2009). Mechanism of Drug Resistance in Mycobacterium tuberculosis. Int J TubercLung Dis, 13(11), 1320- 1330
39
Discussion and feedback