ADSORPSI KATION Pb(II) DAN Cr(III) OLEH BATU PADAS JENIS LADGESTONE TERAKTIVASI H2SO4 DAN NaOH
on
JURNAL KIMIA 7 (2), JULI 2013: 202-210
ADSORPSI KATION Pb(II) DAN Cr(III) OLEH BATU PADAS JENIS LADGESTONE TERAKTIVASI H2SO4 DAN NaOH
Novita Rambu Atandawu, Ida Ayu Gede Widihati, dan I Wayan Suarsa
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran
ABSTRAK
Telah dilakukan penelitian adsorpsi kation Pb(II) dan Cr(III) oleh batu padas jenis ladgestone yang teraktivasi oleh H2SO4 2N dan NaOH 4N. Aktivasi ini bertujuan untuk meningkatkan kapasitas adsorpsi batu padas tersebut. Batu padas yang telah teraktivasi asam dan basa dikarakteristik luas permukaan spesifik dengan metode adsorpsi metilen biru, sementara keasaman permukaan ditentukan dengan cara titrasi asam-basa. Parameter adsorpsi seperti waktu setimbang, isoterm adsorpsi, dan kapasitas adsorpsi ditentukan dengan menggunakan metode spektrofotometer serapan atom (SSA).
Hasil penelitian menunjukkan bahwa batu padas yang diaktivasi H2SO4 memiliki luas permukaan lebih rendah dibandingkan dengan yang diaktivasi dengan NaOH, namun memiliki keasaman permukaan yang lebih tinggi. Kapasitas adsorpsi tertinggi adsorben batu padas terhadap Pb(II) dan Cr(III) dimiliki oleh batu padas teraktivasi NaOH 4N berturut-turut yaitu 12,4976 mg/g dan 12,4945 mg/g..
Kata kunci: aktivasi batu padas ladgestone, adsorpsi, kapasitas adsorpsi
ABSTRACT
Adsorption of Pb (II) and Cr (III) cations by ladgestone activated with 2 N sulfuric acid, and 4 N sodium hydroxide have been studied. The activation aims to increase the adsorption capacity of the ladgestone which was characterized by measuring its specific surface area and the acidity of the ladgestone surface. In addition, equilibrium adsorption time, isotherm adsorption, and the adsorption capacity were also determined using atomic absorption spectrophotometry (AAS).
The results showed that activation with 2 N sulfuric acid increased the acidity of ladgestone surface but it decreased the specific surface area, while activation with 4 N sodium hydroxide increased both the acidity and the specific surface area of the ladgestone. Hence, ladgestone activated with 4 N sodium hydroxide gave the highest adsorption capacity both for Pb (II) and Cr (III) which were 12.4976 mg/g and 12.4945 mg/g respectively.
Keywords: activated ladgestone, adsorption, adsorption capacity
PENDAHULUAN
Batu padas tergolong batuan sedimen yang merekat bersama silika, besi oksida ataupun tanah liat dengan bahan dasar silikon dioksida 70-95%, aluminium oksida 2-10 %, serta mengandung kalsium oksida, besi oksida dan magnesium oksida dalam jumlah yang relatif kecil. Batu padas memiliki banyak pori, yaitu
lebih dari 30% dari jumlah volumenya (Grible,1988). Batu padas dapat dimanfaatkan sebagai adsorben alternatif pengganti karbon aktif mengingat tingginya harga karbon aktif. Adsorben ini mempunyai kemampuan tinggi dalam menyerap logam berat, efektif, berharga murah, bersifat tahan lama dapat digunakan secara berulang–ulang. Batu padas ini dapat
diperoleh dari limbah kerajinan pembuatan patung.
Beberapa daerah di Bali telah menggunakan batu padas sebagai bahan alat tradisional untuk menjernihkan air yang disebut topa. Penelitian awal yang telah dilakukan oleh Kasa (2000) menunjukkan bahwa air yang dijernihkan dengan alat tradisional yang terbuat dari batu padas, terbukti dapat menurunkan kadar beberapa zat pencemar dan bakteri patogen. Menurut penelitian Budiartawan (2003), batu padas awal tanpa modifikasi jenis ladgestone, pearl sandtone dan linroc stone dapat digunakan untuk menurunkan kadar logam Pb dan Cr dalam air. Ketiga jenis batu padas ini yang mempunyai kapasitas adsorpsi paling tinggi dalam menurunkan kadar logam Pb dan Cr dimiliki oleh batu padas jenis ladgestone dengan kapasitas adsorpsi berturut-turut 0,4491 mg/g dan 0,3817 mg/g.
Namun adsorben tanpa diaktivasi terlebih dahulu, bila digunakan sebagai adsorben memberikan hasil yang kurang baik dalam mengadsorpsi logam berat (Haristyanti,2006). Oleh karena itu perlu dilakukan modifikasi seperti aktivasi dengan menggunakan larutan asam seperti HNO3, H2SO4, atau dengan larutan basa seperti NaOH. Proses aktivasi bertujuan untuk meningkatkan luas permukaan spesifik dan keasaman permukaan. Perlakuan aktivasi dengan menggunakan larutan asam atau basa tersebut dapat melarutkan pengotor yang terdapat dalam material tersebut, sehingga mulut pori menjadi lebih terbuka yang memungkinkan peningkatan luas permukaan spesifik. Aktivasi juga dapat meningkatkan situs aktifnya sebab dengan larutnya pengotor menyebabkan situs yang tersembunyi menjadi terbuka (Kumar, 1995). Pernyataan ini didukung dengan penelitian yang dilakukan oleh Haristyanti (2006) menunjukkan bahwa aktivasi batu padas jenis ladgestone dengan H2SO4 2N dan NaOH 4N dapat meningkatkan luas permukaan dan keasaman permukaannya dibandingkan dengan batu padas tanpa aktivasi. Dalam penelitian ini kapasitas adsorpsi terhadap lagam Cu(II) dan Cr(III) yang optimum didapat dengan aktivasi NaOH 4N dengan kapasitas adsorpsi berturut-turut 4,7685 mg/g dan 3,5085 mg/g.
Sejak kasus kecelakaan merkuri di Minamata di Jepang tahun 1953 secara intensif dilaporkan, bahwa pencemaran kation berat terhadap lingkungan meningkat sejalan dengan perkembangan aplikasi teknologi di berbagai industri. United State Environmental Protection Agency (USEPA) mencatat ada 13 unsur logam yang merupakan unsur utama polusi yang berbahaya bagi kesehatan yaitu: stibium, arsen, berilium, kadmium, kromium, tembaga, timbal, nikel, selen, perak, talium, dan seng (Suhendrayatna, 2001).
Kromium (Cr) dan Timbal (Pb) merupakan contoh logam berat yang banyak digunakan dalam bidang industri. Logam berat Pb dan Cr dapat memberikan efek racun terhadap sebagian besar fungsi organ yang terdapat dalam tubuh. Logam Cr merupakan logam berat namun sangat dibutuhkan oleh tubuh, tetapi dalam jumlah yang terbatas yaitu 1,00 ppm. Jika logam Cr berada di tubuh melebihi batasnya maka dapat mengakibatkan keracunan akut terhadap ginjal, hati dan paru-paru. Sedangkan keracunan logam Pb pada manusia dapat mengakibatkan terganggunya sistem syaraf, sistem ginjal, sistem reproduksi, sistem endokrin dan jantung. Keracunan logam Pb juga dapat menyebabkan keterbelakangan mental pada anak-anak (Palar, 1995).
Keberadaan logam berat dalam lingkungan perlu mendaptkan perhatian serius terutama dalam pengolahan limbanya. Oleh karena itu, pada penelitian ini adsorpsi dilakukan dengan cara mengadsorpsi kation Pb(II) dan Cr(III) dari larutan menggunakan adsorben batu padas yang telah diaktivasi H2SO4 2N dan Naoh 4N.
MATERI DAN METODE
Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah batu padas jenis ladgestone yang diambil dari Br. Seraya Singapadu, Sukawati, Gianyar. Bahan-bahan kimia yang digunakan adalah NaOH, H2SO4, Metilen Biru, CrCl3.6H2O, Pb(NO3)2, fenolpthalien (pp), aquades, BaCl2.2H2O, HCl dan H2C2O4.
Peralatan
Alat-alat yang digunakan dalam penelitian ini adalah oven, desikator, peralatan gelas, erlenmeyer, ayakan (ukuran 250 µm dan 106 µm), pengaduk magnet, kertas saring, timbangan analitik, pipet volume, pipet tetes, cawan porselen, penggerus porselen, corong, botol semprot, peralatan instrument meliputi spektrofotometer UV-Vis dan spektrofotometer serapan atom (SSA).
Cara Kerja
Preparasi Sampel
Batu padas jenis ladgestone dihancurkan dan digerus, kemudian diayak dengan ayakan 250 µm dan tertahan pada 106 µm. serbuk batu padas dicuci dengan aquades, kemudian dikeringkan dalam oven pada suhu 1100C sampai beratnya konstan. Setelah itu, serbuk batu padas disimpan di desikator untuk penelitian selanjutnya.
Penentuan luas permukaan batu padas
Penentuan luas permukaan batu padas digunakan metode adsorpsi terhadap larutan metilen biru. Untuk menentukan panjang gelombang maksimum dibuat larutan metilen biru 2 ppm sebanyak 10,0 mL, diukur absorbansinya dengan spektrofotometer UV-Vis pada berbagai panjang gelombang 500 nm sampai 700 nm. Kurva standar metilen biru, dibuat berdasarkan berbagai konsentrasi 1, 2, 3, dan 4 ppm pada panjang maksimumnya (Rahmawati ddk, 2003).
Untuk menentukan waktu kontak optimum, maka 0,1 gram serbuk batu padas tanpa perlakuan dan serbuk batu padas yang telah diaktivasi H2SO4 2 N dan NaOH 4N. masing-masing ditambahkan kedalam 20 mL larutan metilen biru 50 ppm, diaduk dengan pengaduk magnetik dengan waktu yang bervariasi 5, 10, 15, 30, 40, 50 dan 60 menit. Larutan hasil pengadukan disaring dan filtratnya dianalisis menggunakan spektrofotometer UV-VIS pada panjang gelombang maksimum larutan metilen biru tersebut. Absorbansi yang diperoleh dimasukkan dalam persamaan regresi linier metilen biru, sehingga didapatkan konsentrasi
metilen biru yang merupakan berat teradsorpsi maksimum (mg/g).
Penentuan keasaman permukaan batu padas
Penentuan keasaman permukaan dilakukan pada batu padas tanpa perlakuan, serbuk batu padas teraktivasi H2SO4 2 N, dan serbuk batu padas teraktivasi NaOH 4N. Masing-masing seberat 0,5 gram sampel dimasukkan dalam erlenmeyer 250 mL kemudian ditambahkan 15 mL larutan NaOH 0,1 M sambil diaduk dengan pengaduk magnetik selama 15 menit, ditambahkan 3-4 tetes phenolphtalein (pp) sampai berwarna merah muda (adanya NaOH berlebih). Campuran dititrasi dengan larutan HCl 0,1 M sampai terjadi perubahan warna dari merah muda menjadi coklat terang (warna batu padas). Volume HCl yang digunakan dalam titrasi dicatat dengan teliti.
Penentuan waktu setimbang adsorpsi batu padas terhadap kation Pb2+ dan Cr3+.
Sebanyak 0,5 gram batu padas yang memiliki keasaman dan luas permukaan tertinggi dimasukkan ke dalam 5 buah erlenmeyer 100 mL, kemudian ke dalam masing-masing sampel ditambahkan 50 mL larutan Pb2+ 100 ppm. Selanjutnya campuran diaduk dengan pengaduk magnet selama 15, 30, 60, 90, 120 menit. Setiap waktu tertentu campuran di saring dengan kertas saring Whatman 42, filtrat yang diperoleh dianalisis jumlah Pb (II) yang tersisa dengan AAS. Banyaknya Pb (II) yang terserap oleh setiap gram batu padas ini dapat dihitung dengan persamaan berikut :
Λ- Lc^ CjJxV
A= IOOOa S
(1)
Untuk mengetahui waktu setimbang adsorpsi Pb (II), dibuat grafik antara jumlah Pb (II) yang teradsorpsi per gram adsorben dengan waktu kontak. Perlakuan yang sama dilakukan juga untuk penentuan waktu setimbang kation Cr3+.
Penentuan isoterm adsorpsi batu padas terhadap kation Pb2+ dan Cr3+.
Sebanyak 0,5 gram batu padas yang memiliki luas permukaan tertinggi dimasukkan ke dalam 5 buah Erlenmeyer 100 ml, kemudian ditambahkan 50,0 mL larutan Pb(II) dengan konsentrasi 25, 50, 75, 100, 125 ppm. Masing-masing campuran diaduk sesuai waktu setimbangnya. Selanjutnya disaring dan Pb(II) dalam filtrat diukur dengan AAS. Nilai absorbans yang didapat dimasukkan dalam persamaan regresi linier sehingga konsentrasi kation Pb(II) yng tersisa dalam larutan dapat diketahui.
Banyaknya Pb(II) yang terserap oleh setiap gram batu padas dapat ditentukan dengan menggunakan persamaan 1. Untuk penentuan isoterm adsorpsi terhadap kation Pb(II) dibuat grafik antara jumlah Pb(II) yang teradsorpsi per gram adsorben dengan konsentrasi kation Pb(II) yang tersisa. Selanjutnya pola isoterm adsorpsi diperoleh dengan membuat grafik hubungan antara konsentrasi kation Pb(II) yang teradsorpsi per gram sampel. Konsentrasi adsorbat yang diperoleh pada keadaan jenuh digunakan sebagai acuan untuk menentukan kapasitas adsorpsi. Perlakuan yang sama dilakukan juga untuk penentuan isoterm adsorpsi kation Cr3+.
Penentuan kapasitas adsorpsi batu padas terhadap kation Pb2+ dan Cr3+.
Sebanyak 0,5 gram batu padas tanpa pengaktifan, batu padas yang teraktivasi H2SO4, serta batu padas yang telah diaktivasi NaOH, masing-masing dimasukkan ke dalam 3 buah gelas erlenmeyer. Ke dalam masing-masing gelas erlenmeyer ditambahkan 50,0 mL larutan Pb(II) dengan konsentrasi yang didapat dari penentuan isoterm adsorpsi, kemudian dibiarkan kontak selama waktu setimbangnya sambil diaduk dengan pengaduk magnet. Selanjutnya disaring dan filtrat yang diperoleh dianalisis jumlah Pb(II) yang tersisa dengan AAS. Nilai adsorbansi yang didapat dimasukkan kedalam persamaan regresi linear sehingga konsentrasi kation Pb(II) yang tersisa dalam larutan dapat diketahui. Banyaknya Pb(II) yang terserap oleh setiap gram batu padas dapat ditentukan dengan persamaaan 1. Perlakuan yang sama dilakukan
juga untuk penentuan kapasitas adsorpsi kation Cr3+.
HASIL DAN PEMBAHASAN
Karakterisasi Luas Permukaan Spesifik Batu Padas
Luas permukaan batu padas merupakan salah satu karakter fisik yang penting dalam proses adsorpsi, karena luas permukaan mempengaruhi banyaknya adsorbat yang dapat teradsorpsi. Pada penelitian ini, luas permukaan ditentukan dengan metode adsorpsi metilen biru. Panjang gelombang maksimum metilen biru yang digunakan adalah 664 nm. Banyaknya molekul metilen biru yang dapat diadsorpsi sebanding dengan luas permukaan adsorben. Hasil pengukuran luas pemukaan dapat dilihat pada Tabel 1
Tabel 1. Nilai Luas Permukaan Spesifik Batu
Padas
|
Sampel |
Xm (mg/g) |
s (m2/g) |
|
H0 |
9,4910 |
35,1310 |
|
H1 |
9,3320 |
34,5225 |
|
H2 |
9,5749 |
35,4417 |
Keterangan :
H0 = batu padas tanpa aktivasi
H1 = batu padas aktivasi H2SO4 2 N
H2 = batu padas aktivasi NaOH 4N
Xm = berat adsorbat teradsorpsi ( mg/g )
S = luas permukaan adsorpsi ( m2/g)
Tabel 1 menunjukkan bahwa batu padas yang teraktivasi NaOH memiliki luas permukaan lebih tinggi dari pada batu padas tanpa aktivasi dan teraktivasi H2SO4. Luas permukaan tertinggi dimiliki oleh batu padas teraktivasi NaOH (H2) yaitu sebesar 35,4417 m2/g. Hal ini disebabkan karena larutan NaOH 4N melarutkan pengotor-pengotor yang ada di permukaan pori batu padas sehingga luas permukaan spesifikya menjadi lebih besar. Sedangkan batu padas kontrol (H0)
memiliki luas permukaan lebih besar yaitu 35,1310 m2/g dibandingkan dengan batu padas teraktivasi H2SO4 (H1). Aktivasi dengan H2SO4 menyebabkan penurunan luas permukaan spesifik, hal ini mungkin disebabkan karena larutan H2SO4 2N menyebabkan terjadinya beberapa substituti struktur silika alumina dari batu padas (Kumar, 1995).
Keasaman Permukaan Batu Padas
Penentuan keasaman permukaan serbuk batu padas bertujuan untuk mengetahui jumlah mmol situs asam (asam bronsted dan asam lewis) yang terikat pada serbuk batu padas tiap gramnya. Penentuan keasaman permukaan dilakukan dengan metode titrimetri (titrasi asam-basa), dimana situs asam pada adsorben serbuk batu padas direaksikan dengan basa (NaOH) berlebih, sisa OH yang tidak bereaksi dengan situs asam batu padas direaksikan dengan HCl sehingga jumlah zat-zat yang bereaksi ekivalen satu sama lainnya. Nilai keasaman permukaan batu padas disajikan dalam Tabel 2.
Tabel 2. Nilai Keasaman Permukaan Batu Padas
|
Sampel |
Keasaman permukaan (mmol/g) |
Jumlah situs aktif (atom/g) |
|
H0 |
0,0618±0,0117 |
3,72 x 1019 |
|
H1 |
0,1497±0,0116 |
9,01 x 1019 |
|
H2 |
0,1092±0,0117 |
6,55 x 1019 |
Dari Tabel 2 dapat dilihat bahwa nilai keasaman batu padas meningkat dengan adanya aktivasi baik oleh H2SO4 2 N maupun NaOH 4N. Keasaman permukaan batu padas teraktivasi H2SO4 lebih besar daripada batu padas teraktivasi NaOH. Hal ini disebabkan karena H2SO4 dapat mengurangi kation-kation alkali (Na+, K+) dan alkali tanah (Ca2+, Mg2+) dan terjadi subtitusi dengan H+, sehingga situs H+
pada batu padas menjadi bertambah. Pada konsentrasi H2SO4 yang relatif tinggi dapat membentuk situs aktif asam lewis (Al3+, Fe3+) sehingga keasaman permukaan total menjadi meningkat (Nuryono, 2002). Nilai keasaman permukaan dan jumlah situs aktif tertinggi dimiliki oleh batu padas teraktivasi H2SO4 2N yaitu sebesar 0,1497 mmol/gram dengan jumlah situs aktif 9,01 x 1019 atom/gram.
Waktu Setimbang Adsorpsi Batu Padas terhadap Kation Pb2+ dan Cr3+
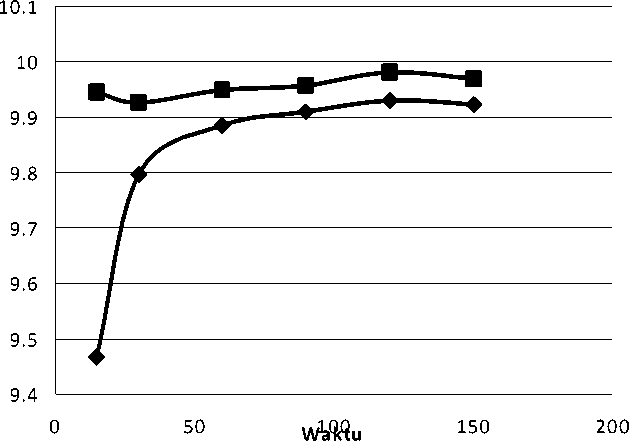
Waktu setimbang adsorpsi merupakan salah satu faktor yang mempengaruhi proses penyerapan. Penentuan waktu setimbang adsorpsi bertujuan untuk mengetahui waktu minimum yang dibutuhkan oleh adsorben batu padas dalam mengadsorpsi kation Pb2+ dan Cr3+ secara maksimal sampai terjadi keadaan setimbang (jenuh). Proses adsorpsi berlangsung secara terus menerus selama belum mencapai keadaan setimbang. Oleh karena itu, untuk mencari waktu kesetimbangan antara adsorbat dan adsorben maka perlu memvariasikan waktu kontaknya. Adapun variasi waktu kontak yang digunakan adalah 15; 30; 60; 90; 120; 150 menit. Tabel dan grafik waktu setimbang Pb2+ dan Cr3+ oleh batu padas dapat ditampilkan pada Tabel dan Gambar dibawah ini:
Berdasarkan Gambar 1 di bawah, dapat dilihat bahwa sampel batu padas teraktivasi H2SO4 (H1) dan sampel batu padas teraktivasi NaOH (H2) memiliki waktu setimbang yang hampir sama yaitu 120 menit terhadap kation Pb2+. Hal ini dibuktikan bahwa pada saat batu padas diinteraksikan dengan kation Pb(II) lebih dari 120 menit jumlah Pb(II) yang teradsorpsi sudah setimbang, artinya batu padas hampir tidak mampu lagi mengadsorpsi Pb(II). Sehingga, penentuan isoterm dan kapasitas adsorpsi untuk kation Pb(II) digunakan waktu setimbang yaitu 120 menit.
Teraktivasi
H2SO4 (H1)
Teraktivasi
NaOH (H2)
Gambar 1. Grafik Waktu Setimbang Pb(II)
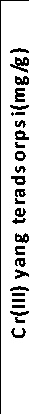
Tera ktivas i NaOH (H2)
Tera ktivas i
Gambar 2. Grafik Waktu Setimbang Cr(III)
Berdasarkan Gambar 2 diatas memperlihatkan bahwa sampel batu padas teraktivasi H2SO4 dan sampel batu padas teraktivasi NaOH dalam mengadsorpsi kation
Cr(III) memiliki kecendrungan yang hampir sama dengan mengadsorpsi kation Pb(II), pada interaksi selama 15 menit pertama terjadi peningkatan adsorpsi relatif tajam, pada menit
berikutnya terjadi sedikit peningkatan, dan adsorpsi secara konstan terjadi setelah menit ke-90. Hal ini menunjukkan bahwa waktu mengadsorpsi kation Cr(II) dalam jumlah yang maksimum diperlukan waktu 90 menit. Waktu etimbang yang didapat selanjutnya digunakan sebagai waktu penyerapan pada penentuan isoterm adsorpsi dan kapasitas adsorpsi.
Isoterm Adsorpsi Batu Padas terhadap Kation Pb2+ dan Kation Cr3+
Penentuan isoterm adsorpsi bertujuan untuk mengetahui pengaruh dari konsentrasi kation Pb(II) dan Cr(III) yang diinteraksikan terhadap jumlah kation Pb(II) dan Cr(III) yang teradsorpsi oleh batu padas. Adapun variasi konsentrasi yang digunakan pada penelitian ini adalah 25, 50, 75, 100, dan 125 ppm dengan waktu kontak untuk kation Pb(II) 120 menit dan Cr(III) 90 menit. Hasil penentuan isoterm adsorpsi untuk Pb(II) dan Cr(III) dapat dilihat pada Tabel 3.
Tabel 3. Isoterm Adsorpsi Pb(II) dan Cr(III)
|
Konsentrasi |
Pb(II) yang terserap (mg/g) |
Cr(III) yang terserap (mg/g) |
|
25 |
2,4944 |
2,4905 |
|
50 |
4,9949 |
4,9916 |
|
75 |
7,4970 |
7,4906 |
|
100 |
9,9998 |
9,9356 |
|
125 |
12,4950 |
12,4921 |
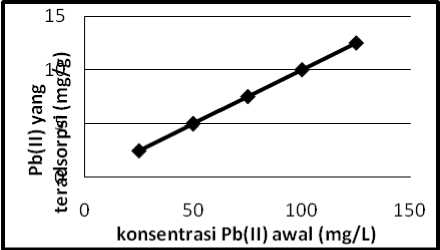
Gambar 3. Grafik isoterm adsorpsi Pb (II)
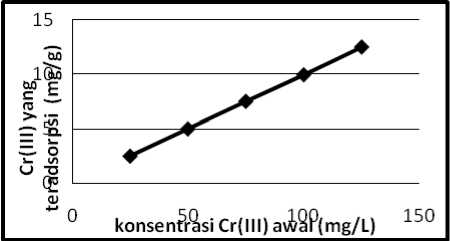
Gambar 4. Grafik isoterm adsorpsi Cr (III)
Dari Tabel 3, Gambar 3 dan Gambar 4, dapat dilihat bahwa adsorpsi meningkat seiring dengan meningkatnya konsentrasi awal dari adsorbat Pb(II) dan Cr(III). Isoterm adsorpsi maksimal untuk kation Pb(II) dan Cr(III) diperoleh pada adsorpsi dengan konsentrasi awal 125 ppm. Hal ini menunjukkan, pada saat mencapai konsentrasi 125 ppm, situs aktif batu padas sudah tidak dapat mengikat kation Pb(II) dan Cr(III).
Kapasitas Adorpsi Batu Padas terhadap Kation Pb2+ dan Cr3+
Penentuan kapasitas adsorpsi bertujuan untuk mengetahui kemampuan penyerapan adsorben batu padas terhadap kation Pb(II) dan Cr(III). Pada tahap ini, konsentrasi Pb(II) dan Cr(III) yang digunakan adalah konsentrasi adsorpsi maksimum yang diperoleh pada penentuan isoterm adsorpsi yaitu 125 ppm. Waktu interaksi yang digunakan untuk adsorpsi kation Pb(II) adalah 120 menit dan kation Cr(III) adalah 90 menit yang merupakan waktu setimbang hasil penentuan variasi waktu penyerapan maksimum. Hasil perhitungan kapasitas adsorpsi dari kation Pb(II) dan Cr(III) dari adsorben batu padas dapat dilihat pada Tabel 4.
Tabel 4. kapasitas Adsorpsi Pb(II) dan Cr(III)
|
Sampel |
Pb(II) yang teradsorpsi (mg/g) |
Cr(III) yang teradsorpsi (mg/g) |
|
H0 |
12,4876 |
12,4896 |
|
H1 |
12,4752 |
12,4759 |
|
H2 |
12,4976 |
12,4945 |
Tabel 4 menunjukkan hasil penentuan kapasitas adsorpsi batu padas terhadap kation Pb(II) dan Cr(III), nilai kapasitas adsorpsi tertinggi untuk Pb(II) dimiliki oleh batu padas teraktivasi NaOH (H2) yaitu 12,4976 mg/g. Demikian juga dengan nilai kapasitas adsorpsi untuk Cr(III) dimiliki oleh batu padas teraktivasi NaOH (H2) yaitu 12,4945 mg/g. Hal ini didukung oleh data luas permukaan (Tabel 1) yang menunjukkan batu padas teraktivasi NaOH memiliki luas permukaan tertinggi yaitu 35,4417 m2/g, sedangkan batu padas teraktivasi H2SO4 memiliki nilai kapasitas adsorpsi lebih kecil untuk kation Pb(II) dan Cr(III) yaitu 12,4752 mg/g dan 12,4759 mg/g dibandingkan batu padas tanpa teraktivasi (H0) yaitu 12,4876 mg/g
dan 12,4896 mg/g. Hal ini disebabkan konsentrasi H2SO4 yang digunakan terlalu tinggi, sehingga menyebabkan perubahan struktur dari batu padas. (Budiarta,1998).
Proses reaksi adsorsi terjadi akibat adanya pertukaran ion antara kation adsorbat dengan ion antarlapis adsorben seperti adsorben seperti ion H+. mekanisme interaksi ini terjadi disebabkan oleh adanya gugus fungsional silanol (Si-OH) yang dominan karena aktivasi H2SO4. Interaksi pertukaran ion diperkirakan terjadi antara ion H+ dengan kation (Pb2+ dan Cr3+) (Tan, 1982). Secara umum, mekanisme pertukaran kation pada batu padas dapat ditunjukkan seperti reaski berikut :
H
I
O Si
I
O
I
O
H
O
Pb2+
-----►
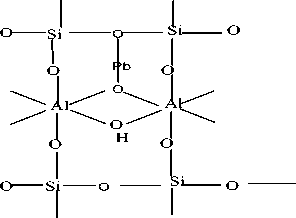
Gambar 5. Proses Terikatnya Kation Pb2+ Pada Senyawa Silika Alumina (Papirer, 2000)
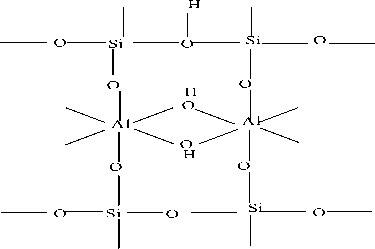
Cr2+
Cr
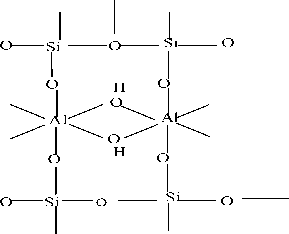
Gambar 6. Proses Terikatnya Kation Cr2+ Pada Senyawa Silika Alumina (Papirer, 2000)
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian dan pembahasan dapat disimpilkan sebagai berikut : 1. Aktivasi batu padas jenis ladgestone menggunakan H2SO4 2N dapat
meningkatkan keasaman permukaan, sedangkan aktivasi menggunakan NaOH 4N dapat meningkatkan luas permukaan spesifiknya.
-
2. Keasaman permukaan tertinggi dimiliki oleh batu padas teraktivasi H2SO4 2 N yaitu 0,1497 mmol/gram dan luas permukaan tertinggi dimilki oleh batu padas teraktivasi NaOH 4 N yaitu 0,1092 mmol/ gram.
-
3. Kapasitas adsorpsi batu padas jenis ladgestone teraktivasi H2SO4 2 N untuk kation Pb(II) yaitu 12,4752 mg/g dan untuk kation Cr(III) yaitu 12,4759 mg/g, sedangkan aktivasi menggunakan NaOH memiliki nilai kapasitas adsorpsi untuk kation Pb(II) yaitu 12,4976 mg/g dan untuk kation Cr(III) yaitu 12,4945 mg/g.
Saran
Berdasarkan hasil penelitian dan simpulan, maka disarankan untuk melakukan penelitian lanjutan mengenai laju dan mekanisme adsorpsi kompetitif kation Pb(II) dan Cr(III) pada batu padas jenis ladgestone teraktivasi NaOH sehingga dapat diketahui dengan pasti laju dan mekanisme adsorpsinya.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penulisan karya ilmiah ini.
DAFTAR PUSTAKA
Larutan, Skripsi, Jurusan Kimia, FMIPA, Universitas Udayana, Denpasar
Budiartawan, I. G., 2003, Adsorpsi Batu Padas Terhadap Kation Pb2+ dan Cr3+ dalam Larutan, Skipsi, Jurusan Kimia, FMIPA, Universitas Udayana, Jimbaran, Denpasar
Grible, C. D., 1988, Routly’s Elements of
Mineralogi , 27th, Ijnwn Hyman, London
Haristyanti, P., 2006, Studi Adsorpsi-Desorpsi Kation Cu(II) dan Cr(III) dalam Air Oleh Batu Padas Jenis Ladgestone Teraktivasi H2SO4 dan NaOH, Skipsi, Jurusan Kimia, FMIPA, Universitas Udayana, Denpasar
Kasa, I W., 2000, Mendapatkan Air Bersih
Secara Tradisional, Laporan Penelitian, FMIPA, Universitas Udayana, Denpasar
Kumar, P., Jasra, R.V., and T.S.G. Bhat, 1995, Evolution of Porosity and Surface Acidity in Montmorillonit Clay on Acid Activation. Ind.Eng, Chem, Res., 34 (4) : 298-307
Nuryono, Suyanta, dan Narsito, 2002, Pengaruh Perlakuan Tanah Diatome dengan Asam Klorida dan Asam Sulfat Terhadap Kemampuan Adsorpsi Cr(III) dan Cd(II), Jurnal MIPA, No ISSN 02159945, Jurusan Kimia FMIPA, Universitas Gajah Mada, Yogyakarta
Palar, H., 1995, Perencanaan dan Toksikologi Kation Berat, Rineka Cipta, Jakarta, h. 274
Papirer, E., 2000, Adsorption On Silica Surface, Marcel Dekker, Inc, New York
Suhendrayatna, 2001, Bioremoval Kation Berat Dengan Menggunakan Mikroorganisme, Institute For Science And Technology Studies, Japan
Tan, K. H., 1982, Dasar-Dasar Kimia Tanah, Penterjemah Goenadi, D.H., a.b. Radjagukguk, B., Cet. 5, Gajah Mada University Press, Yogyakarta
Budiarta, I. M., 1998, Pengaruh Aktivasi HNO3 Pada Serbuk Tulang Sapi Untuk Menurunkan Kadar Kation Pb2+ Dalam
210
Discussion and feedback