TES CEPAT UNTUK DETEKSI ALBUMINURIA BERBASIS PERAK IODIDA(AgI) dan METILEN BIRU
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 16 (2), JULI 2022 DOI: https://doi.org/10.24843/JCHEM.2022.v16.i02.p02
p-ISSN 1907-9850
e-ISSN 2599-2740
TES CEPAT UNTUK DETEKSI ALBUMINURIA BERBASIS PERAK IODIDA (AgI) DAN METILEN BIRU
M. H. Afthoni1* R. Alfanaar2, E. Monica1, R. Rollando1, W. Swastika3, P. N. Alfiyandri1
1Pharmacy Study Program, Ma Chung University, Malang, Jawa Timur, Indonesia 2Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Palangka Raya, Palangka Raya, Kalimantan Tengah, Indonesia 3Informatics Engineering Study Program, Ma Chung University, Malang, Jawa Timur, Indonesia Email: m.h.afthoni@gmail.com
ABSTRAK
Albuminuria adalah kondisi adanya albumin pada urin. Adanya albumin dapat menjadi indikator penyakit ginjal dan kardiovaskular. Albumin dapat dideteksi berdasarkan perubahan warna biru menjadi kecoklatan menggunakan sensor perak iodida – metilen biru. Tujuan dari pengembangan tes cepat ini adalah mendeteksi albuminuria pada urin dengan memanfaatkan reagen perak iodida (AgI) dan metilen biru. Sensor kimia yang dikembangkan merupakan sensor kolorimetri yang terimobilisasi kertas dan dideteksi dengan metode scannometri. Analisis perubahan warna sensor untuk albumin pada penelitian ini menggunakan perangkat lunak imageJ. Sensor albumin berbasis perak iodida - metilen biru yang diusulkan memiliki waktu respon 7 menit dengan rentang linier 200 hingga 500 ppm dan batas deteksi adalah 83,039 ppm batas kualifikasi. Sensor memiliki reprodusibilitas (RSD = 2,6917%) dengan waktu pakai lebih dari 5 bulan dengan nilai akurasi 100,662%.
Kata kunci: albuminuria, sensor kimia, tes cepat.
ABSTRACT
Albuminuria is a condition of the presence of albumin in the urine. The presence of albumin can be an indicator of kidney and cardiovascular diseases. Albumin can be detected based on the change of color from blue to brownish using a silver iodide – methylene blue sensor. This rapid test was developed to detect albuminuria in the urine by utilizing silver iodide (AgI) and methylene blue reagents. The chemical sensor was a colorimetric sensor immobilized with paper and detected by scannometric methods. The analysis of the sensor color changes for albumin was carried out using ImageJ software. The proposed silver iodide - methylene blue-based albumin sensor had a response time of 7 minutes with a linear range from 200 to 500 ppm and the detection limit of 83,039 ppm qualification limit. The sensor had reproducibility (RSD = 2.6917%) with a service life of more than 5 months with an accuracy value of 100.662%.
Keywords: albuminuria, chemical sensor, rapid test.
PENDAHULUAN
Albuminuria adalah kondisi adanya kandungan albumin (protein) pada urin (Kuritzky et al., 2011). Kondisi tersebut tidak normal, adanya albumin dalam urin merupakan salah satu penanda terjadinya disfungsi pada ginjal dan cardiovascular yang dapat berpengaruh pada tingkat kesakitan dan kematian (Toblli et al., 2012).
Pengukuran kadar albumin High Performance Liquid Chromatography (HPLC) (Rodchenkov et al., 2008), serta metodeliquid chromatography tandem mass spectrometry
(LC-MS/MS) dapat dilakukan untuk mengukur kadar albumin(Ketha and Singh 2016). Semua metode tersebut memerlukan alat analisis yang relatif mahal, biaya analisis tinggi, membutuhkan tenaga ahli dalam pengoperasiannya, dan biaya perawatan instrumen yang tinggi sehingga dinilai tidak ekonomis (Reis et al., 2009). Oleh sebab itu dikembangkan tes cepat untuk deteksi albuminuria
Reagent yang digunakan untuk tes cepat ini adalah perak iodida (AgI) dan metilen biru (MB). Prinsip dari sensor ini adalah reaksi antara Ag+ dengan albumin (Boehmler et al.,
2020). Reaksi tersebut akan menghasilkan Ag0 yang merupakan perak nano partikel (AgNPs) adanya perak nano partikel sebagai katalist electron relay effect (N. Gupta, Singh, and R.K. Sharma 2011) dan akan mereduksi MB menjadi leukometilen biru (LMB) (Ajitha et al., 2015). Berdasarkan reaksi tersebut untuk pertama kalinya dibuat deteksi cepat albuminuria dengan cara mengimobilisasi AgI dan MB sebagai kertas kolorimetri untuk tes cepat albuminuria. Kertas kolorimetri difabrikasi dengan cara mengimobilisasi AgI dan MB pada kertas filter dengan metode absorbsi. Hasil dari tes cepat albuminuria mendapatkan hasil yang mirip dengan pengukuran dengan metode standard dengan menggunakan spektrofotometti UV VIS
MATERI DAN METODE
Bahan
Bahan yang digunakan pada penelitian tanpa proses pemurnian adalah bovin serum albumin (BSA) (Himedia), AgI (sigma), Metilen biru (Merck), biuret reagent (Merck)Di-Natrium Hydrogen Fosfat Anhidrat buffer phospat pH 7 (merck) dan kertas saring(Whatman cat No 1001 150), semua
reagent menggunakan pro analisa tanpa proses pemurnian .
Peralatan
Peralatan yang dipakai scanner canon LiDE 300, spektrofotometer jasco 4300, gelas beker, labu ukur, dan alat gelas lain (pyrex), mikropipet (socorex)
Cara Kerja
Preparasi kertas kolorimetri
Kertas kolorimetri sebagai sensor albumin dikembangkan dengan cara menambahkan campuran larutan pereaksi AgI dan MB pada kertas saring. Imobilisasi reagen cukup dengan menggunakan metode absorpsi. Prosedur ini dilakukan dengan cara mencelupkan kertas yang sudah dipotong menjadi bentuk melingkar (diameter = 5 mm), kdalam 10 ml larutan campuran semalaman (~ 12 jam) pada suhu kamar dengan pengaduk lambat(Kuswandi 2010). Reagen pada kertas saring kemudian dikeringkan pada suhu kamar. Selanjutnya membran sensor ditempelkan pada poliakrilik warna putih untuk membentuk strip uji albumin. Kemudian kertas kolorimetri siap
digunakan sebagai strip tes untuk deteksi albumin seperti yang disajikan pada Gambar 1.

Pegangan
Area deteksi
AgNO1 + Metilen biru
Gambar 1. Kertas Kolorimetri Berbasis AgI Terimobilisasi Dan Biru Metilen Sebagai Uji Strip Siap Digunakan.
Preparasi Sampel
Preparasi sampel dengan cara menimbang 1 g albumin kemudian ditambahkan dapar phospat 0,1M pH 7 dan dilarutkan hingga 10 mL. Larutan yang diperoleh siap digunakan untuk langkah selanjutnya.
Optimasi kertas kolorimetri
Reagen konsentrasi AgI dan MB yang digunakan pada kertas kolorimetri sesuai dengan metode sebelumnya (Ajitha et al., 2015), dari mana konsentrasi reagen dioptimalkan. Disini digunakan larutan AgI pada konsentrasi 200 dan 2000 µg/mL, sedangkan MB pada konsentrasi 100 dan 1000 µg/mL digunakan untuk membuat empat kombinasi (1) 200:1000; (2) 200:100, (3) 2000:100, dan (4) 2000:1000.
Perbandingan volume (v/v) kombinasi reagen AgI dan MB terpilih kemudian dioptimasi pada perbandingan volume yang berbeda yaitu 8: 2, 9: 1 dan 9.8: 0.2 (v/v). Kemudian, waktu respon sensor juga dipelajari pada periode dari 0 hingga 20 menit. Untuk penelitian ini, 1000 µg / mL albumin dimasukkan ke dalam membran sensor. Pengaruh pH terhadap respon sensor juga dioptimalkan antara pH 5 hingga pH 8.
Pengujian scanometri
Uji scanometri digunakan untuk menentukan konsentrasi albumin. Pertama, larutan albumin dimasukkan ke dalam membran sensor, penutup menunggu pada waktu yang diinginkan hingga terjadi perubahan warna pada sensor,selanjutnya
perubahan warna sensor ditangkap oleh scanner kertas (CanonScan LIDE 300, Jepang) pada resolusi 300 dpi. Gambar dipindai dan dianalisis dengan program Image J (https://imagej.nih.gov/ij/).
Intensitas perubahan warna sensor dinyatakan sebagai intensitas unit warna yaitu mean red, green and blue (RGB) dan disajikan sebagai nilai intensitas ∆ yaitu hasil pengukuran sampel dikurangi blanko untuk menentukan konsentrasi albumin ditunjukkan pada Gambar 2. Semua pengukuran dilakukan dalam tiga replikasi.

Gambar 2. Uji Scanometrik Untuk Penentuan albumin Menggunakan Kertas Kolorimetri Sebagai uji tes cepat
HASIL DAN PEMBAHASAN
Mekanisme sensor
Mekanisme pendeteksian albumin didasarkan pada reaksi antara albumin dengan AgI yang mereduksi MB. Pada reduksi MB dimediasi oleh perak nanopartikel (AgNPs) yang terbentuk sebagai hasil reduksi AgI oleh albumin pada urin manusia. Ini menurut Ajitha et al. (2015), dimana dalam skema ini, sebagai akibat dari penurunan absorbansi MB diamati adanya peningkatan puncak SPR dari AgNPs. Dalam proses transfer elektron, ketika terdapat perbedaan potensial redoks yang besar antara akseptor dan donor, maka mungkin terjadi pembatasan transfer elektron. Namun, transfer elektron menjadi mudah, katalis yang efektif memiliki nilai potensial redoks menengah antara akseptor dan donor (Mallick et al., 2002). Oleh karena itu, dalam hal ini, terungkap bahwa AgNP bertindak sebagai mediator transfer elektron karena menerima elektron dari ekstrak dan menyumbang ke MB dengan bertindak sebagai katalis redoks, yang pada gilirannya disebut sebagai efek relai elektron.(Gupta et al., 2011).
Demikian pula, dalam reaksi ini, albumin mereduksi Ag + dari AgI menjadi Ag0 sebagai AgNPs, dimana AgNP bertindak sebagai mediator transfer elektron dan mendonasikan ke MB sebagai katalis redoks yang disebut efek relai electron perubahan warna sensor dapat dilihat pada Gambar 3. (Gupta et al., 2011) dan mengurangi MB menjadi LMB (Ajitha et al., 2015) Seperti yang disajikan pada Gambar 4. Perubahan warna tersebut kemudian dianalisis
menggunakan program ImageJ untuk pengukuran kuantitatif, dan hasilnya menunjukkan bahwa perubahan nilai warna ΔRGB memberikan koefisien korelasi (r) dan respon tertinggi terbaik dibandingkan warna lain, yaitu nilai merah, hijau dan biru dapat dilihat pada Gambar 5. Selain itu, perubahan warna pada sensor dengan warna RGB terbukti paling sebanding dengan peningkatan konsentrasi albumin. Oleh karena itu, nilai RGB digunakan untuk pengukuran selanjutnya.
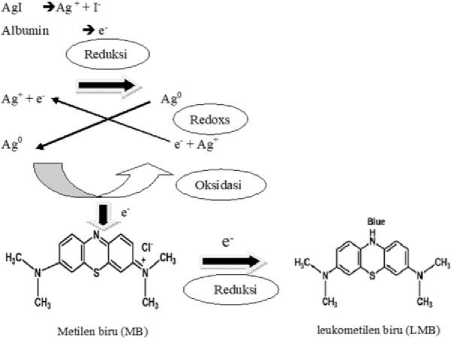
Gambar 3. Mekanisme sensor albumin berbasis
AgI dan metilen biru.

Gambar 4. Perubahan Warna tes cepat, Sensor Sebelum Reaksi; Setelah Interaksi Dengan Albumin

0.0∞
Mean RGB
Mean Red
Mean Green
Mean Blue
∙∙∙ Linear(MeanRGB)
∙∙∙ Linear(MeanRed)
∙∙∙ Linear(MeanGreen)
∙∙∙ Linear(MeanBIue)
y = 0.019x+196.9
R = 0.714
y = 0.024x+155.6
R = 0.843
= 0.024x+128.6
R = 0.931
y = 0.030x+34.29
• R = 0.933
2∞.0∞ 4∞.0∞
6∞.0∞
8∞.0∞ l∞0.∞0 1200.∞0
Kadar (ppm)
Gambar 5. Respon sensor antara range 25 - 1000 µg / mL albumin, dimana mean RGB menunjukkan koefisien korelasi terbaik (r = 0,931). Percobaan dilakukan dalam tiga kali replikasi.
Optimasi Sensor
Perubahan warna respon sensor dari biru menjadi hijau, saat diuji dengan albumin (1000 µg / mL). Selain itu, metode adsorpsi dari imobilisasi digunakan dalam kasus ini. Kemudian dilakukan optimasi konsentrasi AgI dan MB untuk masing-masing dalam campuran serta rasio volumenya, nilai tersebut dapat mempengaruhi respon sensor. optimasi, konsentrasi optimum ditemukan pada 2000 ppm dan 1000 ppm dengan volume AgI dan MB 9: 2 (v / v) masing-masing untuk AgIdan MB karena rasio volume ini memberikan respon sensor yang optimal seperti yang ditunjukkan pada Gambar 6 Selain parameter diatas yang akan mempengaruhi sensor
albumin yang dibuat, parameter lain yang mungkin mempengaruhi respon sensor adalah pH. Di sini, pH antara 5 sampai 8 diuji menggunakan larutan buffer pH. Dalam kasus pH, respon sensor albumin dipengaruhi oleh pH 7 karena memiliki respon yang paling tinggi. seperti yang ditunjukkan pada Gambar 7. Oleh karena itu, sampel yang diuji perlu dikondisikan dengan buffer pH 7 seperti yang biasanya digunakan dalam banyak pengujian. (Gupta et al., 2011; Ajitha et al., 2015). Jadi, untuk percobaan lebih lanjut, data hasil optimasi didapatkan perubahan respon yang signifikan, sehingga sensor ini bekerja pada pH 7 yang merupakan respon paling tinggi.

ppm) 100μl ppm) 100μl ppm) 100μl ppm) 100μl
Gambar 6. Perubahan intensitas warna dengan kombinasi konsentrasi antara AgI dan MB pada kertas kolorimetri. Semua percobaan dilakukan dalam tiga kali replikasi.

Gambar 7. Pengaruh pH buffer terhadap perubahan warna sensor albumin antara pH 5 dan 8.
Karaketerisasi sensor
Waktu respons sensor diamati dalam 20 menit, dimana itu memberi respons stabil terhadap albumin ditunjukkan pada Gambar 8. Karakteristik waktu respon sensor AgI dan MB dari hasil pengamatan diperoleh pada menit ke 7 sudah didapatkan hasil yang relatif stabil.
Selektifitas sensor dilakukan melalui uji selektivitas terhadap efek potensial senyawa aktif lain dalam kandungan urin seperti NaCl, urea dan glukosa. Masing-masing senyawa dicampurkan dengan perbandingan 1:1, 1:10 dan 1:100. Hasil uji interferensi dari tiga bahan tersebut kurang dari 5% yang menunjukkan bahwa metode tersebut tidak memberikan gangguan pada analit. dan menunjukkan bahwa metode selektif di tunjukan pada Gambar 10 Standar selektivitas suatu metode analisis terhadap analit dapat digolongkan baik jika % interferensi < 5% (Jain and Mehata,
2017). Sinyal pengganggu, dihitung dengan mengurangkan perubahan intensitas warna dari zat pengganggu yang ditambahkan sampel dengan sampel asli, dan dibagi dengan perubahan intensitas warna dari sampel asli (Huber 2007) Hasil uji interferensi ditunjukkan pada Gambar 9.
Uji linieritas menunjukkan sensor memberikan respon linier pada konsentrasi 200-500 ppm pada menit ke 7 dengan nilai R2=0.977 sesuai Gambar 10. Hasil uji linieritas dilanjutkan dengan menganalisis nilai p dengan uji anova. Nilai p yang diperoleh dari penelitian ini adalah 2,55467x10-5 yang merupakan nilai dibawah α 0,01. Berdasarkan hasil nilai p maka tes cepat ini memiliki linieritas yang baik (IVT 2017) dengan batas deteksi sensor pada konsentrasi albumin sebesar 83,039 ppm dan batas kuantifikasi sensor adalah 249,12 ppm albumin.

Gambar 8. Respon waktu dari sensor albumin dalam 20 menit

Gambar 9. Hasil Uji Linearitas AgI + methylene blue (MB) terhadap perubahan warna (Δ RGB)
OJ
Q S→ O t
O
2.500
2.000
1.500
1.000
0.500
0.000
-0.500
-1.000

S
-1.500
-2.000
□ 11 □1 1' B
Gambar 10. Hasil Uji Selektifitas Sensor AgI + methylene blue (MB)
Sensor menunjukkan reprodusibilitas yang baik dengan nilai RSD yang dihitung sebesar 2.691%. Nilai reprodusibilitas ini diindikasikan bahwa sensor memiliki presisi yang baik untuk penentuan albumin (Huber 2007). Akurasi yang digunakan adalah dengan menggunakan teknik standart adisi dengan menghitung % recovery. nilai recovery (%) untuk akurasi sensor albumin dihitung sebesar 100.662%. nilai % recovery dalam 0,1% dari konsentrasi sampel yang diuji (95-105%) (Huber 2007). Hasil yang diperoleh menunjukkan sensor memiliki akurasi yang baik dalam penentuan kadar albumin.
Stabilitas sensor
Studi stabilitas sensor respon dilakukan pada suhu kamar (25OC). Respon sensor dievaluasi setiap hari hingga 10% respon sensor menurun dari nilai respon awal. Hasilnya menunjukkan bahwa sensor sangat stabil pada suhu ruang (25oC) sampai 5 bulan.
Aplikasi sensor
Langkah awal aplikasi sensor dalam penentuan albumin pada urin manusia dilakukan dengan membandingkan hasil sensor dengan metode standar. Metode standar yang digunakan yaitu metode spektrofotometer UV-VIS (Thomas, Reddy, and Devanna 2012). Berdasarkan uji-t berpasangan (Miller. James N and Miller 2010), kedua hasil ini tidak ditemukan perbedaan antara kedua metode, karena nilai p yang dihitung lebih dari α = 0,05 hasil tersebut ditunjukkan pada Tabel 1. Dengan demikian, dapat dinyatakan bahwa sensor albumin yang diusulkan sudah sesuai dengan metode standar spektrofotometer UV-VIS, dan dapat disarankan sensor albumin yang diusulkan dapat digunakan sebagai metode alternatif untuk penentuan albumin pada urin manusia.
Tabel 1. Hasil Pengukuran sensor di banding metode spektrofotometer Uv-Vis
|
Keterangan |
Spektrofotometer Uv-Vis P(T ≤ t) two-tail sensor (ppm) (ppm) |
|
Sampel 1 Sampel 2 Sampel 3 |
352,600±2,354 350,921±2,354 0,260 400,809±1,220 402,600±1,140 0,124 450,985±1,100 452,020±1,613 0,299± |
SIMPULAN
Pengembangan tes cepat untuk deteksi albuminuria berbasis AgI dan metilen biru telah berhasil dilakukan. Tes cepat ini memberikan hasil linier pada rentang 200-500 ppm dengan batas deteksi 83,039 ppm dan reprodusibilitas yang baik dengan nilai RSD sebesar 2.691%.
DAFTAR PUSTAKA
Ajitha, B., Reddy, Y. A. K., Reddy, P. S. 2015. Biosynthesis of Silver Nanoparticles Using Momordica Charantia Leaf Broth: Evaluation of Their Innate Antimicrobial and Catalytic Activities. J. Photochem. Photobiol. B: Biology. 146:1–9.
Boehmler, D. J., O’Dell, Z. J., Chung, C., Riley, K. R. 2020. Bovine Serum
Albumin Enhances Silver Nanoparticle Dissolution Kinetics in a Size- And Concentration-Dependent Manner.
Langmuir. 36(4):1053–61.
Gupta, N., Singh, H. P., Sharma, R. 2011. Metal Nanoparticles with High Catalytic Activity in Degradation of Methyl Orange: An Electron Relay Effect. J. Mol. Catal. A: Chem. (355):248–52.
Huber, L. 2007. Validation and Qualification in Analytical Laboratories. Second Edition. New York: Informa Healthcare USA, Inc.
IVT. 2017. Statisitics in Validation.
Jain, S., Mehata, M. S. 2017. Medicinal Plant Leaf Extract and Pure Flavonoid
Mediated Green Synthesis of Silver
Nanoparticles and Their Enhanced
Antibacterial Property. Scientific Reports. 7(1):1–13.
Ketha, H., Singh, R. J. 2016. Quantitation of Albumin in Urine by Liquid Chromatography Tandem Mass
Spectrometry. In: Garg, U. (eds) Clinical Applications of Mass Spectrometry in Biomolecular Analysis. Methods in Molecular Biology. 1378. New York: Humana Press New York.
Kundu, S., Ghosh, S. K., Mandal, M. 2002. Silver and Gold Nanocluster Catalyzed Reduction of Methylene Blue by Arsine in Micellar Medium. Bull. Mater. Sci. 25:577–79.
Kuritzky, L., Toto, R. Buren, P. V. 2011. Identification and Management of Albuminuria in the Primary Care Setting. J. Clin. Hypertens. 13(6):438–49.
Kuswandi, B. 2010. Sensor Kimia Teori, Praktek, Dan Aplikasi. Jember: Jember University Press.
Mallick, K., Witcomb, M., Scurrell, M. 2006. Silver Nanoparticle Catalysed Redox Reaction: An Electron Relay Effect, Mater. Chem. Phys. 97:283–87.
Miller. J. N and Miller, J. C. 2010. Statistics and Chemometrics for Analytical Chemistry. 46(6). England: Pearson
Education Limited.
Reis, P. B., Ramos, R. M., de Souza, L. F., Cançado, S. D. V. 2009. Validation of Spectrophotometric Method to Detect and Quantify Nitrite in Ham Pate. Braz. J. Pharm.Sci. 45(1):49-55.
Rodchenkov, G. M. 2008. Introduction of HPLC/Orbitrap Mass Spectrometry as Screening Method for Doping Control. J. Mass Spectrom. 43(7):949-57.
Thomas, C. T., Reddy, Y. P., Devanna, N. 2012. Impact of Cooking on Charantin Estimated From Bitter Melon Fruits Using High Performance Thin Layer Chromatography. 3(6):149–54.
Toblli, J. E., Bevione, P., Di Gennaro, F., Madalena, L., Cao, G., Angerosa, M. 2012. Understanding the Mechanisms of Proteinuria: Therapeutic Implications.
Int. J. Nephrol. 2012:1-13.
141
Discussion and feedback