IDENTIFIKASI SERTA UJI AKTIVITAS ANTIBAKTERI SENYAWA FLAVONOID EKSTRAK DAUN SRIKAYA (Annona squamosa Linn)
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 16 (1), JANUARI 2022 DOI: https://doi.org/10.24843/JCHEM.2022.v16.i01.p06
p-ISSN 1907-9850
e-ISSN 2599-2740
IDENTIFIKASI SERTA UJI AKTIVITAS ANTIBAKTERI SENYAWA FLAVONOID EKSTRAK DAUN SRIKAYA (Annona squamosa Linn)
I M. D. Swantara*, P. A. Damayanti dan I W. Suirta
Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Jimbaran, Bali, Indonesia
*Email: dira_swantara@unud.ac.id
ABSTRAK
Salah satu tanaman yang memiliki kandungan senyawa flavonoid yang sering dimanfaatkan sebagai obat tradisional di Indonesia adalah tanaman srikaya (Annona squamosa Linn). Isolasi, identifikasi serta uji aktivitas antibakteri senyawa flavonoid dari ekstrak daun srikaya terhadap bakteri Staphylococcus aureus dan Escherichia coli dengan metode sumur difusi telah dilakukan pada penelitian ini. Serbuk daun srikaya dengan kadar air 8% dimaserasi menggunakan metanol lalu dievaporasi hingga diperoleh ekstrak kental 113,85 g. Ekstrak tersebut dipartisi dengan pelarut n-heksana, etil asetat dan n-butanol yang menghasilkan 3,43 gram ekstrak n-heksana, 2,30 g ekstrak etil asetat dan 3,85 g ekstrak n-butanol. Uji fitokimia menunjukkan bahwa ekstrak etil asetat positif mengandung flavonoid dengan kadar total flavonoid terbanyak 26.117,4 mg QE/100 g. Isolat F5 hasil pemisahan serta pemurnian dari ekstrak etil asetat, positif mengandung flavonoid dan relatif murni secara kromatografi lapis tipis. Identifikasi isolat F5 dengan spektrofotometer UV-Visible dan Fourier-Transform Infrared (FTIR) menunjukkan dua pita serapan yaitu pada λ maks 376,40 nm (pita I) dan 256,40 nm (pita II) serta mengandung dugaan gugus fungsi yang terdapat dalam senyawa flavonoid yaitu OH, C=C aromatik, C-H alifatik, C-H aromatik, C-O eter dan C-O alkohol. Isolat tersebut mampu menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli pada konsentrasi 15% (b/v) dengan diameter hambat secara berturut-turut sebesar 7,75 mm dan 7,25 mm. Hasil ini menunjukkan bahwa senyawa flavonoid hasil isolasi dari ekstrak daun srikaya diduga adalah 5,3’,4’-trihidroksiflavonol dan mempunyai aktivitas antibakteri dengan daya hambat sedang.
Kata kunci: antibakteri, daun srikaya (Annona squamosa Linn), isolasi flavonoid, 5,3’,4’-trihidroksiflavonol.
ABSTRACT
One of the plants containing flavonoid compounds, commonly used as traditional medicine in Indonesia, is srikaya (Annona squamosa Linn). Isolation, identification and antibacterial activity test of flavonoid compounds from srikaya leaf extract against Staphylococcus aureus and Escherichia coli by using diffusion well method have been done in this research. Srikaya leaf powder with 8% moisture content was macerated with methanol then evaporated until concentrated extract of 113.85 grams was obtained. The extract was partitioned with n-hexane, ethyl acetate and n-butanol solvents and produced 3.43 grams of n-hexane extract, 2.30 grams of ethyl acetate extract and 3.85 grams of n-butanol extract. The phytochemical test showed that the ethyl acetate extract positively contained flavonoids with the highest total flavonoid levels of 26,117.4 mg QE/100 grams. Isolate F5, as the result of separation and purification of ethyl acetate extract, was positive containing flavonoids and resulting relatively pure isolate, analyzed by thin layer chromatography. Identification of isolate F5 using spectrophotometer UV-Visible and Fourier-Transform Infrared (FTIR) showed two absorption bands at λ max of 376.40 nm (band I) and 256.40 nm (band II) as well as contained functional groups of flavonoid which was OH, C=C aromatic, C-H aliphatic, C-H aromatic, C-O ether and C-O alcohol. These isolates were able to inhibit the growth of Staphylococcus aureus and Escherichia coli at the concentration of 15% (w/v) with inhibitory diameter of 7.75 and 7.25 mm, respectively. These results indicated that flavonoids isolated from srikaya leaf extract were suspected 5,3’,4’-trihydroxyflavonol and had antibacterial activity with moderate inhibitory ability.
Keywords: antibacterial, flavonoid isolation, srikaya leaf (Annona squamosa Linn),5,3’,4'-trihydroxyflavonol.
PENDAHULUAN
Penyakit infeksi merupakan penyebab utama tingginya angka kematian manusia, terutama di negara berkembang seperti Indonesia. Mikroba patogen penyebab utama dari penyakit infeksi adalah bakteri. Salah satu bakteri patogen penyebab infeksi pada manusia adalah bakteri Staphylococcus aureus dan Escherichia coli. Penyakit infeksi yang disebabkan oleh bakteri tersebut seringkali ditangani dengan pemberian antibiotik. Meskipun penggunaan antibiotik memberikan hasil yang memuaskan, penggunaannya harus dibatasi sebab penggunaan berlebihan dapat menimbulkan berkembangnya resistensi bakteri. Resistensi bakteri terhadap antibiotik tertentu mengakibatkan penggunaan antibiotik yang sama tidak lagi efektif untuk mengobati infeksi bakteri tersebut (Fischbach and Walsh, 2009). Metode alternatif yang dapat dilakukan untuk mengatasi permasalahan tersebut adalah dengan mengembangkan obat-obatan herbal yang berasal dari tumbuhan. Kandungan senyawa metabolit sekunder dalam tumbuhan sangat berperan penting dalam aktivitasnya sebagai antibakteri, salah satu diantaranya adalah flavonoid. Flavonoid mampu mengganggu fungsi metabolisme mikroorganisme dengan merusak dinding sel dan menghambat sintesis asam nukleat mikroorganisme (Priya et al., 2010). Flavonoid yang bereaksi dengan DNA bakteri menyebabkan terjadinya kerusakan permeabilitas dinding sel bakteri. Cincin A dan B senyawa flavonoid dapat menghambat sintesis asam nukleat bakteri dengan menumpuk basa asam nukleat melalui proses interkelasi atau ikatan hidrogen, sehingga menghambat pembentukan DNA dan RNA (Hendra et al., 2011).
Salah satu tanaman yang memiliki kandungan senyawa flavonoid serta dimanfaatkan sebagai obat tradisional di Indonesia adalah tanaman srikaya (Annona squamosa Linn). Sebagai antibakteri, srikaya memiliki spektrum yang luas dalam membunuh bakteri gram positif maupun gram negatif. Ekstrak etanol daun srikaya berpotensi menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli (Tansil et al., 2016). Hasil penelitian yang dilakukan oleh Gowdhami et al. (2014) menunjukkan bahwa ekstrak methanol dari daun srikaya mampu menghambat pertumbuhan bakteri E. coli, Klebsiela pneumonia, Vibrio
cholerae, Salmonella typhi, Salmonella paratyphi, dan Proteus mirabilis. Pawaskar and Sasangan (2017) melaporkan bahwa ekstrak metanol dari daun srikaya mampu menghambat pertumbuhan bakteri S. aureus, E. coli, S. typhi dan K. pneumonia, dengan diameter zona hambat yang berkisar antara 10-15 mm. Hasil penelitian di atas mengindikasikan bahwa daun srikaya memiliki aktivitas antibakteri, namun belum ada penelitian yang melaporkan aktivitas antibakteri dari isolat flavonoid dalam daun srikaya. Penelitian ini bertujuan untuk mengisolasi dan mengidentifikasi senyawa flavonoid dari ekstrak daun srikaya (Annona squamosa Linn) yang tumbuh di Bali serta mengetahui daya hambat senyawa flavonoid yang terkandung didalamnya terhadap pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli.
MATERI DAN METODE
Bahan
Bahan yang digunakan dalam penelitian ini adalah daun srikaya (Annona squamosa Linn) yang sudah berbuah, yang diperoleh dari Desa Seminyak, Kecamatan Kuta, Kabupaten Badung, Bali dan kultur murni Staphylococcus aureus dan Escherichia coli diperoleh dari Unit Pelaksana Teknis Daerah Balai Laboratorium Kesehatan Provinsi Bali. Bahan kimia yang digunakan yaitu metanol (teknis), n-heksana (teknis dan p.a), etil asetat (teknis dan p.a), n-butanol (p.a), kloroform (p.a), akuades, kalium asetat, aluminium klorida, etanol 95%, Tween 80, media Nutrient Agar (NA), Nutrient Broth (NB), asam klorida, kuersetin, AlCl3 2%, kertas saring, kapas, aluminium foil, plat KLT, pereaksi geser (aluminium klorida, natrium hidroksida, natrium asetat dan asam borat), natrium hidroksida 10%, pereaksi Wilstatter, pereaksi Bate-Smith-Metcalfe, silika gel GF254, silica gel G60 dan kalium bromida.
Peralatan
Alat-alat yang digunakan yaitu cawan petri, cawan porselin, desikator, gunting, cork borer, jarum ose, batang pengaduk, blender, penangas air, pinset, pipet volume, pipa kapiler, statif dan klem, corong pisah, pipet ukur, pipet mikro beserta tip (Eppendorf), tabung reaksi, pipet tetes, vortex, plat tetes, gelas ukur, labu erlenmeyer, gelas kimia, neraca analitik, penguap putar vakum, labu ukur, autoklaf, bejana KLT, oven, kolom kromatografi,
spektrofotometer UV-Vis (Shimadzu/UV-1800) dan FTIR (Shimadzu IR Prestige-21).
Cara Kerja
Maserasi daun srikaya
Daun srikaya segar dipotong kecil lalu dikeringkan tanpa terkena sinar matahari langsung, kemudian diblender dan diayak dengan saringan hingga menjadi serbuk. Sebanyak 1.000 gram serbuk daun srikaya dimaserasi dengan metanol teknis sampai terendam lalu dibiarkan selama 24 jam, sambil sesekali diaduk kemudian disaring. Proses maserasi ini diulangi sebanyak 7 kali. Filtrat yang terkumpul diuapkan pelarutnya dengan penguap putar vakum, sehingga diperoleh ekstrak kental yang siap untuk diuji aktivitas antibakterinya.
Uji aktivitas antibakteri ekstrak metanol daun srikaya
Uji aktivitas antibakteri dilakukan dengan metode sumur difusi. Cawan petri yang telah berisi 10 mL media NA dan 200 µL suspensi masing-masing bakteri dibiarkan memadat, setelah padat dibuat sumur difusi masing-masing sebanyak 2 buah pada petri dengan menggunakan cork borer. Sebanyak 1 gram ekstrak metanol daun srikaya dilarutkan dalam 1 mL tween 10% (v/v) untuk membuat larutan stok 100% (b/v). Setiap sumur difusi diisi dengan 20 µL larutan stok 100% (b/v), kemudian diinkubasi pada temperatur kamar selama 24 jam. Setelah 24 jam, dilakukan pengamatan daya hambat pada masing-masing petri, lalu dilanjutkan dengan penentuan konsentrasi hambat minimumnya.
Penentuan konsentrasi hambat minimum ekstrak metanol daun srikaya
Penentuan konsentrasi hambat minimum (KHM) dari ekstrak metanol daun srikaya dilakukan dengan metode sumur difusi dengan variasi konsentrasi : 100%, 75%, 50%, 25%, 20%, 15%, 10% dan 0% (v/v) sebagai kontrol. Pengenceran larutan stok 100% (b/v) dilakukan dengan menggunakan tween 10% (v/v) yang juga digunakan sebagai kontrol negatif.
Partisi ekstrak metanol daun srikaya
Sebanyak 96,78 gram ekstrak kental metanol daun srikaya dilarutkan dalam 100 mL campuran metanol-air (7:3), kemudian metanolnya diuapkan dalam penguap putar
vakum sehingga diperoleh ekstrak air. Ekstrak air tersebut kemudian dipartisi dengan 50 mL pelarut n-heksana, etil asetat dan n-butanol dan 10 kali pengulangan lalu ketiga fraksi tersebut dievaporasi, sehingga diperoleh ekstrak kental n-heksana, etil asetat, dan n-butanol.
Uji fitokimia dan penentuan kadar total flavonoid
Ekstrak n-heksana, etil asetat dan n-butanol daun srikaya diuji fitokimia menggunakan pereaksi golongan flavonoid yaitu, pereaksi NaOH 10%, pereaksi Wilstatter dan pereaksi Bate-Smith-Metcalfe. Ketiga ekstrak hasil partisi tersebut kemudian ditentukan kadar total flavonoidnya dengan metode kolorimetri-AlCl3 mengikuti prosedur dari Chang et al. (2002). Pembuatan larutan uji dilakukan dengan menimbang 0,01 gram ekstrak daun srikaya dilarutkan dalam 5 mL etanol, kemudian divorteks sampai homogen. Larutan uji tersebut dipipet 2,0 mL dan dimasukkan ke dalam tabung reaksi lalu ditambahkan dengan 2,0 mL AlCl3 2% kemudian divortex hingga homogen dan diinkubasi pada suhu kamar selama 25 menit. Selanjutnya, pengukuran absorbansi dilakukan pada panjang gelombang maksimum 415 nm. Kadar total flavonoid diperoleh melalui hasil integrasi dengan kurva kalibrasi dari larutan standar kuersetin yang dibuat dengan variasi konsentrasi 0 ppm, 4 ppm, 8 ppm, 12 ppm, 16 ppm dan 20 ppm. Ekstrak dengan kadar flavonoid paling tinggi, kemudian diuji aktivitas antibakterinya terhadap bakteri S. aureus dan E. coli lalu dilanjutkan untuk proses pemisahan dan pemurnian.
Pemisahan dan pemurnian
Pemisahan dan pemurnian senyawa flavonoid dilakukan menggunakan kromatografi kolom dan kromatografi lapis tipis dengan multi eluent. Fase gerak yang digunakan dalam kromatografi kolom adalah campuran n-heksana:kloroform (7:3). Fraksi yang memiliki kadar total flavonoid tertinggi dan relatif murni secara KLT diidentifikasi senyawa golongan flavonoidnya dengan uji fitokimia serta spektrofotometer FTIR dan UV-Vis.
Identifikasi flavonoid
Identifikasi flavonoid pada isolat dilakukan dengan uji fitokimia flavonoid serta menggunakan spektrofotometer FTIR dan UV-Vis dengan penambahan pereaksi geser
aluminium klorida, natrium hidroksida, natrium asetat dan asam borat. Isolat flavonoid yang diperoleh kemudian diuji aktivitas antibakterinya terhadap bakteri S. aureus dan E. coli.
HASIL DAN PEMBAHASAN
Maserasi Daun Srikaya
Serbuk daun srikaya kering dengan persentase kadar air 8% yang dimaserasi menggunakan metanol menghasilkan filtrat berwarna hijau tua sebanyak 5 L. Hasil evaporasi filtrat menghasilkan 104,61 gram ekstrak kental metanol dengan persentase rendemen sebesar 10,46%.
Uji Aktivitas Antibakteri dan Penentuan Konsentrasi Hambat Minimum Ekstrak Metanol Daun Srikaya
Pengujian aktivitas antibakteri dari ekstrak metanol daun srikaya dilakukan terhadap konsentrasi 100%, 75%, 50%, 25%, 20%, 15%, 10% dan 0% (v/v). Konsentrasi dibuat beragam dengan tujuan untuk menentukan konsentrasi terendah dari ekstrak metanol daun srikaya yang dapat menghambat pertumbuhan dari bakteri uji S. aureus dan E. coli. Penentuan Konsentrasi Hambat Minimum (KHM) dari ekstrak metanol daun srikaya terhadap bakteri S. aureus dan E. coli dapat dilihat pada Tabel 1.
Tabel 1. Penentuan Konsentrasi Hambat
Minimum (KHM) dari ekstrak methanol daun srikaya terhadap bakteri S. aureus dan E. coli
|
Konsentrasi (%) |
Diameter Zona S. aureus |
Hambat (mm) E. coli |
|
100 |
14,00 |
12,25 |
|
75 |
13,50 |
11,25 |
|
50 |
12,75 |
10,75 |
|
25 |
11,50 |
9,75 |
|
20 |
9,75 |
9,25 |
|
15 |
7,75 |
7,50 |
|
10 |
0,00 |
0,00 |
|
0 |
0,00 |
0,00 |
Konsentrasi Hambat Minimum dari ekstrak metanol daun srikaya terhadap bakteri S. aureus dan E. coli adalah pada konsentrasi 15% (v/v) dengan diameter zona hambatnya secara berturut-turut sebesar 7,75 mm dan 7,50 mm. Diameter zona hambat dari KHM tersebut tergolong memiliki daya hambat sedang (Ardiansyah, 2005).
Partisi Ekstrak Metanol Daun Srikaya
Partisi yang dilakukan menggunakan pelarut n-heksana menghasilkan 3,43 gram ekstrak kental n-heksana. Pelarut etil asetat menghasilkan 2,30 gram ekstrak kental etil asetat. Partisi yang dilakukan menggunakan pelarut n-butanol menghasilkan 3,85 gram ekstrak kental n-butanol. Ketiga ekstrak hasil partisi dilanjutkan untuk diuji fitokimia flavonoid dan ditentukan juga kadar total flavonoidnya.
Uji Fitokimia dan Penentuan Kadar Total Flavonoid
Hasil pengujian fitokimia senyawa flavonoid dengan menggunakan pereaksi NaOH 10%, Bate-Smith-Metchalfe dan Wilstater terhadap ekstrak etil asetat dan n-butanol menunjukkan perubahan warna spesifik yang disesuaikan dengan tabel reaksi warna flavonoid oleh Geismann (1962) dan menunjukkan hasil positif flavonoid. Sementara itu, ekstrak n-heksana menunjukkan hasil negatif karena tidak menunjukkan perubahan warna spesifik saat direaksikan dengan ketiga pereaksi. Hasil pengujian fitokimia flavonoid secara kualitatif dilanjutkan dengan pengujian secara kuantitatif melalui penentuan kadar total flavonoid untuk memperkuat hasil dugaan yang diperoleh. Penentuan kadar total flavonoid dilakukan dengan metode kolorimetri-aluminium klorida (AlCl3) dan kuersetin sebagai standar. Kurva regresi linier dari absorbansi kuersetin yang diukur menghasilkan persamaan regresi y = 0,0022x - 0,0001. Persamaan tersebut digunakan untuk menentukan kadar total flavonoid dari ketiga ekstrak. Hasil penentuan kadar total flavonoid dari ketiga ekstrak tersebut dipaparkan pada Tabel 2. Ekstrak etil asetat daun srikaya yang memiliki kadar total flavonoid tertinggi, dilanjutkan untuk diisolasi senyawa flavonoidnya.
|
Tabel 2. Kadar Total Flavonoid Ekstrak Daun Srikaya | ||
|
Ekstrak |
Total Senyaw % |
a Flavonoid (QE) mg/100 g |
|
N-heksana |
8,9261 |
8.926,1 |
|
Etil Asetat |
26,1174 |
26.117,4 |
|
N-butanol |
21,7299 |
21.729,9 |
Pemisahan dan Pemurnian
Pemisahan dan pemurnian ekstrak etil asetat dengan kandungan total flavonoid
tertinggi dilakukan dengan metode kromatografi, sebagai berikut :
Kromatografi lapis tipis
Kromatografi lapis tipis silika GF254 digunakan untuk memperoleh fase gerak yang dapat memisahkan senyawa-senyawa yang terdapat pada sampel, melalui nilai Rf dari noda yang tampak ketika plat disinari sinar UV dengan panjang gelombang 366 nm. Ekstrak etil asetat daun srikaya dapat dipisahkan dengan baik menggunakan fase gerak campuran kloroform : n-heksana (7:3), karena menghasilkan 11 noda dengan jarak pemisahan yang relatif baik. Fase gerak tersebut kemudian digunakan untuk memisahkan ekstrak etil asetat menggunakan kromatografi kolom.
Kromatografi kolom
Fase diam yang digunakan dalam kromatografi kolom adalah silika gel 60 dan fase geraknya menggunakan fase gerak terbaik hasil kromatografi lapis tipis yaitu kloroform : n-heksana (7:3). Silika gel 60 bersifat polar sehingga, senyawa yang akan keluar terlebih dahulu adalah senyawa yang bersifat non polar dan semi polar. Pemisahan komponen-komponen ekstrak etil asetat daun srikaya menggunakan kromatografi kolom menghasilkan 160 botol eluat yang digabungkan menjadi 6 fraksi (F1, F2, F3, F4, F5 dan F6) berdasarkan persamaan pola noda yang dihasilkan. Hasil penggabungan fraksi kromatografi kolom ditunjukkan pada Tabel 3.
Keenam fraksi yang diperoleh diuji kadar total flavonoidnya dan diperoleh kadar total flavonoid tertinggi pada fraksi F5 yaitu 0,01210%g/100 mL QE atau setara dengan 121,0101 mg/L QE. Fraksi tersebut dilanjutkan untuk diuji kemurniannya menggunakan kromatografi lapis tipis dengan multi eluent.
Fraksi kelima (F5) diuji kemurniannya menggunakan Kromatografi Lapis Tipis (KLT) dengan berbagai fase gerak antara lain, kloroform : n-heksana (7:3), kloroform, etanol, etil asetat dan kloroforom : n-heksana : etil asetat (6:2:2). Fraksi F5 dapat dikatakan murni secara KLT karena menghasilkan satu noda dengan berbagai fase gerak, sehingga fraksi F5 dapat dilanjutkan untuk identifikasi senyawa flavonoidnya menggunakan spektrofotometer FTIR dan UV-Vis.
Identifikasi Flavonoid
Uji fitokimia
Hasil pengujian isolat F5 terhadap pereaksi Bate-Smith-Metchalfe dan NaOH 10% menunjukkan perubahan warna menjadi kuning, sedangkan terhadap pereaksi Wilstatter menunjukkan perubahan warna menjadi merah. Berdasarkan pada tabel reaksi warna flavonoid oleh Geissman (1962), fraksi kelima (F5) diduga senyawa flavonoid golongan flavonol. Identifikasi dilanjutkan dengan menggunakan spektrofotometer FTIR dan UV-Vis dengan penambahan pereaksi geser untuk memperkuat dugaan yang diperoleh.
Spektrofotometer UV-Vis
Spektrum UV-Vis dari isolat F5 dalam pelarut metanol ditunjukkan pada Gambar 1. Isolat F5 menunjukkan dua pita serapan maksimum yaitu pada panjang gelombang 256,40 nm (pita II) dan 376,40 nm (pita I). Berdasarkan hasil pita serapan yang diperoleh, isolat F5 kemungkinan merupakan senyawa flavonoid golongan flavonol dengan 3-OH bebas (Markham,1988). Hasil identifikasi ini semakin memperkuat dugaan hasil uji fitokimia bahwa isolat F5 merupakan senyawa flavonoid golongan flavonol.
Uji kemurnian
Tabel 3. Hasil penggabungan fraksi kromatografi kolom dengan KLT penggabungan
|
Fraksi |
Botol ke- |
Warna Eluat |
Jumlah Noda |
|
F1 |
3-5 |
Kuning |
1 |
|
F2 |
6-30 |
Hijau tua |
4 |
|
F3 |
31-72 |
Hijau muda |
3 |
|
F4 |
73-104 |
Kuning muda |
1 |
|
F5 |
105-160 |
Kuning muda |
1 |
|
F6 (etanol) |
- |
Cokelat |
3 |
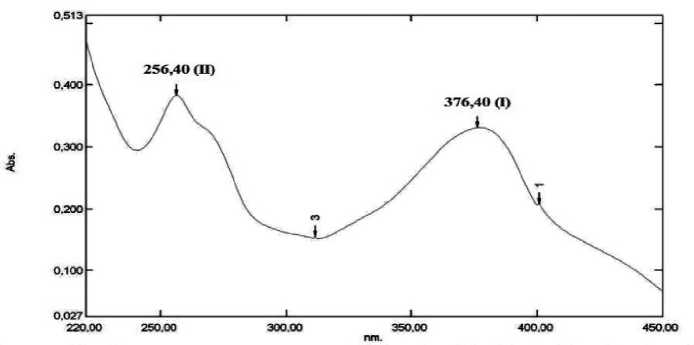
Gambar 1. Spektrum UV-Vis isolat F5
Posisi gugus hidroksi pada inti flavonoid dianalisis dengan penambahan pereaksi geser seperti natrium hidroksida (NaOH) dalam pelarut metanol, aluminium klorida (AlCl3), aluminium klorida dan asam klorida (AlCl3/HCl) natrium asetat (NaOAc), serta natrium asetat dan asam borat (NaOAc/H3BO3). Data pergeseran panjang gelombang setelah penambahan pereaksi geser ditunjukkan pada Tabel 5.
Tabel tersebut menunjukkan pergeseran hipsokromik pada pita I setelah penambahan pereaksi geser NaOH yang disertai dengan penurunan intensitas setelah didiamkan selama 5 menit. Pengamatan tersebut menunjukkan dugaan adanya gugus hidroksi pada posisi C-3 dan C-4’. Penambahan pereaksi geser AlCl3 pada isolat F5 mengakibatkan terjadinya pergeseran batokromik pada pita I. Hal ini mengindikasikan kemungkinan adanya gugus orto-dihidroksi pada cincin B yaitu pada posisi C-3’ dan C-4’. Penambahan AlCl3 dan HCl pada
isolat F5 mengakibatkan terjadinya pergeseran batokromik pada pita I. Hal ini menandakan kemungkinan adanya gugus hidroksi pada cincin A yaitu pada posisi C-5. penambahan pereaksi NaOAc pada isolat F5 adalah terjadinya pergeseran batokromik pada pita II. Pergeseran yang terlalu kecil ini kemungkinan menandakan tidak adanya gugus hidroksi pada posisi C-7. Penambahan pereaksi geser NaOAc dan H3BO3 menyebabkan terjadinya pergeseran batokromik pada pita I. Hasil tersebut mengindikasikan kemungkinan adanya gugus orto-dihidroksi di posisi C-3’ dan C-4’ pada cincin B (Markham,1988). Berdasarkan identifikasi isolat F5 menggunakan spektrofotometer UV-Vis dengan pereaksi geser, mengindikasikan bahwa isolat F5 kemungkinan mengandung senyawa flavonoid golongan flavonol dengan posisi gugus hidroksi pada C5, C3’ dan C4’. Dugaan struktur isolat F5 ditunjukkan pada Gambar 2.
Tabel 5. Data panjang gelombang dan pergeseran panjang gelombang isolat F5 setelah penambahan pereaksi geser
|
Pereaksi geser |
Panjang gelombang λmaks (nm) |
Geseran panjang gelombang λmaks (nm) | ||
|
Pita I |
Pita II |
Pita I |
Pita II | |
|
Isolat F5 |
373,80 |
255,60 |
- |
- |
|
Isolat F5 + NaOH |
331,40 |
- |
-42,4 |
- |
|
Isolat F5 + NaOH (5 menit) |
329,40 |
- |
-44,4 |
- |
|
Isolat F5 |
376,00 |
256,00 |
- |
- |
|
Isolat F5 + AlCl3 |
436,80 |
269,60 |
+60,8 |
+13,6 |
|
Isolat F5 + AlCl3 + HCl |
428,60 |
264,80 |
+52,6 |
+8,8 |
|
Isolat F5 |
374,60 |
255,80 |
- |
- |
|
Isolat F5 + NaOAc |
379,00 |
256,20 |
+4,4 |
+0,4 |
|
Isolat F5 + NaOAc + H3BO3 |
386,60 |
259,40 |
+12,0 |
+3,6 |

Gambar 2. Dugaan Struktur Senyawa 5,3’,4’-trihidroksiflavonol
Spektrofotomer FTIR
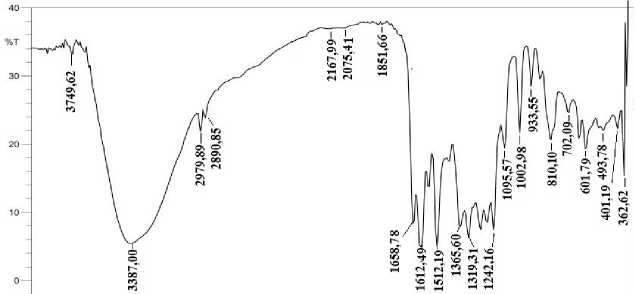
Spektrum inframerah isolat F5 ditunjukkan pada Gambar 3. Hasil identifikasi menggunakan spektrofotometer FTIR mendukung dugaan bahwa isolat F5 merupakan senyawa flavonoid golongan flavonol dengan menunjukkan dugaan gugus fungsi antara lain, regang O-H terikat pada 3.749,62 cm-1, regang O-H bebas pada bilangan gelombang 3.387,00
cm-1 yang diperkuat dengan munculnya lentur OH alkohol pada bilangan gelombang 1.365,60 dan 1.319,31 cm-1 serta lentur C-O alkohol pada bilangan gelombang 1.242,16 dan 1.165,10 cm-1, regang C-H alifatik pada 2.979,89 cm-1 dan 2.890,85 cm-1, regang C=C aromatik pada 1.658,78, 1.612,49 dan 1.5112,19 cm-1, lentur CH aromatik pada 933,55 – 702,09 cm-1, dan lentur C-O eter pada 1.095,57 cm-1.
4000 3500 3000 2500 2000 1500 1000 500
Gambar 3. Spektrum inframerah isolat F5
Uji Aktivitas Antibakteri Ekstrak Etil Asetat dan Isolat F5
Ekstrak etil asetat sebagai fraksi flavonoid dan isolat F5 sebagai isolat flavonoid daun srikaya dibandingkan aktivitas antibakterinya terhadap bakteri S. aureus dan E. coli pada konsentrasi 15% (b/v). Konsentrasi 15% (b/v) dipilih berdasarkan hasil penentuan konsentrasi hambat minimum dari ekstrak metanol daun srikaya terhadap bakteri yang sama. Hasil pengujian ketiga ekstrak tersebut disajikan dalam Tabel 6,
yang menunjukkan bahwa senyawa flavonoid yang terkandung dalam ekstrak etil asetat daun srikaya bekerja secara sinergis dengan senyawa-senyawa semi polar lainnya yang terkandung di dalamnya sehingga ekstrak tersebut lebih aktif sebagai antibakteri dibandingkan dengan isolat F5. Diameter zona hambat isolat F5 15% (b/v) terhadap bakteri S. aureus dan E. coli masing-masing sebesar 7,75 mm dan 7,25 mm dan mengindikasikan bahwa daya hambat isolat F5 15% (b/v) terhadap bakteri S. aureus dan E. coli tergolong sedang (Ardiansyah, 2005).
Tabel 6. Uji Aktivitas Antibakteri Ekstrak Metanol, Ekstrak Etil Asetat dan
Isolat F5 Daun Srikaya terhadap bakteri S. aureus dan E. coli
|
Sampel Uji |
Konsentrasi (b/v) |
Diameter zona hambat (mm) | |
|
S. aureus |
E. coli | ||
|
Ekstrak Metanol |
15% |
7,75 |
7,50 |
|
Ekstrak Etil Asetat |
15% |
11,00 |
8,25 |
|
Isolat F5 |
15% |
7,75 |
7,25 |
SIMPULAN
Senyawa flavonoid yang berhasil diisolasi dari ekstrak daun srikaya diduga merupakan senyawa flavonoid golongan flavonol dengan dugaan struktur senyawa 5,3’,4’-trihidroksiflavonol. Dugaan senyawa flavonoid yang berhasil diisolasi tersebut memiliki daya hambat sedang terhadap pertumbuhan bakteri S. aureus dan E.coli dengan diameter hambat pada konsentrasi 15% (b/v) sebesar 7,75 mm dan 7,25 mm.
DAFTAR PUSTAKA
Ardiansyah. 2005. Daun Beluntas Sebagai Bahan Antibakteri dan Antioksidan. http://www.beritaiptek.com. Diakses tanggal 14 April 2019.
Chang, C., Yang M., and Wen H. C. J. 2002. Estimation of Total Flavonoid Content in Propolis by Two Complementary Colorimetric Methods. J.Food Drug Anal. 10: 178-182
Fischbach, M. A., and Walsh T. 2009. Antibiotics for Emerging Pathogen. Journal of Science. 325(5944): 1089-1093
Geissman, T. A. 1962. The Chemistry of Flavonoid Compound. New York: The Mac Millan Company.
Gowdhami, M., Sarkar B. L., and Ayyasamy P.
M. 2014. Screening of Phytochemicals and Antibacterial Activity Of Annona
squamosa Extracts. International Journal of Pharmaceutical Science Invention. 3(7): 30-39.
Hendra, R., Ahmad S., Sukari A., Shukor M.Y., and Oskoueian E. 2011. Flavonoid analysis and antimicrobial activity of various parts of Phaleria macrocarpa (Scheff) Boerl fruit. International Journal Molecular Science. 12: 34223431
Markham, K.R. 1988. Cara Mengidentifikasi Flavonoid. Bandung: A.B. Kosasih Padmawinata, Institut Teknologi Bandung.
Pawaskar, S. M., and Sasangan K. C. 2017. Preliminary Phytochemical and Invitro Antimicrobial analysis of Annona squamosa Linn. leaf extract. Journal of Pharmaceutical Sciences and Research. 9(5): 618-623
Priya, V. M., Jainu S. K., Mohan, Saraswhati, and Gopan C.S. 2010. Antimicrobial
Activity of Pericarp Extract of Garcinia mangostana Linn. International
Journal of Pharma Sciences and Research. 1(8): 278-281.
Tansil, A. Y. M., Edward N., Jimmy P., dan Robert. A. B. 2016. Uji Daya Hambat Ekstrak Etanol Daun Srikaya (Annona squamosa) Terhadap Pertumbuhan
Bakteri Escherichia coli dan Staphylococcus aureus. Journal e-Biomedik. 4(2): 1-5.
52
Discussion and feedback