AKTIVITAS ANTIOKSIDAN DAN ANTIBAKTERI DARI FRAKSI EKSTRAK METANOL KULIT BATANG KESAMBI (Shleichera Oleosa)
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 16 (1), JANUARI 2022 DOI: https://doi.org/10.24843/JCHEM.2022.v16.i01.p07
p-ISSN 1907-9850
e-ISSN 2599-2740
AKTIVITAS ANTIOKSIDAN DAN ANTIBAKTERI DARI FRAKSI EKSTRAK METANOL KULIT BATANG KESAMBI (Shleichera Oleosa)
B. Situmeang1, Ilham1, A. M. Ibrahim1, F. Amin1, M. Mahardika1, N. Bialangi2 dan W. J. A.
Musa2
1Program Studi Kimia, Sekolah Tinggi Analis Kimia Cilegon, Banten, Indonesia 2Program Studi Kimia, Universitas Negeri Gorontalo, Gorontalo, Indonesia
*Email: boimatumeang@gmail.com
ABSTRAK
Tumbuhan kesambi (Schleichera oleosa) merupakan tumbuhan obat yang termasuk dalam family Sapindaceae, yang banyak tersebar di wilayah Asia seperti India, Nepal, Malaysia, dan Indonesia. Di Indonesia tumbuhan kesambi dapat ditemukan di pulau Jawa dan Bali. Penelitian ini bertujuan untuk menguji aktivitas antioksidan dan antibakteri serta skrining fitokimia fraksi dari ekstrak metanol kulit batang kesambi (Schleichera oleosa). Ektraksi sampel dilakukan menggunakan metode maserasi, sedangkan pemisahan dan analisis fraksi menggunakan metode kromatografi. Aktivitas antioksidan diuji menggunakan metode DPPH dengan kontrol positif vitamin C. Uji aktivitas antibakteri terhadap bakteri Staphylococus aureus dilaksanakan menggunakan metode optical density dengan kontrol positif yaitu ciprofloxacin. Rendemen ekstrak kental metanol diperoleh sebesar 15,5 %. Dari pemisahan dengan kromatografi kolom diperoleh sebanyak 7 fraksi. Hasil uji aktivitas antioksidan menunjukkan fraksi 3 memiliki % inhibisi 69,66 % dengan nilai IC50 sebesar 3,78 ppm. Sedangkan hasil uji antibakteri menunjukkan bahwa fraksi 5 dan 7 memiliki penghambatan terhadap bakteri S.aureus yang paling tinggi dengan inhibisi sebesar 59,76 %. Hasil skrinig fitokimia fraksi 3, 5, dan 7 menunjukkan positif golongan senyawa flavanoid dan fenolik.
Kata kunci: antibakteri, antioksidan, kesambi, Schleichera oleosa, Staphylococcus aureus
ABSTRACT
Kesambi plant (Schleichera oleosa) is a medicinal plant belongs to family Sapindaceae, commonly found in Asian like India, Nepal, Malaysia and Indonesia. In Indonesia, kesambi plants can be found in Java and Bali islands. The purpose of this research was to do antioxidant and antibacterial activity tests, as well as phytochemical screening of kesambi steam bark. The extraction was done using maceration method while the purification and analysis of the fractions was carried out using chromatography thin lawyer. Antioxidant activity was tested using DPPH method with vitamin C as positive control. Antibacterial activity test against Staphylococus aureus was done using optical density method with ciprofloxacin as positive control. The recovery of methanol extraction was 15.5%. Purification of the methanol extract resulted in 7 fractions. The antioxidant activity test showed that fraction 3 had the highest inhibition valueof 69.66% with IC50 value of 3.78 ppm. Antibacterial activity test against S.aureus indicated that fraction 5 and 7 had the highest inhibition value of 59.76%. The result of phytochemical screening showed that fraction 3, 5 and 7 contained flavonoid and phenolic compounds.
Keywords: antibacterial, antioxidant, kesambi, Schleichera oleosa, Staphylococcus aureus
PENDAHULUAN
Tumbuhan kesambi (Schleichera oleosa) merupakan tumbuhan yang banyak tersebar di wilayah Asia seperti India, Nepal, Malaysia, dan Indonesia (Patra et al., 2012). Di Indonesia tumbuhan kesambi banyak terdapat di pulau Jawa tepatnya provinsi Banten, Jawa Timur, dan Bali. Penelitian Srinivas & Baboo (2013),
melaporkan aktivitas antioksidan dari ekstrak etanol kulit batang kesambi dengan nilai IC50 151,59 ppm. Penelitian Situmeang et al (2016), juga melaporkan bahwa tanaman kesambi telah dimanfaatkan untuk melawan radang kulit, bisul, gatal, jerawat, dan infeksi kulit. Berdasarkan hasil uji fitokimia ekstrak kulit batang kesambi mengandung senyawa golongan triterpenoid, steroid, flavonoid dan fenolik (Situmeang dkk, 2016). Antioksidan merupakan
senyawa pendonor electron atau reduktan yang dapat menghambat perkembangan senyawa radikal bebas. (Sunardi, 2007). Radikal bebas merupakan senyawa kimia yang kehilangan satu elektron dari pasangan elektron bebasnya. Radikal bebas yang reaktif akan menyerang satu elektron senyawa nonradikal berupa protein, lemak, karbohidrat, dan DNA agar menjadi netral. Senyawa radikal bebas secara umum masuk kedalam tubuh dan menyerang senyawa nonradikal dan merusak sel-sel yang netral menjadi senyawa yang radikal. Kerusakan yang disebabkan oleh senyawa radikal tersebut bisa menyebabkan stress oksidatif yang berkontribusi terhadap beberapa penyakit seperti diabetes, kanker dan tumor. Selain itu juga menyebabkan penuaan dini (Liochev, 2013).
Infeksi bakteri dapat terjadi karena adanya bakteri yang masuk ke dalam aliran darah melalui mulut atau kulit. Sistem imunitas tubuh dapat dengan cepat bertindak ketika jumlah koloni bakteri yang masuk hanya sedikit dan dalam keadaan normal. Namun, infeksi serius bisa terjadi apabila jumlah koloni bakteri yang masuk ke dalam aliran darah dalam jumlah yang banyak dan bisa menyebabkan infeksi serius (Roslizawati dkk, 2013).
Di Indonesia, jumlah penderita penyakit infeksi bakteri masih cukup tinggi, yakni mencapai 50-70 %. Menurut Wibowo (2006), penyakit infeksi bakteri yang paling banyak disebabkan oleh bakteri gram positif yaitu 54,4%. Bakteri Staphylococcus aureus merupakan bakteri gram positif yang menjadi penyebab terjadinya penyakit infeksi pada kulit (Nurlaeli, 2015).
Bakteri Staphylococcus aureus merupakan bakteri gram positif coccus yang tidak berflagel, dan tidak berspora. Bakteri Staphylococcus aureus bersifat patogen sehingga dapat merusak inangnya. Bakteri Staphylococcus aureus dapat menghasilkan koagulase yang mampu menimbulkan hemolisis terhadap sel darah merah dan lebih cenderung dapat menghasilkan pigmen kuning emas (Jawetz et al., 2008).
Senyawa metabolit sekunder pada tumbuhan seperti flavonoid dan fenolik mempunyai kemampuan sebagai antioksidan (Kolak et al., 2005; Urzua et al., 2008). Di Indonesia, studi kimia dan farmakologi tumbuhan kesambi belum banyak dilakukan. Sampai saat ini uji aktivitas antioksidan dan antibakteri pada kulit batang kesambi hanya
dilakukan pada ekstraknya saja, belum sampai ke fraksi. Berdasarkan penelusuran pustaka penelitian tentang kulit batang kesambi baik di Indonesia maupun di luar Negeri masih terbatas, sehingga uji aktivitas antioksidan dan antibakteri pada fraksi kulit batang kesambi harus dilakukan.
Penelitian ini diharapkan mampu memberikan informasi mengenai fraksi yang memiliki aktivitas antioksidan dan antibakteri dari kulit batang kesambi asal kota Cilegon. Selanjutnya diharapkan dapat meningkatkan nilai sumber daya alam dari tumbuhan kesambi asal kota Cilegon.
MATERI DAN METODE
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah kulit batang kesambi (Schleichera oleosa) yang diambil dari desa Cimerak, Cilegon Banten. Bahan kimia yang digunakan terdiri dari metanol 96%, n-Heksan, etil asetat, etanol 70%, aquadest, HCl pekat (p.a), H2SO2 98% (p.a), silika gel G60, alumunium foil, serbuk Mg, FeCl3 10%, bakteri Staphylococcus aureus, ciprofloxacin, vitamin C (asam askorbat), lactoce broth dan DPPH.
Alat yang digunakan dalam penelitian ini adalah vacum rotary evaporator, blender, neraca analitik, alat gelas, kain saring, wadah maserator, vial, pipet tetes, plat KLT, chamber, pipa kapiler, spatula, batang pengaduk, botol timbang, botol semprot, autoclave, tabung reaksi, kawat ose, oven, inkubator, spektrofotometri UV-Visible, dan cuvet.
Cara Kerja
Preparasi Sampel
Sampel kulit batang kesambi (Schleichera oleosa), didapat dari Cimerak, Cilegon-Banten. Sampel dikeringankan pada suhu ruang 19ºC-30ºC selama dua hari. Selanjutnya sampel kulit batang kesambi ditumbuk sampai didapat serbuk kulit batang kesambi (Schleichera oleosa).
Ekstraksi Kulit Batang Kesambi
Sebanyak 1,5 kg sampel kulit batang kesambi yang sudah dikeringkan dalam suhu ruang dimaserasi secara bertingkat. Pelarut yang digunakan adalah n-heksana, etil asetat, dan metanol. Ekstraksi dilakukan dalam 2 x 24 jam untuk setiap pelarut dan dilakukan pengadukan sampel tiap 6 jam. Setelah 2 x 24 jam dilakukan
penyaringan terhadap sampel. Hasil maserasi ekstrak dievaporasi dengan vacum rotary evaporator dan diperoleh ekstrak n-heksana sebanyak 10 g, etil asetat sebanyak 13 g, dan metanol sebanyak 155 g.
Uji Aktivitas Antioksidan dengan Metode DPPH
Pembuatan Larutan DDPH 160 ppm
Serbuk DPPH (BM: 394,32) 10 mg dilarutkan dengan metanol sebanyak 62,5 ml kemudian dimasukkan ke dalam labu ukur 25 mL (Situmeang et al, 2016).
Penentuan panjang gelombang maksimum
Larutan DPPH 160 ppm dipipet sebanyak 1 mL dan dimasukkan ke dalam tabung, ditambahkan metanol sebanyak 10 mL, kemudian dihomogenkan, dinkubasi pada suhu ruang selama 30 menit. Selanjutkan pengukuran panjang gelombang maksimum mulai dari λ 510-520. Pengukuran serapan maksimum diproleh pada λ 515 nm.
Pembuatan larutan Induk Asam Askorbat Konsentrasi 1000 ppm
Asam askorbat ditimbang sebanyak 50 mg kemudian dilarutkan dengan 50 mL pelarut metanol dalam labu ukur 50 mL, lalu ditera hingga tanda batas.
Pembuatan larutan standar asam askorbat
Larutan induk asam askorbat dipipet sebanyak 0; 0,05; 0,1; 0,15 dan 0,2 mL ke dalam labu ukur 10 mL dan ditambahkan metanol sampai tanda batas. Diperoleh deret standar asam askorbat dengan konsentrasi 0, 5, 10, 15, dan 20 ppm
Pengukuran Absorbansi dengan Spektrofotometer UV-Vis
Larutan deret standar asam askorbat dipipet masing-masing sebanyak 1,2 mL dan dimasukkan ke dalam tabung reaksi. Setelah itu ditambahkan DPPH 160 ppm sebanyak 0,6 mL, lalu dihomogenkan dan diinkubasi pada suhu ruang selama 30 menit, kemudian serapan diukur pada λ 515 nm. Dari pengukuran ini didapat data absorbansi masing-masing larutan.
Uji Aktivitas Antibakteri Staphylococcus aureus
Uji aktivitas antibakteri Staphylococcus aureus yaitu dengan metode Optical Density (OD) atau kekeruhan dengan rangkaian
percobaan meliputi: pembuatan media, peremajaan bakteri, dan pengujian sampel, kontrol positif dan kontrol negatif.
Pembuatan Media Cair Nutrien Broth
Ditimbang sebanyak 2,0 gram lactose broth, dimasukkan kedalam labu erlenmeyer. Ditambahkan aquadest sebanyak 50 mL, diaduk sampai homogen dan ditutup dengan alumunium foil. Kemudian disterilkan dengan autoklaf pada suhu 121 0C selama 15 menit. Setelah dingin media siap digunakan atau disimpan dalam lemari pendingin untuk persediaan.
Peremajaan Bakteri Staphylococcus aureus
Bakteri yang sudah disiapkan diinokulasikan kedalam labu erlenmeyer yang berisi media cair, selanjutnya media cair yang sudah diisi dengan bakteri di inkubasi pada suhu 37 0C selama 24 jam.
Pengujian Sampel Fraksi, Kontrol Positif dan Kontrol negatif
Disiapkan 9 buah tabung reaksi masing-masing diberi label fraksi 1-7, kontrol positif dan kontrol negatif. Dimasukkan 2 mL media cair ke dalam masing-masing tabung reaksi. Ditambahkan 200 µL bakteri Staphylococcus aureus pada masing-masing tabung reaksi. Pada tabung reaksi 1-7 ditambahkan 200 µL sampel masing-masing fraksi, sedangkan pada kontrol positif ditambahkan ciprofolxacin 200 µL, dan pada kontrol negatif ditambahkan 200 µL metanol. Tabung reaksi lalu ditutup dengan alumunium foil dan diinkubasi pada suhu 37 0C selama 24 jam. Setelah diinkubasi selam 24 jam, selanjutnya diukur absorbansinya menggunakan spektrofotometer dengan panjang gelombang λ 590 nm.
Skrining Fitokimia Senyawa Metabolit Sekunder
Uji flavonoid
Uji flavonoid dilakukan dengan uji wilstatter yaitu ekstrak kulit batang kesambi dipipet 1 mL dan dimasukkan kedalam tabung reaksi. Kemudian ditambahkan serbuk magnesium dan 2-4 tetes HCl pekat, kemudian campuran dihomogenkan. Warna jingga yang terbentuk menunjukkan adanya flavonoid.
Uji fenolik
Uji fenolik dilakukan dengan cara ekstrak kulit batang kesambi dipipet 1 mL dan
dimasukkan kedalam tabung reaksi. Kemudian ditambahkan FeCl3 5% sebanyak 1–2 tetes. Adanya kandungan senyawa fenolik ditunjukkan jika terjadi perubahan warna biru kehitaman.
HASIL DAN PEMBAHASAN
Sampel kulit batang kesambi (Schleichera oleosa) sebanyak 1,5 kg diekstraksi selama 2 x 24 jam dengan metode maserasi bertingkat dengan pelarut n-heksana, etil asetat dan metanol. Sampel diaduk tiap enam jam sekali agar terekstraksi sempurna. Pemilihan maserasi bertingkat sebagai metode ekstraksi agar zat-zat yang terdapat dalam sampel dapat terekstraksi dan dipisahkan berdasarkan perbedaan kepolarannya. Metode maserasi ini bertujuan untuk melindungi senyawa yang mudah teroksidasi agar tidak mudah rusak khususnya antioksidan. Ekstraksi dengan metode maserasi juga memiliki proses pengerjaan yang lebih mudah dibandingkan dengan metode lain. Ekstrak pertama yang didapatkan yaitu ekstrak n-heksana. Kemudian residu dikeringkan pada suhu ruang agar bebas dari sisa pelarut n-heksana dan dimaserasi kembali menggunakan pelarut etil asetat, setelah itu didapatkan ekstrak etil asetat. Kemudian residu dikeringkan kembali pada suhu ruang agar bebas dari sisa pelarut etl asetat dan dimaserasi kembali menggunakan pelarut metanol, setelah itu didapatkan ekstrak metanol.
Pelarut polar mampu mengekstrak senyawa yang bersifat polar seperti alkaloid, fenolik, flavonoid, tanin, dan senyawa glikosida. Pelarut semi polar mampu mengekstrak senyawa terpenoid, dan steroid. Pelarut non polar dapat mengekstrak senyawa metabolite primer seperti lipid. Kelebihan metode maserasi adalah pengerjaannya mudah dan kemungkinan rusaknya senyawa kimia yang terkandung dalam bahan dapat dihindari karena tidak disertai pemanasan (Sundari, 2010).
Penggunaan pelarut metanol pada saat maserasi karena metanol merupakan pelarut yang bersifat universal yang dapat melarutkan senyawa yang bersifat polar dan nonpolar. Metanol memiliki gugus polar (-OH) dan gugus non polar (-CH3) (Astarina et al., 2013).
Ekstrak cair yang diperoleh dari proses maserasi kemudian dipekatkan dengan menggunakan rotary evaporator pada temperature suhu 40°C. Hasil evaporasi merupakan ekstrak pekat. Ekstrak pekat yang
diperoleh yaitu ekstrak methanol, etil asetat, dan n-heksana dari kulit batang kesambi (Schleichera oleosa). Ekstrak pekat metanol sebanyak 155 g; etil asetat sebanyak 13 g; dan n-heksana sebanyak 10 g. Hasil rendemen yang diperoleh ekstrak pekat metanol sebanyak 15,5 %, rendemen ekstrak etil asetat 1,3 %, dan rendemen ekstrak n-heksana sebanyak 1,0 %.
Sebanyak 5 g ekstrak pekat metanol dipisahkan menggunakan metode kromatografi kolom terbuka dengan fasa diam silika gel G60 (70-230 mesh), eluen etil asetat dan metanol secara gradien dengan kenaikan kepolaran 10%. Hasil kromatografi kolom diperoleh 7 fraksi. Komposisi pelarut yang digunakan ditunjukkan pada Tabel 1.
Tabel 1. Hasil Pengujian Kromatografi kolom
|
Sistem pelarut (mL) |
Massa (g) | ||
|
Metanol |
Etil asetat | ||
|
1 |
15 |
135 |
0,02 |
|
2 |
30 |
120 |
0,02 |
|
3 |
45 |
105 |
0,05 |
|
4 |
60 |
90 |
0,27 |
|
5 |
75 |
75 |
0,31 |
|
6 |
90 |
60 |
0,51 |
|
7 |
105 |
45 |
0,52 |
Uji aktivitas antioksidan dilakukan pada fraksi hasil kromatografi kolom ekstrak metanol kulit batang kesambi (Schleicera Oleosa), menggunakan pelarut dengan tingkat kepolaran berbeda, kromatografi kolom digunakan untuk mengisolasi senyawa aktif yang terdapat pada ekstrak metanol kulit batang kesambi (Schleicera Oleosa), sedangkan perbedaan pelarut dengan kepolaran yang berbeda digunakan agar didapatkan fraksi yang memiliki senyawa aktif tinggi. Dengan demikian dapat diketahui nilai inhibisi (%) yang baik dari fraksi hasil isolasi ekstrak metanol kulit batang kesambi (Schleicera Oleosa).
Uji aktivitas antioksidan dari fraksi aktif hasil isolasi ektrak metanol kulit batang kesambi (Schleicera Oleosa) menggunakan peredaman radikal DPPH. Metode DPPH dipilih karena memerlukan sedikit sampel, sederhana, mudah, cepat, peka dan lebih efektif dalam menentukan kemampuan aktivitas antioksidan menggunakan radikal bebas 1,1-difenil-2-pikrilhidrazil (DPPH). Metode ini banyak digunakan untuk menguji senyawa yang berperan sebagai free radical scavengers atau donor hidrogen dan mengevaluasi aktivitas
antioksidannya, serta mengkuantifikasi jumlah kompleks radikal-antioksidan yang terbentuk. Hasil pengujian % inhibisi semua fraksi pada konsentrasi 200 ppm ditunjukkan pada Tabel 2.
Tabel 2. Hasil pengujian & inhibisi fraksi
|
Sampel |
Absorbansi |
Inhibisi (%) |
|
Blanko |
0,356 |
0,00 |
|
Fraksi 1 |
0,332 |
6,74 |
|
Fraksi 2 |
0,126 |
64,60 |
|
Fraksi 3 |
0,108 |
69,66 |
|
Fraksi 4 |
0,110 |
69,10 |
|
Fraksi 5 |
0,133 |
62,64 |
|
Fraksi 6 |
0,179 |
49,71 |
|
Fraksi 7 |
0,136 |
61,79 |
Hasil uji aktivitas antioksidan dengan metode DPPH diperoleh serapan yang diukur pada spektrofotometri UV-Vis dengan panjang gelombang 515 nm digunakan untuk mencari % inhibisi yang tinggi dari setiap fraksi, semakin tinggi nilai % inhibisi menunjukan bahwa aktivitas antioksidannya semakin besar. Dari kurva hubungan antara % inhibisi dengan fraksi aktif diatas, fraksi 3 memiliki % inhibisi yang tinggi dibanding dengan fraksi yang lainnya yaitu 69,66 %. Maka dari data Tabel 2, fraksi 3 di uji kembali aktivitas antioksidannya dengan perbedaan konsentrasi untuk mengetahui nilai IC50.
Kurva konsentrasi terhadap persen inhibisi dapat dilihat pada Gambar 1. Hasil uji aktivitas antioksidan dari fraksi aktif kulit batang kesambi menunjukkan bahwa nilai IC50 pada fraksi aktif yang paling tinggi menunjukkan bahwa aktivitas antioksidan paling kuat dibandingkan dengan asam askorbat (vitamin C) karena aktivitas antioksidan dilihat dari nilai IC50 semakin rendah nilai IC50 maka semakin tinggi aktivitas antioksidannya.
Kurva konsentrasi dengan persen inhibisi dibuat untuk dilakukan perhitungan nilai IC50 berdasarkan persamaan regresi yang diperoleh. Perhitungan dilakukan dengan memasukkan angka 50 pada persamaan garis (y = 50) sehingga diperoleh persamaan garis regresi linier y = 0,3263x + 48,765. Nilai IC50 untuk fraksi 3 ditampilkan pada Tabel 3. Aktivitas antioksidan dinyatakan sebagai konsentrasi inhibisi atau IC50 (Inhibition Concentration). IC50 yaitu konsentrasi ekstrak atau fraksi uji yang dibutuhkan untuk menangkap radikal DPPH sebanyak 50%. Suatu senyawa antioksidan sangat kuat jika nilai IC50 kurang dari 50 ppm, antioksidan kuat jika IC50 sebesar 50-100 ppm, antioksidan sedang jika IC50 100-150 ppm, dan antioksidan lemah jika IC50 151-200 ppm. Semakin rendah nilai IC50 semakin tinggi aktivitas antioksidan (Holistic Health Solution, 2011). Besarnya persen peredaman pada fraksi 3 menunjukkan bahwa fraksi 3 mempunyai kemampuan peredaman radikal yang lebih besar dibanding dengan asam askorbat (6,8 ppm).
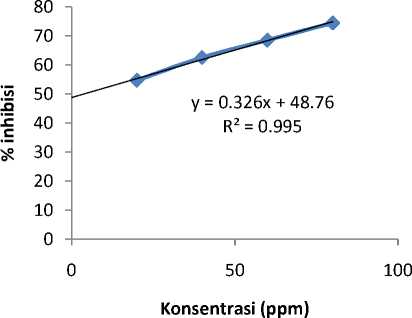
Gambar 1. Kurva Persamaan Regresi Linear
Tabel 3. Hasil uji Aktivitas Antioksidan
|
Konsentrasi (ppm) |
Absorbansi |
Inhibisi (%) |
Persamaan Regresi |
IC50 (ppm) |
|
0 |
0,243 |
0,00 |
Y = 0,3263x + | |
|
20 |
0,110 |
54,73 |
48,765 | |
|
40 |
0,091 |
62,55 |
R = 0,9951 |
3,78 |
|
60 |
0,070 |
71,19 | ||
|
80 |
0,053 |
74,48 |
Hasil Uji Aktivitas Antibakteri
Uji aktivitas antibakteri terhadap bakteri Staphylococcus aureus dilakukan dengan menggunakan metode Optical Density (OD). Tahap persiapan meliputi pembuatan media cair, peremajaan bakteri, persiapan kontrol positif, persiapan kontrol negatif, dan pembuatan konsentrasi 1000 ppm pada fraksi 17.
Untuk mengetahui bahwa bakteri tumbuh dengan sempurna pada tahap peremajaan bakteri yaitu dengan mengamati kekeruhan sampel bakteri, pada tahap peremajaan bakteri ini diketahui sampel berwarna keruh sehingga bakteri dapat digunakan untuk pengujian aktivitas antibakteri menggunakan spektrofotometer. Hasil uji serapan antibakteri menggunakan spektrofotometer dapat dilihat pada Tabel 4.
Berdasarkan Tabel 4 diketahui bahwa fraksi 5 dan 7 memiliki daya penghambatan terhadap bakteri S.aureus yang tinggi dengan nilai penghambatan sebesar 59,76 % dan fraksi 1 memiliki penghambatan yang rendah terhadap bakteri S.aureus yang kecil dengan nilai penghambatan sebesar 16,45 % dan penghambatan kontrol positif sebesar 53,59 %. Dari Tabel 4 fraksi 5 dan 7 memiliki penghambatan terhadap bakteri S.aureus yang lebih tinggi dibandingkan dengan kontrol positif. Penghambatan bakteri juga dapat dilihat dari kekeruhan sampel, semakin keruh warna sampel maka aktivitas antibakterinya semakin kecil dan absorbansinya semakin besar, sedangkan semakin bening warna sampel maka aktivitas antibakterinya semakin besar dan nilai absorbansinya semakin kecil (Mustaffa et al., 2011; Astutiningsih et al., 2014).
Tabel 4. Hasil Uji Aktivitas Antibakteri
|
Sampel |
Absorbansi |
Inhibisi (%) |
|
Fraksi 1 |
0,650 |
16,45 |
|
Fraksi 2 |
0,383 |
50,77 |
|
Fraksi 3 |
0,386 |
50,38 |
|
Fraksi 4 |
0,397 |
48,97 |
|
Fraksi 5 |
0,313 |
59,76 |
|
Fraksi 6 |
0,464 |
40,35 |
|
Fraksi 7 |
0,313 |
59,76 |
|
Kontrol + |
0,361 |
53,59 |
|
Kontrol – |
0,778 |
0 |
Berdasarkan Tabel 4 di atas fraksi 5 dan 7 memiliki daya penghambatan terhadap bakteri S.aureus yang tinggi dengan nilai penghambatan sebesar 59,76 % dan fraksi 1 memiliki penghambatan terhadap bakteri S.aureus yang kecil dengan nilai penghambatan sebesar 16,45 % dan penghambatan kontrol positif sebesar 53,59 %. Dari Tabel 4 di atas fraksi 5 dan 7 memiliki penghambatan terhadap bakteri S.aureus yang lebih tinggi dibandingkan dengan kontrol positif. Penghambatan bakteri juga dapat dilihat dari kekeruhan sampel, semakin keruh warna sampel maka aktivitas antibakterinya semakin kecil dan absorbansinya semakin besar, sedangkan semakin bening warna sampel maka aktivitas antibakterinya semakin besar dan nilai absorbansinya semakin kecil (Astutiningsih et al., 2014).
Selanjutnya fraksi aktif antibakteri dan antioksidan (fraksi 3, 5 dan 7) dilakukan uji skrining fitokimia untuk mengetahui kandungan golongan senyawa metabolit sekunder yang terkandung di dalamnya. Hasil identifikasi flavonoid menunjukkan warna jingga yang berarti positif adanya flavonoid. Logam magnesium dan HCl pekat berfungsi untuk mereduksi inti benzopiron yang terdapat pada struktur flavonoid sehingga terbentuk perubahan warna menjadi merah atau jingga (Agustina et al., 2014). Hasil uji senyawa fenolik dengan reagent FeCl3 menunjukkan perubahan warna menjadi biru kehitaman (Situmeang dkk, 2019).
SIMPULAN
Berdasarkan hasil uji aktivitas antioksidan yang kuat terdapat pada fraksi 3 dengan IC50 sebesar 3,78 ppm dan uji aktivitas antibakteri yang kuat terdapat bakteri S.aureus pada fraksi 5 dan 7 dengan nilai inhibibsi sebesar 59,76 % dan kontrol positif (Ciprofloxacin) sebesar 53,59 %. Fraksi aktif dari ekstrak metanol kulit batang kesambi (Schleichera oleosa) memiliki senyawa flavanoid dan fenolik.
UCAPAN TERIMAKASIH
Ucapan terimakasih disampaikan kepada Kementerian Riset dan Teknologi Pendidikan Tinggi (KEMENRISTEK DIKTI) atas program hibah Penelitian Dosen Pemula (PDP) tahun anggaran 2020.
DAFTAR PUSTAKA
Agustina, W. E. S.,Retno, S. D. A., Ashadi, Mulyani, B dan Puti, C.R. 2014. Skrining fitokimia dan identifikasi komponen utama ekstrak metanol kulit durian (Durio Zlbethinus Murr) varietas petruk. Seminar Nasional Kimia dan Pendidikan Kimia IV. 979363174-0. 271-280.
Astarina, N.W.G., Astuti, K.W., Wardianti, N.K. 2013. Skrining fitokimia ekstrak metanol rimpang bangle (Zingiber Purpureum Roxb). J. Farm. Udayana. 2(4): 26-31.
Astutiningsih, C., Setyani, W dan Hindratna, H. 2014. Uji daya antibakteri dan identifikasi isolat senyawa katekin dari daun teh (Camellia sinensisL. var assamica). J. Farm. Sains. 11(2): 50-57.
Holistic, H. S. 2011. Khasiat Fantastic Kulit Manggis. Grasindo, Jakarta : 17-71.
Jawetz, M., and Adelberg. 2008. Mikrobiologi Kedokteran Edisi 23. Buku Kedokteran EGC. Jakarta
Kolak, U., Topcu, G., Birteqsiz, S., Otuk, G., and Ulubelen, A. 2005. Terpenoid and steroid from the roots of salvi Blepharo claena. Turk. J. Chem. 209: 177-186.
Liochev, S.I., 2013. Reactive Oxygen Species and the free radical theory of Aging. Free Radical Biology and Medicine. 60: 1-4.
Mustaffa, F., Indurkar, J., Ismail, S., Shah, M., and Mansor, S. 2011. An Antimicrobial Compounds Isolated From Cinnamoum iners Leaves With Activity Agains Metichilin-Resistant S. Aureus. Molecules. 1420-3049.
Nurlaeli, M. 2015. Bakteremia Pada Neonatus : Pola Kuman dan Kepekaannya Terhadap Antibiotika di RSUD dr.Moewardi Tahun 2014. Skripsi. Fakultas Farmasi Universitas Muhammadiyah Surakarta.
Patra, G. C., Sahu, P. S., Panda, P., Sahoo, S., Mohapatra, S., & Bindhani, B.K. 2012. Anti-mycotic effect of kusum oil‘ extract on candida albicans clinical isolates from endophthalmitis cases. J. Pharm Bio Sci. 3: 75-84.
Roslizawati., Ramadhan, N. Y., Fakrurrazi., and Hernialtian. 2013. Antibacterrial Activity of Ethanol Extrac And Stew Of Antplant (Myrmecodia sp) Agains Bacteri E. coli. Medika Valeninaria.7(2): 0853- 1915.
Situmeang, B., Uyun, Z dan Ibrahim, A.M. 2016. Analisis kandungan Metabolit Sekunder dan Aktivitas antibakteri tumbuhan kesambi. Jurnal pendidikan kimia Unimed. 8(3): 164168.
Situmeang, B., Ibrahim, A.M., Bialangi, N., Musa, W.J.A., dan Silaban, S. 2019. Antibacterial activity and phytochemical screening of kesambi (Sapindaceae) against Eschericia coli and Staphylococcus aureus. Jurnal Pendidikan kimia Unimed. 11(1): 14-17.
Srinivas, K., & Baboo, C.R.V. 2013. Antioxidant Activity of Ethanolic Extract of Stem Bark of Schleichera oleosa (Lour.Oken). Inter.J. of Pharmacotherapy, 3(1): 12-14.
Sunardi, K.I. 2007. Uji Aktivitas Antioksidan Ekstrak Belimbing Wuluh (Averrhoa blimbi, L.) terhadap 1,1-Diphenyl-2-Picrylhidrazyl (DPPH). Seminar Nasional Teknologi, 1-9.
Sundari, I. 2010. Identifikasi Senyawa dalam Ekstrak Etanol Biji Buah Merah (Pandamus Conoideus Lamk). Surakarta : Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret.
Urzua, A., Marcos. C., Rezende., Carolina. M., and Vasquest, L. 2008. A structure Activity Study of Antibacterial Diterpenoid. Molecules 13: 882-891.
59
Discussion and feedback