STUDI IN SILICO POTENSI AKTIVITAS FARMAKOLOGI SENYAWA GOLONGAN DIHIDROTETRAZOLOPIRIMIDIN
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 15 (2), JULI 2021 DOI: https://doi.org/10.24843/JCHEM.2021.v15.i02.p07
p-ISSN 1907-9850
e-ISSN 2599-2740
STUDI IN SILICO POTENSI AKTIVITAS FARMAKOLOGI SENYAWA GOLONGAN DIHIDROTETRAZOLOPIRIMIDIN
N. Kurnyawaty1*, H. Suwito2, dan F. Kusumattaqiin1
1Jurusan Teknik Kimia, Politeknik Negeri Samarinda, Samarinda, Indonesia 2Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya, Indonesia *Email: noormakurnyawaty@polnes.ac.id
ABSTRAK
Senyawa golongan dihidrotetrazolopirimidin dapat disintesis menggunakan Reaksi Biginelli. Senyawa etil 5-metil-7-(4-morfolinofenil)-4,7-dihidrotetrazolo[1,5a] pirimidin-6-karboksilat (MDP) merupakan senyawa organik baru terdiri atas cincin dihidrotetrazolopirimidin dengan gugus samping morfolinofenil. Penelitian sebelumnya menyebutkan bahwa senyawa pirimidin dan turunannya memiliki berbagai macam aktivitas farmakologi. Pada penelitian ini, senyawa MDP dianalisis menggunakan studi in silico untuk mengetahui potensi yang dimiliki sebagai agen terapi untuk mengatasi masalah kesehatan. Hasil analisis menunjukkan bahwa senyawa MDP berpotensi sebagai antimalaria, antikanker, dan antihiperurisemia dilihat dari binding energy yang bernilai negatif atau rendah. Interaksi senyawa MDP dengan reseptor yang bernilai paling negatif pada saat berinteraksi dengan protein XOD dibandingkan dengan nilai binding energy MDP dengan Kinesin Eg5 dan PfDHODH. Sehingga dapat disimpulkan bahwa senyawa MDP paling potensial jika digunakan sebagai antihiperurisemia dengan nilai binding energy sebesar -8,33 kkal/mol dengan konstanta inhibisi 0,79 µM.
Kata kunci: antihiperurisemia, antikanker, antimalaria, dihidrotetrazolopirimidin, in silico
ABSTRACT
Dihydrotetrazolopyrimidine derivatives can be synthezed using the Biginelli Reaction. Ethyl 5-methyl-7-(4-morpholinophenyl)-4,7-dihydrotetrazolo[1,5a]pyrimidine-6-carboxylate (MDP) is a new organic compound consisting of a dihydrotetrazolopyrimidine ring with morpholinophenyl moiety. Previous studies showed that pyrimidine compounds and their derivatives exhibited various pharmacological activities. In this study, MDP compound was analyzed using in silico studies to determine its potential to be used as therapeutic agent to overcome health problems. The results of the analysis showed that the MDP compound has potential activity as an antimalarial, anticancer, and antihyperuricemia, based on negative or low binding energy. The interaction of MDP compound with XOD protein showed the lowest binding energy compared to Kinesin Eg5 and PfDHODH. Based on the docking experiments performed, it can be concluded that MDP compound showed the most potential to be used as an antihyperuricemia with binding energy of -8.33 kcal/mol and inhibition concentration of 0,79 µM.
Keywords: anticancer, antihyperuricemia, antimalarial, dihydrotetrazolopyrimidine, in silico
PENDAHULUAN
Turunan senyawa pirimidin golongan dihidrotetrazolopirimidin yaitu senyawa etil 5-metil-7-(4-morfolinofenil)-4,7-dihidrotetrazolo[1,5a] pirimidin-6-karboksilat (MDP) telah berhasil disintesis menggunakan Reaksi Biginelli (Suwito et al., 2018). Senyawa MDP merupakan senyawa baru yang diprediksi memiliki berbagai potensi aktivitas farmakologi yang berperan dalam bidang kesehatan. Senyawa pirimidin dan turunannya menjadi sangat penting untuk disintesis dan dikembangkan karena keterlibatannya di dalam
basa penyusun asam nukleat sehingga memiliki aktivitas biologi yang cukup luas (Yerragunta et al., 2013).
Aktivitas farmakologi suatu senyawa organik sangat dipengaruhi oleh gugus-gugus fungsi yang dimilikinya. Senyawa MDP memiliki gugus dihidrotetrazolopirimidin yaitu dua buah cincin, cincin enam dan cincin lima yang terfusi pada struktur molekulnya. Struktur tersebut memiliki kemiripan dengan struktur senyawa purin. Penelitian sebelumnya menunjukkan bahwa senyawa kimia dengan gugus dihidrotetrazolopirimidin memiliki aktivitas sebagai antibakteri (Scapin et al.,
2017) dan antikanker (Wu et al., 2018). Selain itu, senyawa MDP juga memiliki gugus samping morfolinofenil. Senyawa yang memiliki gugus morfolinofenil dapat digunakan sebagai antikanker (Kamal et al., 2011).
Perbedaan gugus fungsi yang dimiliki oleh senyawa organik, memungkinkan adanya aktivitas farmakologi baru. Potensi aktivitas farmakologi suatu senyawa dapat ditentukan atau diprediksi menggunakan studi in silico dengan analisis molecular docking. Studi in silico menjadi suatu teknik penting digunakan untuk proses penemuan senyawa obat baru (Yuriev & Ramsland, 2013). Studi in silico dilakukan secara komputasi untuk pemodelan struktur dan memprediksi aktivitas yang tepat dari suatu senyawa (Meng et al., 2012). Aktivitas farmakologi yang menarik untuk dibahas saat ini adalah antimalaria, antikanker, dan antihiperurisemia. Hal ini dikarenakan penyakit malaria, kanker, dan hiperurisemia masih menjadi masalah kesehatan yang cukup tinggi di Indonesia.
Beberapa penelitian sebelumnya mengatakan bahwa suatu penyakit dapat diatasi dengan menghambat kerja protein atau enzim spesifik yang menyebabkan terjadinya penyakit tersebut. Penelitian Deng et al. (2009) menunjukkan bahwa senyawa turunan pirimidin yaitu triazolopirimidin mampu menghambat kerja protein Plasmodium falciparum Dihydroorotate Dehydrogenase (PfDHODH) dengan nilai IC50 sebesar 0,047 µM. Protein PfDHODH berperan dalam biosintesis pirimidin parasit Plasmodium falciparum penyebab malaria (Hou et al., 2016). Penelitian lain menunjukkan senyawa turunan pirimidin juga dimanfaatkan sebagai agen terapi kanker, yaitu S-monastrol dengan nilai IC50 sebesar 6,7µM yang bekerja dengan cara menghambat protein Kinesin Eg5 (Yan et al., 2004). Protein Kinesin Eg5 berperan dalam proses mitosis pada pembelahan sel (Rath & Kozielski, 2012). Selain itu, Okamoto et al., (2008) juga berhasil menunjukkan adanya interaksi santara senyawa turunan purin yaitu oxipurinol yang mampu menghambat kerja enzim xanthine oxidase (XOD). Enzim XOD berperan dalam reaksi metabolisme purin didalam tubuh manusia yang dapat mengakibatkan peningkatan kadar urisemia. Oleh karena itu, penelitian ini dilakukan untuk menganalisis dan membandingkan potensi aktivitas senyawa MDP sebagai agen terapi antimalaria, antikanker, dan antihiperurisemia
menggunakan studi in silico dengan cara molecular docking.
MATERI DAN METODE
Bahan
Struktur molekul senyawa MDP, struktur protein target reseptor diperoleh dari Protein Data Bank (PDB) (www.rscb.org) menggunakan kode akses PDB: 3I65 untuk antimalaria (reseptor : Plasmodium falciparum Dihydroorotate Dehydrogenase), kode akses PDB : 1Q0B untuk antikanker (reseptor: Kinesin Eg5), dan kode akses PDB: 3BDJ: untuk antihiperurisemia (reseptor : Xanthine Oxidase)
Peralatan
Seperangkat komputer laptop Acer Windows 7 yang dilengkapi dengan program ChemBioDraw 12.0, Hyperchem 8.0, Chimera 1.10.1, AutoDock Tools, dan PyMol.
Cara Kerja
Validasi parameter docking
Validasi parameter docking dilakukan dengan menggunakan proses redocking. Validasi parameter docking dilakukan pada kompleks ligan-resptor. Tahap pertama yang dilakukan adalah ekstraksi dan preparasi reseptor dan ligan menggunakan program Chimera 1.11.2 untuk mendapatkan reseptor serta ligan yang siap untuk proses redocking. Validasi menggunakan AutoDock4 dengan AutoDock Tools sebagai Graphical User Interface (GUI). Nilai RMSD superimpose ligan yang diperoleh dari PDB dan ligan hasil redocking yang baik sebesar ≤ 2 Å (Castro-Alvarez et al., 2017).
Docking senyawa MDP
Senyawa MDP dipreparasi terlebih dahulu dengan cara melakukan penggambaran dan optimasi struktur molekul dalam bentuk 3 dimensi (3D) menggunakan program ChemBiodraw 12.0, Hyperchem 8.0, dan Chimera 1.11.2. Proses docking senyawa MDP dilakukan dengan cara memasukkan senyawa tersebut kedalam masing-masing reseptor yang telah divalidasi. Proses docking dilakukan dengan menggunakan AutoDock Tools. Interaksi yang terbentuk antara ligan dengan reseptor tersebut diavisualisasikan dan dianalisis. Hasil yang diperoleh dari proses docking antara lain adalah binding energy,
ikatan hidrogen yang terbentuk, dan konstanta inhibisi. Hasil docking senyawa MDP dengan masing-masing reseptor dan interaksinya divisualisasikan menggunakan program PyMol.
Analisis data hasil docking
Hasil docking senyawa MDP dengan masing-masing reseptor dianalisis nilai binding energy, ikatan hidrogen yang terbentuk, dan konstanta inhibisi yang didapatkan dari interaksi ligan MDP dengan reseptor.Senyawa MDP dianalogikan sebagai kandidat obat baru yang diperoleh, sedangkan reseptor merupakan suatu protein yang berperan dalam terjadinya suatu penyakit atau penyebab penyakit. Senyawa ligan MDP dibandingkan dengan native ligan yang terdapat dalam kompleks pada PDB.
HASIL DAN PEMBAHASAN
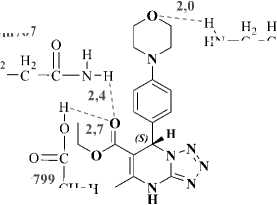
Analisis in silico senyawa MDP dilakukan terhadap reseptor yang berupa protein. Proses docking dilakukan pada senyawa MDP dengan konfigurasi R dan S karena senyawa MDP merupakan senyawa rasemat yang memiliki sebuah atom C khiral (C*) pada atom karbon nomor 7 (Suwito et.al., 2018). Struktur senyawa MDP ditampilkan pada Gambar 1. Potensi aktivitas farmakologi senyawa MDP dianalisis menggunakan studi in silico. Uji dilakukan terhadap tiga jenis aktivitas yaitu antimalaria, antikanker, dan antihiperurisemia.
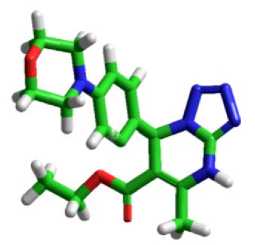
Gambar1. Struktur molekul senyawa MDP
Docking ligan MDP sebagai antimalaria
Analisis pertama dilakukan untuk mengetahui aktivitas antimalaria senyawa MDP. Protein yang digunakan sebagai reseptor
adalah PfDHODH (PDB ID: 3I65). Protein PfDHODH merupakan salah satu enzim yang berperan dalam proses biosintesis pirimidin de novo. Protein PfDHODH menjadi target yang selektif untuk terapi penyakit malaria karena protein tersebut spesifik bekerja dalam biosintesis pirimidin Plasmodum falciparum (Singh et al., 2017).
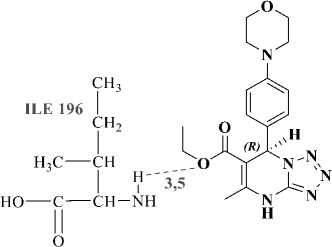
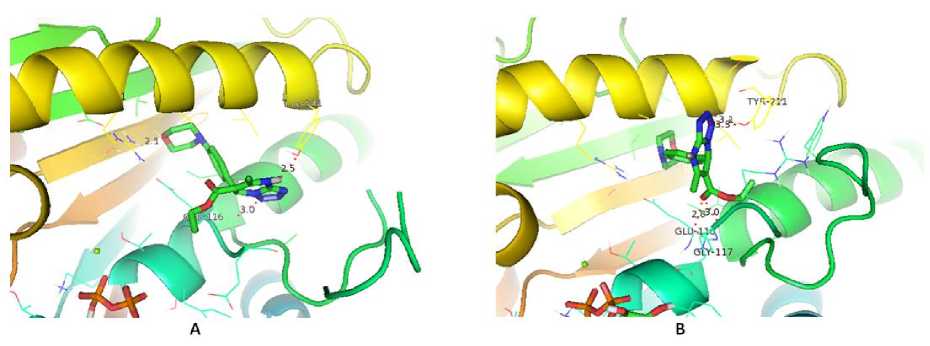
Hasil validasi docking yang didapatkan menunjukkan nilai RSMD sebesar 0,54 Å. Nilai RMSD adalah nilai perbedaan antara koordinat kristal ligan dan koordinat prediksi hasil prediksi program docking. Nilai tersebut telah memenuhi nilai RMSD yang baik yaitu sebesar ≤ 2 Å (Castro-Alvarez et al., 2017). Selanjutnya proses docking dilanjutkan terhadap ligan MDP. Hasil dari proses docking ditampilkan pada Tabel 1. Hasil docking senyawa MDP dibandingkan dengan native ligan yang terdapat di PDB yaitu senyawa 5-metil-7-(naftalen-2-ilamino)-1H-[1,2,4]triazolo[1,5-a]pirimidin-3,8-diium (JZ8). Senyawa JZ8 hasil redocking memiliki nilai binding energy sebesar -9,28 kkal/mol, sedangkan hasil docking R-MDP sebesar-5,19 kkal/mol dan S-MDP sebesar -5,60 kkal/mol. Nilai binding energy ini diperoleh karena adanya interaksi senyawa ligan dengan reseptor yang menunjukkan kecocokan antara bentuk dan volume ligan terhadap sisi ikatan pada reseptor (Motejiunas dan Wade, 2006). Nilai binding energy dipengaruhi oleh terbentuknya ikatan hidrogen antara ligan dengan reseptor. Semakin banyak ikatan hidrogen menyebabkan nilai binding energy akan semakin rendah. Visualisasi interaksi ligan MDP dengan reseptor PfDHODH ditampilkan pada Gambar 2 dan 3. Ikatan hidrogen terbentuk antara ligan MDP dengan residu asam amino Ile196. Nilai binding energy berbanding lurus dengan konstanta inhibisi, semakin rendah nilai binding energy, maka semakin rendah nilai konstanta inhibisinya sehingga konsentrasi yang dibutuhkan oleh suatu ligan untuk menginhibisi protein juga semakin kecil. Konstanta inhibisi JZ8 hasil redocking sebesar 0,159µM, ligan R-MDP dan S-MDP berturut-turut sebesar 155,78 µM dan 77,95 µM. Berdasarkan hasil tersebut dapat dikatakan bahwa senyawa MDP berpotensi sebagai antimalaria, namun efektifitasnya belum lebih baik dari senyawa JZ8.
A
B
Gambar 2. Visualisasi 2D interaksi ligan R-MDP(A) dan S-MDP (B) dengan reseptor PfDHODH
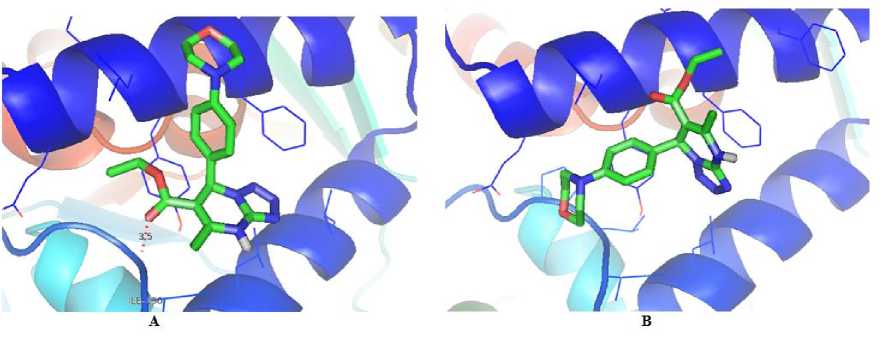
Gambar 3. Visualisasi 3D interaksi ligan R-MDP (A) dan S-MDP (B) dengan reseptor PfDHODH
Docking ligan MDP sebagai antikanker
Analisis berikutnya dilakukan untuk menentukan potensi aktivitas antikanker senyawa MDP. Protein yang digunakan adalah Kinesin Eg5 (PDB ID: 1Q0B). Kinesin Eg5 termasuk dalam protein motor spindle yang berperan pada proses mitosis. Protein Kinesin Eg5 menjadi target yang spesifik untuk terapi penyakit kanker. Senyawa obat berperan untuk menghambat proses mitosis sel kanker sehingga menyebabkan kematian sel kanker itu sendiri dengan cara apoptosis (Guido et al., 2015).
Eksperimen docking ligan MDP menggunakan hasil validasi docking yang telah didapatkan dengan nilai RMSD yang sebesar 0,44 Å. Hasil docking senyawa MDP dengan protein Kinesin Eg5 ditampilkan pada Tabel 1. Selanjutnya hasil docking senyawa MDP dibandingkan dengan native ligan yaitu
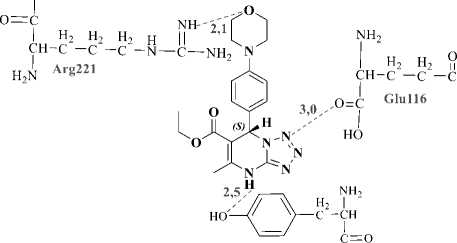
senyawa S-monastrol. Nilai binding energy S-monastrol hasil redocking sebesar -6,41 kkal/mol, sedangkan docking senyawa R-MDP dan S-MDP sebesar -6,44 kkal/mol dan -7,15 kkal/mol. Visualisasi 2D dan 3D interaksi hasil docking senyawa MDP dengan Kinesin Eg5 ditampilkan pada Gambar 4 dan 5. Ikatan hidrogen terjadi antara ligan MDP dengan residu asam amino Glu116, Gly117, Tyr211, Arg22. Konstanta inhibisi native ligan S-monastrol hasil redocking sebesar 20,11µM, docking ligan R-MDP dan S-MDP berturut-turut sebesar 19,05 µM dan 5,77 µM. Berdasarkan hasil docking tersebut, senyawa MDP dapat dikatakan memiliki potensi yang baik sebagai antikanker, ektifitasnya juga terlihat lebih baik dibandingkan senyawa S-monastrol.
I Lysl045 O O
O=C > Glnll94 ∣∣
I H, H2 H2 H2 i I J H1N-CH-C-OH HC-C-C-C-C-NHY - j
’ J CH2
OH L AY" N 2.7 °5
1 /IN Serl080 CH2 ∕ 2,5 1 ∣
∣ H ’ ∕ N N H
HO—C—CH-NH H
Il O
A
Gi∏767
OH
NH2
I H
CH-C
Lys1045
CH-H
NH
B
NH1
2 H1 H2 I -HN-C -C -C -C -CH
OH
Gambar 4. Visualisasi 2D interaksi ligan R-MDP(A) dan S-MDP(B) dengan reseptor Kinesin Eg5
Gambar 5. Visualisasi 3D interaksi ligan R-MDP(A) dan S-MDP(B) dengan reseptor Kinesin Eg5
Docking ligan MDP sebagai antihiperurisemia
Eksperimen docking ligan MDP terhadap reseptor XOD (PDB ID: 3BDJ). Protein XOD berperan penting pada metabolisme purin dalam tubuh manusia. Protein XOD akan mengoksidasi hipoxantin menjadi xantin. Xantin yang terbentuk kemudian di oksidasi lagi dengan XOD membentuk asam urat (Maiuolo et al., 2016). Oleh karena itu, protein XOD dijadikan target yang tepat untuk terapi hiperurisemia
Docking ligan MDP dilakukan dengan menggunakan parameter docking dengan nilai RMSD 0,52 Å. Nilai binding energy yang didapatkan ditampilkan pada Tabel 1. Terbentuknya ikatan hidrogen antara ligan MDP dengan reseptor mempengaruhi aktivitas yang dihasilkan. Interaksi ligan MDP dengan reseptor XOD dapat dilihat pada Gambar 4.
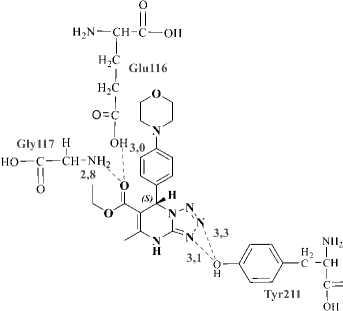
Selanjutnya hasil docking senyawa MDP dibandingkan dengan native ligan yaitu senyawa oxipurinol. Hasil redocking senyawa oxipurinol memberikan nilai binding energy sebesar -5,24 kkal/mol, sedangkan docking senyawa R-MDP dan S-MDP sebesar -6,12 kkal/mol dan -8,33 kkal/mol. Visualisi 2D dan 3D interaksi hasil docking senyawa MDP dengan XOD ditampilkan pada Gambar 6 dan 7. Ikatan hidrogen yang terbentuk antara ligan MDP dengan XOD pada residu asam amino Gln767, Gly799, Lys1045, Ser1080, Gln1194. Konstanta inhibisi native ligan oxipurinol hasil redocking sebesar 144,05µM, docking ligan R-MDP dan S-MDP berturut-turut sebesar 32,87 µM dan 0,79 µM. Berdasarkan hasil docking tersebut senyawa MDP memiliki potensi yang baik sebagai antihiperurisemia, ektifitas senyawa MDP juga terlihat lebih baik dibandingkan senyawa oxipurinol.
OH
Tyr211
OH
B
Gambar 6. Visualisasi 2D interaksi ligan R-MDP(A) dan S-MDP(B) dengan reseptor XOD
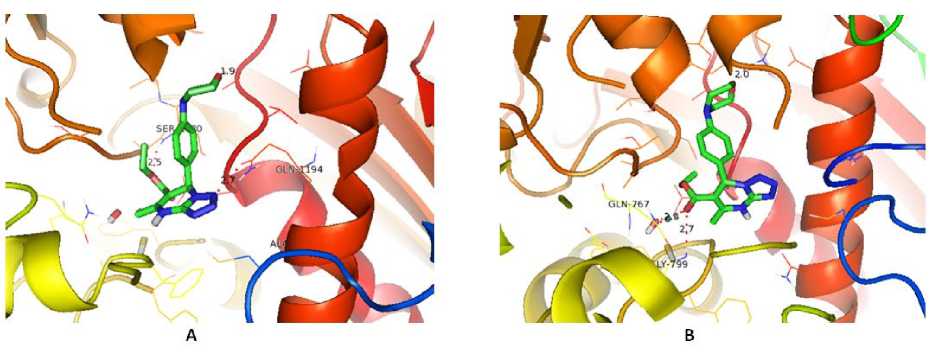
Gambar 7.Visualisasi 3D interaksi ligan R-MDP(A) dan S-MDP(B) dengan reseptor XOD
Analisis data hasil docking
Hasil yang didapat dari proses docking berupa nilai binding energy dan konstanta inhibisi yang dipengaruhi karena terbentuknya ikatan hidrogen. Ikatan hidrogen yang semakin
banyak akan menaikkan kestabilan dari suatu kompleks, sehingga nilai binding energy semakin rendah dan kompleks yang terbentuk semakin stabil serta konstanta inhibisinya juga semakin rendah.
Tabel 1. Perbandingan hasil docking ligan MDP dengan native ligan terhadap masing-masing reseptor
|
Reseptor |
Ligan |
Binding Energy (kkal/mol) |
Konstanta inhibisi (µM) |
Ikatan Hidrogen dengan Residu Asam Amino |
|
JZ8 |
-9,28 |
0,16 |
Gly117, Glu118 | |
|
PfDHODH |
R-MDP |
-5,19 |
155,83 |
Ile 196 |
|
S-MDP |
-5,60 |
77,95 |
- | |
|
S-monastrol |
-6,41 |
20,11 |
Glu116, Glu118 | |
|
Kinesin Eg5 |
R-MDP |
-6,44 |
19,05 |
Glu116, Tyr211, Arg221 |
|
S-MDP |
-7,15 |
5,77 |
Glu116, Gly117, Tyr211 | |
|
XOD |
Oxipurinol |
-5,24 |
144,05 |
Glu802, Arg880, Thr1010, Ala1079, Glu126 |
|
R-MDP |
-6,12 |
32,87 |
Lys1045, Ser1080, Gln1194 | |
|
S-MDP |
-8,33 |
0,79 |
Gln767, Gly799, Lys1045 |
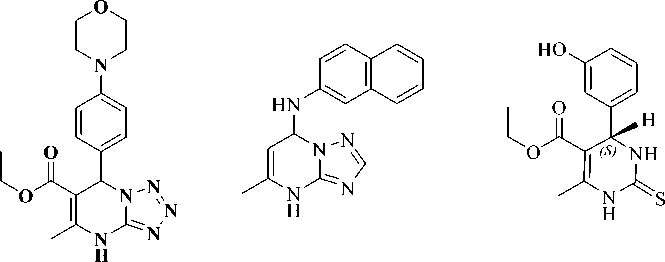
Berdasarkan hasil docking tersebut diperoleh nilai binding energy yang bernilai negatif atau rendah. Nilai negatif tersebut menujukkan terbentuknya kompleks ligan dengan reseptor terjadi secara spontan. Secara umum dapat dikatakan bahwa ligan MDP memiliki potensi sebagai antimalaria, antikanker, dan antihiperurisemia. Hal ini juga dapat dihubungkan dengan kemiripan struktur ligan MDP dengan native ligan pada masing-
masing reseptor. Perbandingan struktur ligan MDP dan native ligan ditampilkan pada Tabel 2. Nilai binding energy yang didapatkan antara ligan dengan reseptor paling rendah pada saat ligan MDP berinteraksi dengan reseptor XOD sebesar -8,33 kkal/mol dengan konstanta inhibisi 0,79µM. Hal ini menunjukkan bahwa kestabilan kompleks ligan MDP-reseptor XOD yang paling baik dan paling stabil.
Tabel 2. Perbandingan struktur ligan MDP dengan native ligan
MDP JZ8 S-monastrol
(Suwito et al., 2018) (Deng et al., 2009) (Yan et al., 2004)
Oxipurinol (Okamoto et al., 2008)
SIMPULAN
Berdasarkan hasil penelitian
menggunakan studi in silico terhadap senyawaetil 5-metil-7-(4-morfolinofenil)-4,7-dihidrotetrazolo[1,5-a]pirimidin-6-karboksilat (MDP) dapat disimpulkan bahwa senyawa tersebut memiliki potensi sebagai antimalaria, antikanker, dan antihiperurisemia. Aktivitas farmakologi yang paling potensial sebagai antihiperurisemia dengan nilai binding energy sebesar -8,33 kkal/mol dengan konstanta inhibisi 0,79µM.
DAFTAR PUSTAKA
Castro-Alvarez, A., Costa, A. M., & Vilarrasa, J. 2017. The Performance of several docking programs at reproducing protein-macrolide-like crystal structures. Molecules. 22(1): 136.
Deng, X., Gujjar, R., El Mazouni, F., Kaminsky, W., Malmquist, N. A., Goldsmith, E. J., Rathod, P. K., & Phillips, M. A. 2009. Structural plasticity of malaria dihydroorotate dehydrogenase allows selective binding of diverse chemical scaffolds. J. Biol. Chem.
284(39): 26999–27009.
Guido, B. C., Ramos, L. M., Nolasco, D. O., Nobrega, C. C., Andrade, B. Y., Pic-Taylor, A., Neto, B. A., & Corrêa, J. R. 2015. Impact of kinesin Eg5 inhibition by 3,4-dihydropyrimidin-2(1H)-one derivatives on various breast cancer cell features. BMC Cancer. 15(1): 283.
Hou, X., Chen, X., Zhang, M., & Yan, A. 2016. QSAR study on the antimalarial activity of Plasmodium falciparum dihydroorotate dehydrogenase (PfDHODH) inhibitors. SAR QSAR Environ. Res. 27(2): 101–124.
Kamal, A., Dastagiri, D., Janaki Ramaiah, M., Surendranadha Reddy, J., Vijaya Bharathi, E., Kashi Reddy, M., Victor Prem Sagar, M., Lakshminarayan Reddy, T., Pushpavalli, S. N. C. V. L., & Pal-Bhadra, M. 2011. Synthesis and apoptosis inducing ability of new anilino substituted pyrimidine sulfonamides as potential anticancer agents. Eur. J. Med. Chem. 46(12): 5817–5824.
Maiuolo, J., Oppedisano, F., Gratteri, S., Muscoli, C., & Mollace, V. 2016.
Regulation of uric acid metabolism and excretion. Int. J. Cardiol. 213: 8–14.
Meng, X.-Y., Zhang, H.-X., Mezei, M., & Cui,
M. 2012. Molecular Docking: A Powerful Approach for Structure-Based Drug Discovery. Current Computer Aided-Drug Design. 7(2): 146–157.
Okamoto, K., Eger, B. T., Nishino, T., Pai, E. F., & Nishino, T. 2008. Mechanism of inhibition of xanthine oxidoreductase by allopurinol: Crystal structure of reduced bovine milk xanthine oxidoreductase bound with oxipurinol. Nucleosides, Nucleotides and Nucleic Acids. 27(6–7): 888–893.
Rath, O., & Kozielski, F. 2012. Kinesins and cancer. Nature Reviews Cancer. 12(8): 527–539.
Scapin, E., Frizzo, C. P., Rodrigues, L. V., Zimmer, G. C., Vaucher, R. A., Sagrillo, M. R., Giongo, J. L., Afonso, C. A. M., Rijo, P., Zanatta, N., Bonacorso, H. G., & Martins, M. A. P. 2017. Synthesis,
antimicrobial activity and cytotoxic
investigation of novel trifluoromethylated tetrazolo[1,5-a]pyrimidines. Medicinal Chemistry Research. 26(3): 640–649.
Singh, A., Maqbool, M., Mobashir, M., & Hoda, N. 2017. Dihydroorotate dehydrogenase: A drug target for the development of antimalarials. Eur. J.
Med. Chem. 125: 640–651.
Suwito, H., Kurnyawaty, N., Ul Haq, K., Abdulloh, A., & Indriani, I. 2018. Ethyl 5-methyl-7-(4-morpholinophenyl)-4,7-dihydrotetrazolo[1,5-a]pyrimidine-6-carboxylate. Molbank. (2): M998.
Wu, L., Liu, Y., & Li, Y. 2018. Synthesis of spirooxindole-O-naphthoquinone-tetrazolo[1,5-a] pyrimidine hybrids as potential anticancer agents. Molecules. 23(9): 1–9.
Yan, Y., Sardana, V., Xu, B., Homnick, C., Halczenko, W., Buser, C. A., Schaber, M., Hartman, G. D., Huber, H. E., & Kuo, L. C. 2004. Inhibition of a Mitotic Motor Protein: Where, How, and
Conformational Consequences. J. Mol. Biol. 335(2): 547–554.
Yerragunta, V., Patil, P., Anusha, V., Kumaraswamy, T., Suman, D., &
Samhitha, T. 2013. Pyrimidine and Its Biological Activity: A Review. Pharma Tutor. 1(2): 39–44.
Yuriev, E., & Ramsland, P. A. 2013. Latest developments in molecular docking: 2010-2011 in review. J. Mol. Recognit. 26(5): 215–239.
179
Discussion and feedback