PENGARUH KONSENTRASI AMMONIUM SULFAT ((NH4)2SO4) SEBAGAI SUMBER NITROGEN TERHADAP PRODUKSI BIOETANOL BERBAHAN BAKU Glacilaria sp.
on
ISSN 1907-9850
PENGARUH KONSENTRASI AMMONIUM SULFAT ((NH4)2SO4) SEBAGAI SUMBER NITROGEN TERHADAP PRODUKSI BIOETANOL BERBAHAN BAKU Glacilaria sp.
Ni Putu Widayanti1), Wiwik Susanah Rita1), dan Yenni Ciawi2)
1)Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali 2)Fakultas Teknik Universitas Udayana, Bukit Jimbaran, Bali
ABSTRAK
Penelitian ini bertujuan untuk menentukan kadar gula reduksi dan pati pada Glacilaria sp. dan mengetahui pengaruh konsentrasi ammonium sulfat ((NH4)2SO4) sebagai sumber nitrogen terhadap produksi bioetanol berbahan baku Glacilaria sp. Konsentrasi ammonium sulfat yang digunakan adalah 0,25%; 0,50%; 0,75%; dan 1% (b/v). Metode penelitian ini meliputi penentuan kadar air, kadar gula reduksi dan kadar pati dengan metode Nelson-Somogyi, optimasi waktu fermentasi, pengukuran pH akhir, dan penentuan kadar etanol.
Hasil penelitian menunjukkan bahwa kadar gula reduksi dan kadar pati yang terkandung pada Glacilaria sp. adalah sebesar 17,14% dan 15,42%. Konsentasi (NH4)2SO4 sebesar 1% (b/v) dalam media menghasilkan etanol dengan jumlah optimum, yaitu sebesar 1,04% (v/v) pada hari ke-7. Media fermentasi dengan konsentrasi (NH4)2SO4 1%; 0,75%; 0,50%; dan 0,25% (b/v) menghasilkan etanol dengan jumlah yang optimum yaitu, berurutan, 0,96% (v/v) pada hari ke-5; 0,78% (v/v) pada hari ke-7; 0,74% (v/v) pada hari ke-7; dan 0,73% (v/v) pada hari ke-7. Secara keseluruhan, kondisi optimum untuk memproduksi bioetanol berbahan baku Glacilaria sp. terdapat pada media dengan konsentrasi (NH4)2SO4 1% (b/v) dan kadar etanol yang dihasilkan adalah sebesar 0,96% (v/v).
Kata kunci : Glacilaria sp., fermentasi, ammonium sulfat, dan bioetanol
ABSTRACT
The aims of this research are to determine the concentration of reducing sugar and starch in Glacilaria sp. and to investigate the influence of the concentration of ammonium sulfate as nitrogen source on the production of bioethanol using Glacilaria sp. as the carbon source. The concentrations of ammonium sulfate employed were 0,25%; 0,50%; 0,75%; and 1% (w/v). The methods employed in this research were the determination of water content, glucose and starch concentration using Nelson-Somogyi method, determinating the optimum duration of fermentation, pH measurement, and the determination of ethanol concentration.
The results showed that the concentrations of reducing sugar and starch in Glacilaria sp. are 17,14% and 15,42%. The concentration of (NH4)2SO4, which produced the optimum concentration of ethanol (1,04% (v/v) on seventh day), was 1% (w/v). The fermentation media containing (NH4)2SO4 of 1%; 0,75%; 0,5%; and 0,25% (w/v) produced optimum concentrations of ethanol, which were 0,96% (v/v) on fifth day; 0,78% (v/v) on seventh day; 0,74% (v/v) on seventh days; and 0,73% (v/v) on seventh day, respectively. The optimum concentration of (NH4)2SO4 was 1% (w/v), which produced maximum concentration of bioethanol from Glacilaria sp., of 0,96% (v/v).
Keywords : Glacilaria sp., fermentation, ammonium sulphate, and bioethanol
PENDAHULUAN
Indonesia terkenal sebagai salah satu negara maritim terbesar di dunia yang sebagian besar wilayahnya terdiri atas perairan. Hal tersebut menyebabkan negara Indonesia kaya akan sumber daya alam lautnya terutama rumput laut yang melimpah (Gautam et al., 2000). Rumput laut yang tumbuh di perairan Bali telah diteliti di Universitas Udayana, tetapi kebanyakan mengarah pada identifikasi makronutrien. Brahmana (2010) telah mengidentifikasi kadar pati dari rumput laut yang tumbuh di sekitar Pantai Segara, dan diperoleh bahwa kadar pati tertinggi dimiliki oleh spesies Gracilaria sp. Glacilaria sp. adalah salah satu kelas dari alga merah yang tumbuh melekat pada substrat tertentu. Sejauh ini pemanfaatan Glacilaria sp. hanya sebatas sebagai bahan baku pangan, obat, dan produk kesehatan. Namun, spesies laut ini ternyata memiliki potensi sebagai sumber Energi Baru dan Terbarukan (EBT) yang dapat menyumbangkan solusi dalam menghadapi kelangkaan bahan bakar minyak (BBM) di era globalisasi ini.
Salah satu sumber mengatakan bahwa kandungan rumput laut kering terdiri atas air (11,28%), abu (36,05%), protein (1,86%), lemak (0,42%), serat kasar (8,96%), dan karbohidrat (41,43%). Pati yang terdapat pada Glacilaria sp. dapat dihidrolisis dengan asam sehingga pecah menjadi molekul glukosa. Glukosa dapat diubah menjadi produk etanol melalui proses fermentasi dengan bantuan mikroorganisme berupa Saccharomyces cerevisiae. Penggunaan Saccharomyces cerevisiae dalam pembuatan etanol telah banyak dikembangkan di beberapa negara seperti Brazil, Afrika Selatan, dan Amerika Serikat karena Saccharomyces cerevisiae mampu memproduksi etanol dalam jumlah besar (Harvey, 2009; Narita, 2005).
Etanol hasil fermentasi harus didestilasi agar etanol yang diperoleh lebih murni. Penggunaan metode destilasi untuk memperoleh bioetanol disebabkan karena senyawa kimia tersebut mampu dipisahkan berdasarkan perbedaan titik didihnya atau kevolatilan dari senyawa kimia tersebut. Salah satu kegunaan penting bioetanol yaitu dapat dijadikan energi
alternatif yang dapat menambah volume bahan bakar minyak yang jumlahnya sangat terbatas untuk ke depannya. Selain itu, bioetanol juga dapat digunakan sebagai campuran dalam bahan bakar minyak (BBM) yang berfungsi sebagai agen peningkat angka oktan dan sumber oksigen untuk pembakaran yang ramah lingkungan sebagai pengganti metil tetra butil eter (MTBE) (Archunan, 2004; Kim et al., 2008).
Pengambilan sampel Glacilaria sp. dilakukan pada salah satu perairan yang berpotensi memproduksi rumput laut yaitu di Pantai Serangan yang berlokasi di Kota Denpasar.
Salah satu faktor yang mempengaruhi dalam pembuatan bioetanol agar memperoleh hasil maksimum adalah media. Media untuk produksi etanol harus memenuhi kebutuhan elemen dasar dalam pembentukan biomassa dan produk fermentasi. Kebutuhan elemen dasar mikroba yang digunakan yaitu sumber karbon yang diperoleh dari karbohidrat. Selain itu, diperlukan zat tambahan seperti sumber nitrogen, sulfur, dan mineral lain dalam media fermentasi. Wijiyono (2009) menyatakan bahwa mikroba membutuhkan paling sedikit 267 mg N/liter untuk dapat melakukan proses pertumbuhan dan fermentasi. Salah satu sumber nitrogen yang dapat dimanfaatkan sebagai sumber nutrien dalam media fermentasi adalah ammonium sulfat. Pada penelitian ini, digunakan ammonium sulfat ((NH4)2SO4) sebagai sumber nitrogen yang murah dan dipelajari pengaruhnya pada proses fermentasi etanol (Hakim, 2007).
Tersedianya sumber nitrogen dengan konsentrasi yang tepat dalam media fermentasi diharapkan mampu meningkatkan pertumbuhan mikroba sehingga dapat diperoleh kadar etanol maksimum. Berdasarkan kenyataan tersebut, perlu dilakukan penambahan ammonium sulfat ((NH4)2SO4) sebagai sumber nitrogen dengan konsentrasi yang bervariasi untuk menentukan pengaruhnya terhadap produksi etanol pada fermentasi Glacilaria sp.
MATERI DAN METODE
Bahan
Bahan-bahan yang digunakan dalam penelitian ini antara lain: sampel rumput laut Glacilaria sp., ragi NKL, asam sulfat (H2SO4) natrium hidroksida (NaOH), pereaksi Nelson, pereaksi arsenomolibdat, standar glukosa, alkohol 70%, spiritus, standar etanol, dan ammonium sulfat ((NH4)2SO4).
Peralatan
Alat-alat yang digunakan dalam penelitian ini antara lain: neraca analitik, seperangkat alat gelas laboratorium, pipet volume, pipet ukur, pipet tetes, pipet mikro, cawan porselen, botol fermentasi (botol kaca), kertas saring, ayakan, kertas indikator pH, blender, hotplate, jarum ose, Shaker (Atta model AE-3605), termometer, inkubator (Sanyo), Autoklaf (LaboAutoclave), desikator, aluminium foil, clippark, pisau, oven, spatula, magnetik stirer, botol semprot, seperangkat alat spektrofotometer UV-Vis (Varian DMS 80), seperangkat alat destilasi, dan seperangkat alat kromatografi gas (Varian 3300).
Cara Kerja
Persiapan sampel rumput laut
Sampel rumput laut dibersihkan dari pengotornya, kemudian dikeringkan dengan kipas angin sampai kering selama ± 3 hari. Sampel rumput laut yang telah kering dihancurkan dengan menggunakan blender. Kemudian disaring menggunakan ayakan, sehingga didapatkan tepung rumput laut.
Penentuan kadar air secara gravimetri
Mula-mula cawan kosong dikeringkan dalam oven selama 1 jam dengan suhu 1050C, kemudian didinginkan dalam desikator selama 30 menit dan ditimbang berulang-ulang hingga beratnya konstan. Sampel ditimbang sebanyak 2 gram dalam cawan tersebut, kemudian dikeringkan dalam oven pada suhu 100-1050C selama 5 jam atau sampai beratnya konstan. Cawan yang berisi sampel didinginkan di dalam desikator selama 30 menit lalu ditimbang hingga beratnya konstan (AOAC, 1970).
Persiapan sampel untuk analisis kadar gula reduksi
Sebanyak 1 gram tepung rumput laut Glacilaria sp. dibuat suspensi dengan cara dicampur dengan H2SO4 3,5% (v/v) dengan perbandingan 1:8 (b/v), kemudian sampel dipanaskan pada suhu 1000C dan diaduk dengan stirer pada skala 5 selama 1 jam. Suspensi rumput laut tersebut selanjutnya diuji secara kualitatif dengan reagen Benedict dan diukur kadar gula reduksinya secara kuantitatif. Sampel yang telah diketahui kadar gula reduksinya selanjutnya disiapkan sebagai media fermentasi (Junk dan Pancoast, 1980).
Pembuatan kurva standar glukosa
Sebanyak 1 mL larutan standar glukosa 0 (blanko); 20 ppm; 40 ppm; dan 60 ppm secara terpisah dimasukkan ke dalam tabung reaksi, kemudian masing-masing tabung reaksi tersebut ditambahkan dengan 1 mL reagen Nelson dan semua tabung dipanaskan pada penangas air yang mendidih selama 20 menit. Selanjutnya semua tabung reaksi diambil dan didinginkan di dalam gelas beker yang berisi air dingin sehingga suhu tabung reaksi mencapai 250C. Setelah dingin, campuran ditambah 1 mL reagen arsenomolibdat dan diaduk sampai semua endapan Cu2O yang ada larut kembali. Larutan tersebut ditambah 7 mL akuades dan diaduk sampai homogen. Absorbansi campuran selanjutnya diukur dengan spektrofotometer UV-Vis pada panjang gelombang 540 nm (Sudarmadji et al., 1997).
Penentuan kadar gula reduksi dan kadar pati (Metode Nelson-Somogyi)
Sebanyak 1,0 mL filtrat jernih yang disaring dari hasil hidrolisis rumput laut dimasukkan ke dalam tabung reaksi, ditambahkan 1 mL reagen Nelson dan dipanaskan pada penangas air yang mendidih selama 20 menit. Selanjutnya larutan tersebut diambil dan didinginkan di dalam gelas beker yang berisi air dingin sehingga suhu tabung reaksi mencapai 250C. Setelah dingin, larutan tersebut ditambah 1 mL reagen arsenomolibdat dan dikocok sampai semua endapan Cu2O yang ada larut kembali. Selanjutnya larutan tersebut ditambahkan 7 mL akuades dan divortex sampai
homogen. Kemudian absorbansi campuran diukur dengan spektrofotometer UV-Vis pada panjang gelombang 540 nm. Setelah kadar gula reduksi diketahui, berat pati dihitung dengan cara mengalikan berat glukosa dengan 0,9 sehingga kadar pati dapat diketahui (Sudarmadji et al., 1997 dimodifikasi).
Regenerasi kultur
Sebanyak 0,5 gram ragi NKL (Saccharomyces cerevisiae) ditambah 25 mL larutan glukosa 1% dalam erlenmeyer 50 mL, diisolasi pada kondisi anaerobik dengan cara ditutup rapat dengan clipark, aluminium foil, dan plastik. Labu erlenmeyer yang telah berisi ragi dan glukosa 1% (b/v) diletakkan di atas shaker selama 24 jam dengan temperatur ruang 29-300C (Fardiaz, 1992).
Pembuatan inokulum untuk fermentasi
Biakan pada larutan glukosa 1% (b/v) diinokulasi dengan cara ditambahkan suspensi rumput laut sebanyak 10 mL, kemudian diinkubasi selama ± 48 jam dengan kondisi aerobik pada suhu 300C. Inokulasi rutin dilakukan setiap 48 jam sebanyak 3 kali. Inokulum yang telah diinokulasi sebanyak 3 kali akan digunakan pada fermentasi utama (Fardiaz, 1989).
Pembuatan kurva standar etanol
Labu ukur 5 mL yang kosong ditimbang terlebih dahulu dan dicatat massanya. Labu ukur 5 mL yang berisi air suling selanjutnya ditimbang dan dicatat massanya dan dinyatakan sebagai etanol 0% (hanya mengandung air suling). Sebanyak 4 buah standar etanol 5%; 10%; 20%, dan 40% masing-masing disiapkan dalam labu ukur 5 mL kemudian ditimbang dan dicatat massanya.
Sebanyak 1 µL larutan standar etanol masing-masing 0% (tidak dilakukan); 5%; 10%; 20%, dan 40% diinjeksikan satu per satu ke dalam tempat injeksi sampel pada kromatografi gas. Hasil pendeteksian etanol dalam sampel akan direkam oleh rekorder pada GC. Luas area dari masing-masing standar etanol pada kromatogram selanjutnya dicatat. Luas area selanjutnya diplotkan dengan konsentrasi standar etanol sehingga membentuk kurva standar untuk
melihat kelinierannya. Setelah diketahui garisnya linier, kurva hubungan antara berat jenis (densitas) dengan konsentrasi standar etanol selanjutnya dibuat sebagai kurva standar untuk mengukur kadar etanol pada sampel (Tuti et al., 2010).
Optimasi waktu fermentasi dengan penambahan (NH4)2SO4 1% (b/v) pada media fermentasi
Sebanyak 10 gram tepung rumput laut dihidrolisis dengan H2SO4 3,5% (v/v) dengan perbandingan 1:8 (b/v), kemudian sampel dipanaskan pada suhu 1000C dan diaduk dengan stirer pada skala 5 selama 1 jam. Cairan hasil hidrolisis diatur pHnya dengan cara menambahkan larutan NaOH 4 M sedikit demi sedikit hingga pHnya berkisar antara 4-5. Suspensi tersebut kemudian dipindahkan ke dalam 4 buah botol yang sudah steril. Masing-masing botol ditambah glukosa 1% (b/v), (NH4)2SO4 1% (b/v), inokulum sebanyak 2%, dan diisi kode A, B, C, dan D. Media tersebut kemudian difermentasi di dalam inkubator pada temperatur 78-850C selama 3, 5, 7, dan 9 hari. Hasil fermentasi kemudian didestilasi pada temperatur 78-850C. Etanol yang diperoleh kemudian ditimbang dan dihitung densitasnya. Hasil perhitungan densitas selanjutnya diplotkan pada kurva hubungan antara densitas dengan konsentrasi etanol untuk memperoleh kadar etanol pada sampel. Waktu fermentasi yang menghasilkan etanol dengan kadar optimum selanjutnya akan digunakan sebagai waktu optimum untuk fermentasi selanjutnya.
Hidrolisis rumput laut untuk fermentasi
Rumput laut Glacilaria sp. ditimbang masing-masing sebanyak 5 gram untuk semua jenis perlakuan (16 jenis perlakuan). Masing-masing sampel dimasukkan ke dalam erlenmeyer dan ditambahkan H2SO4 3,5% (v/v) dengan perbandingan 1:8 (b/v), kemudian sampel dipanaskan pada suhu 1000C dan diaduk dengan stirer pada skala 5 selama 1 jam.
Pengaturan pH dan penambahan nutrien
Cairan hasil hidrolisis diatur pHnya dengan cara menambahkan larutan NaOH 4 M sedikit demi sedikit hingga pHnya berkisar
antara 4-5. Suspensi tersebut kemudian dipindahkan ke dalam 16 botol fermentasi yang telah diberi label masing-masing sebanyak 50 mL. Masing-masing suspensi rumput laut ditambah 1 ml larutan glukosa 2% (b/v) dan larutan ammonium sulfat ((NH4)2SO4) 1% (b/v) pada botol A1–A4; 0,75 % (b/v) pada botol B1– B4; 0,5% (b/v) pada botol C1–C4; dan 0,25% (b/v) pada botol D1–D4 kemudian dikocok beberapa kali agar bercampur secara homogen.
Fermentasi alkohol
Masing-masing media kemudian ditambah inokulum sebanyak 2% dari jumlah media fermentasi. Penambahan inokulum dilakukan secara aseptik di atas bunsen. Fermentasi dilakukan di dalam inkubator pada temperatur 25-300C. Seluruh media diinkubasi selama 4, 5, 6, dan 7 hari.
Pengukuran pH akhir
Media yang difermentasi diukur pH akhirnya pada hari ke-4, 5, 6, dan 7 secara kualitatif dengan menggunakan indikator pH. Pengukuran pH media dilakukan dengan mengamati perubahan warna yang terjadi selanjutnya mencocokkan warnanya dengan warna indikator pH. Hasil pengukuran yang diperoleh kemudian dicatat.
Pengukuran kadar etanol
Cairan hasil fermentasi masing-masing media (media A sampai D) didestilasi mulai dari hari ke-4 sampai hari ke-7. Cairan tersebut diukur volumenya terlebih dahulu kemudian dimasukkan ke dalam labu destilasi 250 mL dan ditambahkan beberapa butir batu didih. Selanjutnya sampel didestilasi pada suhu 780-850C. Kemudian hasil destilasi dimasukkan tepat sampai tanda batas ke dalam labu ukur yang disesuaikan dengan jumlah destilat yang diperoleh. Dinding labu ukur dikeringkan, lalu ditimbang. Labu ukur dicuci sampai bersih, dikeringkan dan dibiarkan pada suhu kamar, lalu ditimbang. Penentuan berat air suling juga dilakukan dengan labu ukur tersebut (Harvey, 2009 dimodifikasi). Kadar etanol ditentukan dengan bantuan kurva hubungan antara densitas dengan konsentrasi standar etanol (Tuti et al., 2010).
HASIL DAN PEMBAHASAN
Penentuan Kadar Air, Gula Reduksi, dan Pati Rumput Laut Glacilaria sp.
Kadar air dalam suatu bahan sangat erat kaitannya dengan aktivitas air (aw) yang dapat digunakan oleh mikroba untuk pertumbuhannya sehingga dapat digunakan untuk mengetahui daya awet dari bahan. Kadar air rumput laut kering yang diperoleh dari penelitian ini adalah 18,38%.
Hasil uji kualitatif dengan reagen Benedict menunjukkan adanya kandungan gula reduksi yang cukup besar dalam sampel Glacilaria sp. yang ditandai dengan terbentuknya endapan berwarna merah bata pada sampel saat dipanaskan. Hasil uji kuantitatif dengan metode Nelson-Somogyi (Sudarmadji et al., 1997) menunjukkan kadar gula reduksi pada rumput laut Glacilaria sp. adalah 17,14%. Kadar gula reduksi tersebut cukup baik untuk proses fermentasi. Hal ini sesuai dengan hasil penelitian Amerine dan Cruess (1960), yang menyatakan bahwa glukosa dapat difermentasi dengan baik pada kadar gula pereduksi 15-20%. Terhadap konsentrasi gula yang lebih tinggi, misalnya di atas 25%, khamir tidak akan memfermentasi lagi karena kadar gula yang terlalu tinggi dapat menghambat pertumbuhan mikroorganisme.
Kadar pati yang terkandung dalam sampel Glacilaria sp. dapat dihitung yaitu dengan cara mengalikan berat glukosa dengan 0,9 (Sudarmadji et al., 1997). Kadar pati rata-rata dari rumput laut Glacilaria sp. tersebut yaitu sebesar 15,42%
Hasil dari pengukuran absorbansi sejumlah standar glukosa dengan seri konsentrasi 0-60 ppm pada panjang gelombang 540 nm diperoleh persamaan regresi y = 0,00565x – 0,002 dengan r = 0,9997, nilai ini menunjukkan bahwa absorbansi dengan konsentrasi memberikan hubungan yang linier.
Pembuatan Kurva Standar Hubungan antara Densitas dan Konsentrasi Etanol untuk Analisis Sampel
Konsentrasi larutan standar yang dipilih untuk pembuatan kurva standar adalah 0%, 5%, 10%, 20%, dan 40%. Hasil perhitungan densitas
dari masing-masing larutan standar etanol disajikan pada Tabel 1.
Tabel 1. Hasil Perhitungan Densitas Standar Etanol
|
Konsentrasi standar etanol |
Densitas etanol |
|
0 % |
1,0000 |
|
5 % |
0,9916 |
|
10 % |
0,9850 |
|
20 % |
0,9689 |
|
40 % |
0,9425 |
Tabel 1 menunjukkan hubungan antara konsentrasi dan densitas standar etanol. Persamaan garis regresi linier yang diperoleh dari hasil perhitungan, yaitu y = -696,5x + 695,8 dengan koefisien regresi sebesar 0,9980. Kadar etanol pada sampel dapat diketahui dengan memplotkan data densitas etanol dari sampel pada kurva standar hubungan densitas dengan konsentrasi etanol (Tuti, et al., 2010).
Optimasi Waktu Fermentasi dengan Konsentrasi Ammonium Sulfat 1% (b/v) pada Media
Waktu fermentasi yang dipilih agar mikroba mampu melakukan fermentasi secara optimum adalah 3, 5, 7, dan 9 hari. Pemilihan waktu fermentasi tersebut didasarkan pada penelitian Prescott dan Dunn (1959) yang menyatakan bahwa fermentasi etanol memerlukan waktu 3-7 hari. Keempat komposisi media fermentasi yang sama dengan variasi waktu yang berbeda menghasilkan etanol dengan kadar yang berbeda. Kadar etanol yang diperoleh dari hasil optimasi waktu fermentasi disajikan pada Gambar 1.
Gambar 1 menunjukkan terjadinya peningkatan kadar etanol sampai hari ke-7, yaitu berturut-turut 0,54% (v/v) pada hari ke-3, 0,63% (v/v) pada hari ke-5, hingga mencapai kadar maksimum yaitu 1,04% (v/v) pada hari ke-7. Hingga hari ke-7 diduga pertumbuhan dan aktivitas Saccharomyces cerevisiae berada pada fase logaritmik dan kesediaan nutrien sangat mencukupi serta dihasilkan zat-zat metabolik secara maksimal. Kecepatan pertumbuhan pada fase logaritmik dipengaruhi oleh tersedianya
nutrien yang cukup dalam media (Fardiaz, 1989). Pada hari ke-9 kadar etanol yang dihasilkan menurun yaitu mencapai 0,22% (v/v). Hal ini diduga disebabkan oleh beberapa faktor, diantaranya proses fermentasi sudah berjalan lambat karena kandungan gula dan nutrien di dalam media semakin sedikit sehingga etanol yang dihasilkan semakin menurun serta terjadi oksidasi alkohol yang sudah terbentuk menjadi asam asetat.
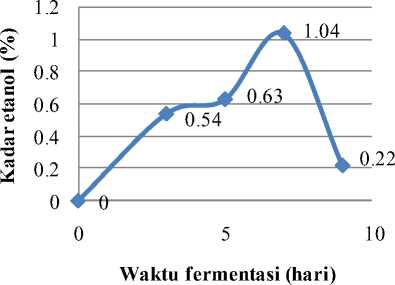
Gambar 1. Kurva Optimasi Waktu Fermentasi dengan Konsentrasi Ammonium Sulfat 1% (b/v) pada Media
Pengukuran pH Akhir Fermentasi
pH awal media sebelum fermentasi adalah 4,5 yang menunjukkan pH optimum bagi mikroba untuk tumbuh dan melakukan fermentasi. Setelah fermentasi berlangsung dengan variasi waktu dan konsentrasi ammonium sulfat sebagai sumber nitrogen, maka dapat diketahui pH akhir media fermentasi. Pengaruh waktu fermentasi dan konsentrasi ammonium sulfat terhadap pH media disajikan pada Gambar 2.
Kurva pada Gambar 2 menunjukkan semakin lama fermentasi berlangsung, maka pH akhir fermentasi secara keseluruhan cenderung semakin rendah. Kecenderungan pH media fermentasi semakin menurun kemungkinan disebabkan ammonium sulfat yang digunakan sel khamir sebagai sumber nitrogen diubah menjadi NH4+. Molekul NH4+akan berikatan dengan sel sebagai R-NH3. Dalam proses ini, H+ ditinggalkan dalam media, sehingga semakin
lama waktu fermentasi semakin rendah pH media (Judoamidjojo et al., 1989). Namun, media dengan konsentrasi (NH4)2SO4 0,75% (v/v) dan waktu fermentasi 5 hari menunjukkan perubahan pH yaitu dari 3,9 menjadi 4,3. Hal ini diduga karena kondisi media fermentasi yang kurang optimum yang menyebabkan pertumbuhan sel khamir sangat sedikit sehingga hanya sedikit sel yang berikatan dengan NH4+.
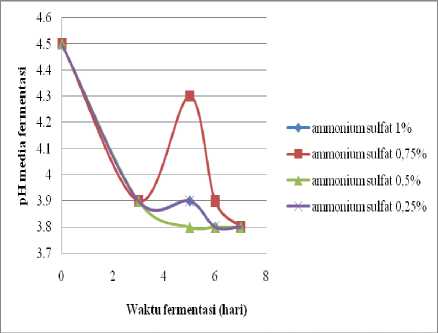
Gambar 2. Kurva Pengaruh Waktu Fermentasi dan Konsentrasi Ammonium Sulfat
terhadap pH Media
Proses terjadinya penurunan pH juga dapat diakibatkan terbentuknya metabolit-metabolit selama proses fermentasi berlangsung. Selama proses fermentasi terjadi pembentukan asam seperti asam laktat, asam asetat, dan asam piruvat yang dapat menurunkan pH media (Reed dan Peepler, 1973). Asam-asam tersebut terbentuk akibat adanya oksigen (Fardiaz 1989).
Pengaruh Konsentrasi Ammonium Sulfat (NH4)2SO4 terhadap Produksi Bioetanol Berbahan Baku Glacilaria sp.
Pengaruh ammonium sulfat terhadap produksi bioetanol dapat diketahui dengan menggunakan variasi konsentrasi ammonium sulfat, yaitu 0,25 %, 0,5 %, 0,75 %, dan 1 % (b/v) pada media fermentasi. Jumlah etanol yang dihasilkan dari 16 sampel dengan variasi konsentrasi etanol dan lama waktu fermentasi disajikan pada Gambar 3.
Kurva pada Gambar 3 menunjukkan bahwa kultur dengan konsentrasi ammonium
sulfat 1% (b/v) mengalami peningkatan kadar etanol dari hari ke-4 sampai hari ke-5 yaitu dari 0,70% menjadi 0,96% (v/v). Penurunan kadar etanol mulai terjadi pada hari ke-6 sampai hari ke-7 yaitu dari 0,95% menjadi 0,62% (v/v). Fermentasi pada media dengan konsentrasi ammonium sulfat 0,75% (b/v) menghasilkan etanol sebanyak 0,35% (v/v) pada hari ke-4. Peningkatan kadar etanol terjadi pada hari ke-5 yaitu dari 0,35% menjadi 0,47% (v/v). Kadar etanol mulai menurun pada hari ke-6, yaitu 0,002% (v/v). Selanjutnya, terjadi peningkatan etanol pada hari ke-7 yaitu mencapai 0,78% (v/v). Pada media fermentasi dengan konsentrasi ammonium sulfat 0,5% (b/v), terjadi peningkatan kadar etanol yang dihasilkan, yaitu 0,69% (v/v) pada hari ke-4 dan 0,70% (v/v) pada hari ke-5. Kadar etanol mulai menurun pada hari ke-6 dengan kadar etanol 0,005% (v/v). Kadar etanol kembali meningkat pada hari ke-7, yaitu sebanyak 0,74% (v/v). Fermentasi pada media dengan konsentrasi ammonium sulfat 0,25% (b/v), terjadi peningkatan jumlah etanol yang dihasilkan mulai hari ke-4 sampai hari ke-7, yaitu berturut-turut 0,56%; 0,57%; 0,69%; dan 0,73% (v/v). Kadar etanol terendah yang dihasilkan oleh kultur dengan konsentrasi awal ammonium sulfat 1%; 0,75%; 0,5%; dan 0,25% (b/v) adalah masing-masing sebesar 0,62% (v/v) pada hari ke-7; 0,002% (v/v) pada hari ke-6; 0,005% (v/v) pada hari ke-6; dan 0,56% (v/v) pada hari ke-4.
Fermentasi pada media dengan konsentrasi ammonium sulfat 1% (b/v) menghasilkan etanol dengan kadar paling optimum pada hari ke-5. Sampai hari ke-5 diduga pertumbuhan dan aktivitas Saccharomyces cerevisiae berada pada fase logaritmik. Nutrien yang tersedia pada media dikonsumsi secara baik serta dihasilkan zat-zat metabolik secara maksimal pada fase ini. Kecepatan pertumbuhan pada fase tersebut dipengaruhi oleh ketersediaan nutrien dalam media (Fardiaz, 1989). Peningkatan konsentrasi ammonium sulfat akan meningkatkan ion ammonium dalam media. Selanjutnya ion ammonium sebagai sumber nitrogen digunakan dalam pembentukan asam amino, asam nukleat, dan protein sel (Egbosimba dan Slaughter, 1987).
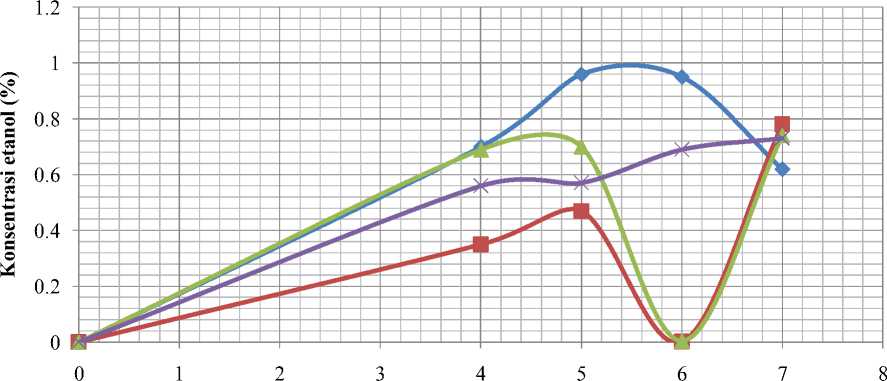
Waktu fermentasi (hari)
ammonium sulfat 1% -B- ammonium sulfat 0,75%
—⅛- ammonium sulfat 0,5% ammonium sulfat 0,25%
Gambar 3. Kurva Pengaruh Waktu Fermentasi dan Konsentrasi Ammonium Sulfat terhadap Produksi Bioetanol Berbahan Baku Glacilaria sp.
Kadar etanol yang sangat rendah dihasilkan pada hari ke-6, yaitu pada media dengan konsentrasi ammonium sulfat 0,75% dan 0,5% (b/v). Hal ini diduga disebabkan oleh beberapa faktor yaitu proses fermentasi sudah berjalan lambat karena kandungan gula dan nutrien di dalam media semakin sedikit. Keadaan ini juga diduga disebabkan karena etanol sudah mengalami oksidasi berubah menjadi asam asetat, sehingga pH media menjadi turun dan aktivitas Saccharomyces cerevisiae menjadi terhambat. Faktor lain yang dapat mempengaruhi adalah adanya kontaminan seperti bakteri asam laktat dan bakteri asam asetat yang mampu menjadi inhibitor dalam proses fermentasi sehingga etanol yang dihasilkan sangat rendah.
Kadar etanol yang dihasilkan secara keseluruhan masih kecil. Salah satu faktor yang berpengaruh adalah jumlah rumput laut yang digunakan sedikit yaitu 5 gram dalam 50 mL media fermentasi. Jumlah glukosa yang digunakan sebagai sumber C dalam fermentasi
sangat berpengaruh terhadap kadar etanol yang dihasilkan. Hasil penelitian yang dilakukan oleh Karta (2012) menunjukkan bahwa fermentasi dengan media yang berbahan alga Codium geppiorum 25 gram tanpa penambahan ammonium sulfat menghasilkan etanol rata-rata 3,03%. Semakin banyak jumlah rumput laut yang digunakan, maka ketersediaan sumber C akan semakin banyak sehingga mampu memenuhi kebutuhan mikroba untuk tumbuh dan beraktivitas. Faktor lain yang juga berpengaruh terhadap jumlah etanol yang dihasilkan dalam fermentasi adalah ketersediaan oksigen. Berdasarkan kurva pada Gambar 3, fase logaritmik berlangsung dengan cepat yang ditandai dengan peningkatan jumlah etanol yang diikuti dengan penurunan jumlah etanol yang tidak teratur. Hal ini diduga disebabkan oleh ketersediaan oksigen untuk mikroba yang belum mencukupi karena ketiadaan oksigen menyebabkan jumlah sel khamir menjadi terbatas sehingga kemampuan mikroba untuk
melakukan pertumbuhan menjadi kurang maksimal.
Berdasarkan kurva pengaruh konsentrasi ammonium sulfat terhadap produksi bioetanol maka dapat diketahui ammonium sulfat sangat berpengaruh terhadap proses fermentasi. Hal ini terlihat dari kadar etanol tertinggi yang diperoleh pada konsentrasi (NH4)2SO4 1% (b/v). Ammonium sulfat berperan sebagai sumber nitrogen bagi mikroba. Sumber nitrogen ini digunakan untuk pembentukan asam nukleat dan asam-asam amino.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian dan pembahasan yang telah dilakukan, maka dapat disimpulkan hal-hal sebagai berikut:
-
1. Kadar gula reduksi dan kadar pati rata-rata yang terkandung dalam rumput laut Glacilaria sp. yang diambil di Pantai Serangan adalah 17,14% dan 15,42%.
-
2. Waktu optimum yang diperlukan mikroba untuk menghasilkan etanol dengan kadar tertinggi adalah pada hari ke-7 yaitu dari 115 mL media rumput laut Glacilaria sp. diperoleh etanol dengan kadar 1,04% (v/v).
-
3. Penambahan ammonium sulfat 1% (b/v) pada media fermentasi mampu menghasilkan etanol secara optimal yaitu sebesar 0,96% (v/v) pada hari ke-5,
penambahan ammonium sulfat 0,75%; 0,5%; dan 0,25% (b/v) menghasilkan etanol secara optimal pada hari ke-7 dengan kadar masing-masing sebesar 0,78%; 0,74%; dan 0,73% (v/v). Penambahan ammonium sulfat 1% (b/v) menghasilkan etanol dengan kadar terendah terjadi pada hari ke-7 yaitu sebesar 0,62% (v/v) sedangkan pada penambahan ammonium sulfat 0,75%; 0,5%; dan 0,25% (b/v) dihasilkan etanol dengan kadar terendah masing-masing sebesar 0,002% (v/v) dan 0,005% (v/v) pada hari ke-6 dan 0,56% (v/v) pada hari ke-4.
-
4. Kondisi optimum produksi bioetanol berbahan baku Glacilaria sp. terdapat pada penambahan konsentrasi ammonium sulfat 1% (b/v) pada media rumput laut dengan
kadar etanol yang dihasilkan sebesar 0,96% (v/v) pada hari ke-5.
Saran
Sesuai hasil penelitian, dapat dikemukakan saran sebagai berikut:
-
1. Perlu dilakukan penelitian lebih lanjut terhadap penambahan konsentrasi
ammonium sulfat di atas 1% untuk menentukan kondisi optimum lainnya
sehingga diperoleh kondisi optimum yang dapat memproduksi bioetanol dengan
jumlah dan kualitas yang lebih baik.
-
2. Perlu dilakukan penelitian lebih lanjut mengenai pengaruh sumber nitrogen yang lain terhadap produksi bioetanol berbahan baku Glacilaria sp.
-
3. Perlu dilakukan penelitian lebih lanjut mengenai jenis mikroba lain yang mampu memfermentasi Glacilaria sp. dengan kadar etanol yang lebih optimal.
UCAPAN TERIMA KASIH
Melalui kesempatan ini penulis menyampaikan terimakasih kepada ibu Dra. Iryanti Eka Suprihatin, M.Sc., Ph.D, ibu Ida Ayu Gede Widihati, S.Si., M.Si., dan bapak Putu Suarya, S.Si., M.Si. atas saran dan masukannya, serta pihak-pihak lain yang telah membantu dalam penyelesaian penelitian ini.
DAFTAR PUSTAKA
Archunan, G., 2004, Microbiology, 1th ed., Sarup and Sons, New Delhi
Brahmana, E. M., 2010, Identifikasi Beberapa Rumput Laut di Pantai Segara, Sanur yang Memiliki Kadar Pati dan Protein yang Relatif Tinggi serta Komposisi Asam Aminonya, Skripsi, Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas
Udayana, Bukit Jimbaran
Egbosimba, E. E. dan Slaughter, J. C., 1987. The Influence of Ammonium Permease Activity and Carbon Source on The Uptake of Ammonium from Simple
Defined Media by Saccharomyces cerevisiae, J. General Microbiology, 133:375-379
Fardiaz, S., 1989, Fisiologi Fermentasi, Pusat Antar Universitas, Institut Pertanian Bogor, Bogor
Fardiaz, S., 1992, Mikrobiologi Pangan I, PT. Gramedia Pustaka Umum, Jakarta
Gautam, M., Lele, U., Kartodiharjo, H., Khan, A., Erwinsyah, I., and Rana, R., 2000, Indonesia The Challenges of Bank Involvement in Forest, Operation Evaluation Department, Evalution Country Case Study Series, World Bank, Washington DC, USA
Hakim, K., 2007, Pengaruh Penambahan
Ammonium Sulfat Terhadap Produksi Etanol pada Fermentasi Umbi singkong (Manihot utilissima Pohl.) dengan Inokulum Saccharomyces cerevisiae, Skripsi, Fakultas Farmasi, Universitas Muhammadiyah Surakarta, Surakarta
Harvey, F., 2009, Bioetanol Berbahan Dasar Ampas Rumput Laut Kappaphycus alvarezii, Skripsi, Institut Pertanian Bogor, Bogor
Judoamidjojo, R. M., Sa’id, E. G., dan Hartoto, L., 1989, Biokonversi, Departemen
Pendidikan dan Kebudayaan, Dirjen Dikti, Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor
Junk, W. R. dan Pancoast, H., 1980, Handbook of Sugar, The Avi Publishing Company Inc., Westport-Connecticut
Karta, W., 2012, Pembuatan Bioetanol dari Alga Codium geppiorum dan Pemanfaatan Batu Kapur Nusa Penida Teraktivasi untuk Meningkatkan Kualitas Bioetanol,
Tesis, Program Pascasarjana, Universitas Udayana, Denpasar
Kim, G. S., Myung, K. S., Kim, Y. J., Oh, K. K., Kim, J. S., Ryu, H. J., and Kim, K. H., 2008, Method of Producing Biofuel Using Sea Algae, World Intelectual Property Organization, Seoul
Narita, V., 2005, Saccharomyces cerevisiae
Superjamur yang Memiliki Sejarah Luar Biasa, Pustaka Utama, Jakarta
Prescott, S. G. dan Dunn, C. G., 1959, Industrial Microbiology. The AVI Publisher,
Connecticut
Reed, G. and Peepler, H. J., 1973, Yeast
Technologi, The AVI Publishing Co., Inc., New York
Sudarmadji, S., Haryono, B., dan Suhardi, 1997, Prosedur Analisa untuk Bahan Makanan dan PertanianEdisi keempat, Liberty, Yogyakarta
Tuti, S. dan Mahasiswa Angkatan 2008, 2010, Laporan Kunjungan Mata Kuliah Pilihan Bioenergi Sub-Materi Bioetanol, Program Studi Diploma III Teknik Kimia, Fakultas Teknik, Universitas Diponegoro, Semarang
Wijiyono, 2009, Efektivitas Penambahan Ammonium terhadap Pertumbuhan dan Laju Fermentasi Saccharomyces cerevisiae dalam Pembuatan Anggur, diakses melalui:
<http://wijiyovan.wordpress.com/2008/1 0/21/efektivitas-penambahan-ammonium-terhadap-pertumbuhan-dan-laju-fermentasi-saccharomyces-cerevisiae-dalam-pembuatan-anggur/>, diakses tanggal 2 Desember 2011
10
Discussion and feedback