SINTESIS DAN KARAKTERISASI ZEOLIT-TiO2 SERTA PEMANFAATANNYA SEBAGAI FOTOKATALIS UNTUK DEGRADASI RHODAMIN B
on
p-ISSN 1907-9850 e-ISSN 2599-2740
SINTESIS DAN KARAKTERISASI ZEOLIT-TiO2 SERTA PEMANFAATANNYA SEBAGAI FOTOKATALIS UNTUK DEGRADASI RHODAMIN B
W. A. Fauzi, I N. Simpen, dan I W. Sudiarta
Program Studi Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana Email: wempicauliafauzi@gmail.com
ABSTRAK
Sintesis komposit zeolit-TiO2 telah berhasil dilakukan dengan mencampurkan zeolit alam terkativasi H2SO4 dengan TiO2. Komposit yang terbentuk kemudian dikarakterisasi gugus fungsi dengan Fourier Tranform Infrared (FTIR) dan luas permukaan secara metode BET (Breunaur, Emmet dan Teller). Hasil karakterisasi FTIR dan BET menunjukkan bahwa sintesis komposit zeolit-TiO2 relatif berhasil. Hal tersebut dapat dilihat dari karakterisasi BET, yaitu semakin tinggi luas permukaan komposit dari 63,031 m2/g menjadi 73,913 m2/g, kemudian diperkuat dengan munculnya gugus fungsi TiO2 pada zeolit pada panjang gelombang 2345,44 cm-1, 792,74 cm-1, dan 424,34 cm-1. Selanjutnya, komposit digunakan untuk fotodegradasi zat warna rhodamin B dengan persentase tertinggi 97,39% pada waktu kontak irradiasi optimum menit ke-10 dan pH efektif larutan 4.
Kata kunci: fotodegradasi, rhodamin B, komposit zeolit-TiO2
ABSTRACT
The synthesis of zeolite-TiO2 composite has been successfully performed by mixing the H2SO4-enriched natural zeolite to TiO2. The composites are formed then characterized functional groups using Fourier Transform Infrared (FTIR) and surface area with BET (Breunaur, Emmet and Teller) method. The characterization results showed that the synthesis of zeolite-TiO2 composites is relatively successful. Those can be seen from BET characterization higher to the composite surface area from 63.031 m2/g to 73.913 m2/g, then reinforced by the appearance of the functional groups of TiO2 in zeolite at wavelength 2345.44 cm-1, 792.74 cm-1, and 424.34 cm-1. Furthermore, the composite is used for the photodegradation of rhodamin B dyes with the highest degradation percentage was 97.39% in optimal irradiation contact time was reached at 10 minutes and the effective pH of 4.
Keywords : photodegradation, rhodamin B, zeolite-TiO2 composite
PENDAHULUAN
Tingkat pencemaran lingkungan dewasa ini semakin meningkat. Bahan-bahan pencemar utama bersumber dari senyawa-senyawa kimia yang dibuang ke lingkungan. Industri tekstil merupakan salah satu sumber dari limbah tersebut karena masih banyak industri tekstil yang membuang limbah langsung ke lingkungan sekitar seperti sungai dan laut, tanpa melalui proses pengolahan dan penyaringan agar aman bagi mahluk hidup di sekitarnya (Sastrawijaya, 2000).
Rhodamin B merupakan salah satu zat warna yang sering digunakan dalam industri tekstil, karena menghasilkan warna yang menarik, harganya murah, dan mudah diperoleh (Syakri, 2017).

Gambar 1. Struktur rhodamin B (Nalwa, 2001)
Pengolahan limbah zat warna rhodamin B telah banyak dilakukan dengan berbagai metode, antara lain flotasi, sedimentasi, dan metode adsorpsi karbon aktif. Akan tetapi, metode-metode tersebut kurang efektif karena zat warna masih terakumulasi di dalam adsorben dalam bentuk senyawa yang kompleks, sehingga akan kembali dapat mencemari lingkungan jika dibuang langsung ke lingkungan. Sebagai alternatif, metode efektif untuk mengolah limbah zat warna tersebut yaitu dengan fotodegradasi menggunakan bahan fotokatalis dan irradiasi sinar ultraviolet. Dengan metode fotodegradasi ini, zat warna dapat diuraikan menjadi komponen-komponen yang lebih sederhana yang relatif lebih aman untuk lingkungan (Wijaya dkk., 2005).
Fotodegradasi memerlukan suatu katalis yang bersifat semikonduktor seperti Titanium dioksida (TiO2). TiO2 adalah material semikonduktor yang baik digunakan untuk aktivitas fotodegradasi karena mempunyai energi band gap yang besar yaitu 3,2 eV yang mampu menguraikan zat warna dan berisfat stabil terhadap temperatur (Batista et al., 2010). Sifat inilah yang menjadi dasar penggunaan TiO2 dalam peneletian ini.
Titanium dioksida memiliki daya adsorpsi yang rendah terhadap zat warna, sehingga efisiensi fotokatalitiknya rendah. Efektivitas fotokatalis TiO2 dapat ditingkatkan dengan menambahkan pengemban pada katalis yang menyebabkan bertambahnya luas permukaan katalis. Pengemban yang digunakan adalah zeolit. Pemilihan zeolit sebagai materi pengemban katalis karena zeolit mempunyai pori-pori yang besar sehingga, stabil dalam suhu tinggi, dan keberadaannya di Indonesia melimpah. Katalis TiO2 yang teremban pada zeolit diharapkan dapat memiliki fungsi ganda yaitu sebagai adsorben sekaligus fotokatalis (Wijaya dkk., 2005). Proses pengembanan TiO2 pada zeolit dilakukan dengan metode keramik (solid state reaction). Metode keramik merupakan reaksi langsung antara reagen dengan
reagen lainnya pada temperatur beriksar 3000C-16000C (Lufaso, 2014).
Pada penelitian Chandra (2012), melakukan fotodegradasi menggunakan TiO2/zeolit dengan metode impregnasi untuk mendegradasi rhodamin B menghasilkan persentase degradasi optimum 95,55% pada menit ke 120 dan pH rhodamin B adalah 4.
Berdasarkan uraian tersebut di atas, maka dilakukan fotodegradasi zat warna rhodamin B menggunakan zeolit-TiO2 yang disintesis secara metode keramik. Selanjutnya, dipelajari pengaruh variasi waktu kontak dan pH optimum dari proses fotodegradasi.
MATERI DAN METODE
Bahan
Bahan yang digunakan dalam penelitian ini adalah zeolit alam klipnoptilolit, TiO2, rhodamin B, H2SO4, akuades, HCl, indikator phenolpthalein, dan NaOH.
Peralatan
Peralatan yang digunakan dalam penelitian ini adalah peralatan gelas, corong, pipet volumetri, pipet tetes, pengaduk magnetik, batang pengaduk, timbangan analitik, tanur, oven, ayakan 200 mesh, botol vial, kotak penyinaran, kertas saring, plastik hitam, lampu UV, spektroskopi Fourier Transform Infrared (FTIR), Surface Area Analyzer (SAA), pH meter, dan spektrofotometer UV-vis.
Cara Kerja
Aktivasi zeolit dengan asam sulfat
Seratus (100) g zeolit alam yang lolos ayakan 200 mesh dimasukkan ke dalam gelas beaker yang berisi 1000 mL akuades sambil diaduk dengan pengaduk magnetik selama 3-4 jam. Kemudian, zeolit disaring dan dipanaskan pada suhu 500C sampai mencapai berat konstan. Ke dalam 100 g zeolit yang telah dicuci ditambahkan 1000 mL asam sulftat 2 M dan diaduk selama 14-16 jam menggunakan pengaduk magnet. Setelah
itu, dicuci dengan akuades sebanyak 3 kali dan dikeringkan pada suhu 1200C.
Sintesis komposit zeolit-TiO2
Sejumlah zeolit yang sudah dicuci dicampurkan dengan TiO2 secara padat-padat dengan perbandingan zeolit:TiO2 yaitu 100:1 (1 gram zeolit dengan 0,01 gram TiO2), 100:3 (1 gram zeolit dengan 0,03 gram TiO2), dan 100:5 (1 gram zeolit dengan 0,05 gram TiO2). Kemudian, campuran diaduk sampai homogen dan dipanaskan dalam tanur pada suhu 3500C selama 12 jam.
Karakterisasi zeolit-TiO2
Dua puluh (20) g serbuk zeolit-TiO2 yang hasil sintesis dilakukan analisis menggunakan FTIR untuk mengetahui gugus fungsi zeolit-TiO2 dan metode BET untuk menentukan luas permukaan spesifik zeolit-TiO2.
Penentuan waktu penyinaran optimum
Tujuh buah gelas beker 50 mL dibungkus plastik hitam kemuudian masing-masing diisi dengan 25 mL larutan rhodamin B 100 mg/L. Ke dalam tujuh gelas beker tersebut ditambahkan masing-masing 0,5 gram zolit-TiO2. Setelah dimasukkan ke dalam kotak penyinaran bungkus plastik hitam dibuka. Tujuh buah gelas beker berisi zeolit-TiO2 disinari dengan sinar UV 253,47 nm masing-msaing selama 5, 10, 20, 30, 40, 50, dan 60 menit. Pemisahan filtrat yang mengandung sisa zat warna dan suspensi dilakukan dengan sentrifugasi pada kecepatan 3500 rpm selama 10 menit.
Penentuan pH efektif degradasi
Enam gelas beker 50 mL yang telah dibungkus plastik hitam masing-masing diisi dengan 25 mL larutan rhodamin B 100 mg/L dengan pH 4, 5, 6, 7, 8, dan 9 dengan menambahkan HCl 0,5 M atau NaOH 0,5 M ke dalam larutan. Ke dalam masing-masing gelas beker dimasukkan sebanyak 0,5 gram katalis zeolit-TiO2 dan diaduk sampai homogen.
Gelas beker kemudian dimasukkan ke dalam kotak penyinaran dengan sinar UV 253,247 nm dengan waktu optimum yang telah didapat pada prosedur sebelumnya. Pemisahan antara suspensi dan filtrat yang mengandung sisa zat warna dilakukan dengan sentrifugasi pada kecepatan 3500 rpm selama 10 menit.
Penentuan fotodegradasi rhodamin B pada kondisi optimum
Enam buah gelas 50 mL yang sudah dibungkus plastik hitam masing-masing diisi dengan 25 mL larutan rhodamin B konsentrasi optimum yang didapat pada prosedur sebelumnya. Ke dalam enam buah gelas dimasukkan 25 mL rhodamin B kemudian ditambahkan masing-maisng 0,5 gram zeolit-TiO2 dan diaduk sampai homogen. Tiga gelas dimasukkan ke dalam kotak penyinaran dan pembungkus plastik hitam dilepas. Gelas beker disinari sinar UV 253,47 nm selama waktu optimum. Tiga buah gelas beker sisanya dilakukan perlakuan yang sama namun tanpa penyinaran UV selama waktu optimum. Pemisahan antara suspensi dan filtrat yang mengandung sisa zat warna rhodamin B dilakukan sentrifugasi dengan kecepatan 3500 rpm selama 10 menit
HASIL DAN PEMBAHASAN
Berdasarkan Tabel 1 ditunjukkan bahwa zeolit-TiO2 100 : 5 memiliki luas permukaan terbesar yaitu 73,913 m2/g. Dalam penelitian Maria (2013) didapatkan luas permukaan spesifik zeolit alam sebesar 63,031 m2/g. Kenaikan luas permukaan katalis disebabkan oleh bertambahnya pori-pori pada katalis setelah ditambahkan zeolit. Luas permukaan yang tinggi akan memperbesar kemampuan katalis untuk mengadsorpsi zat warna sehingga peluang untuk mendegradasi zat warna akan semakin tinggi.
Tabel 1. Hasil Penentuan Luas Permukaan
Zeolit-TiO2 dengan Metode
BET
|
Komposit |
Luas Permukaan (m2/g) |
|
Zeolit-TiO2 (100:1) |
72,297 |
|
Zeolit-TiO2 (100:3) |
62,659 |
|
Zeolit-TiO2 (100:5) |
73,913 |
Hasil karakterisasi keasaman dan kebasaan permukaan zeolit-TiO2 sesuai dengan Tabel 2 dan 3 menunjukkan bahwa zeolit yang termodifikasi oleh TiO2 memiliki sifat keasaman permukaan rendah dan kebasaan permukaan komposit yang tinggi. Terlihat bahwa kebasaan pada variasi zeolit-TiO2 100 : 5 kebasaan permukaannya paling tinggi dibandingkan zeolit-TiO2 100 : 3 dan 100 : 1 yaitu 21,6579±0,3240 mmol/g dengan jumlah situs basa 1,3042 x 1022 atom/g. Kebasaan permukaan yang tinggi mampu untuk membantu proses adsorpsi zeolit-TiO2 terhadap zat warna rhodamin B yang bersifat asam (Sibarani, 2016). Semakin tinggi daya adsorpsi zeolit-TiO2 terhadap rhodamin B akan memperbesar peluang degradasi rhodamin B.
Tabel 2. Data Nilai Keasaman Permukaan dan Jumlah Situs Aktif Zeolit-TiO2
|
Komposit |
Keasaman Permukaan (mmol/g) |
Jumlah Situs Aktif Asam (atom/g) |
|
Zeolit-TiO2 |
0,2561 |
1,5422 x |
|
(100:1) |
1022 | |
|
Zeolit-TiO2 |
1,5546 |
1,2162 x |
|
(100:3) |
1022 | |
|
Zeolit-TiO2 (100:5) |
0 |
0 |
Tabel 3. Data Nilai Kebasaan Permukaan dan Jumlah Situs Aktif Zeolit-TiO2
|
Komposit |
Kebasaan Permukaan (mmol/g) |
Jumlah Situs Aktif Basa (atom/g) |
|
Zeolit-TiO2 |
20,4047 |
1,2287 x |
|
(100:1) |
1022 | |
|
Zeolit-TiO2 |
20,1965 |
1,2162 x |
|
(100:3) |
1022 | |
|
Zolit-TiO2 (100:5) |
21,6579 |
1,3042 x 1022 |
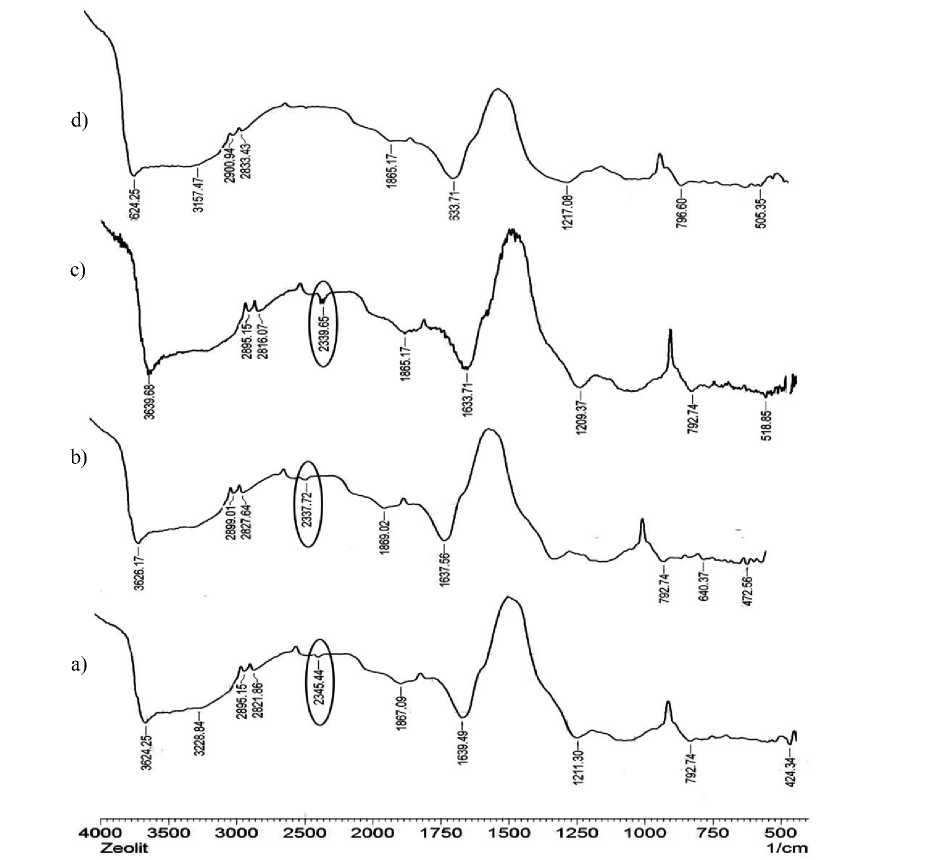
Gambar 2. Spektra FTIR (a) Zeolit-TiO2 (100:5), (b) Zeolit-TiO2 (100:3), (c) Zeolit-TiO2 (100:1), dan (d) Zeolit alam
Berdasarkan Gambar 2 spektra zeolit, terdapat serapan pada bilangan gelombang 1217,08 cm-1 dan 796,60 cm-1 yang merupakan serapan regangan asimetris dan asimetris eksternal O-Si-O atau O-Al-O. Serapan pada bilangan gelombang 505,35 cm-1 merupakan karakteristik ikatan Al-O dan Si-O (Stuart, 1999). Hadirnya TiO2 pada permukaan zeolit, dibuktikan dengan munculnya serapan pada panjang gelombang 2339,65 cm-1 (zeolit-TiO2 100:1), 2337,56 cm-1 dan 640,37 cm-1 (zeolit-TiO2 100:3), kemudian 2345,44 cm-1, 792,74 cm-1, dan 424,34 cm-1 (zeolit-TiO2 100:5) yang merupakan karakteristik dari TiO2 (Utubira dkk., 2006).
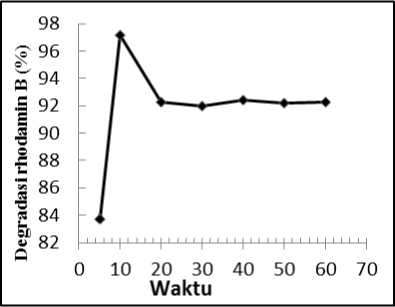
Gambar 3. Hubungan antara waktu kontak irradiasi dengan persentase degradasi
Berdasarkan Gambar 3 diketahui waktu penyinaran optimum zeolit-TiO2 dalam mendegradasi rhodamin B menunjukkan bahwa dari menit ke-5 menuju menit ke-10 terjadi kenaikan persentase degradasi rhodamin B. Setelah mencapai menit ke-10, proses degradasi tidak meningkat secara signifikan. Penurunan persentase degradasi yang terjadi diperkirakan karena pada menit ke-10 kemampuan komposit dalam mendegradasi rhodamin B sudah mencapai titik optimumnya dengan mendapatkan persentase degradasi 97,14%. Penurunan persentase degradasi juga bisa disebabkan oleh komposit yang digunakan sebagai adsorben mengalami kejenuhan dalam mengadsorpsi larutan rhodamin B, sehingga ketika waktu adsorpsi melebihi waktu optimumnya, maka akan terjadi proses desorpsi. Akibatnya, konsentrasi larutannya kembali mengalami peningkatan yang menyebabkan persentase degradasi menjadi menurun (Agusriyanti, 2015).
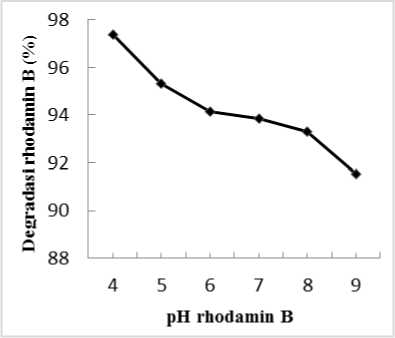
Gambar 4. Hubungan antara pH dengan persentase degradasi
Berdasarkan Gambar 4, diketahui bahwa rhodamin B lebih mudah terdegradasi pada pH asam dari pada pH basa yaitu didapatkan persentase degradasi tertinggi pada pH 4. Hal ini sesuai dengan teori pHpzc (point of zero charge). Nilai pHpcz adalah nilai pH permukaan suatu oksida tidak bermuatan. Nilai pHpcz dari TiO2 adalah sebesar 6,8. Jadi, permukaan titanium pada TiO2 akan bermuatan positif pada kondisi asam (pH < 6,8), sedangkan akan bermuatan negatif pada kondisi basa (pH > 6,8) (Fang-bai et al.,
2001). Reaksi TiO2 dalam asam dan basa dapat dituliskan sebagai berikut.
Ti-OH + H+ —► TiOH2+
Ti-OH + OH-—► TiO- + H2O
Dalam pelarut air, rhodamin B termasuk dalam zat warna bermuatan negatif. Hal ini menyababkan rhodamin B tidak efektif terdegradasi dalam pH basa (Sibarani dkk., 2016). Permukaan TiO2 akan bermuatan positif pada kondisi asam ditandai dengan adanya gugus TiOH2+ sehingga semakin banyak rhodamin B yang mampu terserap pada permukaan zeolit-TiO2 dan bereaksi dengan radikal bebas (Park et al., 2005). Permukaan TiO2 bermuatan negatif pada kondisi basa dengan adanya gugus TiO-, sehingga rhodamin B tidak mudah diserap pada permukaan zeolit-TiO2 dan sulit didegradasi oleh radikal bebas (Okitsu et al., 2005). Hasil yang didapatkan sesuai dengan penelitian yang dilakukan oleh Chandra (2012), mendapatkan pH tertinggi 4 dengan persentase degradasi 95,32%, hal yang sama juga didapatkan oleh Sibarani (2016) yaitu pH degradasi optimum 4 dengan persentase 95,05%.
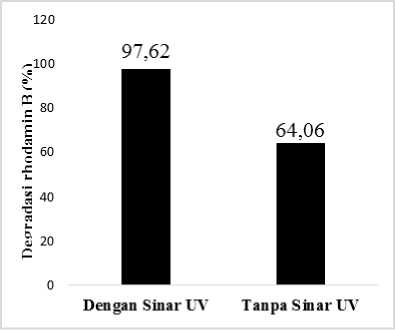
Gambar 5. Persentase degradasi rhodamin B dengan sinar UV dan tanpa sinar UV
Hasil fotodegradasi degradasi zeolit-TiO2 dapat dilihat pada Gambar 5, yaitu mendapatkan persen degradasi sebesar 97,62%. Sedangkan hasil persentase degradasi zeolit-TiO2 tanpa sinar UV adalah sebesar 64,06%. Kemampuan zeolit-TiO2 dalam mendegradasi zat warna disebabkan oleh kemampuan TiO2 yang bersifat semikonduktor yang memiliki pita valensi yang berisi elektron dan pita konduksi yang masih kosong. Pada
saat fotokatalis tersebut terkena irradiasi sinar UV yang memiliki energi yang sesuai atau bahkan melebihi energi celah pita dari oksida titan tersebut, maka elektron-elektron dalam pita valensi dari fotokatalis tersebut akan tereksitasi ke pita konduksi yang akan menghasilkan elektron (e-cb) dan kekosongan atau hole (h+vb) yang berperan sebagai muatan positif (He, et al., 2009).
TiO2 + hv —► TiO2 (h+vb +e-cb)
Selanjutnya h+vb akan bereaksi dengan hidroksida logam yaitu hidroksida oksida titan yang terdapat dalam larutan membentuk radikal hidroksida logam yang merupakan oksidator kuat untuk mengoksidasi senyawa rhodamin B. Elektron yang ada pada permukaan semikonduktor akan terjebak dalam hidroksida logam dan dapat bereaksi dengan H2O atau O2 yang ada dalam larutan membentuk radikal hidroksi (•OH) atau superoksida (•O) yang akan mengoksidasi senyawa rhodamin B (Sonawane, 2006).
h+vb + H2O —► •OH
e-cb + O2 —► •O
Radikal-radikal ini akan terbentuk terus-menerus selama zeolit-TiO2 masih dikenai irradiasi sinar UV dan akan menyerang senyawa rhodamin B yang berada di permukaan komposit sehingga akan mengalami degradasi menghasilkan CO2, H2O, dan senyawa-senyawa yang lebih sederhana.
•OH + rhodamin B —► CO2 + H2O + senyawa sederhana (Batista et al., 2010)
Perbedaan persentase degradasi yang dihasilkan antara rhodamin B dengan zeolit-TiO2 menggunakan sinar UV dan tanpa sinar UV yaitu sebesar 33,56% membuktikan adanya proses degradasi. Hal ini membuktikan bahwa adanya TiO2 berpengaruh terhadap proses fotodegradasi, yaitu sebagai fotokatalis yang mengoksidasi zat warna menjadi senyawa yang lebih sederhana (Agusriyanti dan Artsanti, 2015).
SIMPULAN
Berdasarkan penelitian yang telah dilakukan dapat disimpulkan bahwa zeolit-TiO2 100:5 memiliki luas permukaan sebesar 73,913 m2/g, mampu mendegradasi zat warna rhodamin B secara optimum pada menit ke-10, dan pH degradasi tertinggi 4 dengan persentase degradasi tertinggi 97,39%. Memperoleh hasil persentase fotodegradasi murni sebesar 33,73%.
UCAPAN TERIMA KASIH
Diucapkan terimakasih kepada ibu Emmy Sahara, ibu Wiwik Susanah Rita, dan ibu Iryanti E. Suprihatin atas saran-saran konstruktifnya.
DAFTAR PUSTAKA
Agusriyanti, S., dan Artsanti, P., 2015,
Pemanfaatan Zeolit Alam Ciamis sebagai Pengemban Fotokatalis TiO2 untuk Fotodegradasi Zat Warna Rhodamin B, J. Sains Dasar, 4(1), 9299
Batista, A. P. L., Carvalho, H. W., Luz, G. H. P., Martins, P. F. Q., Goncalves, M., and Oliviera, L. C. O., 2010,
Preparation of Cu/SiO2 and
Photocatalytic Activity by
Degradation of Methylene Blue,
Journal of Environmental Chemisty, (8), 63-67
Chandra, D.A.P., 2012, Degradasi
Fotokatalitik Zat Warna Tekstil Rhodamin B Menggunakan Zeolit Terimpregnasi TiO2, Skripsi,
Universitas Airlangga, Surabaya
Fang-bai., L., Guo-bang, G., Yun-Ji, H., and Hong-Fu, W., 2001, TiO2Assisted
Photo-Catalys Degradation Process of Dye Chemicals, Journal of Environmental Sciences, 13(1), 6468
He, Z., Sun, C., Yang, S., Ding, Y., He, H., and Wang, Z, 2009, Photocatalytic Degradation of Rhodamine B by Bi2WO6 with Electron Accepting Agent Under Microwave Irradiation: Mechanism and Pathway, Journal of Hazardous Material, 162, 1477-1486
Lufaso, M. 2014. Solid State Chemistry Lecture-Synthesis of solids,
https://www.unf.edu/~michael.lufaso/c hem4627/indeks.html>, tanggal akses 3 Agustus 2018
Maria, D.C., Cotto-Maldonado, Teresa, C., Eduardo, E., Arancha, G.M., and Francisco, M., 2013, Photocatalytic
Degradation of Rhodamine-B Under UV-Visible Light Irradiation using
Different Nanostructured Catalysts, American Science Journal, 3, 178-202
Nalwa, H. S., 2001, Advances in Surface
Science, Vol. 38, Academic Press, Los Angeles, California, USA
Okitsu, K., Iwasaki, K., Yobiku, Y., Bandow, H., Nishimura, R., and Maeda, Y., 2005, Sonochemical Degradation of Azo Dyes in Aqueos Solution: a New Heterogeneous Kinetics Model Taking into Account the Local Concentration of OH Radicals and Azo Dyes, Journal Ultrasonic Sonochemistry, 12(4), 255-262
Park, H., and Choi, W., 2005, Photocatalytic Reactivities of Nation-Coated TiO2 for the Degradation Changed Organic Compounds under UV or Visible Light, Journal Phys. Chem. B, 109(23), 11667-11674
Sastrawijaya, T., 2000, Pencemaran
Lingkungan, PT. Rineka Cipta, Jakarta
Sibarani, J., Purba, D.L., Suprihatin, I.E., dan Manurung, M., 2016, Fotodegradasi Rhodamin B Menggunakan
ZnO/UV/Reagen Fenton, Jurnal Cakra Kimia, 4(1), 84-94
Stuart, B., and Ando, D.J.,1999, Modern Infrared Spectroscopy, John Wiley & Sons, New York
Sonawane, R.S., and Dongare, M.K., 2006, Sol-gel Syntesis of Au/TiO2 Thin Films for Photocatalytic Degradation of Phenol in Sunlight, Journal of Molecular Catalyst A: Chemical, 243, 68-76
Syakri, S., 2017, Analisis Kandungan
Rhodamin B Sebagai Pewarnsa Pada Seediaan Lipstik Impor yang Beredar Di Kota Makasar, Jurnal Farmasi UIN Alauddin Makasar, 5(1), 40-45
Utubira, Y., Wijaya, K., Triyono, E., 2006, Preparasi dan Karakterisasi TiO2-
Zeolit serta Pengujiannya pada Degradasi Limbah Industri Tekstil secara Fotokatalitik, Indonesian Journal of Chemistry, 6(3), 231-237
Wijaya, K., Tahir, I., dan Haryati, N., 2005, Sintesis Fe2O3-Montmorillonit dan Aplikasinya sebagai Fotokatalis untuk Degradasi Zat Pewarna Congo Red, Indo. J. Chem., 5(1), 41-47
81
Discussion and feedback