ADSORPSI MULTI LOGAM BERAT KROM(III), TIMBAL(II), DAN TEMBAGA(II) DALAM SISTEM LARUTAN BINARY OLEH SILIKA GEL TERIMOBILISASI DIFENILKARBAZIDA
on
p-ISSN 1907-9850
e-ISSN 2599-2740
ADSORPSI MULTI LOGAM BERAT KROM(III), TIMBAL(II), DAN TEMBAGA(II) DALAM SISTEM LARUTAN BINARY OLEH SILIKA GEL TERIMOBILISASI DIFENILKARBAZIDA
I W. Sudiarta1*, P. Suarya1, dan C. M. P. Widya1
1 Program Studi Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayan, Bukit Jimbaran, Badung, Bali 80364
*E-mail: wayansudiarta@unud.ac.id
ABSTRAK
Adsorpsi multi ion logam, timba l(Pb), tembaga (Cu), dan krom (Cr) dalam sistem larutan binary Pb(II)-Cr(III), Cr(III)-Cu(II), dan Pb(II)-Cu(II) menggunakan adsorben silika gel terimobilisasi difenilkarbazida (Si-DPZIDA) dengan metode bath adsorpsi pada pH 2 dan waktu pengadukan 8 jam. Sistem larutan binary terdiri dari ion logam utama dan ko-kation, dengan konsentrasi logam ko-kation bervariasi 0,5; 1,0; dan 1,5 mM, sedangkan konsentrasi ion logam utama tetap 5,0 mM. Tujuan adsorpsi multi ion logam ini adalah untuk mengetahui efek dari kehadiran ko-kation terhadap adsorpsi ion logam utama. Hasil penelitian menunjukkan bahwa kehadiran Cr(III) maupun Cu(II) sebagai ko-kation memberikan efek sinergis terhadap daya serap Pb(II), sinergistik tertinggi terjadi pada konsentrasi Cr(III) 1,5 M dan Cu(II) 1,0 mM dengan daya serap Pb(II) masing-masing 0,5808 dan 0,5867 mmol/g. Daya adsorpsi logam Cr(III) mengalami efek sinergistik dengan kehadiran ko-kation Pb(II) maupun Cu(II). Efek sinergis terbesar terjadi pada konsentrasi Pb(II) 0,5 mM dan Cu(II) 0,5 mM, masing-masing dengan daya sorpsi Cr(III) 0,1041 dan 0,1010 mmol/g. Pada adsorpsi ion logam utama Cu(II), kehdiaran Cr(III) maupun Pb(II) memberikan efek antagonistik. Efek antagonistik tertinggi terjadi pada kehadiran ko-kation Cr(III) dan Pb(II) pada konsentrasi 0,5 mM dan 0,5 mM, dengan daya serap Cu(II) masing-masing sebesar 0,2768 dan 0,2736 mmol/g.
Kata kunci: adsoprsi multi logam, larutan binary, silika gel terimobilisasi, efek sinergistik, dan antagonistik
ABSTRACT
The adsorption of multi-metal ions of lead (Pb), copper (Cu), and chromium (Cr) was carried out in a binary solution systems of Pb(II)-Cr(III), Cr(III)-Cu(II), and Pb(II)-Cu(II) using a diphenylcarbazide immobilized silica gel adsorbent (Si-DPZIDA) by bath adsorption method at pH 2 and 8 hours stirring time. The binary solution system consists of major metal ions and co-cations, wherein the co-cation metal concentration were varies from 0.5, 1.0, and 1.5 mM, while concentration of major metal ions remained 5.0 mM. The purpose of this multi ion metal adsorption is to know the effect of the presence of co-cation on the adsorption of major metal ions. The results showed that the presence of Cr(III) and Cu(II) as co-cation gave a synergistic effect on the absorption capacity of Pb(II). The highest synergistic occurred at Cr(III) concentration of 1.5 M and that of Cu(II) of 1.0 mM with absorption capacity of Pb(II) each 0.5808 and 0.5867 mmol/g. The adsorption power of Cr(III) metal experiences a synergistic effect in the presence of co-cations Pb(II) and Cu(II). The largest synergistic effect occurred at the Pb(II) concentrations of 0.5 mM and Cu(II) 0.5 mM, respectively with Cr(III) sorption 0.1041 and 0.1010 mmol/g. In the adsorption of major Cu(II) metal ions, the presence of Cr(III) and Pb(II) gives antagonistic effects. The highest antagonistic effect occurred in the presence of Cr(III) and Pb(II) co-cations at 0.5 mM and 0.5 mM concentrations, with Cu(II) absorption of 0.2768 and 0.2736 mmol /g.
Keywords: multi-metal adsorption, immobilized silica gel, synergistic, antagonistic effects
PENDAHULUAN
Timbal (Pb), tembaga (Cu), nikel (Ni), krom (Cr), merkuri (Hg), dan arsen (As) merupakan logam-logam yang banyak digunakan dalam
perindustrian seperti industri pelapisan logam, industri cat dan zat warna tekstil, serta industri penyamakan kulit. Industri-industri tersebut dapat menghasilkan limbah yang mengandung logam-logam yang ikut terbawa dalam limbah industri
dan bersifat stabil. Keberadaan logam dalam tubuh dapat masuk melalui rantai makanan (oral), melalui pernafasan (inhalasi), dan melalui kulit (absorpsi). Beberapa logam berat seperti timbal, nikel, kadminium, arsen, krom sering dijumpai dalam air buangan yang bersifat karsinogenik dan toksik terhadap lingkungan (Kocasoy, & Sahin, 2007).
Keberadaan multi logam dalam air limbah menyebabkan dampak interaktif tergantung pada beberapa faktor seperti jumlah ko-kation yang berkompetisi pada situs-situs aktif, konsentrasi ion logam, pH, sifat dan jumlah adsorben (Saeed, et al., 2005).
Treatmen terhadap air limbah merupakan peluang besar dalam rekayasa lingkungan dan pembuatan kebijakan. Beberapa teknologi yang cocok untuk treatmen air limbah yang mengandung ion-ion logam berat antara lain presipitasi kimia, osmosis balik, redoks, elektrodialisis, dan adsorpsi. Adsorpsi merupakan teknologi yang banyak dikembangkan dan cocok untuk beragam air yang mengandung logam berat dalam jumlah kelumit (trace) dan yang tidak dapat dihilangkan dengan metode lain. Adsorpsi dapat diterapkan untuk treatmen air limbah menggunakan beragam material sebagai adsorben, seperti limbah pertanian, alga, bakteri, fungi, zeolit, lempung, karbon aktif, dan silika (Oscik, 1982).
Penelitian tentang adsorpsi ion logam berat yang dilaporkan dalam literatur sebagian besar berupa adsorpsi dari larutan mono-ion logam (Vinh, et al., 2015; Reddy, et al., 2015; Ghasemi, et al., 2014; Mahajan & Sud, 2013; Machida et al., 2006). Adsorpsi multi logam penting dipelajari untuk mengetahui tingkat interferensi dari kehadiran ko-kation dalam air limbah dan efisiensi adsorben dalam menghilangkan ion-ion tersbut dari air limbah (Srivastva, et al., 2006). Adsorpsi kompetitif berbagai ion logam berat dalam sistem multi-logam telah dilaporkan belakangan ini oleh beberapa peneliti. Hadi, et al., (2014) melaporkan adsorpsi Cu, Pb, dan Zn dari single, binary dan ternary system menggunakan adsorben berbahan limbah pertanian. Mohan & Singh (2002) menemukan bahwa kapasitas adsorpsi karbon aktif untuk Cd(II)dan Zn(II) menurun dalam system multi-logam dibandingkan dengan dalam sistem binary. Chiban, et al. (2011) melaporkan bahwa
kapasitas adsorpsi Pb(II) dalam Carpobrothus edulis kering, menurun dengan kehadiran Cd(II) dalam sistem binary. Ting & Teo (1994), melaporkan bahwa dalam system multi-komponen, ion-ion logam berinteraksi satu dengan lainnya dengan jenis interaksi sinergis, antagonis, dan non-interaktif. Sifat interaksi ko-kation dengan logam utama tidak dapat diprediksi berdasarkan studi logam tunggal, karena itu adsorpsi simultan dua logam atau lebih penting untuk dipelajari.
Penghilangan logam-logam toksik melalui adsorpsi menggunakan karbon aktif dari berbagai biomassa, kitosan dan agar telah dilaporkan oleh beberapa peneliti. Selektivitas adsorpsi ion-ion logam berbeda pada setiap adsorben (Myroslav, et al., 2006). Tingkat kompetitif ion-ion logam dalam berinteraksi dengan adsorben bervariasi sesuai dengan adsorben yang digunakan. Selektivitas adsorpsi kaolinit dalam sistem multi ion logam berat adalah Pb < Cu < Zn < Cd (Srivastava, et al., 2005). Selektivitas adsorpsi zeolit alam adalah Co2+ Co2+ > Cu2+ > Zn2+ > Mn2+ (Erdem, et al., 2004).
Pemanfaatan silika gel termodifikasi sebagai adsorben telah banyak di teliti. Mahmoud & Al-Saadi (2007) melaporkan hasil penelitiannya mengenai sintesis silika gel termodifikasi difenilkarbazon (DPCZ) untuk ektraksi dan pre-konsentrasi Cr(III) dan Fe(III) dimana hasil yang diperoleh dari adsorpsi terbaik oleh Si-DPCZ terhadap logam Cr(III) adalah 0,350 mmol/g serta aplikasinya yang potensial untuk Si-DPCZ bagi ekstraksi selektif dan pre-konsentrasi bagi ion logam berat Cr(III) dalam tingkat konsentrasi ppm dan ppb telah dengan sukses ditunjukkan dengan presentase penemuan kembali lebih dari 95% untuk ion logam yang telah diujikan. Kemampuan adsorpsi silika gel tanpa modifikasi dan silika gel terimpregnasi difenilkarbazida dalam menurunkan Cr(III) secara berturut-turut sebesar 1,95% dan 25,78%. Hasil penelitiannya ini juga menunjukkan peningkatan kemampuan adsorpsi untuk Cr(III) dan Cr(IV) pada silika gel terimpregnasi difenilkarbazida bila dibandingkan dengan silika gel tanpa modifikasi (Mandala, 2012). Tujuan dari penelitian ini adalah untuk mengetahui pengaruh ko-kation terhadap kapasitas adsorpsi kation utama dalam sistem larutan binary Pb(II)-Cu(II), Pb(II)-Cr(III), Cu(II)-Pb(II), Cu(II)-Cr(III), Cr(III)-Pb(II), dan Cr(III)-Cu(II).
MATERI DAN METODE PENELITIAN
Bahan dan Peralatan Penelitian
Bahan-bahan yang digunakan adalah CrCl3.6H2O, CuSO4, Pb(NO3)2, HNO3, HCl 37%, Silika Gel Terimmobilisasi difenilkarbazida (Si-DPZIDA, NaOH, H2SO4, HNO3, Toluena, ethyl alkohol, dietil eter, silika gel 60, larutan buffer pH 1 – 7, akuades, dan akua demineralisasi.
Alat-alat yang diguanakan antara lain serangkat alat-alat gelas, Shaker, Magnetic strirer, Spektrofotometer Serapan Atom (AAS), pH meter dan kertas saring Whatman 42.
Adsorpsi Mono Komponen
Semua adsorpsi dikerjakan dengan sistem bath adsorption. Adsorpsi mono-komponen Cr(III), Cu(II), dan Pb(II) dikerjakan untuk mengetahui adsorpsi masing-masing logam pada sistem larutan mono-logam. 50 mL larutan ion logam 1x10-3 M dicampur dengan 0,2 g adsorben (dosis = 0,2g/50 mL) diaduk pada kecepatan tetap selama 3 jam pada suhu kamar. Semua eksperimen dikerjakan pada pH 2 ( pH optimum Cr(III) ) dan dilakukan tiga kali ulangan (Jain, et al., 2010; 2013;). Jumlah logam yang terserap, qe, (mMol logam per g adsoreben ) untuk setiap sistem adsorpsi dihitung menggunakan persamaan (1):
∕mMol∖ (Ci — Ce) qe (---) = —∏— x v
XgJ M
dimana, Ci dan Ce adalah konsentrasi awal dan kesetimbangan logam, V adalah volume larutan dalam liter (L), M adalah massa adsorben dalam gram (g). Konsentrasi ion logam sisa dalam larutan ditentukan dengan spektrometer serapan atom (AAS)
Adsorpsi multi-komponen sistem binary
Pengaruh ko-kation dalam adsorpsi Cr(III), Cu(II), dan Pb(II) oleh silika gel terimpregnasi difenilkarbazida dipelajari dalam komponen sistem binary. Desain percobaan yang digunakan dalam sistem binary adalah Pb(II)-Cr(III), Pb(II)-Cu(II), Cu(II)-Cr(III), bergantian sebagai kation utama dan ko-kation. Pengaruh ko-kation terhadap kapasitas adsorpsi Pb(II), Cu(II), dan Cr(III) dipelajari pada berbagai konsentrasi ko-kation yaitu 0,5; 1,0; dan 1,5 mM dengan dosis setiap sistem yaitu 0,1 g/25 mL. Adsorpsi dikerjakan
sesuai dengan pH optimum kation utama. Jumlah logam yang tersisa dalam setiap adsorpsi ditentukan dengan AAS.
HASIL DAN PEMBAHASAN
Studi adsorpsi silika gel terimobilisasi difenilkarbazida (Si-DPZIDA) terhadap logam-logam berat dalam sistem larutan binary dilakukan dengan menginteraksikan 0,1 g adsorben Si-DPZIDA dengan 25 mL larutan multi logam dengan konsentrasi kation logam utama 5 x10-3 M dan konsentrasi ko-logam bervariasi 0,5 x10-3 , 1,0 x10-3, dan 1,5 x10-3 M, pH 2, dengan lama pengadukan 3 jam.
Adsorpsi binary ion logam Cr(III) dan Pb(II) pada Si-DPZIDA
Berdasarkan kurva pada Gambar 1, teramati bahwa kehadiran ko-kation Pb(II) pada adsorpsi Cr(III) memberikan efek sinergistik yaitu menguatkan daya adsorpsi Cr(III) pada adsorben. Jumlah Cr(III) yang terserap pada sistem dengan kehadiran Pb(II) lebih besar dibandingkan dengan tanpa kehadiran Pb(II). Efek sinergistik tertinggi diberikan oleh kehadiran Pb(II) pada sistem dengan konsentrasi 0,5 mM, dengan daya serap 0,1041 mmol/g, sedangkan pada sistem tanpa kehadiran Pb(II) daya serap terhadap Cr(III) adalah 0,0591 mmol/g.
Kurva pada Gambar 2 menunjukkan bahwa terjadi peningkatan daya serap Pb(II) pada Si-DPZIDA dibandingkan dengan tanpa kehadiran ko-kation Cr(III). Efek sinergistik tertinggi terjadi pada kehadiran Cr(III) dengan konsentrasi 1,5 mM, dengan daya serap 0,5808 mmol/g, sedangkan pada sistem tanpa kehadiran Cr(III) daya serap Pb(II) sebesar 0,5878 mmol/g.
Berdasarkan kurva pada Gambar 3, teramati bahwa kehadiran ko-kation Cu(II) pada adsorpsi Cr(III) memberikan efek sinergistik yaitu menguatkan daya adsorpsi Cr(III) pada adsorben. Jumlah Cr(III) yang terserap pada sistem dengan kehadiran Cu(II) lebih besar dibandingkan dengan tanpa kehadiran Cu(II). Efek sinergistik tertinggi diberikan oleh kehadiran Cu(II) pada sistem dengan konsentrasi 0,5 mM, dengan daya serap 0,1010 mmol/g, sedangkan pada sistem tanpa kehadiran Cu(II) daya serap terhadap Cr(III) adalah 0,0591 mmol/g.
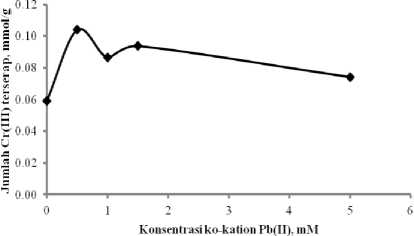
Gambar 1. Daya adsorpsi Si-DPZIDA
terhadap ion Cr(III) dengan kehadiran ko-kation Pb(II) pada sistem binary Cr-Pb.
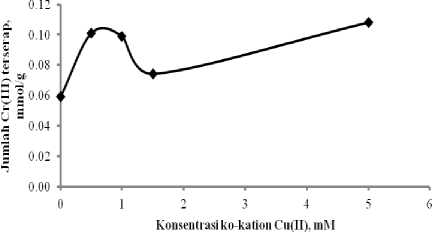
Gambar 3. Daya adsorpsi Si-DPZIDA terhadap ion Cr(III) dengan kehadiran ko-kation Cu(II) pada sistem binary Cr-Cu
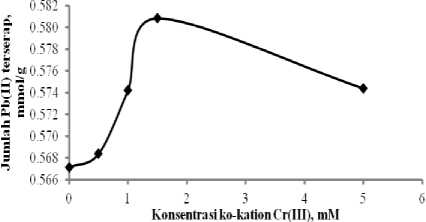
Gambar 2. Daya adsorpsi Si-DPZIDA terhadap ion Pb(II) dengan kehadiran ko-kation Cr(III) pada sistem binary Pb-Cr.
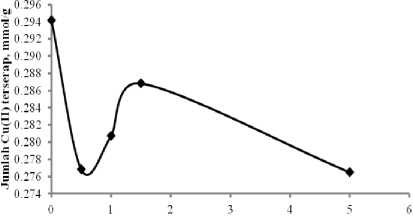
Konsentrasi kokation Cr(III)
Gambar 4. Daya adsorpsi Si-DPZIDA
terhadap ion Cu(II) dengan kehadiran ko-kation Cr(III) pada sistem binary Cu-Cr
Adsorpsi binary ion logam Cr(III) dan Cu(II) pada Si-DPZIDA
Kurva pada Gambar 4 menunjukkan bahwa terjadi penurunan daya serap Cu(II) pada Si-DPZIDA dibandingkan dengan tanpa kehadiran ko-kation Cr(III). Efek antagonistik tertinggi
Adsorpsi binary ion logam Pb(II) dan Cu(II) pada Si-DPZIDA
Kurva pada Gambar 5 menunjukkan bahwa terjadi peningkatan daya serap Pb(II) pada Si-DPZIDA dibandingkan dengan tanpa kehadiran ko-kation Cu(II). Efek sinergistik tertinggi terjadi pada kehadiran Cu(II) dengan konsentrasi 1 mM, dengan daya serap 0,5867 mmol/g, sedangkan pada sistem tanpa kehadiran Cu(II) daya serap Pb(II) sebesar 0,5672 mmol/g.
terjadi pada kehadiran Cr(III) dengan konsentrasi 0,5 mM, dengan daya serap 0,2768 mmol/g, sedangkan pada sistem tanpa kehadiran Cr(III) daya serap Cu(II) sebesar 0,2941 mmol/g.
Kurva pada Gambar 6 menunjukkan bahwa terjadi penurunan daya serap Cu(II) pada Si-DPZIDA dibandingkan dengan tanpa kehadiran ko-kation Pb(II). Efek antagonistik tertinggi terjadi pada kehadiran Pb(II) dengan konsentrasi 0,5 mM, dengan daya serap 0,2736 mmol/g, sedangkan pada sistem tanpa kehadiran Pb(II) daya serap Cu(II) sebesar 0,2941 mmol/g.
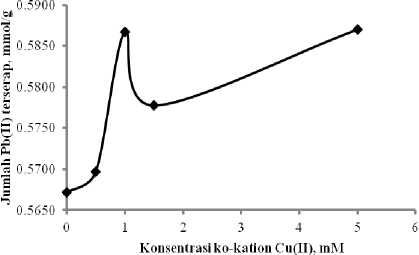
Gambar 5. Daya adsorpsi Si-DPZIDA
terhadap ion Pb(II) dengan kehadiran ko-kation Cu(II) pada sistem binary Pb-Cu
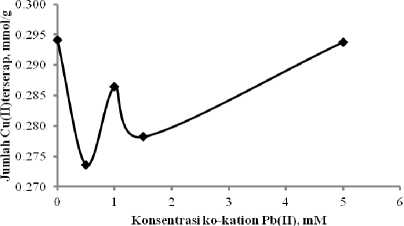
Gambar 6.
Daya adsorpsi Si-DPZIDA terhadap ion Cu(II) dengan kehadiran ko-kation Pb(II) pada sistem binary Cu-Pb
Adsorpsi multi logam Pb, Cu, dan Cr dalam sistem binary menunjukkan daya serap yang beragam akibat kehadiran ko-kation logam lain. Kehadiran logam lain (ko-kation) pada adsorpsi logam Pb(II) dan Cr(III) menunjukkan efek sinergistik, sedangkan pada logam Cu(II) kehadiran logam lain memberikan efek anta-gonistik.
KESIMPULAN
Kehadiran ko-kation Pb(II) memberikan efek sinergistik pada adsorpsi Cr(III) yaitu meningkatkan jumlah Cr(III) yang terserap pada adsorben Si-DPZIDA dengan daya adsorpsi lebih besar dari 0.0591 mmol/g. Efek sinergisitas terbesar terjadi pada ko-kation Pb(II) dengan konsentrasi 0,5 mM dengan daya serap Cr(III) 0,1041 mmol/g. Ketika Cr(III) sebagai ko-kation, juga memberikan efek sinergistik pada adsorpsi
Pb(II) yaitu meningkatkan jumlah Pb(II) yang terserap pada Si-DPZIDA, dengan daya adsorpsi lebih besar dari 0,5672 mmol/g. Efek sinergis terbesar terjadi pada kehadiran ko-kation Cr(III) dengan konsentrasi 1,5 mM, dengan daya serap Pb(II) 0,5808 mmol/g. Dalam adsorpsi sistem binary Cr-Cu, ko-kation Cu(II) memberikan efek sinergistik yaitu meningkatkan jumlah Cr(III) yang terserap pada adsorben Si-DPZIDA dengan daya adsorpsi lebih besar dari 0.0591 mmol/g. Efek sinergis terbesar terjadi pada kehadiran ko-kation Cu(II) pada sistem dengan konsentrasi 0,5 mM, dengan daya serap Cr(III) 0,1010 mmol/g.
Sedangkan ketika Cr(III) berfungsi sebagai ko-kation, memberikan efek antagonistik yaitu
menurunkan jumlah Cu(II) yang terserap pada adsorben Si-DPZIDA dengan daya serap lebih rendah dari 0.2941 mmol/g. Efek antagonis
terbesar terjadi pada kehadiran ko-kation Cr(III)
pada konsentrasi 0,5 mM, dengan daya serap Cu(II) 0,2768 mmol/g. Dalam adsorpsi sistem binary Pb-Cu, ko-kation Cu(II) memberikan efek sinergistik yaitu meningkatkan jumlah Pb(II) yang terserap pada adsorben Si-DPZIDA dengan daya sorpsi lebih besar dari 0,5672 mmol/g. Efek sinergis terbesar terjadi pada kehadiran ko-kation Cu(II) pada sistem dengan konsentrasi 1,0 mM, dengan daya serap Pb(II) 0,5867 mmol/g. Sedangkan ketika Pb(II) berfungsi sebagai ko-kation, memberikan efek antagonistik yaitu menurunkan jumlah Cu(II) yang terserap pada adsorben Si-DPZIDA, dengan serapan lebih kecil dari dari 0.2941 mmol/g. Efek antagonis terbesar terjadi pada kehadiran ko-kation Pb(II) pada konsentrasi 0,5 mM, dengan daya serap Cu(II) 0,2736 mmol/g
UCAPAN TERIMA KASIH
Ucapan terima kasih penulis sampaikan kepada Universitas Udayana Kementerian Riset, Teknologi dan Pendidikan Tinggi atas dukungan finansial melalui Hibah Unggulan Program Studi tahun 2017.
DAFTARPUSTAKA
Chiban, M. & Sinan, F., 2011, Removal of Cu (II) ions from aqueous solution by microparticles of dried Carpobrotus edulis plant
in a column system, Water Qual Res J Can.,46 (3): 259-267.
Erdem, E., Karapinar, N., & Donat, R., 2004, The Removal of Heavy Metal Cations by
Natural Zeolite, Journal of Colloidand Interface Surface Science, 280: 309-314.
Ghasemi, M., Soudani, A., Zahedi, G., Goodarzi, M., & Javadian, H., 2014, Kineticand
Equilibrium study of Ni(II) sorption from aqueous solution onto Peganum harmala – L., Int. J Environ Sci. Technol., 1: 18351844.
Hadi, P., Barford, J., & Mckay, G., 2014, Selective toxic metal uptake using an e waste based novel sorbent-single, binary and ternary systems, J Environ Chem Eng 2: 332-339.
Jain, M., Garg, V.K., & Kadiverlu, K., 2010,
Adsorption of heksavalent chromium from aqueous medium onto carbonaceous adsorbent prepared from waste biomass, Journal of Environmental Management, 91: 949-957.
Jain, M., Garg, V.K., & Kadiverlu, K., 2013,
Cadmium(II) sorption and desorption in a fixed bed columm usingg sunflower waste carbon calcium-alginate beads,
Bioresourse Technoogyl, 129: 242-248.
Kocasoy, G. & Sahin, V., 2007, Heavy Metal Removal from Industrial Wastewater by Clinoptilolite. Journal Environmental Science and Health Part A, 42, 2139-2146. http://www.ncbi.nlm.nih.gov/pubmed/180 74286.
Machida, M., Mochimaru, T., & Tatsumoto, H., 2006, Lead(II) adsorption onto the graphene layer of carbonaceous materials in aqueous solution, Carbon, 44: 26812688.
Mahajan, G., & Sud, D., 2013, Application of lingo-cellulotic waste material for heavy metal ions removal from aqueous solution, Journal of Enviromental Chemical Engenering.,1: 1020-1027.
Mahmoud, M., & Al-Saadi, M.S.M., 2007, Silica gel-physically adsorbed diphenylcarbazone as a selective solid phase
extractor and pre-concentrator for
chromium(III) and iron(III), Journal of Saudi Chemical Society., 11(2): 331-340.
Mohan, D. & Singh, K.P., 2002, Single and multicomponent adsorption cadmium and Zinc using activated carbon derived from bagasse-an agricultural waste, Water Resoursce, 36: 2304-2318.
Myroslav, S., Boguslaw. B., Artur, P.T., & Jacek, N., 2006, Study of the selection
mechanism of heavy metals (Pb2+, Cu2+, Ni2+, and Cd2+) adsorption on clinoptilolite, Journal of Colloid and Interface Science, 304 (1): 21-28.
Oscik, J., 1982, Adsorption, John Willey & Sons, Inc. New York.
Reddy, P. M. K., Krishanmurthy, K., Mahammaddunissa, S.K., Dayamani, K., & Subrahmanyam, C., 2015, Preparation of activated carbon from bio-waste: Effect of surface functional groups on methylene blue adsorption, International Journal of Environmental Scence Technology.,12: 1363-1372.
Saeed, A., Iqbal M., & Akhtar M.W., 2005,
Removal and recoveryof lead(II) from single and multimetal (Cd, Cu, Ni, Zn ) solution by crop milling waste (black gram husk), Journal of Hazard Matererial B117, 65-73.
Srivastava V.C., Mall I.D., & Mishra I.M., 2006, Modelling individual and competitive adsorption cadmium(II) and Zinc(II) metal ions from aqueous solution onto bagase fly ash, Separation Science Technology., 50: 113-117.
Srivastava, P., Singh, B. & Angove, M., 2005, Competitiveadsorption behavior of heavy metal on kaolinite, Journal of Colloid and Interface Science, 290: 28-38.
Tin, Y.P., & Teo, W.K., 1994, Uptake of
Cadmium and Zinc by Yeast : Effects of Co-metal Ion and Physical/Chemical Treatments, Bioresourse Technology., 50: 113-117.
Vinh N.V., ZafarM., Behera S.K., & Park H.S., 2015, Arsenic(III) removal from aqueous solution by raw and zing-loaded pine cone biochar: equilibrium, kinetics, and
thermodynamics studies, International Journal of Environmental Science
Technology, 12: 1283-1294.
164
Discussion and feedback